2. 同济大学 污染控制与资源化研究国家重点实验室,环境科学与工程学院,上海 200092
2. State Key Laboratory of Pollution Control and Resource Reuse,College of Environmental Science and Engineering,Tongji University,Shanghai 200092
近年来,由于化学品的吸附/脱附及微生物降解作用在生态修复、毒性评价及环境风险评估中占据的重要作用,使这方面的研究日益受到重视(Dettenmaier et al., 2009).对土壤或沉积物上吸附污染物的研究表明,大多数情况下吸附剂的标化有机碳分配系数Koc越高,其吸附有机物的能力越强(Park et al., 2004; Park et al., 2003; Sharer et al., 2003).与土壤有机质相比较,尽管黑碳在土壤及沉积物中所占比例不高,但其对环境中天然有机污染物(NOCs)的吸附有着极其重要的贡献(Chiou,1995; Chiou et al., 2000; Chun et al., 2004).由于存在丰富的吸附位点,黑碳比一般土壤吸附有机物的容量更大、吸附速率更快.如有研究表明,小麦或水稻秸秆基黑碳对敌草隆的吸附比土壤高400~2500倍(Yang and Sheng, 2003).黑碳作为一种广泛存在于土壤中的吸附剂(Yang et al., 2008),其具有的强吸附特性改变了有机物在环境中的存在形态及生物可利用性,使之成为考察环境中污染物归趋的重要影响因子.
无论是土壤还是黑碳的脱附实验中均发现明显的脱附迟滞现象,前期的许多研究试图探究该现象的机理并提出了相应的脱附模型.如早先建立了由遵循一级动力学方程的快速脱附及慢速脱附组成的双位点脱附模型(Cornelissen et al., 1998; Cornelissen et al., 1997a,Cornelissen et al., 1997b),随后在此基础上增加了极慢速脱附位点发展成为遵循一级动力学方程的三位点脱附模型.但后期很多研究发现多孔介质吸附剂或老化过程中的吸附态有机物存在不可脱附的现象(Fu et al., 1994; Kan et al., 1997; Kan et al., 1994; Sharer et al., 2003),因此提出三位点脱附模型,认为吸附位点可分为平衡位点、非平衡位点及不可脱附位点,三种位点各遵循不同的脱附方程(Park et al., 2004; Park et al., 2005; Park et al., 2002; Park et al., 2001; Sharer et al., 2003).对于多微孔结构的黑碳特别是在老化后其不可逆脱附的吸附态有机物占很大比例,因此改进后的三位点脱附模型显然更加适合.
微生物降解影响有机物在环境中的归趋越发受到重视.研究认为吸附态有机污染物只有先脱附进入液相环境后才能进行微生物降解,很多模型也是基于该假设建立(Feng et al., 2000; Park et al., 2003; Zhang et al., 1998).然而也有研究表明微生物可将吸附态污染物直接降解无需脱附过程.如有研究发现霍顿腐殖土中微生物降解的初始矿化速率(IMRs)比基于吸附态物质能够瞬时脱附这假设下得出的速率还高(Park et al., 2003; Park et al., 2005);另外有研究中发现土壤中微生物降解的初始矿化速率比没有土壤的液相控制组中的速率还高(Park et al., 2003;Feng et al.,2000).以上现象均有悖于基于液相降解理论所得的结论,其最可能解释就是微生物能够直接降解吸附态有机物.
随着污染物与吸附剂接触时间增加,某些吸附态污染物不可逆的转化为其它相使其环境活性逐渐降低的过程,即老化作用.在长时间的老化中,黑碳中有机物的吸附过程大致包括快速且可逆的吸附过程及慢速且不可逆的吸附过程,吸附等温线基本为非线性(Chun et al., 2004; Luo et al., 2011; Yang et al., 2006)并且非线性逐渐增强.而有机物的不可逆吸附导致随着吸附剂与有机物的接触时间越长,其脱附抑制作用越强,即位于难脱附位点上的有机物所占比例将增加(Chen et al., 2009; Hatzinger and Alexander, 1995),出现脱附迟滞(Hysteresis)甚至锁定现象(Sequestration).上述现象对环境中吸附态有机物的生物有效性亦有着重要影响.但作为有机物在环境中生物有效性的重要控制因素之一,长时间的老化研究还很缺乏,已有的研究也主要集中在土壤上,在黑碳中的研究很少.因此本文选取苯酚这一水体中常见的典型有机污染物作为研究对象,以三位点脱附模型为基础,探讨老化时间对黑碳中吸附态苯酚的脱附及两组不同菌密度下的微生物降解的影响.
2 材料与方法(Materials and methods) 2.1 实验材料及细菌准备本文中的吸附剂为自制黑碳,由松木在自然状态下燃烧得到.所得黑碳经以下步骤处理:洗涤(超纯水)、干燥(85 ℃,24 h)、研磨过筛(100目)、浸润(甲醇)、过滤、再洗涤(超纯水)、干燥(85 ℃,48 h),高压灭菌(120 ℃,20 min)、真空干燥(106 ℃,24 h).储存前取0.2 g黑碳置于0.2 mol · L-1磷酸盐缓冲溶液(PB溶液)中浸润1 d,将提取液涂琼脂营养平板保证灭菌完全.比表面积由Micromeritics ASAP2020测得,以N2-BET法测定比表面积(SABET)并用t-plot模型计算微孔比表面积(SAμp)和外比表面积(SAEXT).黑碳元素组成由浙江大学的Thermo Finnigan Flash EA 1112元素分析仪测定.
实验所用苯酚购买自上海百灵威科技有限公司,纯度为特级纯(99.9%);微生物降解细菌为Pseudomonas putida ATCC 11172,购买自日本微生物菌种保藏中心.该菌能以苯酚作为唯一碳源,矿物质培养液使用M9培养液,由KH2PO4 3 g · L-1,Na2HPO4 3 g · L-1,NH4Cl 2 g · L-1,NaCl 0.5 g · L-1组成,另加1%的微量元素(MgSO4 · 7H2O 0.04 g · L-1,CaCl2 · 2H2O 0.025 g · L-1,FeSO4 · 7H2O 0.025 g · L-1,CuSO4 · 5H2O 0.04 g · L-1,ZnSO4 · 7H2O 0.2 g · L-1,MnSO4 · 7H2O 0.4 g · L-1).恶臭假单胞杆菌培养过程为将细菌从平板接种至100 mL营养培养液(Tryptone 10 g · L-1,Yeast extract 5 g · L-1,NaCl 5 g · L-1)进行增殖培养,于摇床(150 r · min-1,30 ℃)培养24 h,后转移至25 mL聚四氟乙烯管离心15 min(2000 r · min-1,4 ℃),弃上清液,用等体积PB悬浮,再离心,如此清洗两次除去营养培养基,将其转移至100 mL M9培养液中(500 mg · L-1苯酚溶液)并添加1%微量元素,于摇床中(180 r · min-1,30 ℃)适应培养18 h,使假单胞杆菌产生相应的降解酶,从而缩短接种后的适应期.通过适应培养的细菌再如上述清洗过程清洗两遍,用PB溶液制成细菌悬浮液,以紫外分光光度法(600 nm)确定悬浮液中的细菌数量,保证微生物降解体系中微生物密度约为1.45×107 CFU · mL-1和2.47×107 CFU · mL-1,待用.在实验前,所有容器、营养液及转移用品等都经过高压蒸汽灭菌(121 ℃,20 min)保证体系无菌.
2.2 批量平衡吸附实验本实验中吸附热力学实验采用普遍使用的批量平衡吸附实验并得出吸附等温线.苯酚先于PB溶液中制成50000 mg · L-1的储备液,后将其用PB溶液稀释成7组不同浓度的目标液(2、5、10、20、30、50和70 mg · L-1).准备7组(每组3个平行样)25 mL玻璃管,分别加入0.02 g黑碳,24 mL不同浓度的苯酚溶液及1% NaN3溶液(抑制微生物活动),置振荡器上恒温振荡(150 r · min-1,30 ℃)1 d、10 d和22 d,保证样品瓶中顶部空间< 1 mL.每组另设3个没有黑碳的空白样测定老化过程中因挥发、氧化或瓶壁吸附等因素引起的损失.完成各自老化过程后,每组各取2 mL样品过0.22 μm的一次性针式滤头(无苯酚吸附),滤液用高效液相色谱(HPLC)测定苯酚的平衡浓度,结合初始平衡浓度计算得到黑碳中吸附态苯酚的量.高效液相色谱仪采用Agilent1200,分析参数为紫外检测器,波长为272 nm;Waters XBridge C18柱(5 μm,4.6 mm×150 mm);甲醇 ∶ 水=55 ∶ 45;流量为1 mL · min-1.
2.3 脱附实验在本实验中,选用苯酚的初始平衡浓度为30 mg · L-1,平衡过程与批量平衡吸附实验类似.脱附实验每个老化时间点设置9组(每组3个平行样),另设一组没有黑碳的空白.在老化过程中添加1% NaN3溶液排除微生物降解的影响.完成相对应的老化过程后,用杯式过滤器过0.45 μm无机滤膜将固液分离,液相进样测液相浓度,根据差值法计算黑碳中吸附的苯酚量;固相进行最长达11 h的脱附实验,脱附时间点分别设置为 0.5、1、2、3、5、7、9和11 h.在达到各脱附时间点时,依次取一组样品过0.45 μm有机滤膜进行固液分离,液相进样测脱附下来的浓度;固相以丙酮为萃取剂在55 ℃中超声萃取两次,每次1 h,分别进行固液分离,所得有机相用安捷伦气相色谱的FID检测器测定,计算回收率.色谱条件:色谱柱为毛细管柱HP-6,30 m×0.32 mm×0.25 μm;进样口温度 250 ℃;进样模式:分流比为1 ∶ 2;进样量 1 μL;升温程序:起始温度 60 ℃,以每min 25 ℃的速度升温至 220 ℃,总运行时间 9 min.
2.4 连续稀释脱附实验设置连续稀释脱附实验是为了计算老化过程中不可脱附位点上苯酚所占的比例.各老化时间内设置一组(每组3个平行样)样品,苯酚的初始平衡浓度为30 mg · L-1,老化完成后固液分离,液相进HPLC测脱附下来的苯酚量;固相转移至新的25 mL玻璃瓶中,并以没有苯酚的磷酸盐缓冲溶液补足至初始体积,继续放置于摇床中脱附,依此类推,连续稀释脱附时间点设置如脱附时间点相同,并在此基础上最终延长至10 d,10 d内仍不能脱附下来的苯酚认为是不可脱附的,计算各老化时间点内的不可脱附因子.如前面实验,在所有非微生物实验中均加1% NaN3溶液排除微生物降解的影响.
2.5 微生物降解实验微生物降解实验的吸附过程如前面实验类似,区别在于此实验涉及微生物因此不添加1% NaN3溶液.每个老化时间点设置两组不同菌密度的实验,菌密度分别为1.45×107 CFU · mL-1和2.47×107 CFU · mL-1,细菌培养过程如2.1节所示,保证其为对数期的静息细胞,排除细菌适应期的干扰.微生物降解时间点同脱附实验时间点设置相同.完成各时间内的降解后固液分离,液相进HPLC测降解后液相中剩余的苯酚量;固相用丙酮萃取两次,有机相进GC测萃取出的苯酚量.微生物降解量的数据在考虑进各老化时间点内的回收率后由差值法计算得到.同时设置老化时间为1 d的黑碳悬浮液(基质为PB溶液)及PB溶液中的液相微生物降解空白试验,用来研究黑碳提取液对微生物降解的影响.在所有的微生物降解体系中,保证系统无菌排除杂菌对实验的影响.
2.6 脱附模型在此实验中,脱附数据的分析模型选用由Park等(2004;2005;2002; 2001)发展过的三位点脱附模型.该模型假设:(i)吸附态有机物的吸附位点可分为平衡位点、非平衡位点及不可脱附位点三种位点;(ii)平衡位点上的吸附态有机物脱附模型遵循Freundlich非线性方程;(iii)非平衡位点上的脱附速率与非平衡位点及液相中的浓度梯度成正比.
从数学意义上讲,平衡位点及不可脱附位点上苯酚的吸附分配表达如下:

而非平衡位点上苯酚的脱附方程遵循如下:

式中,KF 为Freundlich分配系数(mg · kg-1 ·(mg · L-1)-n);n为描述等温线曲率的常数;C 为液相浓度(mg · L-1);Ce 为吸附平衡时的液相浓度;t为脱附时间(h);α 为非平衡位点上的一级脱附速率常数(h-1);feq为平衡位点所占比例因子;fneq为非平衡位点所占比例因子;fnd为不可脱附位点所占比例因子;Seq、 Sneq和Snd分别为平衡位点、非平衡位点及不可脱附位点上吸附在黑碳上的苯酚浓度(mg · kg-1),三种位点上总固相浓度为S:
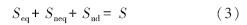
三种位点上的比例因子和为1:
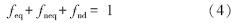
KF和n的值由吸附等温线得到;fnd由脱附达10 d的连续稀释脱附曲线得到;feq,fneq和 α则由三位点脱附模型根据脱附数据拟合得到.
3 结果与讨论(Results and discussions) 3.1 黑碳性质本研究所采用的黑碳元素组成及比表面数据如表 1.黑碳中的主要元素为碳(81.32%)与土壤有机质中的均化有机碳含量(58%)相比其碳化率明显要高出很多;从表中的比表面数据可知,SAμP/SAEXT=1.58,即在黑碳的比表面积中,总比表面积非常大而且微孔比表面积很丰富.
| 表1 黑碳特征 Table 1 Characteristics of black carbon |
在本实验中黑碳上苯酚的吸附等温线都呈非线性,并且能够由Freundlich方程很好的拟合(图 1),数学表达方程为:

式中,Cis 为各老化时间点内吸附在黑碳上的苯酚平衡浓度(mg · kg-1);Ciw为相应的液相苯酚浓度(mg · kg-1).
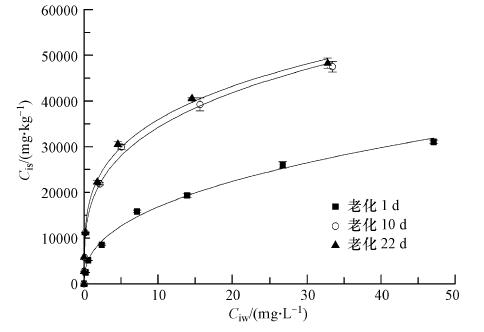 |
| 图 1 不同老化时间内黑碳上苯酚的吸附等温线 Fig. 1 Sorption isotherms of phenol in BCs during aging periods |
3 组不同老化时间内的拟合结果见表 2,其拟合后的R2>0.988;曲率n值从老化1 d的0.413减小到老化22 d的0.261,表明平衡时间越长,吸附等温线的非线性越强;由图 1可看出,在同一初始平衡浓度下,随着老化时间增加,吸附在黑碳中的苯酚量也越大;不同平衡时间内的KF从6496.7增加到19555.8(mg · kg-1)(mg · L-1)-n,根据图中的等温线剖面图也可知,在平衡实验前期黑碳上增加的苯酚吸附量明显快于平衡实验后期,并且到一定平衡时间后越来越趋于吸附饱和.所有的吸附等温线均表明黑碳为一种高效的吸附剂,特别是初始平衡浓度较低的情况下如老化10 d及22 d后黑碳基本上能完全吸附初始平衡浓度小于10 mg · L-1的苯酚溶液(图 1).黑碳的高吸附能力主要取决于其庞大的总比表面积特别是丰富的微孔面积(117.70 m2 · g-1,占总比表面积的61.2%)(Allen-King et al., 2002;Chun et al., 2004),这主要是由于极大的比表面积赋予黑碳足够多的吸附位点吸附苯酚.黑碳对有机物的吸附作用主要是由表面吸附作用和填充吸附组成,外比表面吸附位点上的表面吸附作用,吸附速率快于微孔中的填充吸附,而丰富的微孔使黑碳吸附苯酚出现迟滞现象,呈现很强的非线性.
| 表2 不同老化时间内苯酚的Freundlich吸附等温线方程拟合数据 Table 2 Freundlich sorption isotherm parameters evaluated from phenol sorbed to black-carbon during aging |
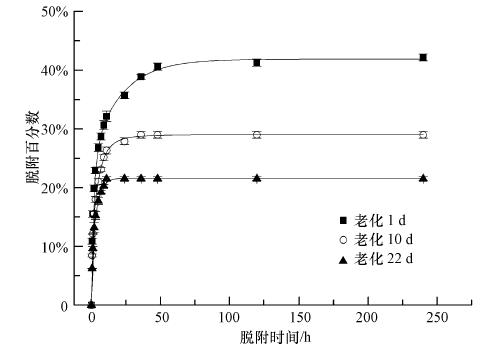
图 2和图 3中脱附及连续稀释脱附数据用各脱附时间点内苯酚的脱附百分比表示.黑碳上苯酚的脱附包括前期的快速脱附及慢速脱附,在脱附5 d后基本处于不可脱附状态,当连续稀释脱附10 d时已基本达到表观脱附平衡,因此仍不能从黑碳中脱附下来的苯酚认为是不可脱附的.老化过程中没有黑碳的空白实验表明平衡过程中所有样品均无损失.
 |
| 图 2 连续稀释脱附实验中吸附态苯酚的脱附百分数 Fig. 2 Liquid-phase percentage of desorbed phenol from series dilution desorption experiment |
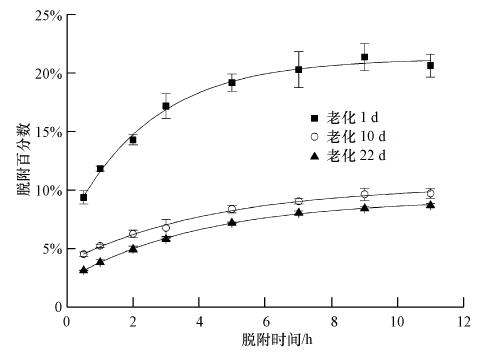 |
| 图 3 脱附实验中吸附态苯酚的脱附百分数 Fig. 3 Liquid-phase percentage of desorbed phenol from desorption experiment |
从表 3可知,三组老化实验中的fnd均处于较高的水平,仅老化1 d的黑碳其不可脱附位点比例达60.4%.同样老化1~2 d在低有机碳含量的土壤中其不可脱附位点比例则要小得多,如Sharer等研究Compac土壤(有机质含量为3.3%)对二溴化乙烯、氯苯、莠去津及2,4-D的吸附在老化1 d后其fnd最大为32%(Sharer et al., 2003); Park等研究4种不同土壤(有机质含量<3.9%)吸附有机物菲在老化2 d后其fnd最大为15%(Park et al., 2001),均远小于本实验的60.4%.
| 表3 三位点脱附模型拟合参数 Table 3 Evaluated desorption parameters of black-carbon-sorbed phenol using three-site desorption model over different aging periods |
比较图 2和图 3的连续稀释脱附数据可知,由于苯酚的不定期移除脱附,导致在相同的脱附时间内其脱附的苯酚量远大于脱附实验中能够脱附下来的量.脱附数据采用三位点脱附模型拟合,其可决系数R2均>0.971(表 3),表明此模型能够较好的拟合苯酚在黑碳上的脱附.从表 3中看出fnd值从0.604增加到0.857,当老化22 d 时黑碳中不可脱附位点上的苯酚就已占绝对优势.随着老化时间的延长,feq从0.277减少到0.117,而fneq也逐渐减少并保持在较低水平.
从图 3脱附曲线中可发现,黑碳上的苯酚脱附过程存在脱附迟滞现象及锁定现象,这可通过吸附迟滞现象解释(Braida et al., 2003).吸附迟滞现象包括不变的迟滞现象(Permanent hysteresis)及真实迟滞现象(True hysteresis).前者主要是由人为因素或实验设备引起,在本实验中已确认所用玻璃瓶、抽滤装置、滤膜及一次性针式过滤头等对苯酚均没有吸附,长时间老化的无黑碳空白实验表明,老化过程中无挥发或非微生物氧化导致吸附过程苯酚的 减少,同时非微生物对照实验添加1% NaN3亦排除微生物降解,上述质量控制过程均尽量排除不变的迟滞现象的影响.后者主要是由不可逆吸附机制导致,对黑碳这类多孔性吸附剂而言,这种现象可能是由孔洞变形造成(Braida et al., 2003).该解释认为苯酚分子填充进入黑碳微孔,其内部微环境被迫发生变化而膨胀,同时可能打开原先不能进入的孔洞而产生新的内表面,原先的孔洞或因相邻孔洞膨胀而堵塞造成该分子被锁定,或没被堵塞继续接受新的吸附质造成吸附滞后.这填充-膨胀-填充或填充-膨胀-锁定的过程因为存在一定的时间差导致吸附迟滞现象.而在脱附的过程中,处于外表面的吸附态苯酚能快速脱附下来,这相当于处于平衡位点上的苯酚;一部分微孔中的苯酚分子则只能在相邻分子离开所在孔洞,等周围基体恢复到原先状态时才能脱附,或者在填充-膨胀过程中打开新的逃逸路径之后才能脱附,无论是孔洞恢复或孔洞的重新安排都需要一定的时间,使微孔中的吸附态苯酚分子一般比外表面之类的分子脱附速率慢,造成脱附迟滞;部分被锁定的分子则可能继续被锁定,或者某些微孔中的分子在孔洞重新安排打开新路径逃逸的过程中,导致周围孔洞堵塞使其它分子被锁定,变成不可脱附.而黑碳的微孔结构丰富并且其孔径很小,使吸附态苯酚分子之间“竞争脱附”激烈,特别是长时间老化后其能够发生孔洞重排的空间很小,所以黑碳的脱附迟滞及锁定现象较以表面吸附及表面分配作用为主的土壤及沉积物而言要明显得多.
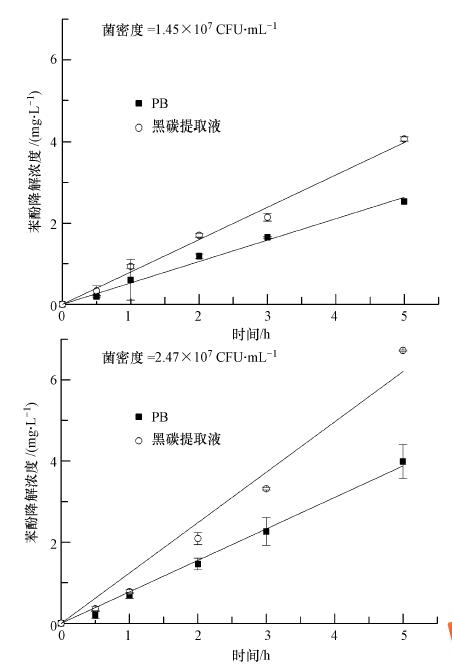 |
| 图 4 不同缓冲液中的液相微生物降解曲线 Fig. 4 Biodegradation of phenol in two different buffers |
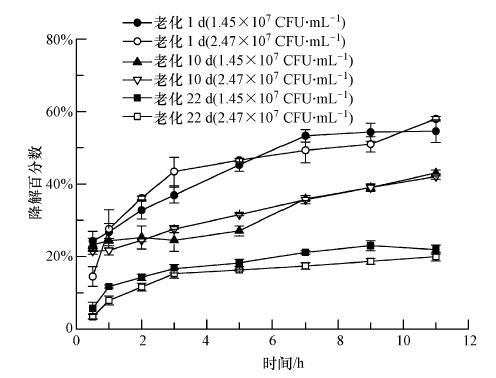 |
| 图 5 老化过程中不同菌密度条件下的微生物降解量 Fig. 5 Degradation percentages of phenol under different bacterial densities during aging |
在微生物降解的定量过程中,回收率扮演着重要的角色.在老化延长到6个月的预实验中表明,回收率随着老化时间的延长不可避免的下降,但其稳定性却逐渐增加.在本实验中,11~12个样品的回收率数据先经过狄克逊方法检验其数据有效性(α= 0.05),以置信度为95%的置信区间表示(表 4).两种不同菌密度条件下的液相降解实验数据(表 5)表明,两种液相中的微生物降解符合一级动力学方程,黑碳提取液及PB溶液中微生物降解速率均随着恶臭假单胞杆菌密度的增加而增加,并且在不同菌密度下黑碳提取液中的微生物降解速率均比PB溶液中的速率快,这可能归因于黑碳悬浮液中浸提出的某些养素能够刺激微生物提高降解活性(Yang et al., 2006).吸附态苯酚的微生物降解实验数据表明(图 5)随着老化时间的延长,不同菌密度条件下的微生物降解量明显降低,说明其生物可利用性逐渐减小,如老化1 d 与老化22 d的微生物降解百分数相差30%多.这是由于随着老化的进行,处于易脱附位点上的苯酚逐渐减少,不可脱附位点上的苯酚逐渐增多,使其生物可利用性逐渐减少.但在比较同一老化时间内不同菌密度条件下的数据时可发现老化1 d与10 d的实验中两者之间生物可利用性并无明显的统计学差异,老化22 d的则有较小的差异.
| 表4 不同老化时间内的回收率 Table 4 Recovery during aging period |
| 表5 不同菌密度条件下液相中的微生物降解曲线 Table 5 Biodegradation curves in liquid-phase under different bacterial densities |
在所有吸附态苯酚的微生物降解体系中,液相中的苯酚始终维持在较低的水平(<1.34 mg · L-1,数据未列出)说明吸附态苯酚脱附下来后不能被瞬时降解.在计算微生物降解速率时发现前0.5 h的降解速率均数倍于黑碳提取液中的速率,如老化1 d时菌密度为1.45×107 CFU · mL-1的前0.5 h降解速率为7.640 mg · L-1 · h-1,而黑碳提取液中的速率为0.797 mg · L-1 · h-1;菌密度为2.47×107 CFU · mL-1的前0.5 h降解速率为4.461 mg · L-1 · h-1,而黑碳提取液中的降解速率为1.241 mg · L-1 · h-1,这可能是无意间扩大了各老化时间内的回收率,使通过差值法计算出的前0.5 h苯酚降解量偏高.但从回收率实验可知不同老化点内同组实验的回收率稳定性较高(表 4),因此为了消除回收率准确性的影响在分析微生物降解数据时减去前半小时内的降解量,同时脱附数据与连续稀释脱附数据也依此处理,结果见图 6.
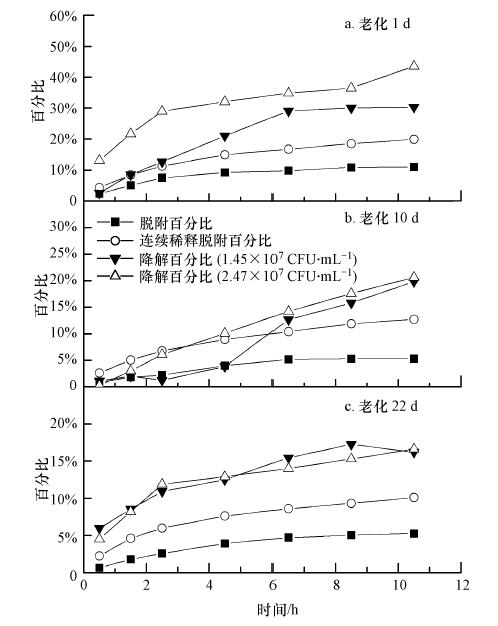 |
| 图 6 老化过程中不同实验体系内黑碳中吸附态苯酚消耗的量(减去前0.5 h降解或脱附出的苯酚量) Fig. 6 Removed substrate of sorbed phenol in different systems during aging(subtracting the degraded or desorbed phenol in the first half an hour) |
3 组老化时间点内的微生物降解曲线全部处于连续稀释脱附曲线之上,表明不可脱附位点上的部分吸附态苯酚也能被细菌降解.这种现象在Park等研究土壤中吸附态菲的生物可利用性时也曾发现(Park et al., 2001).一种解释是恶臭假单胞杆菌提取吸附态苯酚的能力比有机溶剂更强,效率更高,甚至能提取出不可脱附位点上的苯酚,这种假设仍是基于脱附后液相降解理论;另一种解释是细菌能够通过胞外酶的作用直接降解部分吸附态苯酚而不需脱附这一过程,这与液相降解理论的假设是相反的.总之,对于这方面的内容还需要深入研究.
4 结论(Conclusions)1)3组不同老化实验中黑碳均存在平衡位点、非平衡位点及不可脱附位点3种位点.位于不可脱附位点上的苯酚均占绝大部分(>60.4%),其比例随着老化时间延长不断增加,总体趋势为易脱附位点上的苯酚逐渐转移至难脱附位点或不可脱附位点上.由于黑碳中大量微孔的存在,其吸附等温线非线性逐渐增强,脱附特征明显存在脱附迟滞及锁定现象.
2)由连续稀释脱附实验与脱附实验数据比较可得,不定期的移除脱附出的苯酚能够极大的促进脱附的进行,这表明非生物移除脱附产物在脱附体系中占据很重要的作用.
3)随着老化时间的延长,吸附态苯酚的生物可利用性逐渐降低,但同一老化时间内两组不同菌密度之间的生物可利用性并无明显的统计学差异;同时发现黑碳中不可脱附位点上的部分苯酚亦能被降解.
| [1] | Allen-King R M,Grathwohl P,Ball W P.2002.New modeling paradigms for the sorption of hydrophobic organic chemicals to heterogeneous carbon-aceous matter in soils,sediments,and rocks[J].Advances in Water Resources,25(8/12):985-1016 |
| [2] | Braida W J,Pignatello J J,Lu Y F,et al .2003.Sorption hysteresis of benzene in charcoal particles [J].Environmental Science and Technology,37(2):409-417 |
| [3] | Chen H,He X M, Rong X M,et al.2009.Adsorption and biodegradation of carbaryl on montmorillonite,kaolinite and goethite [J].Applied Clay Science,46 (1):102-108 |
| [4] | Chiou C T.1995.Comment on"Thermodynamics of organic chemical partition in soils"[J].Environmental Science and Technology, 29(5):1421-1422 |
| [5] | Chiou C T,Kile D E,Rutherford D W,et al.2000.Sorption of selected organic compounds from water to a peat soil and its humic-acid and humin fractions:potential sources of the sorption nonlinearity [J].Environmental Science and Technology,34(7):1254- 1258 |
| [6] | Chun Y,Sheng G Y,Chiou C T,et al.2004.Compositions and sorptive properties of crop residue-derived chars [J].Environmen-tal Science and Technology,38(17):4649-4655 |
| [7] | Cornelissen G,Rigterink H,Vrind B A,et al.1997a.Two-stage desorption kinetics and in situ partitioning of hexachlorobenzene and dichlorobenzenes in a contaminated sediment [J].Chemosphere,35(10):2405-2416 |
| [8] | Cornelissen G,Van Noort P C M,Govers H A J.1997b.Desorption kinetics of chlorobenzenes,polycyclic aromatic hydrocarbons,and polychlorinated biphenyls: sediment extraction with TenaxR and effects of contact time and solute hydrophobicity [J].Environmental Toxicology and Chemistry,16(7):1351- 1357 |
| [9] | Cornelissen G,Rigterink H,Ferdinandy M M A,et al.1998.Rapidly desorbing fractions of PAHs in contaminated sediments as a predictor of the extent of bioremediation [J].Environmental Science and Technology,32(7):966-970 |
| [10] | Dettenmaier E M,Doucette W J,Bugbee B.2009.Chemical hydrophobicity and uptake by plant roots [J].Environmental Science and Technology,43(2):324-329 |
| [11] | Feng Y C,Park J H, Voice T C,et al.2000.Bioavailability of soil-sorbed biphenyl to bacteria [J].Environmental Science and Technology,34(10):1977-1984 |
| [12] | Fu G M,Kan A T,Tomson M.1994.Adsorption and desorption hysteresis of pahs in surface sediment [J].Environmental Toxicology and Chem-istry,13(10):1559-1567 |
| [13] | Hatzinger P B,Alexander M.1995.Effect of aging of chemicals in soil on their biodegradability and extractabil-ity [J].Environmental Science and Technology,29(2):537-545 |
| [14] | Kan A T,Fu G M,Tomson M B.1994.Adsorption/desorption hysteresis in organic pollutant and soil/sediment interaction [J].Environmental Science and Technology,28(5):859-867 |
| [15] | Kan A T,Fu G M,Hunter M A, et al .1997.Irreversible adsorption of naphthalene and tetrachlorobiphenyl to Lula and surrogate sediments [J].Environmental Science and Tec-hnology,31(8):2176-2185 |
| [16] | Luo L,Lou L P,Cui X Y,et al.2011.Sorption and desorption of pentachlorophenol to black carbon of three different origins [J].Journal of Hazardous Materials,185(2/3):639-646 |
| [17] | Park J H,Zhao X D,Voice T C.2001.Biodegradation of non-desorbable naphthalene in soils [J].Environmental Science and Technology,35(13):2734-2740 |
| [18] | Park J H,Zhao X D,Voice T C.2002.Developme-nt of a kinetic basis for bioavailability of sorbed naphthalene in soil slurries[J].Water Research,36(6):1620-1628 |
| [19] | Park J H,Feng Y C, Ji P S,et al.2003.Assessment of bioavailability of soil-sorbed atrazine [J].Applied and Environmental Microbiology,69(6):3288-3298 |
| [20] | Park J H,Feng Y C,Cho S Y,et al.2004.Sorbed atrazine shifts into non-desorbable sites of soil organic matter during aging [J].Water Research,38(18):3881-3892 |
| [21] | Park J H,Sharer M,Feng Y,et al.2005.Effects of aging on the bioavailability and sorption /desorption behavior of biphenyl in soils [J].Water Science and Technology,52(8):95-105 |
| [22] | Sharer M,Park J H,Voice T C,et al. 2003.Aging effects on the sorption-desorption characteristics of anthropogenic organic compounds in soil [J].Journal of Environmental Quali-ty,32(4):1385-1392 |
| [23] | Yang J F,Ying G G,Zhao J L,et al.2008.Advance in research on the influence of black carbon on the enviro-nmental geochemistry processes of environmental contaminants [J].Ecology and Environment,17(4):1685-1689 |
| [24] | Yang Y N,Sheng G Y.2003.Enh-anced pesticide sorption by soils containing particulate matter from crop residue burns [J].Environmental Science and Technology,37(16):3635 -3639 |
| [25] | Yang Y N,Sheng G Y,Huang M S.2006.Bioavailability of diuron in soil containing wheat-straw-derived char [J].The Science of the Total Environment,354(2/3):170-178 |
| [26] | Zhang W X,Bouwer E J,Ball W P.1998.Bioavailability of hydrophobic organic contaminants:effects and implications of sorption-related mass transfer on bioremediation [J].Groundwater Monitoring and Remediation,18(1):126-138 |
 2014, Vol. 34
2014, Vol. 34


