2. 西北农林科技大学水土保持研究所,杨凌712100;
3. 中科院水利部水土保持研究所,杨凌712100
2. Institute of Soil and Water Conservation,Northwest A & F University,Yangling 712100;
3. Institute of Soil and Water Conservation,Chinese Academy of Sciences and Ministry of Water Resources,Yangling 712100
近十几年来,随着社会经济的发展,环境问题日益突显.特别是工业“三废”排放,导致大气、水体和土壤的污染较为严重.我国约有1.3×104 hm2耕地受到铅等重金属污染,不仅导致粮食减产10×106 t(张从,2000),也给人体健康带来了极大危害(余彬和郑钦玉,2007;代全林,2007),污染问题亟待解决.在当前重金属污染治理众多方法中,吸附法去除重金属因其经济高效、环保得到人们广泛关注(Ranganathan,2003;Mohan and Karthikeyan, 1997).诸多学者选用不同种类的吸附剂对各类重金属污染进行了吸附性实验研究,主要集中于粘土矿物、生物质材料、无机矿物等吸附材料及其改性材料上,比如生物质秸秆、生物碳、碳纳米管、天然黏土、膨润土等已证明具有较强吸附性被广泛应用作为吸附剂(Umar et al., 2010;Aroua et al., 2008;Kabbashi et al., 2009;Wang et al., 2009).而这些传统的吸附材料生产成本昂贵,因而寻找廉价吸附剂替代是环境科学研究的一个方向(Ramesh et al., 2005).砒砂岩因廉价易得,具有层状结构及较强的阳离子交换能力等,有可能成为治理重金属污染且低成本的天然吸附材料,然而当前对于砒砂岩的吸附特性鲜有研究.
砒砂岩是河流相氧化环境下碎屑岩的沉积,集中分布在黄土高原北部晋陕蒙接壤区,其成岩程度低、沙粒间胶结强度弱,很容易形成水土流失(张德全等,2006).目前,人们将砒砂岩视作一种易形成水土流失的介质去治理,很少将其资源化,而且将砒砂岩资源化再利用作为吸附材料吸附去除铅的研究尚未见报道.本文以3种颜色砒砂岩作为Pb(Ⅱ)的吸附剂,通过研究砒砂岩对Pb(Ⅱ)的动力学吸附与等温吸附特性,分析砒砂岩用量、pH、离子强度(IS)因素对吸附特性的影响,结合红外光谱分析来探讨砒砂岩吸附Pb(Ⅱ)的作用机理,以期为重金属污染治理提供实验基础.
2 材料与方法(Materials and methods) 2.1 试验材料供试材料为采自内蒙古准格尔旗暖水乡(39°44′23.6″N,110°34′34.3″E)的红色、白色、灰色砒砂岩,风干,碾碎,过0.25 mm尼龙筛,备用.其基本矿物组成、理化性质见表 1和图 1.其中,颗粒组成、pH、CEC、有机质和Pb、Cd、As本底含量采用常规分析方法(鲁如坤,2000),比表面积采用BET比表面积测定仪(V-Sorb 2008P)测定,矿物组成、化学成分分别采用粉晶X射线衍射仪(D/MAX-2600pc)和7220分光光度计测定.试验所需化学试剂为分析纯的Pb(NO3)2、NaNO3.
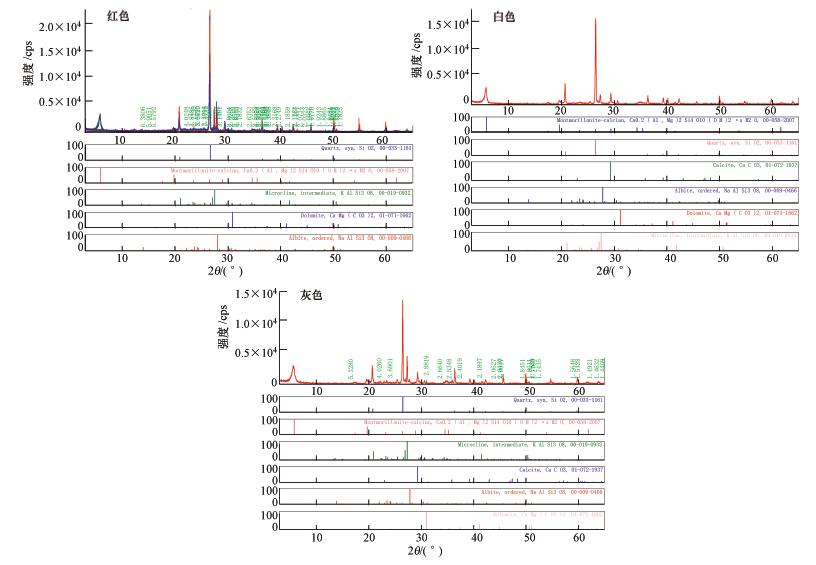 |
| 图 1 3种颜色砒砂岩的XRD谱图 Fig. 1 XRD patterns of Pisha sandstone at three different colors |
| 表1 供试砒砂岩矿物组成、理化性质 Table 1 Mineral compositions,chemical and physical properties of the experimental Pisha sandstones |
于100 mL聚氯乙烯塑料瓶中,分别加入试验所需不同用量的3种砒砂岩作为吸附剂,不同浓度的Pb(NO3)2为吸附质,以及不同浓度的NaNO3溶液作为支持电解质,同时以去离子水为空白对照,并用0.01 mol · L-1 NaOH和HNO3调节溶液pH,置于恒温振荡器(THZ-92C)中.在温度(25±2)℃,转速为180 r · min-1下,振荡一定时间,之后过滤出上清液,用火焰原子吸收分光光度计(Z-2000)测试上清液中Pb(Ⅱ)浓度和用pH计(PHS-3C)测试平衡pH.吸附等温试验的同时,测定上清液中K(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)、Mg(Ⅱ)离子浓度.
2.2.2 傅里叶变换红外光谱仪(FTIR)表征分别取适量吸附Pb(Ⅱ)前后的砒砂岩与KBr均匀混合,研磨压片,用傅里叶变换红外光谱表征砒砂岩吸附Pb(Ⅱ)前后的表面官能团变化.
2.3 数据处理 2.3.1 吸附量砒砂岩对Pb(Ⅱ)的吸附通过差量法计算得到,并用吸附量(qe)、吸附率(η)来表示Pb(Ⅱ)的吸附.
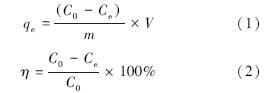
式中,qe为吸附平衡后砒砂岩对Pb(Ⅱ)的单位吸附量(mg · g-1);C0为Pb(Ⅱ)初始浓度(mg · L-1);Ce为吸附后上清液中Pb(Ⅱ)浓度(mg · L-1);V为溶液体积(mL);m为砒砂岩质量(g).
2.3.2 模型模拟(1)等温吸附模型(Do,1998):
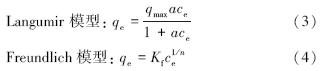
Dubinin-Radushkevich(D-R)模型:

式中,qe为Pb(Ⅱ)的平衡吸附量(mg · g-1);qmax为理论最大吸附量(mg · g-1);ce为Pb(Ⅱ)平衡浓度(mg · L-1);a、Kf、n、k均为模型常数.另外,D-R模型中ε=RTln(1+ 1/ce )为Polanyi势,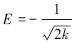 为平均吸附自由能,表征吸附类型.
为平均吸附自由能,表征吸附类型.
(2)动力学模型(Ho et al., 1998):

式中,qt、qe分别为t时刻和平衡时的吸附量(mg · g-1); k1、k2分别为准一级和准二级动力学吸附速率常数(min-1、g · mg-1 · min-1);Kd为内扩散速率常数(mg · g-1 · min-1/2);c为截距,与边界层厚度有关.
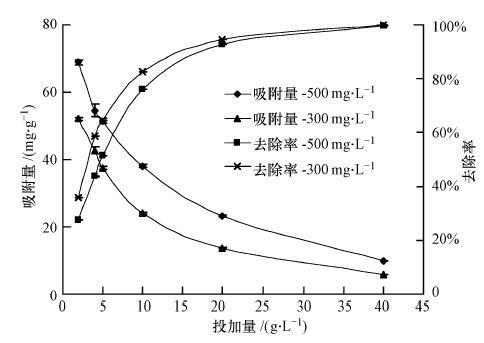
3 结果与讨论(Results and discussion) 3.1 砒砂岩用量对吸附的影响试验温度控制在(25±2)℃,砒砂岩用量在2~40 g · L-1之间,Pb(Ⅱ)初始浓度为300 mg · L-1和500 mg · L-1,溶液初始pH=5,同时以去离子水为空白对照,振荡4 h.在以上条件下砒砂岩用量对Pb(Ⅱ)的吸附效果(去除率)与吸附效率(单位质量吸附剂的吸附量)的影响见图 2.
由图 2可知,随着砒砂岩含量的逐渐增加,砒砂岩对Pb(Ⅱ)的去除效果越佳,并逐渐趋于平衡.当投加量为40 g · L-1时,去除率高达100%.尽管Pb(Ⅱ)的去除率随砒砂岩用量的增加逐渐提高,但吸附剂效率却不断降低.这可能是由于砒砂岩用量增加,其相应表面活性吸附位点、吸附官能团亦增加,导致去除率提高;而吸附效率则因砒砂岩用量增多,分配到单位质量吸附剂的吸附量减小,从而使效率降低.
 |
| 图 2 投加量对砒砂岩吸附与去除Pb(Ⅱ)的影响 Fig. 2 Effect of dosages on Pb(Ⅱ)adsorption and removal onto Pisha sandstone |
试验结果还表明,Pb(Ⅱ)初始浓度为500 mg · L-1时的吸附量比300 mg · L-1时的高,也就是说,随着Pb(Ⅱ)初始浓度的增大,吸附效率也增大,且Pb(Ⅱ)初始浓度对吸附效率具有显著影响.Pb(Ⅱ)初始浓度为500 mg · L-1时的去除率小于300 mg · L-1的,表明随着Pb(Ⅱ)初始浓度的增大,去除率逐渐减小,但相比吸附效率,溶液初始浓度对去除率的影响较小.可见吸附效果与吸附效率成反比,溶液初始浓度与吸附效果成反比.
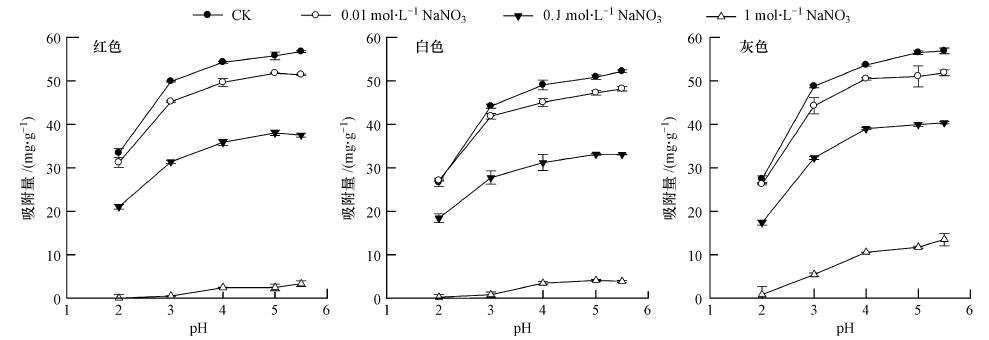
3.2 pH和离子强度对砒砂岩吸附Pb(Ⅱ)的影响Pb(Ⅱ)在水中存在各种羟合配离子形态,pH<6.0时,Pb主要以Pb2+形式存在,pH>6.0时,Pb的配位离子逐渐生成并开始沉淀(冯宁川,2009).为研究砒砂岩对Pb(Ⅱ)的吸附特性,设置溶液的初始pH为2、3、4、5、5.5,离子强度分别为0、0.01、0.1、1 mol · L-1 NaNO3,3种颜色砒砂岩用量为5 g · L-1,Pb(Ⅱ)初始浓度为500 mg · L-1,于(25±2)℃振荡4 h,其吸附过程如图 3所示.3种颜色砒砂岩在同一离子强度下,均呈现出吸附量随初始pH的增大而增加的趋势,并且平衡pH在2.31~5.01之间(数据未列出).当初始pH在2~3范围内,Pb(Ⅱ)的吸附量随pH的增大急剧增加,当初始pH>3时,Pb(Ⅱ)的吸附量随pH的增大缓慢提高.主要因为①重金属离子的吸持量与其表面电荷性质密切相关.砒砂岩的蒙脱石含量达30%(见表 1),当pH越小时,砒砂岩表面带负电荷的吸附位点越易被大量的H(Ⅰ)占据而带正电荷,导致吸附Pb(Ⅱ)的吸附位点减少,并与Pb(Ⅱ)间形成静电斥力,使得Pb(Ⅱ)的吸附量与去除率越小(于天仁等,1996;丁武泉等,2006;Sun,1993);当pH增大时,溶液H(Ⅰ)浓度减小,同时溶液中Fe(Ⅱ)、Al(Ⅲ)、Ca(Ⅱ)、Mg(Ⅱ)浓度也在减小,使得与Pb(Ⅱ)间竞争吸附能力减弱,吸附量增加(Spark et al., 1995);而且砒砂岩中含有带可变电荷的Fe、Al氧化物达11.77%~18.52%(见表 1),随着pH的增大可变负电荷增加,引力增大,对Pb(Ⅱ)的静电吸附量增加.②砒砂岩中Fe、Al氧化物约11.77%~18.52%,SiO2约62.98%~69.02%(见表 1),Fe、Al、Mn、Si的氧化物是专性吸附的主要载体(杨金燕等,2005).当pH升高时,Pb离子的形态逐渐发生变化,水解度逐渐增加,使得Pb由Pb2+转化为PbOH+,降低了与氧化物表面接触的障碍,不仅使专性吸附更易发生(丁武泉等,2006;James and Healy, 1972),而且因其离子的表观价数降低,静电吸附量也增加.
3 种颜色砒砂岩在同一pH条件下,均呈现出吸附量随离子强度的增大而显著减小的趋势(p<0.01),这是由于随离子强度的增大,改变了双电层厚度,影响了ζ电势,从而降低了Pb(Ⅱ)的静电吸附.
于天仁等(1996)对吸附受离子强度影响的研究表明,在1 mol · L-1电解质溶液中电性吸附点几乎被支持电解质完全占据,此时吸附剂对金属离子的吸附曲线可反映专性吸附的特征,可被认为是专性吸附曲线,该条件下的吸附量可被认为是专性吸附量.结合图 3可知,3种颜色砒砂岩对Pb(Ⅱ)不仅存在静电吸附也存在着一部分专性吸附.杨亚提和张一平(2003)研究表明,在pH=5的条件下,Pb(Ⅱ)在1 mol · L-1支持电解质与0.01 mol · L-1支持电解质下的吸附量的比值为专性吸附量的百分比,可知红、白、灰3种颜色砒砂岩的专性吸附比例分别为5.79%、8.66%、22.4%,表明专性吸附在吸附过程中起了一定作用,但非主要作用.灰色砒砂岩所占比例最大,可能与其自身氧化物、有机质含量和pH有关.
 |
| 图 3 pH和离子强度对砒砂岩吸附Pb(Ⅱ)的影响 Fig. 3 Effect of pH and ionic strength on Pb(Ⅱ)adsorption onto Pisha sandstones |
由上述pH和离子强度变化对吸附的影响可知,3种颜色砒砂岩对Pb(Ⅱ)的吸附主要为静电作用引起的吸附.
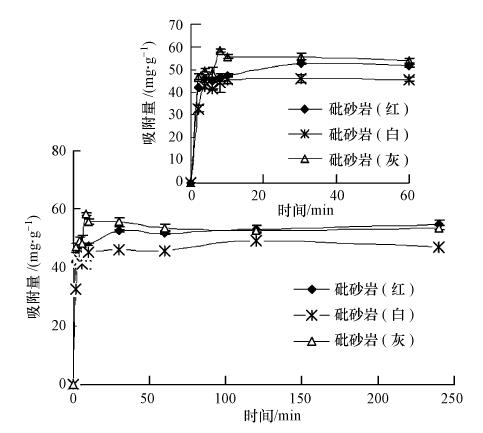
3.3 Pb(Ⅱ)在砒砂岩上的吸附动力学在(25±2)℃,砒砂岩用量为5 g · L-1,Pb(Ⅱ)初始浓度为500 mg · L-1、溶液初始pH=5的条件下,以去离子水为空白对照,振荡2、4、6、8、10、30、60、120、240 min后,红、白、灰砒砂岩对Pb(Ⅱ)的吸附随反应时间的变化过程如图 4所示.
 |
| 图 4 不同颜色砒砂岩吸附Pb(Ⅱ)的动力学曲线 Fig. 4 Kinetic process of Pb(Ⅱ)on Pisha sandstone at different colors |
由图 4可知,3种颜色砒砂岩对Pb(Ⅱ)的吸附速度都很快,30 min内就可以达到吸附平衡.整个吸附过程中,前10 min为快速吸附阶段,其吸附量可达到平衡后吸附量的90%以上,10~30 min为慢速吸附阶段,吸附量缓慢增加,并逐渐达到平衡,60 min后基本不变.其原因主要是吸附开始初期砒砂岩表面存在大量的吸附位点,吸附速率迅速提高,随着吸附时间的增加,吸附位点逐渐趋于饱和,吸附速率降低(张金利和张林林,2012).此外,灰色砒砂岩在吸附8 min时出现了“吸附过饱和点”,这可能是由于溶液中Pb(Ⅱ)与H(Ⅰ)出现了明显的竞争吸附(姚娜等,2010).
为进一步反映砒砂岩对Pb(Ⅱ)的吸附动力学特性,分别采用准一级(6)、准二级动力学模型(7)和内扩散模型(8)进行拟合.通过拟合表明(见表 2),3种砒砂岩的准二级动力学模型的拟合效果(R2=0.9995~0.9999)优于其他两种模型,且qe,cal与qe,exp更接近.以上结果表明,基于假定吸附速率受化学吸附机理控制的,包括吸附剂与吸附质之间的电子共用或电子转移的准二级动力学方程能更好地描述砒砂岩对Pb(Ⅱ)的吸附动力学过程,也就是说吸附速率被化学吸附所控制.从3种颜色砒砂岩的准二级动力学吸附速率常数k2可以看出,k2(灰)>k2(白)>k2(红),表明灰色砒砂岩的吸附速度最快.在这一点上,上文关于3种砒砂岩专性吸附所占比例,砒砂岩(灰)>砒砂岩(白)>砒砂岩(红)的结论,直接证实了3种颜色砒砂岩吸附速率的快慢.
| 表2 吸附动力学方程拟合参数 Table 2 Kinetic parameters of Pb(Ⅱ)adsorption on Pisha sandstones |
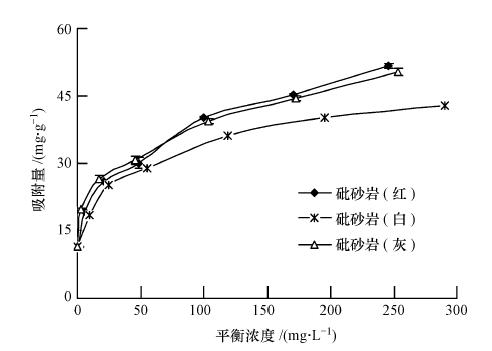
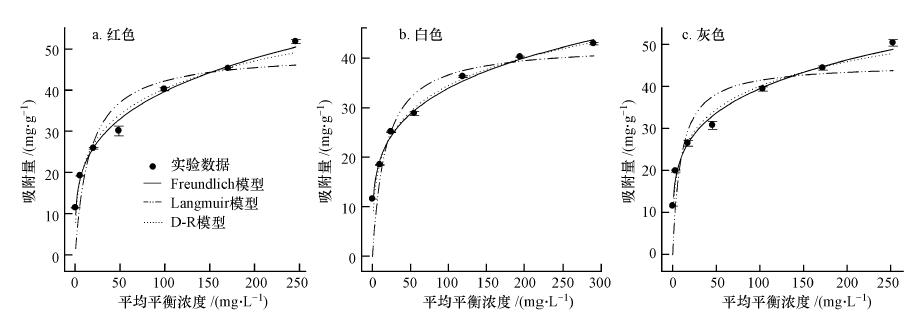
在(25±2)℃,砒砂岩用量为5 g · L-1,Pb(Ⅱ)初始浓度为50~500 mg · L-1,溶液初始pH=5的条件下,以去离子水为空白对照,振荡4 h,砒砂岩(红、白、灰)吸附Pb(Ⅱ)随平衡浓度的变化过程如图 5所示.
 |
| 图 5 不同颜色砒砂岩吸附等温线 Fig. 5 Adsorption isotherms of Pb(Ⅱ)on Pisha sandstone at different colors |
由图 5可知,3种颜色砒砂岩对Pb(Ⅱ)的平衡吸附量均随Pb(Ⅱ)平衡浓度的增大而增大,但其增大幅度逐渐减小,并在高浓度时,转向吸附饱和趋势.原因在于对于一定量的吸附剂而言,其表面的吸附位点是有限的.不同颜色砒砂岩在Pb(Ⅱ)的吸附能力上略有差异.红色砒砂岩吸附等温线与灰色大致相同,吸附量略大于灰色,白色最小.这与三者阳离子交换量的大小密切相关.
3 种颜色砒砂岩对Pb(Ⅱ)的等温吸附特征可通过Langmuir(3)、Freundlich(4)和Dubinin-Radushkevich(D-R)(5)模型拟合来进一步描述,见图 6,其模型参数和决定系数见表 3.拟合结果表明,在试验浓度范围内,Freundlich和D-R模型都得到了较好的可决系数(R2 > 0.9),Freundlich模型说明了3种颜色砒砂岩均是以非均匀孔隙或表面为主要吸附位,对Pb(Ⅱ)的吸附并不是均匀的单层吸附,且Freundlich方程参数n>1说明砒砂岩对Pb(Ⅱ)的吸附是优惠吸附;D-R模型中︳E(红)︳、︳E(白)︳和︳E(灰)︳均在8~16 kJ · mol-1之间,表明其吸附机制是离子交换.
 |
| 图 6 吸附等温模型拟合 Fig. 6 Isothermal model of Pb(Ⅱ)adsorption on Pisha sandstones |
| 表3 吸附等温模型拟合参数 Table 3 Isothermal parameters of Pb(Ⅱ)adsorption on Pisha sandstones |
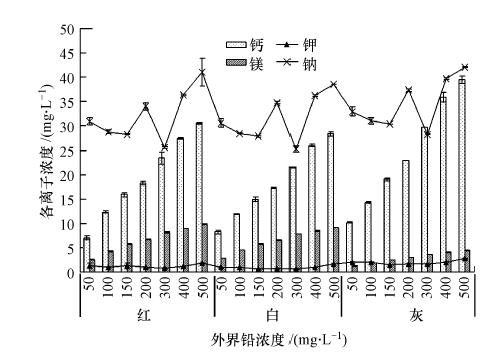
究其离子交换作用,试验对3种颜色砒砂盐吸附等温过程释放的K(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)、Mg(Ⅱ)离子浓度进行测定,分析4种离子浓度随Pb(Ⅱ)初始浓度的变化关系后发现(图 7),3种砒砂岩吸附Pb(Ⅱ)平衡后的上清液中Ca(Ⅱ)、Mg(Ⅱ)浓度均随外界初始Pb(Ⅱ)浓度的增大而显著增大,K(Ⅰ)、Na(Ⅰ)则没有明显的变化规律,说明砒砂岩吸附Pb(Ⅱ)的过程中存在着一定程度的离子释放.试验进一步对不同Pb(Ⅱ)初始浓度下Pb(Ⅱ)的吸附量与K(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)、Mg(Ⅱ)释放浓度进行了相关分析,结果见表 4.表 4中砒砂岩对Pb(Ⅱ)的吸附量与其释放的Ca(Ⅱ)、Mg(Ⅱ)浓度极显著正相关,与K(Ⅰ)、Na(Ⅰ)无明显相关,这也进一步说明,砒砂岩吸附Pb(Ⅱ)的过程中存在着一定程度的离子交换过程.而Pb(Ⅱ)与Ca(Ⅱ)、Mg(Ⅱ)均为二价阳离子,所以Ca(Ⅱ)、Mg(Ⅱ)被代换下来的机会大于其他离子(薛培英等,2011).
 |
| 图 7 砒砂岩等温吸附溶液中K(Ⅰ)、Na(Ⅰ)、Ca(Ⅱ)、Mg(Ⅱ)浓度 Fig. 7 Concentrations of K(Ⅰ),Na(Ⅰ),Ca(Ⅱ) and Mg(Ⅱ)in the isotherm adsorption solutions |
| 表4 砒砂岩Pb(Ⅱ)吸附与离子释放的相关关系 Table 4 Relationship between Pb(Ⅱ)adsorption and ion release by Pisha sandstones |
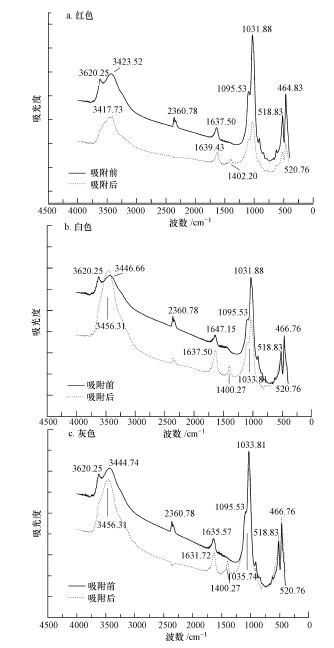
3种颜色砒砂岩吸附Pb(Ⅱ)前后的FTIR表征结果如图 8所示,可以看出吸附之前和之后的红外光谱图类似,但吸附前后三色砒砂岩都发生了某些峰的漂移以及新峰的出现.以红色砒砂岩为例,吸附前它的红外光谱特征在高频区有两个明显的吸收谱带,一个在3620.25 cm-1附近,是由于O—H的伸缩振动引起的,另一个在3423.52 cm-1附近,其归属为层间水分子的的伸缩振动;在中频区2360.78 cm-1为结晶水的伸缩振动,1637.5 cm-1附近是层间水弯曲振动,1031.88 cm-1和1095.53 cm-1附近分别有一强吸收带和明显吸收肩,它们为Si—O伸缩振动;在低频区出现的两个强的吸收谱带分别在518.83 cm-1和464.83 cm-1处附近,它们主要与Si—O与M—O(M为金属离子)的偶合振动有关(闻辂,1989).吸附重金属后,砒砂岩在3620.25 cm-1附近没有明显吸收峰,表明羟基与Pb(Ⅱ)发生了作用;而在1402.2 cm-1附近出现了一个新峰,此为碳酸盐的伸缩振动峰,其可能是形成了PbCO3之类的沉淀,这表明,砒砂岩对铅的吸附除了静电吸附、离子交换,还存在着化学沉淀.
 |
| 图 8 3种色砒砂岩吸附Pb(Ⅱ)前后的红外光谱图 Fig. 8 FTIR spectra of Pb(Ⅱ)adsorption by Pisha sandstone with three colors |
3.6 不同材料吸附Pb(Ⅱ)的能力比较
表 5对比了砒砂岩和其它吸附材料对Pb(Ⅱ)的最大吸附量.可以看出,与其它材料相比砒砂岩对Pb(Ⅱ)有着良好的吸附能力,加之较低的成本,是一种理想的天然吸附材料.
| 表5 不同吸附材料对Pb(Ⅱ)吸附能力比较 Table 5 Comparison of Pb(Ⅱ)adsorption capacity in different adsorption materials |
1)砒砂岩对Pb(Ⅱ)具有良好的吸附效果,且受用量、体系pH和离子强度的影响强烈.随pH的增大,吸附量增大;随离子强度的增大吸附量相应减小.
2)3种颜色砒砂岩对Pb(Ⅱ)的吸附在30 min内即可达到吸附平衡,吸附速率表现为:灰色>白色>红色,吸附过程均符合准二级动力学模型模拟结果.
3)在本试验浓度范围内,等温吸附模型Freundlich和Dubinin-Radushkevich(D-R)模型都能很好地解释砒砂岩对Pb(Ⅱ)的吸附过程,3种砒砂岩均是以非均匀孔隙或表面吸附为主.结合红外光谱(FTIR)表征,吸附机理以静电吸附、离子交换为主,辅以部分化学吸附和一部分化学沉淀综合起作用.
| [1] | Arou a M K,Leong S P P,Teo L Y,et al.2008.Real-time determination of kinetics of adsorption of lead (Ⅱ) onto palm shell-based act-ivated carbon using ion selective electrode[J].Bioresource Technology,99(13):5786-5792 |
| [2] | 陈坚.2009.污泥活性炭的制备及其对铅镉的吸附研究.广州:中山大学.45-47 |
| [3] | 代全林.2007.植物修复与超富集植物[J].亚热带农业研究,3(1):51-56 |
| [4] | 丁武泉,李航,杨兴伦,等.2006.重金属吸附对紫色土表面电荷性质的影响[J].农业环境科学学报,25(3):711-715 |
| [5] | Do D D.1998.Adsorption analysis:Equilibria and kinetics[M].London:Imperial College Press |
| [6] | Farooq U,Kozinski J A,Khan M A,et al.2010.Biosorption of heavy metal ions using wheat based biosorbents-A review of the recent literature[J].Bioresource Technology,101(14):5043-5053 |
| [7] | 冯宁川.2009.橘子皮化学改性及其对重金属离子吸附行为的研究.长沙:中南大学.41-44 |
| [8] | Ho Y S,McKay G.1998.A comparison of chemisorption kinetic models applied to pollutant removal on various sorbents[J].Process Safety and Env-ironmental Protection,76(4):332-340 |
| [9] | James R O,Healy T W.1972.Adsorption of hydrolyzable metal ions at the oxide-water interface Ⅲ.Ther-modynamic model of adsorption[J].Journal of Colloid and Interface Science,40(1):65-81 |
| [10] | Kabbashi N A,Atieh M A,Al-Mamun A,et al. 2009.Kinetic adsorption of application of carbon nanotubes for Pb(Ⅱ) removal from aqueous solution[J].Journal of Environmental Sciences, 21(4):539-544 |
| [11] | 鲁如坤.2000.土壤农业化学分析法[M].北京:中国农业科技出版社 |
| [12] | Mohan S V,Karthikeyan J.1997.Removal of lignin and tannin colour from aqueous solution by adsorption onto activated charcoal[J].Environmental Pollution,97(1/2):183-197 |
| [13] | Ramesh A,Lee D J,Wong J W C.2005.Adsorption equilibrium of heavy metals and dyes from wastewater with low-cost adsorbents:A review[J].Journal of the Chinese Institute of Chemical Engineers,36(3):203-222 |
| [14] | Ranganathan K.2003.Adsorption of Hg(Ⅱ) ions from aqueous chloride solutions using powdered activat-ed carbons[J].Carbon,41(5):1087-1092 |
| [15] | Sen Gupta S,Bhattacharyya K G.2008.Immobilization of Pb(Ⅱ),Cd(Ⅱ) and Ni(Ⅱ) ions on kaolinite and montmorillonite surfaces from aqueous medium[J].Journal of Environmental Management,87(1):46-58 |
| [16] | Spark K M,Johnson B B,Wells J D.1995. Characterizing heavy metal adsorption on oxides and oxyhydroxides[J].European Journal of Soil Science,46:621-631 |
| [17] | Sun H Y.1993.Effect on Zn adsorption on charge of variable charge soils[J].Pedosphere,(3):239-246 |
| [18] | Wang S,Dong Y,He M,et al.2009.Characterization of GMZ bentonite and its application in the adsorption of Pb(Ⅱ) from aqueous solutions[J].Applied Clay Science,43(2):164-171 |
| [19] | 闻辂.1989.矿物红外光谱学[M].重庆:重庆大学出版社.88-100 |
| [20] | 薛培英,李庆召,颜昌宙,等.2011.黑藻吸附Cu2 +机制研究[J].环境科学,32(6):1614-1619 |
| [20] | 杨金燕,杨肖娥,何振立,等.2005.土壤中铅的吸附-解吸行为研究进展[J].生态环境,14(1):102-107 |
| [21] | 杨亚提,张一平.2003.恒电荷土壤胶体对Cu2+、Pb2+的静电吸附与专性吸附特征[J].土壤学报,40(1):102-109 |
| [22] | 姚娜,侯红,王林权,等.2010.2种典型土壤中外源Ag+的吸附行为及形态转化研究[J].环境科学,31(4):1085-1091 |
| [23] | 余彬,郑钦玉.2007.土壤铅污染的防治技术[J].安徽农学通报,13(13):56-60 |
| [24] | 于天仁,季国亮,丁昌璞.1996.可变电荷土壤的电化学[M].北京:科学出版社.66-85 |
| [25] | Zehhaf A,Benyoucef A,Berenguer R,et al.2012.Lead ion adsorption from aqueous solutions in modified Algerian montmorillonites[J].Journal of Thermal Analysis and Calorimetry,110(3):1069-1077 |
| [26] | 张从.2000.污染土壤生物修复技术[M].北京:中国环境科学出版杜.1-42 |
| [27] | 张德全,宋日生,梁俊林,等.2006.砒砂岩区的侵蚀及危害 //发展水土保持科技、实现人与自然和谐—中国水土保持学会第三次全国会员代表大会学术论文集 |
| [28] | 张金利,张林林.2012.重金属Pb(Ⅱ)在黏土上吸附特性研究[J].岩土工程学报,34(9):1584-1589 |
| [29] | 赵庆良,夏小青,王广智,等.2011.沸石及其改性材料硅炭素处理含铅废水[J].环境科学研究,24(9):1023-1028 |
| [30] | Zhu J Z,Yang J,Deng B L.2010.Ethy-lenediamine-modified activated carbon for aqueous lead adsorption[J].Environmental Chemistry Letters,8(3):277-282 |
 2014, Vol. 34
2014, Vol. 34


