2. 陕西省微生物研究所,西安 710043
2. Microbiology Insti-tute of Shaanxi,Xi'an 710043
石油烃污染一直是我们面临的环境问题之一.生物修复技术因其成本低,不易对环境产生负面影响,而被广泛应用(Xing and Pignatello,1998).长链烷烃和芳香烃等由于水溶性小,致使其生物可利用性差,一般需投加表面活性剂以提高其修复效率(陈延君等,2007; 朱生凤等,2010).生物表面活性剂具有无毒、易降解,明显降低水表面张力,可增溶疏水性有机物等优点,而成为相关研究的热点(纪卿和云喜玲,2003; Bognolo,1999; Harvey et al.,1990).鼠李糖脂是其中最为常用的微生物表面活性剂,其化学结构为鼠李糖和碳链长短不同的饱和或不饱和脂肪酸等形成的糖脂,其中有双糖和单糖脂,脂肪酸碳链长短多在8~10个碳(Nie et al.,2010).一般自然发酵所产的鼠李糖脂为其混合物.据文献(霍丹群等,2009; 常虹等,2013)报道,在代谢石油烃时,鼠李糖脂能促进菌株生长,促进石油烃的降解,加速污染环境的修复速度.据文献(Sotirova et al.,2009;朱生凤等,2010)报道,鼠李糖脂可通过乳化增溶作用提高烃类污染物的溶解度,进而提高石油烃的生物可利用性.我们实验室前期分离获得一株铜绿假单胞菌NY3(Nie et al.,2010),能高产鼠李糖脂,且快速降解石油烃.本论文研究了NY3菌所产鼠李糖脂对该菌代谢烃类的碳源谱的扩展作用及其以多环芳烃为碳源生长的促进作用,研究并解析了NY3菌代谢烃的过程中,鼠李糖脂对菌体细胞表面特性、烃在本体溶液与细胞间的传质效率等的影响作用.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 菌种来源铜绿假单胞菌NY3(属于假单胞菌属,革兰氏阴性菌),本实验室分离并鉴定(Nie et al.,2010).
2.1.2 试剂和培养基无机盐培养基:1.0 g NH4NO3,1 mL微量元素(常虹等,2013),0.5 mL 1 mol · L-1 MgSO4 · 7H2O溶液,0.1 mL 1 mol · L-1 CaCl2 · 2H2O溶液,25 mL磷酸盐缓冲液(K2HPO4 42 g,NaH2PO4 28 g),pH为7.5,用蒸馏水定容至1000 mL,121 ℃高压水蒸气灭菌30 min,备用.
LB培养基:NaCl 5.0 g,牛肉膏3.0 g,蛋白胨10.0 g,蒸馏水1000 mL;pH调节为7.5左右,121 ℃灭菌30 min,备用.
2.2 实验方法 2.2.1 NY3种子液的制备将NY3接种于LB培养基中,30 ℃,150 r · min-1,好氧振荡24 h,OD600nm达到1.85 ± 0.06,备用.
2.2.2 鼠李糖脂的发酵与提纯用NY3菌发酵产鼠李糖脂,按文献(卢国满等,2006)中方法提取鼠李糖脂纯品,储于4 ℃冰箱,备用.
2.2.3 原油的生物降解实验原油为陕北长庆油田第二采油厂的脱水原油,含蜡较多,常温下易凝固(Zhang et al.,2005; 常虹等,2013).在无菌条件下,锥形瓶中加入200 mL上述无机盐培养基,直接加入30 min紫外灯照射后的原油(由于原油中无水,菌体不易生存,表面可能附着的菌体用紫外灯照射法灭菌),浓度达1000 mg · L-1,NY3菌接种量为8%(V/V).加入鼠李糖脂,浓度为100 mg · L-1,以未加鼠李糖脂为对照.降解体系和对照均做3组平行样.30 ℃,150 r · min-1摇床培养.定时采样,测降解液的pH值和OD600nm.相同的平行样,摇床培养4 d后,用3×10 mL的正己烷萃取,合并有机相,定容,利用气相色谱测定各烃组分的降解率.
2.2.4 鼠李糖脂对NY3菌以单一烃类为碳源和能源生长的影响实验无菌条件下,按2.2.3节中的条件加无机盐、鼠李糖脂和NY3菌种子液,再外加各单一烃(如表 1所示),使其浓度分别达800 mg · L-1.以未加鼠李糖脂为对照,3组平行实验.30 ℃,150 r · min-1摇床培养4 d,测降解液的pH值和OD600nm.以4 d的OD600nm减0时刻OD600nm的差值表示菌种净生长量.
| 表1 NY3菌以单一烃类为碳源和能源生长及其产酸特征 Table 1 Growth and acids production properties of Pseudomonas aeruginosa NY3 under the single hydrocarbons as the sole carbon source and energy |
无菌操作条件下,100 mL无机盐培养基于250 mL锥形瓶中,以2%(V/V)的正十六烷作为唯一碳源,NY3菌接种量为8%,在30 ℃,150 r · min-1的恒温振荡培养5 d.同时LB培养基培养NY3菌.10000 r · min-1条件下离心10 min,收集菌体细胞,用无机盐培养液洗涤3次后,制成菌悬液,OD400nm调节为1.68 ± 0.08.两种菌悬液分别和鼠李糖脂进行吸附作用.各取5 mL上述菌悬液与5 mL浓度为0、20、40、60、80、100、120、140 mg · L-1的鼠李糖脂溶液在50 mL锥形瓶中混合.30 ℃,150 r · min-1的恒温振荡1.5 h,使菌体细胞与鼠李糖脂充分作用.再在10000 r · min-1条件下离心10 min,收集菌体,用无机盐培养液洗涤3次,分散到5 mL的无机盐培养液中,在400 nm处测定该菌悬液的吸光度,3组平行实验.以菌体与鼠李糖脂吸附作用前后OD400nm的差值反映鼠李糖脂与菌体细胞表面的相互作用(任芳谊,2008).
菌体表面的疏水性通过BATH方法测定(Zhang and Miller, 1994; 任芳谊,2008).将上述与鼠李糖脂作用后的菌悬浮液5 mL与1 mL正十六烷混合,充分振荡后静置5 min,再剧烈振荡60 s,然后室温静置分层30 min,下层水相菌悬液用移液枪小心吸出,测OD400nm.按式(1)计算和鼠李糖脂作用后的菌体表面的疏水性并求其平均值:
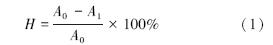
式中,H为菌体表面疏水性;A0为吸附前菌液吸光度;A1为吸附后菌液吸光度.
2.2.6 NY3菌细胞烃类浓度的测定取4瓶100 mL 2.2.1节中制备的NY3菌种子液,分别在10000 r · min-1条件下离心10 min,收集菌体,用去离子水洗涤3次,分别悬于20 mL去离子水中.分别加1 mL正十六烷,并投加鼠李糖脂浓度达100 mg · L-1.30 ℃,以未加鼠李糖脂为对照组.150 r · min-1恒温振荡20、40、60、90 min后,10000 r · min-1条件下离心10 min,收集菌体,并用去离子水洗涤3次,加入20 mL 10% NaClO溶液,40 ℃,150 r · min-1下裂解细胞40 min,往破胞液中加5 mL正己烷萃取正十六烷,以正十二烷为内标物(陈帆等,2000).每个样品平行3组实验.用气相色谱测定细胞中正十六烷的含量.
2.2.7 气相色谱测定烃类的方法和色谱条件气相色谱测定原油组分及其降解率:将2.2.3节中萃取的原油溶于2 mL正己烷中,用安捷伦6890N单检测器气相色谱仪(FID检测器),用标准物质鉴定烷烃组分,并计算各组分的降解率.色谱条件:5% Phenyl Methyl Siloxane HP-5毛细管气相色谱柱(30 m×320 μm×0.25 μm).载气:99.99%高纯氮气.进样口温度300 ℃,分流比31.1 ∶ 1.检测器温度:300 ℃,氢气流量40 mL · min-1,空气流量450 mL · min-1,进样量1 μL.程序升温:初始50 ℃,保留7 min,再以20 ℃ · min-1升温至100 ℃,保留1 min,最后以5 ℃ · min-1升温至290 ℃,保留5 min.
正十六烷含量测定的气相条件:进样口温度250 ℃,分流比50.0 ∶ 1.程序升温:初始160 ℃,保留1 min,再以20 ℃ · min-1升温至260 ℃,保留6 min.其他条件同上.
2.2.8 傅里叶红外谱图将上述与浓度分别为0和100 mg · L-1的鼠李糖脂作用1.5 h后的NY3菌体(以正十六烷为唯一碳源和LB培养基生长所收集的)(见2.2.5节)充分振荡洗涤,离心收集,真空干燥,与KBr充分混合研磨,压片制样,用IRPrestige-21/FTIR-8400S傅里叶红外光谱仪器测量(时有明等,2008).
3 结果(Results) 3.1 表面活性剂对NY3菌降解烃类的影响作用 3.1.1 鼠李糖脂对NY3菌降解原油的影响按照2.2.3节中的实验方法,NY3菌以原油为唯一碳源生长,测定不同条件下生长液的pH值和OD600nm,结果如图 1所示.由图 1可知,在未投加鼠李糖脂条件下,NY3菌在半固体原油上生长速率非常缓慢,48 h OD600nm仅为0.570,96 h OD600nm可达到1.083.小幅度pH值下降说明有少量酸产生,产酸是烃被氧化代谢的证据.添加鼠李糖脂后,NY3菌能以半固体原油为唯一碳源快速生长.24 h后OD600nm已经达到1.152(已扣除鼠李糖脂产生的乳化现象所贡献的光密度),48 h时已达到最高点4.380,随NY3菌快速生长,发酵液pH也明显下降;菌体生长量达到最大时,pH值也降至最低,pH=6.48.随后,菌的生长已趋于稳定,且有些微的下降,发酵液pH出现小幅度上升趋势.NY3菌在长势最旺盛的时段内,pH的下降也是最明显的,说明NY3菌在生长最快的时候,产酸也是最多的.
 |
| 图 1 铜绿假单胞菌NY3在半固体原油中的生长及其产酸特征 Fig. 1 Growth curves and properties of acidic compound production by Pseudomonas aeruginosa NY3 on semi solid crude oil as carbon sources |
一般认为,随着正构烷烃碳链的增长,其疏水性逐渐增大,生物可利用性也逐渐降低.NY3菌生长4 d后,按照2.2.7节中的实验方法,测定剩余原油中各组分的含量,结果如图 2所示.从图 2c结果看,添加鼠李糖脂的体系反应4 d后,原油中的液态烷烃几乎完全降解,而固态烷烃也有大幅度的降解.鼠李糖脂明显加快了半固体原油中烃的降解.与起始时刻原油气相色谱如图 2a所示的结果相比,计算各组分去除率,然后,比较投加和未投加鼠李糖脂的降解率,计算鼠李糖脂对烃类降解的提高效率结果,如图 2d所示.
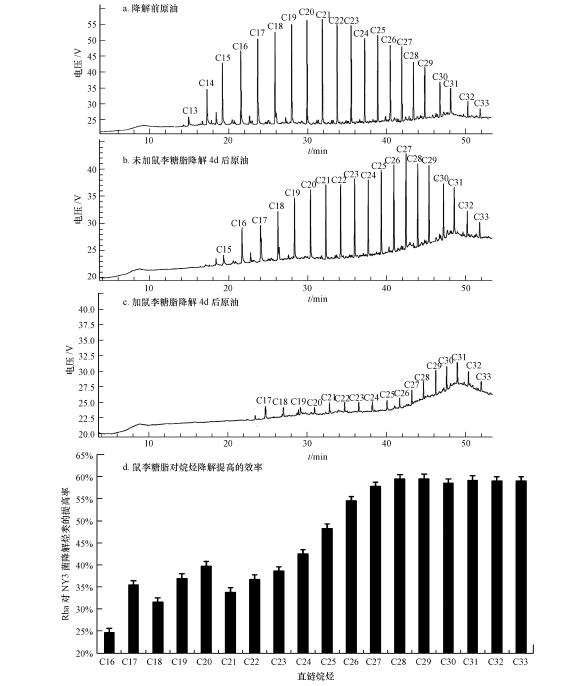 |
| 图 2 鼠李糖脂对NY3菌降解原油中烃类效率的促进作用 Fig. 2 Improvement of rhamnolipid on degradation of crude oil by Pseudomonas aeruginosa NY3 |
图 2可以明显看出,在添加鼠李糖脂后,NY3菌对原油的降解率均有提高,且提高率随着烷烃碳链的增加而增加,对正二十六烷至正三十三烷降解效率提高幅率可达约60%.因此,NY3菌所产鼠李糖脂,可以显著提高烷烃的可生物利用性,尤其对长链烷烃.文献(吴小红等,2006)报道,添加鼠李糖脂后受试菌体降解石油烃的半衰期缩短了近1倍,石油烃的降解率提高了11%~26%.而对本文受试菌NY3来说,添加鼠李糖脂对原油中长链烃的降解率提高幅度可高达60%,因此,鼠李糖脂使该菌降解烃类的碳链长度大大增加,扩大了其代谢的碳源谱.
3.1.2 鼠李糖脂对NY3菌降解单一烃类的影响作用为进一步证明投加鼠李糖脂能促进了烃的代谢过程,按照2.2.4节中的实验方法,分别以单一烷烃和4个多环芳烃(菲、芴、荧蒽、芘)为碳源,测定4 d后NY3菌的生长量,结果如表 1所示.从表 1结果看,投加鼠李糖脂后,NY3菌以所有受试烃为唯一碳源均能生长,但鼠李糖脂对C22~C32正构烷烃和多环芳烃等碳源的代谢促进作用更明显.与上述原油中混合烃降解时获得的结果一致.
3.2 鼠李糖脂对NY3菌表面性能及其吸附烃类性能的影响 3.2.1 菌细胞表面性能的比较鼠李糖脂是表面活性剂,能提高疏水性有机物的表观溶解度,因而提高其生物可利用性(Doong and Lei, 2003).按前期初步研究结果推测,鼠李糖脂也可与菌体相互吸附,可改变菌体表面的特性,从而改变菌体对疏水性有机物的传质方式和速度,从而加速其可利用性.为验证这一推测,按照2.2.5节中的实验方法,取5 mL菌悬液(OD400nm =1.68 ± 0.08)与5 mL不同浓度鼠李糖脂溶液(如图 3横坐标所示)作用后,离心、洗涤、收集菌体,并用等体积的无机盐溶液悬浮,以与鼠李糖脂作用前后OD400nm的差值,计算被鼠李糖脂吸附的菌体量,结果如图 3a所示.同时测定吸附鼠李糖脂后所收集菌体的表面疏水性,结果如图 3b所示.从图 3a看,NY3菌新鲜菌体细胞易与鼠李糖脂相互作用,被鼠李糖脂吸附的细胞量随着鼠李糖脂浓度的增加而增加.而LB培养基中生长的菌体比以正十六烷为唯一碳源生长的菌体细胞与鼠李糖脂亲和力更大,吸附量更大,导致吸附前后菌体的表面疏水性差别更大,如图 3b所示,两种培养基所生长的新鲜菌体疏水性变化趋势无明显差别.与鼠李糖脂作用后,LB培养基生长的菌体疏水性比正十六烷为唯一碳源生长的菌体细胞疏水性提高约30%,说明鼠李糖脂对菌体的表面特性影响很大.在实验过程中我们观察到,与作用前相比,由于鼠李糖脂作用后的菌体细胞分散更不易收集,洗涤时需更高的离心速度.并且,随着鼠李糖脂浓度的增加,菌体细胞的收集也更困难,菌体收集量减少,菌体更易分散于洗涤溶液中.当鼠李糖脂浓度达100 mg · L-1,作用后菌体收集量达到最小值,这是由于被鼠李糖脂吸附所造成的菌体细胞损失.作用1.5 h后离心收集时细胞易分散,说明鼠李糖脂已经改变了菌体表面特性,结合3.1节中的结果分析,鼠李糖脂与细胞作用后,细胞表面的疏水性增加,有利于细胞对烃类物质的吸收与代谢.这一结果与文献(任芳谊,2008)中报道的结果相似.
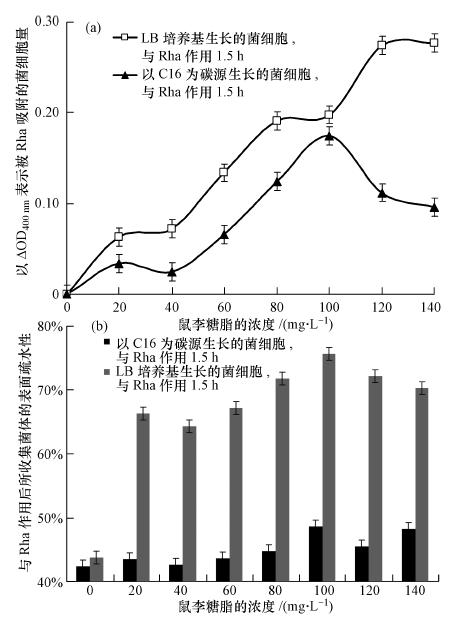 |
| 图 3 鼠李糖脂浓度对NY3菌表面性能的影响 Fig. 3 Effect of the NY3 strain surface properties under different dosages of rhamnolipid surfactants |
用LB培养基生长的NY3菌细胞,在体系中加入100 mg · L-1的鼠李糖脂后,按照2.2.6节及2.2.7节方法进行实验,结果如图 4所示.从图 4可知,在体系中加入100 mg · L-1的鼠李糖脂后,作用20、40、60、90 min时,NY3菌细胞所积聚的正十六烷量均较未添加鼠李糖脂组的高.添加鼠李糖脂后,反应20 min,菌细胞所积聚的正十六烷量提高了0.63 nmol · mg-1(以干菌计),当反应到90 min后,其增加量可达到1.10 nmol · mg-1(干菌).
 |
| 图 4 鼠李糖脂对NY3菌细胞摄取十六烷效率的影响 Fig. 4 Effect of rhamnolipid on the intake efficiency of hexadecane by NY3 cells |
说明鼠李糖脂是一种两亲性物质(Lang and Wullbrandt, 1999; 梁生康等,2005),可在油水界面定向排列成单分子膜.其亲水基一般由1~2个鼠李糖环构成,可与菌充分接触;憎水基由不同长度碳链的脂肪酸构成,与烃类物质接触,从而使烃类物质进入菌细胞,加速疏水性有机物的传质速度,促进NY3菌体对烃类化合物的摄取能力.
3.3 鼠李糖脂对NY3菌细胞结构特征的影响按照2.2.8节中的方法,分别测定以十六烷为唯一碳源的无机盐培养基和以LB培养基生长的NY3菌细胞与鼠李糖作用前后的红外光谱,结果如图 5所示.3440 cm-1处中等强度、且较宽的吸收带是O—H和N—H等(亲水键)伸缩振动吸收引起的;2900~3000 cm-1范围内较弱谱峰为C—H键(疏水键)的伸缩振动峰,1200~1400 cm-1范围内较强的峰为C—H键的变角振动峰,两者均为脂肪链的特征吸收峰(李涛和阳辛凤,2009),可反映菌体细胞中疏水性烃基含量.1654 cm-1、1543 cm-1峰来自蛋白质中酰胺Ⅰ、酰胺Ⅱ的特征振动峰;800~1200 cm-1峰为多糖特征峰,其中最强峰1080 cm-1峰为碳水化合物C—O—C的伸缩振动峰(赵德璋等,2007).
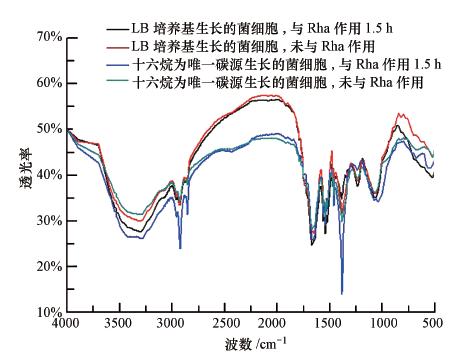 |
| 图 5 与鼠李糖脂作用前后对NY3菌体的红外谱图 Fig. 5 IR spectrum of NY3 cells before and after interaction with rhamnolipid |
参照文献(樊晓宇等,2012)中的方法,计算各峰面积,并计算3440 cm-1处峰面积与其它各峰面积的比值,结果发现,3440 cm-1处峰面积与1654 cm-1、1543 cm-1、1080 cm-1处峰面积的比值,和细胞是否与鼠李糖脂作用关系不大,即投加鼠李糖脂与否对NY3菌体细胞中蛋白质、碳水化合物含量影响不大.而3440 cm-1处峰面积与2900~3000 cm-1、1200~1400 cm-1处峰面积比值与投加鼠李糖脂与否的关系较大,如表 2所示.由表 2结果看,与未投加鼠李糖脂相比,与100 mg · L-1鼠李糖脂溶液作用后,菌体细胞在3440 cm-1处峰面积与2900~3000 cm-1波段峰面积、1200~1400 cm-1波段峰面积的比值均明显降低,说明添加鼠李糖脂后,菌体细胞中疏水性脂类的相对含量增加.这种增加可能是由鼠李糖脂的吸附引起,也可能是由于细胞摄入烃类的速度加快,使得烃或其氧化产物或类似于聚羟基脂肪酸(PHA)类物质在细胞内的积聚而引起的.
| 表2 鼠李糖脂对NY3菌细胞的红外吸收特性的影响 Table 2 Effect of rhamnolipid on the FT-IR absorption properties of NY3 cells |
1)与未加鼠李糖脂相比,油含量为1000 mg · L-1,投加鼠李糖脂100 mg · L-1,生长24和48 h,NY3菌净的生长量分别提高8.60和6.68倍,且产酸量较多,pH明显下降,烷烃降解率也明显提高,且提高率随着烷烃碳链的增加而增加,对正二十六烷至正三十三烷降解效率提高幅率可达约60%.
2)鼠李糖脂小于100 mg · L-1时,随其浓度增高,菌体表面的疏水性略有增加.以LB培养基生长的NY3菌细胞,在100 mg · L-1的鼠李糖脂和十六烷存在下,反应20、90 min,菌细胞所积聚的正十六烷量比未加鼠李糖脂时分别增加了0.63、1.10 nmol · mg-1(以干菌计).说明鼠李糖脂能加快疏水性有机物的传质速度.
3)红外光谱分析结果表明,与未投加鼠李糖脂相比,NY3菌生长时,鼠李糖脂使菌体细胞中疏水性脂类的相对含量明显增加.
| [1] | Bognolo G.1999.Biosurfactants as emulsifying agents for hydrocarbons[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 152(1/2):41-52 |
| [2] | 常虹,聂麦茜,葛碧洲,等.2013.铜绿假单胞菌NY3所产表面活性剂对原油降解的影响[J].环境工程学报,7(2):771-776 |
| [3] | 陈帆,黄禹,叶慧.2000.一种气相色谱定量方法的研究[J].温州师范学院学报(哲学社会科学版),(6):38-39 |
| [4] | 陈延君,王红旗,王然,等.2007.鼠李糖脂对微生物降解正十六烷以及细胞表面性质的影响[J].环境科学,28(9):2117-2122 |
| [5] | Doong R A,Lei W G.2003.Solubilization and mineralization of polycyclic aromatic hydrocarbons by pseudomonas putida in the presence of surfactant[J].Journal of Hazardous Materials,96(1):15-27 |
| [6] | 樊晓宇,聂麦茜,徐鹏,等. 2012.左氧氟沙星对铜绿假单胞菌NY3产表面活性剂特性的影响作用[J].精细化工,29(3):245-249 |
| [7] | Harvey S,Elashvili L,Valdes J J,et al. 1990.Enhanced removal of Exxon Valdez spilled oil from Alaskan gravel by a microbial surfactant[J].Nature Biotechnology,8(3):228-230 |
| [8] | 霍丹群,易志红,侯长军.2009.鼠李糖脂对微生物降解石油烃废水的影响[J].生物技术,19(4):78-81 |
| [9] | 纪卿,云喜玲.2003.表面活性剂的分类、性能及其应用原理[J].集宁师专学报,25(4):58-59 |
| [10] | Lang S,Wullbrandt D.1999.Rhamnose lipids-biosynthesis,microbial production and application potential [J].Applied Microbiology and Biotechnology,51(1):22-23 |
| [11] | 李涛,阳辛凤.2009.糖脂类表面活性剂产生菌株的筛选[J].热带农业工程,33(1):5-8 |
| [12] | 梁生康,王修林,陆金仁,等.2005.假单胞菌O-2-2产鼠李糖脂的结构表征及理化性质[J].精细化工,22(7):499-502 |
| [13] | 卢国满,刘红玉,曾光明,等.2006.鼠李糖脂快速定量分析方法及其影响因素研究[J].微生物学通报,33(4):106-111 |
| [14] | Nie M Q,Yin X H,Ren C Y, et al.2010.Novel rhamnolipid biosurfactants produced by a polycyclic aromatic hydrocarbon-degrading bacterium Pseudomonas aeruginosa strain NY3[J].Biotechnology Advanc-es,28(5):635-643 |
| [15] | 任芳谊.2008.鼠李糖脂在微生物表面的吸附及其对微生物表面性质的影响 .长沙:湖南大学 |
| [16] | 时有明,刘刚,周湘萍,等.2008.基于曲线拟合的形态相似鹅膏菌的傅里叶变换红外光谱研究[J].分析化学,36(8):1105-1108 |
| [17] | Sotirova A,Spasova D,Vasileva-Tonkova E,et al . 2009.Effects of rhamnolipid-biosurfactant on cell surface of Pseudomonas aeruginosa[J].Microbiological Research,164(3):297- 303 |
| [18] | 吴小红,曾光明,袁兴中,等.2006.生物表面活性剂鼠李糖脂对水体中石油烃降解的促进作用[J].应用与环境生物学报,12(4):570-573 |
| [19] | Xing B S,Pignatello J J.1998.Competitive sorption between 1,3-dichlorobenzene or 2,4-dichlorophenol and natural aromatic acid in soil organic matter[J].Environmental Science & Technology,32(5):614-619 |
| [20] | Zhang G L,Wu Y T,Qian X P, et al.2005.Biodegradation of crude oil byPseudomonas aeruginosa in the presence of rhamnolipids[J].Journal of Zhejiang University Science,6(8):725-730 |
| [21] | Zhang Y, Miller R M.1994.Effect of a Pseudomonas rhamnolipid biosurfactant on cell hydrophobicity and biodegradation of octadecane[J].Applied and Environmental Microbiology,60(6):2101-2106 |
| [22] | 赵德璋,刘刚,宋鼎珊,等.2007.鹅膏菌的傅里叶变换红外光谱研究[J].光谱学与光谱分析,27(6):1086- 1089 |
| [23] | 朱生凤,梁生康,吴亮,等.2010.鼠李糖脂及其产生菌对原油生物降解影响研究[J].环境科学与技术,33(5):15-20 |
 2014, Vol. 34
2014, Vol. 34


