2. 生态系统保护与恢复杭州市重点实验室,杭州师范大学,杭州 310036
2. Key Laboratory of Hangzhou City for Ecosystem Protection and Restoration,Hangzhou Normal University,Hangzhou 310036
底泥磷向上覆水的释放与水体富营养化关系密切(Lawrence et al., 1965; Sundby et al., 1992).目前,人们主要运用以原位覆盖和疏浚为代表的物理修复技术、化学修复技术及生态修复技术来控制沉积物磷素的释放.例如,林建伟等(2007)采用1 L的广口试剂瓶作为模拟反应器,发现改性天然沸石材料和有机改性沸石覆盖均能抑制某富营养化景观水体底泥中磷的释放,且有机改性沸石的作用更为显著.毛成责等(2009)研究发现,氯化镧改性能使底泥从释放磷的状态转变为吸附磷的状态,改性后平均每克底泥能吸附磷18.4 μg,吸附率为13.25%.有学者在研究沉水植物对沉积物磷形态及其上覆水水质的影响时发现,在无外源磷输入的情况下,菹草生长使难溶性铁磷含量增加为800 mg · kg-1,其含量占TP总量的51%,而对照组中铁磷含量只占TP总量的16%(徐会玲等,2010; Karjalainen et al., 2001).目前,工程中常用曝气复氧技术来提高水体的溶解氧浓度,以此达到氧化底泥并抑制内源磷释放的目的(袁文权等,2004; 李大鹏等,2007).当富营养水体中的内源磷负荷以有机磷为主,且水体和沉积物中金属离子不足时,仅通过曝气复氧技术难以达到治理效果,此时需要补充一定剂量的金属离子(黄建军,2009). Murphy等(1998)研究发现,金属离子投入水体后,会与底泥中释放出来的磷形成沉淀,阻止磷向水体的扩散.因此,曝气复氧与化学修复技术相结合能有效地达到抑制底泥磷释放的效果.
现有的工程技术措施主要着重于对磷的治理效果,从生态安全的角度来评价技术安全性的研究并不多.微生物是底泥生态系统中最具代表性、最灵敏的物种,其组成类别及多样性的变化能够有效地反映工程技术对它们的影响.变性梯度凝胶电泳(DGGE)技术是由Fischer和Lerman于1979年最先提出的用于检测DNA突变的一种电泳技术(Murphy et al., 1998),该技术能够根据电泳条带的多寡和亮度辨别样品中微生物的种类、丰度和优势类群的数量,分析微生物的多样性,具有检测极限低、分离快速简便、重复性效果好、能同时分析多个样品的优点(赵兴青等,2006).1993年,Muyzer等(1993)首次将DGGE技术应用于微生物生态学研究,并证实这种技术在研究自然界微生物群落的遗传多样性和种群差异方面具有明显的优越性.DGGE目前已发展成为研究微生物群落结构的重要分子生物学手段(Lapara et al., 2001; Santegoeds et al., 1998),同时也成为研究土壤微生物多样性及种群演替的重要方法之一.赵兴青等(2006)就采用PCR-DGGE分子指纹图谱技术比较了南京市玄武湖、莫愁湖和太湖不同位置的表层沉积物微生物群落结构.柴蓓蓓(2012)将PCR-DGGE技术用于研究水源水库沉积物多相界面污染物迁移转化对微生物群落结构的影响,结果表明,在不同静水压下,微生物群落在结构及遗传性方面均表现出显著差异.因此,在分子水平对微生物群落的研究也可以运用到修复工程中,对修复技术进行安全性评价.
为了有效抑制水体中内源磷的释放,本文将微臭氧曝气复氧技术与原位化学修复技术相结合,研究微臭氧曝气加氢氧化钙复合技术抑制底泥磷素释放的效果,并运用PCR-DGGE技术对实验处理后的底泥微生物种群进行研究,检测经过处理后的底泥中微生物种群结构和微生物多样性的变化规律,对修复技术进行安全性评价,以期为污染水体的治理与生态修复提供基础理论依据.
2 材料与方法(Materials and methods) 2.1 实验装置及材料利用增加采样绳及刻度标记后的PSC-1/40彼得森挖泥器采集西湖表层30 cm底泥样品,在现场将泥样均匀混和后,置于具盖塑料盒中运回实验室备用;采集西湖上覆水(TP浓度为0.1 mg · L-1),置于18.9 L矿泉水桶中运回实验室备用.其他仪器包括:自制微臭氧曝气加药一体机(实用新型,专利号:ZL201020130427.0)、YXQ-LS-30SII立式压力蒸汽灭菌器、岛津UV-2450分光光度计、LDZ5-2型台式低速离心机、上海雷磁PHS-25型数显指针酸度计、土壤微生物DNA提取试剂盒、PCR纯化试剂盒等.
2.2 模拟反应器实验试验采用自制模拟实验柱(高120 cm,直径10 cm),为不透明封底PVC管,并向其中加入取自西湖的底泥(高30 cm)和上覆水(高50 cm).在实验柱内放入取样管,取样管底端置于泥面正上方5 cm处,用于抽取上覆水水样,静置3 d后进行实验.采用自制微臭氧曝气加药一体机对模拟反应器进行微臭氧曝气加氢氧化钙复合实验.模拟反应器示意图见图 1.
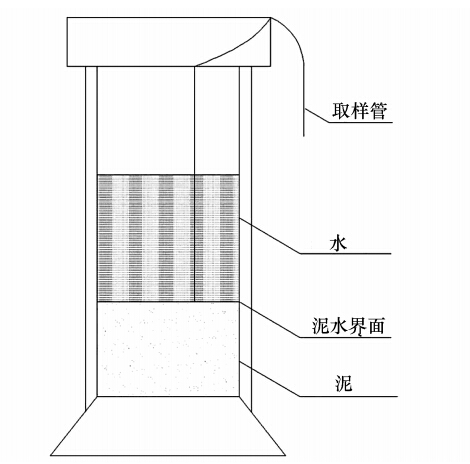 |
| 图 1 模拟反应器示意图 Fig. 1 Diagram of simulate reactor |
分组:I组为不做任何处理的空白对照组;II组为臭氧曝气强度为0.6 g · min-1的单一微臭氧曝气组,曝气时间为1 h;III组为0.6 g · min-1微臭氧曝气+ 0.01 mol · L-1 Ca(OH)2溶液复合实验组;IV组为0.6 g · min-1微臭氧曝气+0.02 mol · L-1 Ca(OH)2溶液复合实验组;III和IV组曝气时间均为1 h.使用曝气加药一体机完成每组处理,Ca(OH)2溶液通过曝气头表面的药液溢出孔加入反应器中.
取样:微臭氧曝气前,测定加入水样的TP浓度;分别于曝气后30 min、12 h、24 h、36 h、2.0 d、2.5 d取样,之后每隔0.5 d取1次;1周后每天取样1次,直至装置内TP浓度稳定.每次取水样25 mL,同时补充回原始水样25 mL.水样取出后立即用电极法测定所取水样pH,然后对水样进行离心(3000 r · min-1,5 min),取离心上清液测定其TP浓度.
2.3.2 检测方法pH值采用电极法测定;钼酸铵分光光度法检测TP浓度(国家环境保护总局,2002):取1 g沉积物,加入浓硫酸+高氯酸溶液后置于电炉上加热消煮60 min,冷却后取上清液测定TP浓度,计算出沉积物中的TP含量.
底泥中各形态磷含量检测方法(刘素美等,2001):取2 g沉积物,向其中加入30 mL 1 mol · L-1 NH4Cl溶液,于离心管中振荡提取1 h,离心分离出溶液,将剩下的沉淀物+30 mL 0.5 mol · L-1NH4F溶液,于离心管中继续振荡提取1 h,离心分离出上清液,用钼酸盐比色法测定溶液中磷的浓度,计算出沉积物中铝磷的含量;将上步骤中剩下的沉淀物+20 mL饱和NaCl溶液振荡10 min,离心10 min,弃上清液,继续加入30 mL 0.1 mol · L-1NaOH溶液,振荡提取24 h,离心分离出溶液,继续加浓硫酸2 mL,振荡10 min,离心分离10 min,分离出溶液后,用钼酸盐比色法测定溶液中磷的浓度,计算出沉积物中铁磷的含量.取1 g沉积物,加入30 mL 0.5 mol · L-1 HCl溶液,于离心管中振荡提取1 h,离心分离出溶液,用钼酸盐比色法测定溶液中磷的浓度,计算出沉积物中钙磷的含量.
2.4 DGGE实验 2.4.1 底泥的处理底泥于自然状态下风干并除去杂质后,分别加入Ca(OH)2 0、0.165、0.82、1.65 g,同时进行1 h曝气强度为0.6 g · min-1的微臭氧曝气,分别在0、15、30 d后取样.
2.4.2 土壤微生物DNA提取方法土壤微生物DNA采用土壤微生物DNA提取试剂盒进行提取,步骤如下:称0.5 g土壤置于2 mL离心管中,加入0.4 g Glass Beads,再加入780 μL Buffer C1和100 μL Buffer C2,漩涡器高速振荡3~5 min,再加入100 μL Buffer C3,漩涡混匀;70 ℃水浴处理10 min,12000 r · min-1离心 1 min,转650 μL上清液到新的1.5 mL离心管中,加入150 μL Buffer C4混匀;冰上放置5 min,12000 r · min-1 离心1 min,转移上清到新的2 mL离心管中,加入0.7倍的异丙醇,颠倒混匀,12000 r · min-1离心2 min;倒掉上清,倒置离心管于吸水纸上30~60 s;加入100 μL灭菌去离子水,再加入350 μL Buffer C5(必须把Buffer C5混匀后再吸取),漩涡混匀,70 ℃水浴放置数分钟,至沉淀完全溶解即可;12000 r · min-1离心1 min,转400 μL上清液到新的1.5 mL离心管中,加入150 μL无水乙醇,混匀;将上一步所得溶液加入到GBC吸附柱中(吸附柱放入收集管中),12000 r · min-1离心30 s,倒掉滤液,重新把吸附柱放回收集管中;向GBC吸附柱中加入500 μL Buffer WB,12000 r · min-1离心30 s,倒掉废液,将吸附柱重新放回收集管中;向GBC吸附柱中加入650 μL Wash Buffer,12000 r · min-1 离心30 s,倒掉废液,将吸附柱重新放回收集管中;向GBC吸附柱中加入650 μL Wash Buffer,12000 r · min-1离心30 s,倒掉废液,将吸附柱重新放回收集管中;12000 r · min-1离心2min,以彻底晾干吸附材料中的残余漂洗液;将GBC吸附柱转入新的1.5 mL离心管中,向吸附膜的中间部位悬空滴加50 μL洗脱缓冲液TE或灭菌去离子水,室温放置2 min,12000 r · min-1离心2 min,将溶液收集到离心管中.提取后,采用分光光度计进行DNA含量和纯度测定.
2.4.3 样本PCR扩增方法样本采用嵌套PCR扩增.第1步PCR扩增反应的引物设计如下:Bac-V3-F1: 5-GAGTTTGATCCTGGCTCAG-3;Bac-V3-R1: 5-AGAAAGGAGGTGATCCAGC C-3,扩增长度为1532 bp.第一轮PCR扩增反应体系包括灭菌去离子水1.5 μL、Bac-V3-F1(10 μmol · L-1)0. 5 μL、Bac-V3-R1(10 μmol · L-1)0.5 μL、基因组DNA 1.0 μL和Platinum PCR Supermix High Fidelity(Invitrogen)21.5 μL.反应条件:94 ℃预变性2 min;94 ℃变性30 s,58 ℃退火30 s,68 ℃延伸1 min,35个循环.
第2步PCR扩增反应:引物设计40bp GC-clamp:CGCCCGCCGCGCGCGGCGGGCGG GGCGGG GGCACGGGGGG;Bac-V3-F2: 5-GC-clamp-CCTA CGGGAGGCAGCAG-3(341-359);Bac-V3-R2:5-ATTACCGCGGCTGCTGG-3(518-534);扩增长度为230 bp.第二轮PCR扩增反应体系包括灭菌去离子水1.5 μL、Bac-V3-F2(10 μmol · L-1)0.5 μL、Bac-V3-R2(10 μmol · L-1)0.5 μL、第一轮PCR产物(稀释10倍)1.0 μL和Platinum PCR Supermix High Fidelity(Invitrogen)21.5 μL.反应条件:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火45 s,68 ℃延伸30 s,30个循环.
2.4.4 PCR产物的DGGE实验和分析采用PCR纯化试剂盒纯化PCR产物.取8 μL上述样品,采用Decode Universal Mutation Detection System(Bio-Rad,USA)对细菌PCR扩增产物进行电泳分离.电泳条件:凝胶变性梯度35%~60%,电泳缓冲液为1×TAE,电泳温度60 ℃,电泳时间12 h.电泳结束后,SYBR GreenⅠ染色30 min,采用Gel Doc2000凝胶成像系统(Bio-Rad,USA)观察凝胶上的条带、拍照并对差异和优势条带进行切胶.
采用Quantity One 4.62软件,对DGGE电泳图谱中的样品进行DNA标记,并对样品的DNA条带数进行统计计算,得到每条泳道的DNA个数信息,对DNA强度和不同泳道DNA条带强度进行分析,获得详细数据,用于后续的土壤微生物多样性指数计算和分析.
2.4.5 土壤微生物多样性指数计算采用Berger-Parker优势度指数d、Margalef丰富度指数DMg、Shannon多样性指数H对土壤样品微生物多样性进行评价分析,具体公式如下:

采用OriginPro 8.0 分析软件对数据进行统计分析.数据差异性分析采用One-way ANOVA分析方法,p<0.05为差异显著,p<0.01为差异极显著.
3 结果(Results) 3.1 微臭氧曝气加氢氧化钙复合技术对上覆水pH值的影响图 2为曝气强度为0.6 g · min-1的微臭氧曝气1 h,同时加入不同浓度氢氧化钙溶液处理后,历时11 d模拟反应器内上覆水pH值变化的趋势.从图中可以看到,I、II和III组水样的pH值没有明显差异,都在7.3左右,而IV组水样的pH值在7.8左右,呈弱碱性状态.
 |
| 图 2 微臭氧曝气加氢氧化钙复合技术对上覆水pH值的影响 Fig. 2 Impact of pH values about micro-ozone aeration composite calcium hydroxide technology for the overlying water |
图 3为曝气强度为0.6 g · min-1的微臭氧曝气1 h,同时加入不同浓度氢氧化钙溶液处理后,历时14 d模拟反应器内上覆水TP浓度的变化趋势.从图中可以看到,II组单独微臭氧曝气时,短时间内上覆水TP浓度在0.55~0.95 mg · L-1之间波动,2 d后TP浓度下降到0.39 mg · L-1并一直在0.1~0.3 mg · L-1范围内波动,但相对其他组而言,TP浓度整体较高.在微臭氧复合氢氧化钙处理下,上覆水TP浓度整体呈较低水平,均在0.05 mg · L-1上下波动,其中,IV组上覆水的TP浓度最终值与I组相比,底泥磷释放的抑制率达到了34%.
 |
| 图 3 微臭氧曝气加氢氧化钙复合技术对上覆水TP浓度的影响 Fig. 3 Impact of TP concentrations about micro-ozone aeration composite calcium hydroxide technology for the overlying water |
表 1为I组和IV组底泥中各形态磷含量的分布比例,可以看出,IV组与I组相比,底泥中可溶性磷和铁磷含量分别降低了92%和60%,铝磷含量升高了50%,钙磷含量升高了1.2%.
| 表1 不同处理组表层底泥形态磷的分布比例 Table 1 Proportions of sequential extraction phosphorus in sediment in different groups |
基于PCR扩增产物的DGGE电泳图谱如图 4所示.由于DGGE的原理是不同细菌的16S rDNA片段碱基组成的差异,因此,电泳时在凝胶上能够分开不同的DNA条带.图中条带1为底泥经过曝气强度为0.6 g · min-1的微臭氧曝气1 h后0 d时取样的DNA条带;条带2~4为底泥经过微臭氧曝气1 h同时加入0.165、0.825、1.65 g Ca(OH)2后0 d时取样的DNA条带;条带5~8分别为底泥经过微臭氧曝气1 h同时加入0、0.165 、0.825、1.65 g Ca(OH)2后15 d时取样的DNA条带;条带9~12分别为底泥经过微臭氧曝气1 h同时加入0、0.165、0.825、1.65 g Ca(OH)2后30 d时取样的DNA条带.
 |
| 图 4 不同实验组底泥中微生物的DGGE图谱结果 Fig. 4 DGGE profiles of microorganisms in sediment in different experimental groups |
基于DGGE电泳图谱的聚类分析如图 5所示.从图 5中可以看出,12组样品明显聚为3类,分别是1~4、6~9、10~12,但各类之间的差异性并不明显,相似性在65%~85%之间.因此,从相似性分析看,不同样品间微生物多样性差异并不明显,这说明处理组与对照组底泥微生物多样性变化不大.
 |
| 图 5 不同实验组底泥微生物多样性的相似性分析 Fig. 5 Similarity analysis of microbial diversity in sediment in different experimental groupss |
根据公式(1)~(4),计算了底泥微生物的3种多样性指数,结果见表 2.可以看出,Berger-Parker优势度指数随时间的延长有略微的降低,而加入药剂的剂量对其没有影响,大致都处于2.00%~2.52%范围内;Margalef丰富度指数在曝气复合药剂处理初期为4.5左右,而经过30 d后达到了4.8左右,增加了6%,加入药剂的剂量对其没有明显的影响;Shannon多样性指数从4.1左右增加到4.2左右,没有明显的时间与剂量效应.根据上述3种多样性指数结果分析比较,12组底泥样品中,微生物多样性并无明显差异,这也证实聚类分析的结果,即处理组与对照组底泥微生物多样性变化不大.
| 表2 3种底泥微生物多样性指数计算结果 Table 2 Calculation results of three diversity index in sediment microbes |
水体的氧化还原状态会影响内源磷的释放强度和释放量.富营养化水体的底泥在厌氧状态下,内源磷会很快被释放出来,平均释放速率达到7.3 mg · m-2 · d-1;而在好氧条件下,底泥磷的平均释放速率为0.53 mg · m-2 · d-1,仅为厌氧条件下的7.3%,这表明通过曝气保持水体上覆水的好氧状态对控制底泥TP的释放有良好的抑制效果(林建伟等,2005).袁文权等(2004)对水库底泥进行连续曝气处理,检测发现磷的释放速率为-0.69 mg · m-2 · d-1,与不做任何处理的底泥相比,底泥释磷的抑制效率达到67.01%.本研究发现,单一微臭氧曝气时上覆水TP浓度在短时间内有很大波动,2 d后TP浓度下降并保持在一定范围内,磷的释放速率为0.019 mg · m-2 · d-1,5 d后达到稳定,磷的释放速率为0.004 mg · m-2 · d-1,但较其它组仍处于较高水平.在单一微臭氧曝气初期,上覆水中TP浓度有明显的升高.这可能是由于曝气的搅动作用,引起底泥中的还原性物质向上覆水体中释放,从而导致水体中TP浓度上升.彭进平等(2004)的研究结果亦表明,对于浅水性湖泊经扰动后,水体中的磷素增加了25%.因此,对受污水体进行单一曝气不能高效地达到抑制磷素释放的效果.
研究表明,向富营养化水体投加钙盐能有效固定磷酸盐,降低上覆水中磷的浓度,抑制效率最高可达50%(Prepas et al., 2001; Walpersdorf et al., 2004; Rodriguez et al., 2008).刘忻等(2009)在河道水投加1250 mg · L-1 的Ca(OH)2溶液后发现,上覆水中的TP浓度降至0.05 mg · L-1以下,达到《景观娱乐用水标准》(GB12941-91)中C类标准(TP≤0.05 mg · L-1)和《地表水环境质量标准》(GB3838—2002)中Ⅱ类标准(TP≤0.1 mg · L-1).实验设计微臭氧曝气加氢氧化钙复合处理实验,以期到达更好的抑制底泥磷释放效果.本实验中微臭氧曝气复合浓度为0.02 mol · L-1的氢氧化钙溶液组上覆水中的pH值明显偏高,呈弱碱性状态,且其抑制底泥磷释放效果明显,处理后的TP浓度低于0.05 mg · L-1,抑制率达到了34%,实验进行5 d后就已达到明显效果,表明微臭氧曝气加氢氧化钙复合技术有实际运用意义.
底泥中形态磷含量的分布显示,IV组与I组相比,底泥中可溶性磷和铁磷含量分别降低了92%和60%,钙磷和铝磷含量则分别升高了2%和50%.实验中加入的氢氧化钙增加了上覆水中OH-浓度,使沉积物对磷的吸附能力增强(Bostrom et al., 1982; 高丽等,2004).沉积物中铝磷的活性变化与铁磷类似,是沉积物中较稳定的磷形态,能控制沉积物磷的再释放(Sun et al., 2009; Wang et al., 2006).沉积物中的钙磷通常被认为是生物难利用磷,一般情况下不容易被溶解和吸附,对水体富营养化影响较小,表现出沉积埋藏的特性(魏世强等,2006).水中高浓度的Ca2+能显著提高沉积物对磷的吸附量,使沉积物中部分其他形态的磷转化为钙磷,钙磷在沉积物中的活性较小,沉降到沉积物表面进而转化为更稳定的钙磷化合物,从而抑制内源磷向上覆水的释放(朱红,2012;刘冠男等,2011).由此可知,微臭氧曝气加氢氧化钙复合技术对底泥磷素释放抑制的主要机理是底泥经过处理后,可溶性磷和铁磷比例降低,铝磷比例升高,最终生成难分解的钙磷.
Díez等(2001)首次用DGGE研究海洋中微型真核生物群落的多样性;赵兴青等(2008)用PCR-DGGE技术研究了太湖沉积物中微生物多样性;曹晨波(2010)利用 PCR-DGGE 技术对经过纯氧曝气和含氧水注入处理的底泥细菌总数和细菌多样性进行分析,发现其细菌相似性达到 90.5%.本研究应用PCR-DGGE技术对实验组底泥微生物多样性进行了分析,经过土壤微生物多样性指数分析和评价,发现采用微臭氧曝气加氢氧化钙复合抑制磷释放技术后,不同样品间微生物多样性差异并不明显,相似性在65%~85%之间;Berger-Parker优势度指数随时间的延长有略微的降低;Margalef丰富度指数在曝气复合药剂处理初期为4.5左右;Shannon多样性指数从4.1左右增加到4.2左右.这些数据说明处理组与对照组底泥微生物多样性变化不大,加入药剂对其没有影响,不会导致底泥微生物多样性的减少.因此,可以认为微臭氧曝气加氢氧化钙复合技术对底栖微生物群落是安全的,不会改变底泥微生物多样性.
5 结论(Conclusions)1)研究表明,微臭氧曝气加氢氧化钙复合技术对内源磷释放的抑制效果较好,且氢氧化钙为价格便宜的化学药剂,预示着该技术具备工程应用的经济可行性.
2)微臭氧曝气加氢氧化钙复合技术抑制富营养湖泊底泥磷释放的机理在于臭氧形成的氧化环境下,氢氧化钙与底泥表面的磷形成难分解态的沉积物,从而进一步抑制下层底泥中磷的释放.
3)DGGE电泳图谱分析结果和3种生物多样性指数计算结果均表明,微臭氧曝气加氢氧化钙复合技术处理组与对照组底泥中微生物多样性差异并不显著(p>0.05),可以认为该技术对底栖微生物群落的影响甚微,不会改变底泥微生物多样性.
| [1] | Bostrom B,Jansson M,Forsberg C.1982.Phosphorus release from lake sediment[J].Archiv fur Hydrobiologie,18:55-59 |
| [2] | 曹晨波.2010.河道底泥有机污染物人工增氧生物减量的研究 .哈尔滨:哈尔滨工业大学 |
| [3] | 柴蓓蓓.2012.水源水库沉积物多相界面污染物迁移转化与污染控制研究.西安:西安建筑科技大学 |
| [4] | Díez B,Pedrós-Alió C,Marsh T L,et al.2001.Application of denaturing gradient gel electrophoresis(DGGE)to study the diversity of marine picoeukaryotic assemblages and comparison of DGGE with other molecular techniques[J].Applied and Environmental Microbiology,67(7): 2942-2951 |
| [5] | 高丽,周健民.2004.磷在富营养化湖泊沉积物-水界面的循环[J].土壤通报,35(4):512-515 |
| [6] | 国家环境保护总局.2002.水和废水监测分析方法[M].北京:中国环境科学出版社 |
| [7] | 黄建军.2009.城市河道底泥营养盐释放及化学修复研究 .天津:天津大学 |
| [8] | Karjalainen H,Stefansdottir G,Tuominen L,et al.2001.Do submersed plants enhance microbial activity in sediment? [J].Aquatic Botang,69(1):1-13 |
| [9] | Lapara T M,Konopka A A, Nakastu C H,et al.2001.Effects of elevated temperature on bacterial community structure and function in bioreactors treating a synthetic wastewater[J].Microbial Biotechnology,24(2):140-145 |
| [10] | Lawrence R P,Smith E E,Carol M G.1965.The exchange of phosphate between estuarine and sediments[J].Limnology and Oceanography,21(2):167-172 |
| [11] | 李大鹏,黄勇,李伟光.2007.曝气预处理强化底泥对磷的吸附效果研究[J].中国给水排水,23(19):23-26 |
| [12] | 林建伟,朱志良,赵建夫,等.2007.有机改性沸石覆盖抑制底泥氮磷释放的效果[J].同济大学学报(自然科学版),35(12):1651-1655 |
| [13] | 林建伟,朱志良,赵建夫.2005.曝气复氧对富营养化水体底泥氮磷释放的影响[J].生态环境,14(6):812-815 |
| [14] | 刘冠男,董黎明.2011.水体中Ca2+ 对湖泊沉积物憐吸附特征的影响[J].环境科学与技术,34(2):36-41 |
| [15] | 刘素美,张经.2001.沉积物中磷的化学提取分析方法[J].海洋科学,25(1):22-25 |
| [16] | 刘忻,俞珊珊,於胜洪,等.2009.氧氧化韩除河道水中磷的试验研究[J].环境科学与管理,34(2):129-132 |
| [17] | Murphy T P,Hall K G,Northcote T O.1998. Lime treatment of a hard water lake to reduce eutrophication[J].Lake and Reservoir Management,4(2):51-62 |
| [18] | Muyzer G,de Waal E C,Uitterlin-den A G.1993.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied and Environmental Microbiology,59(3):695-700 |
| [19] | 毛成责,余雪芳,廖丹,等.2009.氯化镧对西湖底泥磷缓释及磷固定作用研究[J].杭州师范大学学报(自然科学版),8(1):51-55 |
| [20] | Prepas E E,Babin J,Murphy T P,et al.2001.Long-term effects of successive Ca(OH)2 and CaCO3 treatments on the water quality of two eutrophic hardwater lakes[J].Freshwater Biology,46 (8):1089-1103 |
| [21] | 彭进平,逄勇,李一平,等.2004.水动力过程后湖泊水体磷素变化及其对富营养化的贡[J].生态环境,13(4):503-505 |
| [22] | Rodriguez I R,Amr-hein C,Anderson M A.2008.Laboratory studies on the coprecipitation of phosphate with calcium carbonate in the Salton Sea,California[J].Hyd-robiologia,604(1):45-55 |
| [23] | Santegoeds C,Ferdelman T G,Muyzer G,et al.1998.Structural and functional dynamics of sulfate-reducing populations in bacterial biofilms[J].Applied and Environmental Microbiology,64:3731-3739 |
| [24] | Sun S J,Huang S L,Sun X M,et al.2009. Phosphorus fractions and its release in the sediments of Haihe River,China[J].Journal of Environmental Sciences,21(3):291-295 |
| [25] | Sundby B, Gobeil C,Silberberg N.1992.The phosphorus cycle in coastal marine sediments[J].Limnology and Oceanography,37(6):1129-1145 |
| [26] | Walpersdorf E, Neumann T,Stuben D.2004.Efficiency of natural calcite precipitation compared to lake marl application used for water quality improvement in an eutrophic lake[J].Applied Geochemistry,19(11):1687-1698 |
| [27] | Wang H,Inukai Y,Yamauchi A.2006.Root development and nutrient uptake[J]. Critical Reviews in Plant Sciences,25(3):279-301 |
| [28] | 魏世强,赵晓松,朱端卫,等.2006.环境化学[M].北京:中国农业出版社 |
| [29] | 徐会玲,唐智勇,朱端卫,等.2010.菹草,伊乐藻对沉积物磷形态及其上覆水水质的影响[J].湖泊科学,22(3):437-444 |
| [30] | 袁文权,张锡辉,张丽萍.2004.不同供氧方式对水库底泥氮磷释放的影响[J].湖泊科学,16(1):28-34 |
| [31] | 赵兴青,杨柳燕,陈灿,等.2006.PCR-DGGE 技术用于湖泊沉积物中微生物群落结构多样性研究[J].生态学报,26(11):3610 -3616 |
| [32] | 赵兴青,杨柳燕,尹大强,等.2008.不同空间位点沉积物理化性质与微生物多样性垂向分布规律[J].环境科学,29(12):3537-3545 |
| [33] | 朱红.2012.菹草叶面CaCO3-P共沉淀对上覆水和沉积物磷的作用机制研究 .武汉:华中农业大学 |
 2014, Vol. 34
2014, Vol. 34


