2. 辽宁大学药学院, 沈阳 110036
2. School of Pharmacy, Liaoning University, Shenyang 110036
石油也称为原油,是一种复杂的混合物,含有多种烃类主要有烷烃类(正烷烃、支链烷烃)、芳香烃、脂环烃等及少量其他的非烃类物质,是一种重要的能源,也是国民经济发展的重要物质基础(汪杰等,2010).由于人类不合理利用,致使大量的石油烃进入环境,造成了许多国家和地区地下水和地表水的石油烃污染(詹研,2008;Nadim et al., 2000;Vazquez and Mansoori, 2000).
生物修复是清除石油污染的一种重要的手段,国内外学者对石油污染的生物降解进行了广泛的研究,特别是近几年来,极端环境微生物是微生物学研究的热点(Oh et al., 2001;Maria et al., 2005;Anne et al., 2003; Namio et al., 2005;黄廷林等,2008).国外学者已从南极海洋中分离筛选得到不同种属的低温降解细菌,如Halomonas sp.和Sphingomonas等(Milva et al., 2005;Yakimov et al., 2004).我国北方冬季气候寒冷,废水处理设施进水温度普遍较低,微生物活性受到抑制,生物法处理效率较低,工程中一般采用降低污染负荷、增加污泥回流量、增加污水停留时间等措施来保证冬季污水处理出水达标,故筛选出耐低温的石油降解菌有重要的现实和经济意义(马溪平等,2010).
国内相关研究从被石油污染的海洋、土壤中筛选出多种石油降解菌(张秀霞等,2010;林学政等,2009),但多是从自然环境中筛选得到的菌株,而忽略了石油废水处理系统中已有的石油降解菌,基于此从处理石油废水的曝气污泥中驯化、分离得到能在低温条件下以石油为碳源的高效降解菌株,并对其生长与降解特性进行研究及分子水平鉴定,以期为耐低温细菌在传统的生物处理和修复系统中的应用提供参考,并对该厂石油废水处理提供理论依据,为日后工程菌制备提供菌株来源.
2 材料和方法(Materials and methods) 2.1 菌种来源及石油代替物从抚顺石油二厂曝气池中采集到的活性污泥作为菌种来源.本实验用柴油代替石油进行实验.柴油组分以烃类链烃为主,C9~C26之间涵盖了石油组分中大多数链烃.因此,能够以柴油为碳源和能源的菌种基本上对石油也同样能够利用.由于实验开始时间为冬季,故从中国石油加油站购得柴油型号为-35#柴油.
2.2 培养基富集培养基:蛋白胨(10 g · L-1)、牛肉膏(3 g · L-1)、NaCl(5 g · L-1)、pH值7.0(含柴油溶液).
无机盐培养基:Na2HPO4·12H2O(3.8 g · L-1)、KH2PO4(1 g · L-1)、NaCl(1 g · L-1)、MgSO4(0.2 g · L-1)、NH4Cl(0.1 g · L-1)(含柴油溶液).
分离培养基:蛋白胨(10 g · L-1)、牛肉膏(3 g · L-1)、NaCl(5 g · L-1)、琼脂15%~20%,pH值7.0(含柴油溶液).
2.3 菌株的驯化、筛选和分离将采集到的活性污泥在富集培养基中富集培养得到可降解柴油的菌株,然后利用无机盐培养基(柴油为碳源)进行菌株驯化,逐步增大培养基中柴油浓度,7 d为一个驯化周期.当柴油的驯化浓度提高到2000 mg · L-1时,菌种降解效果稳定后进行低温驯化,梯度降低温度到15 ℃.将驯化后的菌液涂布于分离培养基平板上.待菌落特征明显后,挑取单菌落、经1次、2次或多次划线分离后,镜检得到25株以柴油为碳源的纯菌株,进行菌株降解能力试验,最终从5株降解率较高的菌株中筛选得到1株在低温条件下对柴油有高效降解性能的菌株Q21.
2.4 分析方法柴油浓度的测定(采用紫外分光光度法):将经处理后的柴油液加入正己烷萃取,5000r · min-1离心分离15 min后转入分液漏斗中静置分层.取上清液,把下层液体放回摇瓶重新萃取离心,合并两次的萃取液经无水Na2SO4过滤后倒入10 mL容量瓶中,用正己烷定容.稀释一定倍数以正己烷为空白对照,在225 nm波长处测定吸光度.柴油组分的测定(气相色谱质谱法):待测样品经正己烷萃取离心后取上清液,过无水硫酸钠柱后进样.GC条件:FID检测器;温度:进样口290 ℃;柱温40 ℃保持4 min以10 ℃ · min-1升温至290 ℃保持8 min;检测器230 ℃;进样量为1 μL;柱子:DB-5MS.菌体细胞浓度的测定(采用光电比浊法):利用紫外分光光度计在600 nm波长处测定培养基的光密度值(OD600),光密度值与菌体的细胞浓度成正比,光密度值越大,培养基中的菌体细胞浓度就越大.
2.5 菌株鉴定常规鉴定:根据菌株的革兰氏染色反应情况、个体形态、菌落特征以及生理生化反应特征对菌株进行初步鉴定.
16S rDNA序列分析:从目的菌株Q21中提取DNA后,以菌株的DNA为模板,利用通用引物F27(5′AGACTTTGATCCTGGCTCAG -3′)和R1492(5′-ACGGTTACCTGTTACGACTT -3′)进行PCR扩增,构建25 μL的反应体系:1 μLDNA模板、2 μL dNTP、2.5 μL 10×PCR Buffer、引物各1 μL、0.2 μL Taq酶、17.3 μL去离子水.PCR反应流程:①94 ℃预变性(5 min);②94 ℃变性(30 s),58 ℃退火(30 s),72 ℃延伸(90 s),共30个循环;③重复第二步,共30个循环;④72 ℃复性(10 min);⑤4 ℃保持,将PCR扩增产物与PMD18-T载体(Takara公司生产)连接,转化到大肠杆菌感受态细胞.16S rDNA测序工作由哈尔滨博仕生物技术有限公司完成,将测得的16S rDNA序列在GenBank进行Blast,对获得的同源序列进行序列分析.用BioEditv 5.06进行多序列比对,采用MEGA 4.0软件中的邻接法(Neighbor-joining,NJ)构建系统进化树.
3 结果(Results) 3.1 菌株筛选结果在低温条件下,分离得到了25株以柴油为碳源的菌株.将得到的菌株分别加入到柴油浓度为2000 mg · L-1的无机盐培养基中,在15 ℃、摇床转速为150 r · min-1的条件下振荡培养72 h,菌株降解情况如图 1所示.由图 1可见,25株菌株中有5株菌株的柴油降解率高于50%,分别是Q4、Q10、Q17、Q21和Q25.对5株降解率高的菌株进行复筛,分别在柴油浓度为2000 mg · L-1的无机盐培养基中,温度为15 ℃、摇床转速为150 r · min-1的条件下,振荡培养72 h,菌株降解情况如图 2所示.最终确定了低温条件下对柴油具有高效降解的菌株Q21,对Q21的形态特征及生理生化特征进行分析,并对其进行柴油降解试验.
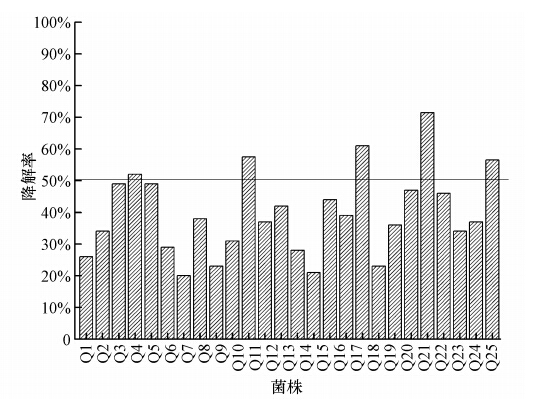 |
| 图 1 不同菌株的柴油降解率 Fig. 1 Degradation rate of different petroleum degradation bacteria |
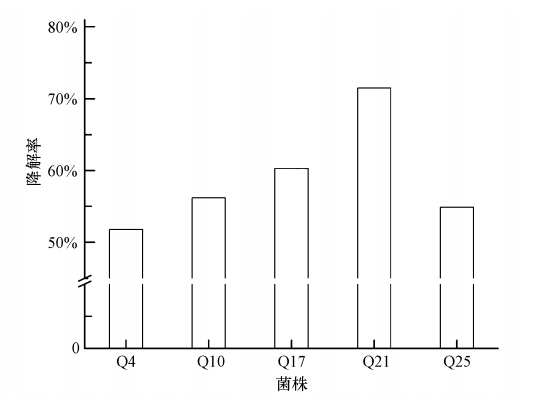 |
| 图 2 5株高效菌株的柴油降解率 Fig. 2 Degradation rate of five high effective petroleum degradation bacteria |
菌株Q21:灰白色圆形菌落、不透明、光滑、边缘整齐、无芽孢、无鞭毛、革兰氏染色呈阴性、菌株个体为球杆状、大小为(0.4~0.9)μm×(0.6~2.8)μm.生理生化结果如表 1所示.
| 表1 菌株Q21生理生化试验结果 Table.1 Results of physiological tests used to identify the strains Q21 |
根据试验结果,并结合《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》可初步鉴定菌株Q21为不动杆菌属(Pseudomonas Migula).
3.2.2 菌株Q21的鉴定根据菌株Q21的形态特征、生理生化特性和16S rDNA分子水平测序结果,确定菌株Q21为琼式不动杆菌(Acinetobacter junii),该菌在GenBank中登录号为EF669479.图 3为菌株Q21系统进化树(代号zj15为菌株Q21).图 4为菌株Q21原子力显微镜图片.得到高效的耐低温石油降解菌对北方冬季污水处理及突发石油污染后期深度修复有重要的理论和实际意义.
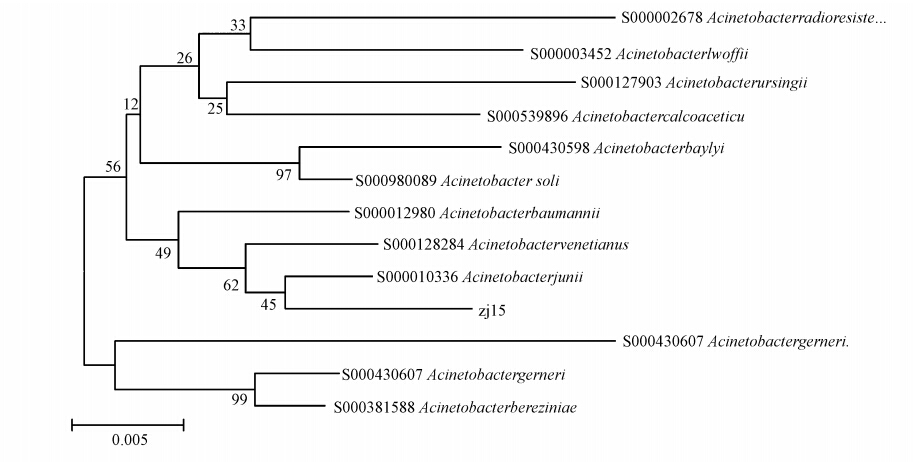 |
| 图 3 菌株Q21系统进化树 Fig. 3 Phylogenetic tree of the strain Q21 |
 |
| 图 4 菌株Q21原子力显微镜图片 Fig. 4 The AFM 3D surface images of the strain Q21 |
按10%的接种量(原菌液OD600=0.2)将处于对数生长期的菌株Q21接种于柴油质量浓度为2000 mg · L-1的无机盐培养基中,在15 ℃、pH=7.0、摇床转速为150 r · min-1的条件下振荡培养,菌株Q21生长曲线和柴油的降解进程如图 5所示.图 5显示为Q21在84 h内的生长和降解柴油的情况.12 h以内菌株生长缓慢,为适应期;12~48 h菌株大量繁殖,为对数生长期,柴油的降解率上升很快;48~72 h为稳定期,菌体数量基本不变,在72 h时柴油的降解率为71.50%;而在72 h后菌株进入衰减期,此时菌株增长缓慢,84 h后菌株生长曲线下降,柴油降解不明显,可能原因为菌株降解柴油后代谢的中间产物阻碍了菌株的进一步生长.因此本实验选定72 h为最佳降解时间.
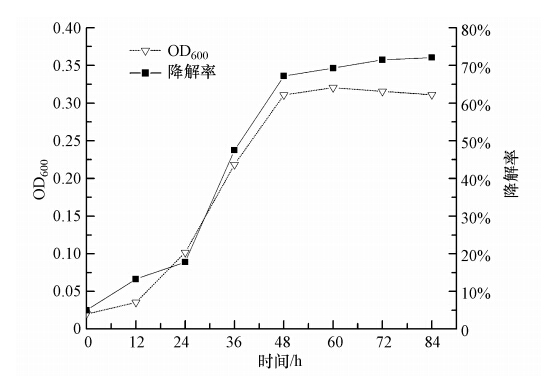 |
| 图 5 菌株Q21生长曲线和柴油的降解曲线 Fig. 5 Growth curve of strain Q21 and petroleum degradation |
本实验将处于对数生长期的菌株Q21分别按1%、5%、10%、15%和20%(原菌液OD600=0.2)的接种量接种于柴油质量浓度为2000 mg · L-1的无机盐培养基中,在15 ℃、pH=7.0、150 r · min-1的条件下振荡培养,实验重复3次.72 h时菌株Q21生长和降解柴油的情况如图 6所示,菌株Q21的生长和柴油的降解率随着接种量的增加而提高,当接种量在10%以上时却对菌株Q21的生长和对柴油的降解能力影响都不大,可能是由于菌株密度过大使菌株处于相对贫营养状态,使菌株Q21的生长代谢能力受到限制.
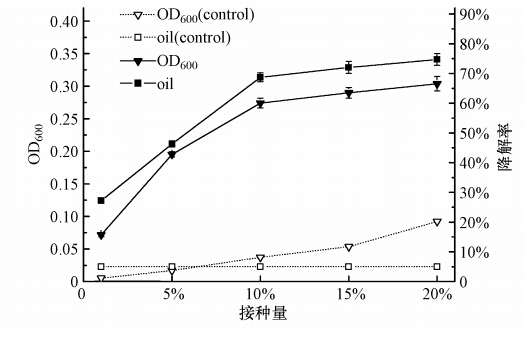 |
| 图 6 接种量对菌株Q21生长和降解率的影响 Fig. 6 Effects of inoculum on the growth and degradation characteristics of the Q21 |
温度是微生物生存繁殖的重要影响因子,较低温度下微生物新陈代谢处于受抑制状态.本实验按10%的接种量(原菌液OD600=0.2)将处于对数生长期的菌株Q21接种于柴油质量浓度为2000 mg · L-1的无机盐培养基中,在pH=7.0、150 r · min-1的条件下振荡培养,分别考察菌株Q21在5 ℃、10 ℃、15 ℃、20 ℃、25 ℃的适应性,实验重复3次.图 7为72h时的菌株Q21生长和降解柴油的情况,菌株Q21在5~25 ℃的条件下均可以生长,而且在10~15 ℃时,柴油72h时的降解率均在35%以上,并且在15 ℃时菌株Q21生长和柴油的降解率均达到最大值,因此选定15 ℃为菌株Q21降解柴油的最适温度.
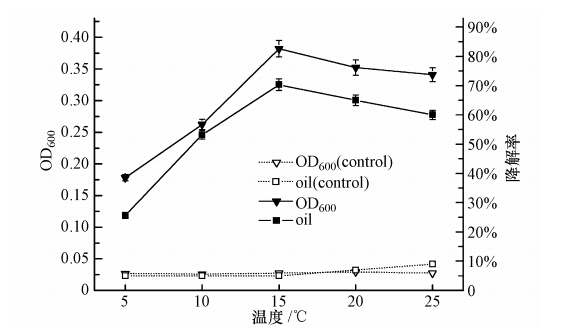 |
| 图 7 温度对菌株Q21生长和降解率的影响 Fig. 7 Effects of temperature on the growth and degradation rate of Q21 |
不同微生物都有其最适合的生长pH值范围,且pH值对微生物的生长代谢有很大的影响.本实验按10%的接种量(原菌液OD600=0.2)将处于对数生长期的菌株Q21接种于柴油质量浓度为2000 mg · L-1、pH值分别为5.0、6.0、7.0、8.0、9.0的无机盐培养基中,在15 ℃、150 r · min-1的条件下振荡培养,实验重复3次.图 8为72 h时菌株Q21的生长和柴油的降解情况,pH对菌株Q21的生长影响很大,在pH值为6.0~8.0时柴油的降解率均在50%以上.当pH值为7.0时,菌株Q21的生长和柴油降解率都达到最大值.因此,菌株Q21的最适生长pH值为7.0.
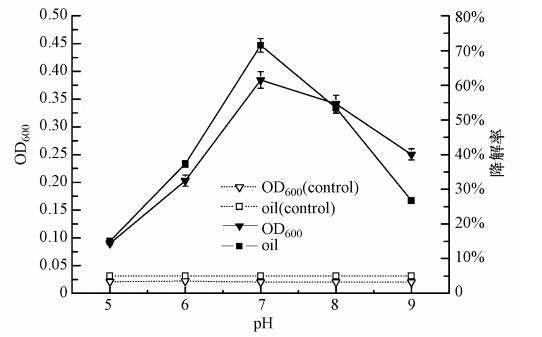 |
| 图 8 pH对菌株Q21生长和降解率的影响 Fig. 8 Effects of pH on the growth and degradation rate of Q21 |
摇床转速间接地影响了实验环境中的溶解氧含量.本实验按10%的接种量(原菌液OD600=0.2)将处于对数生长期的菌株Q21接种于柴油质量浓度为2000 mg · L-1的无机盐培养基中,在15 ℃,pH值为7.0的条件下,考察当摇床转速分别为90、120、150、180和210 r · min-1时,对菌株Q21生长和柴油降解率的影响,实验重复3次.图 9为72h时菌株Q21的生长和柴油的降解情况,当转速小于150 r · min-1时,菌株Q21的生长能力和柴油降解能力均受到抑制,增大摇床转速,菌株Q21的生长和柴油的降解能力都有显著的提升.当转速大于150 r · min-1时,对菌株Q21的生长和柴油降解率的影响却不明显,可能是由于振荡剧烈导致菌株不能正常生长及容器内溶解氧含量趋于饱和,因此,从能量与效率角度考虑,认为菌株Q21的最适摇床转速为150 r · min-1.
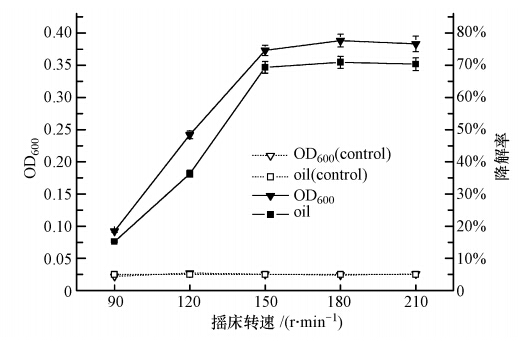 |
| 图 9 摇床转速对菌株Q21生长和降解率的影响 Fig. 9 Effects of shaker rotary speed on the growth and degradation rate of Q21 |
盐度对细菌生长具有重要的作用.高盐度可使渗透压增高导致细胞原生质分离,还可使微生物酶活性受阻影响生长.本实验按10%的接种量(原菌液OD600=0.2)将处于对数生长期的菌株Q21接种于柴油质量浓度为2000 mg · L-1的无机盐培养基中,在15 ℃,pH值为7.0,摇床转速为150 r · min-1的条件下,考察盐度(以NaCl计)分别为0.5%、1.0%、1.5%、2.0%、2.5%、3.0%时对菌株Q21生长和柴油降解率的影响,实验重复3次.图 10为72h时菌株Q21的生长和柴油的降解情况,随着盐度增大菌株的生长能力和柴油降解能力明显减弱,当盐度为3%时降解率仍能达到30%以上,表现出一定耐盐性,其最适盐度为0.5%~1%,降解率可达70%.
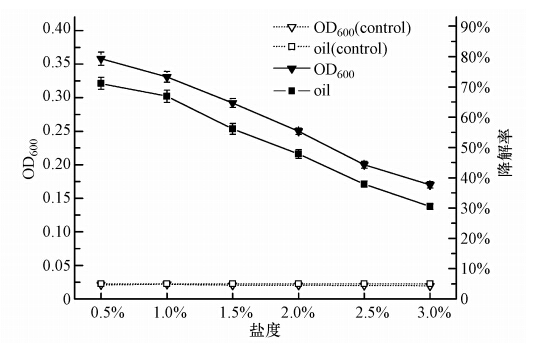 |
| 图 10 盐度对菌株Q21生长和降解率的影响 Fig. 10 Effects of salinity on the growth and degradation rate of Q21 |
将以最佳降解条件:接种量10%(原菌液OD600=0.2)、温度15 ℃、pH 7.0、摇床转速150 r · min-1、盐度0.5%降解72h后的菌液(降解前含柴油浓度2000 mg · L-1),经正己烷完全萃取后稀释一定倍数,以不同直链烷烃(C8~C24)做标样,不经过菌株处理的培养基(含柴油浓度2000 mg · L-1)经正己烷完全萃取后稀释同样的倍数后做空白对比,通过GC-MS进行分析.结果如图 10所示,虽然有杂质干扰,但是从空白对照样品GC-MS图谱中可以看出,柴油中包含了C9~C24之间的所有烷烃,而经菌株Q21降解处理后的残油组分中烷烃组分种类明显减少,且单一烷烃的含量也减少许多.经分析该菌株对C8~C15之间的烷烃有很高的降解能力,可以大部分降解支链烷烃;对高碳数的烷烃也均有一定降解,有较广泛的降解范围.进一步验证了降解菌株Q21在低温下较好的降解柴油.
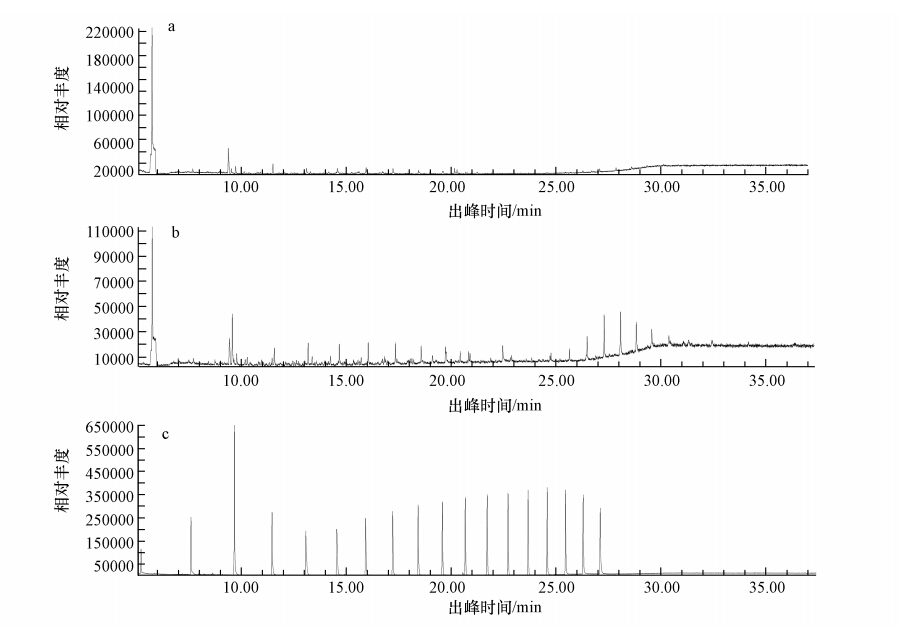 |
| 图 11 菌株Q21降解柴油的GC-MS图谱(a:Q21的降解图谱;b:空白对照图谱(稀释一定倍数);c:C8~C24直链烷烃标样图谱) Fig. 11 GC-MS of diesel degradation by degrading bacteria Q21 |
1)在低温条件下(15 ℃),从抚顺石油二厂曝气池的活性污泥中筛选和分离得到5株能以柴油为碳源的高效降解菌株,其中Q21降解能力最强.在15 ℃、柴油浓度为2000 mg · L-1的无机盐培养基中培养72 h后,柴油降解率可达71.5%,为耐低温高效柴油降解菌,这为低温条件下柴油的生物降解提供了指导意义.
2)由菌株鉴定结果可知:菌株Q21为革兰氏阴性菌;对菌株Q21的个体形态特征鉴定、生理生化特征鉴定和16S rDNA序列分析表明,菌株Q21为琼式不动杆菌(Acinetobacter junii).
3)由菌株Q21的生长和降解性能实验可知:菌株Q21降解柴油的最适接种量是10%,最适温度是15 ℃,最佳pH值为7.0,最适摇床转速为150 r · min-1,最佳盐度为0.5%~1.0%.降解后的残油组分经GC-MS分析结果表明,菌株Q21能降解柴油中所含的C9~C24之间大部分烷烃,这对菌株在实际环境中的应用具有重要的指导意义.
| [1] | Anne G R, Kjetil B H, Marion B, et al. 2003. In situ biodegradation of petroleum hydrocarbons in frozen arctic soils[J]. Cold Regions Science and Technology, 37(2): 97-120 |
| [2] | 黄廷林, 唐智新, 徐金兰, 等. 2008. 黄土地区石油污染土壤生物修复室内模拟试验研究[J]. 农业环境科学学报, 27(6): 2206-2210 |
| [3] | 林学政, 沈继红, 杜宁, 等. 2009. 北极海洋沉积物石油降解菌的筛选及系统发育分析[J]. 环境科学学报, 29(3): 536-541 |
| [4] | 马溪平, 李银萍, 徐成斌. 2010. 低温条件下硝基苯降解菌的筛选及鉴定[J]. 环境科学学报, 30(9): 1793-1797 |
| [5] | Maria D D, Angelina L G, Michaud L, et al. 2005. Diesel oil and PCB-degrading psychrotrophic bacteria isolated from Antarctic seawaters (Terra Nova Bay, Ross Sea)[J]. Polar Research, 23(2): 141-146 |
| [6] | Milva P, Attilio C, Gianfranco L, et al. 2005. An Antarctic p sychrotrophic bacteria Halomonas sp. ANT-3b, growing on n-hexa-decane, produces a new emulsifying glycolipid [J]. FEMS Microbiology Ecology, 53: 157-166 |
| [7] | Nadim F, Hoag G E, Liu S L, et al. 2000. Detection and remediation of soil and aquifer systems contaminated with petroleum products: an overview[J]. Journal of Petroleum Science and Engineering, 26(1): 169-178 |
| [8] | Namio K, Mitsuru H, Kazufumi T, et al. 2005. Isolation and characterization of Rhodococcus sp. Strains TMP2 and T12 that degade 2, 6, 10, 14-tetramethyl-pentadecane (pristane) at moderately low temperatures [J]. Journal of Biotechnology, 115(2): 129-136 |
| [9] | Oh Y S, Sim D S, Kim S J. 2001. Effects of nutrients on crude oil biodegradation in the upper intertidal zone[J]. Marine Pollution Bulletin, 42(12): 1367-1372 |
| [10] | Vazquez D, Mansoori G A. 2000. Identification and measurement of petroleum precipitates [J]. Journal of Petroleum Science and Engineering, 26(1/4): 49-55 |
| [11] | 汪杰, 郑维爽, 礼晓, 等. 2010. 高效石油降解菌的筛选鉴定及修复能力研究[J]. 环境科学学报, 30(6): 1228-1234 |
| [12] | Yakimov M M, Gentile G, Bruni V, et al. 2004. Crude oil-induced structural shift of coastal bacterial communities of Rod Bay (Terra Nova Bay, Ross Sea, Antarctica) and characterization of cultured cold adapted hydrocarbonoclastic bacteria[J]. FEMS Microbiology Ecology, 49(3): 419-432 |
| [13] | 詹研. 2008. 中国土壤石油污染的危害及治理对策[J]. 环境污染与防治, 30(3): 91-96 |
| [14] | 张秀霞, 郑茂盛, 王荣靖, 等. 2010. 石油污染土壤中高效石油烃降解菌Y-16的筛选及其降解性能[J]. 环境工程学报, 4(8): 1916-1920 |
 2014, Vol. 34
2014, Vol. 34


