2. 黑龙江大学功能无机材料化学教育部重点实验室, 哈尔滨 150080;
3. 黑龙江大学高效转化的化工过程与技术教育厅重点实验室, 哈尔滨 150080
2. Key Laboratory of Functional Inorganic Material Chemistry, Ministry of Education of the People's Republic of China, Heilongjiang University, Harbin 150080;
3. Key Laboratory of Chemical Engineering Process and Technology for High-Efficiency Conversion, College of Heilongjiang Province, School of Chemistry and Materials Science, Heilongjiang University, Harbin 150080
污水污泥中含有大量的有机质,很多学者都认为将其作为原料制备多孔污泥碳(SC)是一种合理的污泥资源化方法(Ding et al., 2012;Gómez-Pacheco et al., 2012;Liu et al., 2012).Velghe等发现污泥中的无机成分主要以氧化物或盐的形式存在,在碳化过程中小部分无机成分热分解或挥发,在SC骨架的表面形成多孔结构,大部分的无机成分仍然留在SC中(Velghe et al., 2012).很多研究者认为,无机成分的洗脱(酸洗)对提高SC的比表面积、孔容积具有重要作用(Ren et al., 2012;Ros et al., 2007).但是,所有的研究中都把酸洗液直接排掉或经过中和之后排放(Qian et al., 2009;Smith et al., 2009).酸洗液中含有大量有用的金属离子,如Al3+、Fe3+、Ca2+和Mg2+等,如果能加以回收利用,是提高污泥价值、避免二次污染的科学选择.因此,在前期的工作中,本研究小组以污泥为原料制备了SC,利用盐酸对可溶性无机成分进行了充分洗脱;对收集的酸洗液进行分步除杂后,可以利用提纯的铝酸钠溶液制备出纳米Al(OH)3材料,并考察了沉淀反应终点pH值对Al(OH)3材料性质的影响(Zou et al., 2012);此研究实现了污泥中Al3+的回收,为剩余污泥的处置与处理找到一条化害为利、变废为宝的合理出路.
在前期的研究中发现,以污泥-铝酸钠溶液为铝源制备的Al(OH)3胶粒的尺寸、结构不易控制,且由于颗粒间静电引力、颗粒表面羟基易与自由水分子形成氢键等原因,易发生颗粒的团聚现象(Zou et al., 2012).为了解决这些问题,本文在制备Al(OH)3的过程中加入表面活性剂聚乙二醇-1000(PEG-1000),并对实验条件进行优化,探讨表面活性剂的限制效应、渗透压效应和空间位阻作用对胶粒的表面性质、形貌与结构的影响机制,阐明使用表面活性剂对以污泥为铝源制备高质量的Al(OH)3的必要性.
2 材料与方法(Materials and methods) 2.1 主要材料氢氧化钠(NaOH)、盐酸(HCl)、氯化钡(BaCl2)、碳酸钠(Na2CO3)、PEG-1000均为分析纯,由天津市科密欧化学试剂有限公司生产;污水污泥取自哈尔滨文昌污水处理厂污泥脱水间.
2.2 材料的制备方法铝酸钠溶液的制备方法:称取一定质量的干燥污泥,在氮气气氛、气体流量为100 mL · min-1的条件下,对污泥进行碳化热处理,碳化温度为800 ℃,升温速率为5 ℃ · min-1,碳化时间为1 h;将得到的SC材料在温度为80 ℃的HCl溶液(2 mol · L-1)中处理2 h,SC与酸浸萚恋闹柿勘任? ∶ 20;将所得溶液的pH调为5~7,加BaCl2溶液(1 mol · L-1)反应5~10 min,接着加Na2CO3溶液(1 mol · L-1)搅拌反应5~10 min,将所得沉淀物过滤、保存留作它用;向滤液中滴加2 mol · L-1的NaOH溶液,通过控制pH值到5~7之间得到沉淀;然后,将沉淀物用过量NaOH溶液滴定到pH值为13,过滤除去未溶的沉淀(干燥后保存)得到相对纯净的铝酸钠溶液(Zou et al., 2012).
纳米Al(OH)3的制备方法:量取6份100 mL相同浓度的铝酸钠溶液,按体积比0.01%、0.05%、0.1%、0.2%、0.4%和0.6%分别加入浓度为10%的聚乙二醇-1000(PEG-1000),在室温下充分搅拌后,将一定量的浓度为2 mol · L-1的HCl溶液缓慢加入反应体系中(终点pH前,应将HCl溶液适当稀释后滴加).当体系达到预定的pH=6后,继续搅拌反应20 min,将所得Al(OH)3溶胶用去离子水反复洗涤3次,再用适量无水乙醇洗涤3次,以去除滤饼中大部分的水分,减少干燥过程中造成的硬团聚;最后,将滤饼在50 ℃下鼓风烘干12 h左右,得到纳米Al(OH)3材料.
2.3 材料表征溶液中的离子浓度使用Optima 5300DV电感耦合等离子体发射光谱仪(ICP-AES)进行测试.Al(OH)3样品的表面官能团使用傅里叶红外光谱(FT-IR)进行表征,测试仪器的型号为Nicolet IS10,采用KBr压片法.扫描电镜(SEM)测试的仪器型号为Hitachi S4800型,加速电压为5 kV,样品表面进行喷金处理.N2吸附-脱附等温线的测定(BET)使用仪器的型号为TriStar Ⅱ全自动分析仪,可以测定样品的比表面积和孔径分布.材料的晶型测试使用由日本理学公司生产的RigakuD/maxIIIB型X-射线衍射仪(XRD),测试条件为:CuKα(λ=1.5406),管电压40 kV,管电流20 mA,扫描速度8° · min-1.通过透射电镜(TEM)观察样品形貌,仪器型号为FeiTecnia G2-STWIN,加速电压为200 kV.
3 结果与讨论(Results and discussion) 3.1 PEG-1000加入量对Al(OH)3沉淀效率的影响图 1中结果显示,随着PEG-1000加入比例的升高,溶液中残余的Al3+浓度呈现先降低后升高的趋势.这是由于PEG-1000的加入不仅影响了Al(OH)3沉淀的效率,而且对己形成的粒子的生长速度也有一定的影响.从图 1中的原液(PL)沉淀后剩余离子浓度的柱状图中可以看出,铝酸钠溶液中含有少量的Si(含Si物质在各步除杂反应过程中基本不发生反应)、Fe、Ca和Mg杂质,其中Fe、Ca和Mg在沉淀反应前后的浓度基本没有变化,这与其初始浓度比较低有关.在反应过程中,PEG-1000很容易吸附在快速生成的Al(OH)3的表面(An et al., 2010),PEG-1000上的羟基可以与颗粒的表面羟基发生作用:
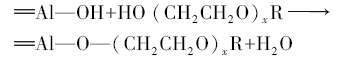
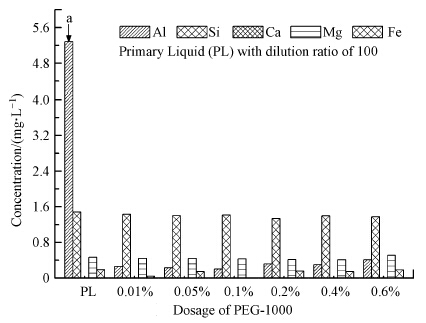 |
| 图 1 PEG-1000加入量对溶液中各残余离子浓度的影响 Fig.1 Concentration of the residual inorganic elements with addition of PEG-1000 |
当少量PEG-1000加入反应体系中,由于其空间位阻作用减弱了颗粒与颗粒之间的相互键合作用,使得Al(OH)3颗粒能够快速的生成,使得沉淀较为完全,也能有效地阻止颗粒的团聚.随着PEG-1000加入量的增加,被包进松散的Al(OH)3颗粒中的PEG-1000分子增多,使得PEG不能充分覆盖颗粒的表面,从而限制了PEG的分散作用和PEG的再吸附,PEG覆盖效果差,产生的空间位阻效应有限,不能很好地限制团聚.从而限制了反应物离子的扩散速率,降低了离子之间的碰撞几率,使得Al3+的沉淀效率降低.
3.2 PEG-1000对纳米Al(OH)3性质的影响Al(OH)3的FTIR谱图如图 2a所示,在400~900 cm-1和3200~3700 cm-1范围,出现两个相对较宽的吸收带;吸收带的宽化归因于超细颗粒或无定形结构中键长的连续分布,表明样品具有尺寸较小或非晶态的特征(Zou et al., 2012).在570 cm-1出现了AlO4四面体中Al—O键的伪晶格伸缩振动峰(Miyazaki et al., 2013);在3470 cm-1处出现了O—H键变形伸缩振动峰;这两个特征峰的出现,进一步证实形成了较小粒子尺寸或无定形结构的Al(OH)3(Li et al., 2010).在852 cm-1处出现了[AlO2]-离子的特征伸缩振动峰,这表明在弱酸性条件下制得的样品上吸附有游离的[AlO2]-离子(Miyazaki et al., 2013),也说明制备的Al(OH)3样品具有较好的纯度.位于1633 cm-1的振动峰是残留于样品内的层间水造成的.在2975 cm-1左右处出现了一个较明显的吸收峰,这个峰是由PEG-1000中—CH2—振动引起的,随着PEG-1000加入量增加后,这个振动峰有逐渐增强的趋势;这说明在沉淀过程后,PEG-1000通过化学作用的方式连接在Al(OH)3的表面(Stosiek et al., 2010).从图 2b中可以看出,当PEG-1000加入量不同时,制得的非晶态Al(OH)3样品的表面形貌差别不明显,都呈现比较松散的结构,样品粒子堆集形成多孔结构,堆集孔的孔径相对比较均一,孔径集中在中孔-大孔(40~100 nm)的范围内.
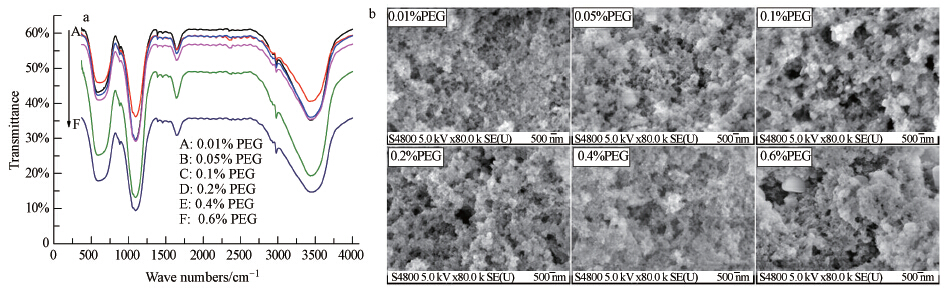 |
| 图 2 PEG-1000加入量对Al(OH)3表面官能团的影响(a)和Al(OH)3的SEM分析图(b) Fig.2 Concentration of the residual inorganic elements(a) and FT-IR spectra of the Al(OH)3 with addition of PEG-1000(b) |
从图 3的N2吸附-脱附等温线可以看出,不同PEG加入量得到的Al(OH)3样品的孔型曲线属于IV型,具有介孔材料的特征,在脱附等温线上出现的滞后环是由于发生在材料表面介孔里的毛细现象造成的(Li et al., 2011).由孔径分布曲线可以知道,Al(OH)3的孔径分布在介孔-大孔的范围内.从表 1中数据可以看出,随着PEG加入量的增加,Al(OH)3的SBET和孔体积都是呈先增大后减小的趋势.由此可见,通过控制表面活性剂的加入比例可以在一定程度上调节Al(OH)3的孔结构.PEG分子易与Al(OH)3表面建立较强的氢键而交联在胶粒的表面(An et al., 2010),纳米颗粒之间存在着由于链的体积的影响而不能触及的空隙,合适的PEG量,可以抑制一次颗粒形成二次颗粒的速度,也就是说,PEG分子的交联和包覆对于生成小尺寸的Al(OH)3颗粒是有利的,也可以有效地限制团聚(An et al., 2010).随着PEG加入量的增加,Al3+的沉淀效率降低,Al(OH)3粒子的生长速度降低,反而加快了一次颗粒叠加形成二次颗粒的速度,粒子尺寸变大,PEG分子对于大尺寸Al(OH)3颗粒的覆盖作用变差,颗粒之间的碰撞也越频繁,粒子之间的团聚作用也变得明显;从而使得Al(OH)3的SBET和孔体积逐渐变小,平均孔径变大.
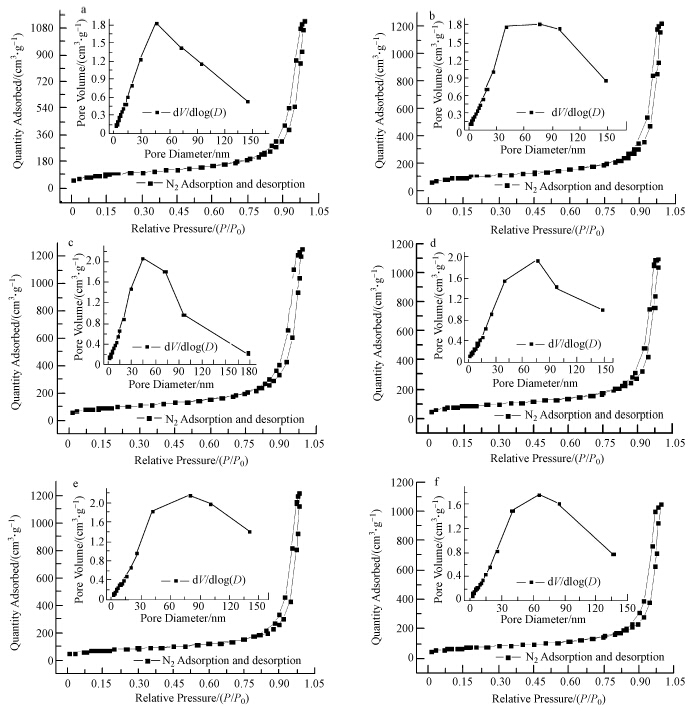 |
| 图 3 不同PEG-1000加入量得到的Al(OH)3样品的N2吸附-脱附谱图和孔径分布对比(a. 0.01% PEG;b. 0.05% PEG;c. 0.1% PEG;d. 0.2% PEG;e. 0.4% PEG;f. 0.6% PEG) Fig.3 Nitrogen adsorption/desorption isotherms and pore size distribution(inset)of the samples obtained at different PEG dosages(a. 0.01% PEG; b. 0.05% PEG; c. 0.1% PEG; d. 0.2% PEG; e. 0.4% PEG; f. 0.6% PEG) |
由表 1的数据可知,PEG加入量为0.05%的Al(OH)3的SBET最大,加入量为0.6%的Al(OH)3的SBET最小,在以下的XRD和TEM分析中将详细对比这两个样品的区别.
| 表 1 在不同PEG-1000加入量得到的Al(OH)3的SBET和孔结构 Table 1 Textural properties of the Al(OH)3 obtained at different PEG-1000 dosages |
从图 4a可以看出,在PEG-1000加入量为0.05%和0.6%时,Al(OH)3的XRD谱图基本没有变化,均显示为弥散的非晶漫散射包,说明得到的Al(OH)3是无定形的;表明表面活性剂对溶胶-凝胶法得到的Al(OH)3的晶型没有影响.在图 4b中的Al(OH)3样品显现出良好的分散性,絮状结构的粒子尺寸范围大概为10~30 nm.从图 4c中可以看出,在PEG-1000加入量为0.6%时,得到的Al(OH)3粒子尺寸相对较大,分散较好的20~40 nm的絮球可以在图中清晰地观察到.据文献报道,Al(OH)3的等电位点大约在7.5~8.5的pH值范围(Sipos,2009;Williams et al., 2011),当pH值(本实验中pH=6.0)低于Al(OH)3的等电位点时,正电的Al(OH)3就会吸引带负电的颗粒(Miyazaki et al., 2013;Williams et al., 2011);PEG-1000分子中含有羟基,在水溶液中会电离出质子,促进其在Al(OH)3颗粒表面的交联,阻止Al(OH)3颗粒的团聚;所以,当PEG-1000加入量增加12倍(0.05%至0.6%),都可以得到分散性较好的纳米粒子;但是,Al3+的沉淀效率会降低,生成粒径相对较大的粒子,降低样品的SBET(表 1).当PEG-1000加入量为0.05%时,可以得到分散更好、粒径更小的纳米絮状物.
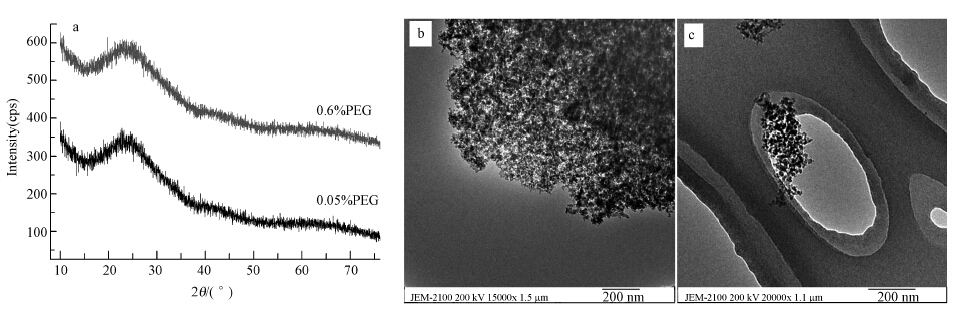 |
| 图 4 Al(OH)3样品的XRD(a)和TEM分析图(b. 0.05% PEG;c. 0.6% PEG) Fig.4 XRD(a) and TEM(b. 0.05% PEG; c. 0.6% PEG)analyses of the Al(OH)3 samples |
1)N2吸附-脱附曲线的数据说明,随着PEG加入量的增加,Al(OH)3的SBET和孔体积都呈先增大后减小的趋势;Al(OH)3的孔径分布在介孔-大孔的范围内;PEG加入量为0.05%的Al(OH)3的SBET最大,为359 m2 · g-1.
2)FTIR结果显示,在2975 cm-1左右处出现了一个由PEG-1000中—CH2—振动引起的吸收峰,随着PEG-1000加入量增加,这个振动峰有逐渐增强的趋势;PEG-1000的加入对促进非晶态的纳米Al(OH)3粒子的分散有很大作用,其加入量(v/v)不宜超过0.2%.以环境废物(污泥)为原料、加入少量表面活性剂即可以得到分散较好的Al(OH)3,符合经济、高效的原则,具有一定的发展前景.
| [1] | An B C, Ji G J, Wang W Y, et al. 2010. Azeotropic distillation-assisted preparation of nanoscale gamma-alumina powder from waste oil shale ash[J]. Chemical Engineering Journal, 157(1): 67-72 |
| [2] | Ding R, Zhang P F, Seredych M, et al. 2012. Removal of antibiotics from water using sewage sludge-and waste oil sludge-derived adsorbents[J]. Water Research, 46(13): 4081-4090 |
| [3] | Gómez-Pacheco C V, Rivera-Utrilla J, Sánchez-Polo M, et al. 2012. Optimization of the preparation process of biological sludge adsorbents for application in water treatment[J]. Journal of Hazardous Materials, 217-218: 76-84 |
| [4] | Li X B, Wang D Q, Zhou Q S, et al. 2011. Concentration variation of aluminate ions during the seeded precipitation process of gibbsite from sodium aluminate solution[J]. Hydrometallurgy, 106(1/2): 93-98 |
| [5] | Liu C, Tang Z G, Chen Y, et al. 2010. Characterization of mesoporous activated carbons prepared by pyrolysis of sewage sludge with pyrolusite[J]. Bioresource Technology, 101(3): 1097-1101 |
| [6] | Miyazaki A, Numata M, Etou M, et al. 2013. Evidence for tetrahedral AlO4 formation induced by Zn2+ adsorption onto Al(OH)3 gel[J]. Colloid Surface (A: Physicochem Eng Aspects), 420: 115-121 |
| [7] | Qian Q R, Mochidzuki K, Fujii T, et al. 2009. Removal of copper from aqueous solution using iron-containing adsorbents derived from methane fermentation sludge[J]. Journal of Hazardous Materials, 172(2/3): 1137-1144 |
| [8] | Ren X L, Liang B H, Liu M, et al. 2012. Effects of pyrolysis temperature, time and leaf litter and powder coal ash addition on sludge-derived adsorbents for nitrogen oxide[J]. Bioresource Technology, 125: 300-304 |
| [9] | Ros A, Lillo-Ródenas M A, Batlle C C, et al. 2007. A new generation of sludge-based adsorbents for H2S abatement at room temperature[J]. Environmental Science & Technology, 41(12): 4375-4381 |
| [10] | Sipos P. 2009. The structure of Al(Ⅲ) in strongly alkaline aluminate solutions-A review[J]. Journal of Molecular Liquids, 146(1/2): 1-14 |
| [11] | Smith K M, Fowler G D, Pullket S, et al. 2009. Sewage sludge-based adsorbents: A review of their production, properties and use in water treatment applications[J]. Water Research, 43(10): 2569-2594 |
| [12] | Stosiek C, Scholz G, Schroeder S L, et al. 2010. Structure and properties of noncrystalline aluminum oxide-hydroxide fluorides[J]. Chemistry of Materials, 22(7): 2347-2356 |
| [13] | Velghe I, Carleer R, Yperman J, et al. 2012. Characterisation of adsorbents prepared by pyrolysis of sludge and sludge/disposal filter cake mix[J]. Water Research, 46(8): 2783-2794 |
| [14] | Williams G R, Moorhouse S J, Prior T J, et al. 2011. New insights into the intercalation chemistry of Al(OH)3[J]. Dalton Transactions, 40(22): 6012-6022 |
| [15] | Zou J L, Dai Y, Tian C G, et al. 2012. Structure and properties of noncrystalline nano-Al(OH)3 reclaimed from carbonized residual wastewater treatment sludge[J]. Environmental Science & Technology, 46(8): 4560-4566 |
 2014, Vol. 34
2014, Vol. 34


