金属元素特别是铁与微生物在(缺)厌氧的环境中,铁的氧化物还原解离生成的活性Fe(ΙΙ),主导了对污染物的还原降解过程.微生物还原高价态的铁氧化物不仅会影响重金属的生物环境地球化学循环,也会影响有机物污染物、重金属及营养物质(N、P)在环境中的归宿(Elsner et al., 2003,Gaberell et al., 2003).环境介质中(土壤、沉积物等)的溶解有机质(DOM)积极参与了铁的异化还原过程,已被大量的研究所证实(Rakshit et al., 2009,Uchimiya,2010);DOM以其活跃的化学反应活性,无疑成为影响和制约铁异化还原的众多因素的核心关注点,也是诠释铁异化还原机制的关键.故阐明DOM对铁氧化物及水合物还原作用的调控机制是必要的,因此,本文选择了以含醌式结构的氧化还原敏感性官能团的2-磺酸钠蒽二酚(AQS)为模型溶解有机质,以典型的金属还原菌-脱色希瓦氏菌(Shewanelladecolorationis,S12)与针铁矿为研究对象,构建铁还原菌-针铁矿相互作用体系,探讨AQS对针铁矿异化还原特征的影响因素,从而为DOM调控下的铁异化还原过程机制研究提供科学的理论支持.
2 实验与步骤(Materials and methods) 2.1 针铁矿制备配制1.0 mol · L-1的Fe(NO3)3100 mL溶液和4.5 mol · L-1的KOH溶液200 mL.在剧烈搅拌情况下,将KOH溶液快速加入到FeCl3溶液中,并迅速把混合溶液稀释到1L.将稀释的溶液在70 ℃水浴中恒温反应60 h,在反应过程中,搅拌反应液3~5次,水浴反应得到黄褐色沉淀.60 h后,用漏斗过滤、洗涤至滤出液的pH值呈中性;将洗涤后的沉淀用去离子水稀释定容为500 mL的胶体悬浮(Schwertmann and Cornell, 2000).
2.2 菌种、培养基及实验方案脱色希瓦氏菌S12由广东省微生物研究所提供(Xu et al., 2005),该菌具有利用高价态金属氧化物和有机污染物作为电子受体进行厌氧呼吸的能力. S12菌与针铁矿相互作用体系的成分包括不同浓度的2-磺酸钠蒽二酚(AQS)、针铁矿及1 mol · L-1的HIPES +1 mol · L-1的缓冲溶液NH4Cl +1 mol · L-1 乳酸钠(pH =7. 0).在32 ℃的LB培养基中好氧培养16 h后,菌体经5000 r · min-1离心5 min,无菌超纯水洗涤重悬浮,此操作重复3次,最终配成一定浓度的菌悬液(A600 =1.6).按体积比分别为1%和5% 将菌体接种于反应体系中.反应体系分装于100 mL棕色瓶,用高纯氮充气排氧,然后用橡胶塞压紧,置于厌氧培养箱(SHELLAB-Bactron ΙΙΙ)中于32 ℃静置培养.每隔一定时间间隔取样,对AQS进行200~600 nm波长扫描,测定针铁矿被还原而生成总的Fe(II)浓度及溶解态Fe(II)浓度.
2.3 测定方案测定的具体步骤为:在厌氧箱中取2 mL上清液至比色皿中,对其进行200~600 nm波长扫描.然后将上清液倒回反应体系,总铁测定:将密闭的反应瓶溶液摇匀,取0. 5 mL溶液,再加入1mL HCl(0. 5 mol · L-1)提取30 min,0.45 μm滤膜过滤,然后取上述滤液0.2 mL至10 mL比色管中,再分别加1 mL邻菲罗啉(1 g · L-1)和NH4AC-HAc(50 mmol · L-1)缓冲溶液,混匀,经15 min显色充分后,在510 nm检测波长下测定其吸光度,根据比色法的工作曲线得出待测样品的浓度.溶解态铁测定:将密闭的反应瓶溶液摇匀,取0.5mL溶液,直接通过0.45 μm滤膜过滤,然后取上述滤液0.2 mL至10 mL比色管中,其余加药量及顺序同上.
3 结果与讨论(Results and discussion) 3.1 不同含量针铁矿的异化还原特征厌氧培养3 d后,各反应体系中开始加入不同浓度的针铁矿,还原解离态铁总量(Fetot)和可溶态铁含量(Fedis)均快速增加(图 1),这主要是针铁矿耦合了生物驱动(微生物呼吸作用)以及非生物驱动(体系中还原态AH2QS作用)下的还原解离过程(Zhu et al., 2013).由于体系中S12菌接种量和AQS量均相同,故还原解离过程到达平衡所需时间主要受针铁矿含量影响.如在针铁矿含量分别为0.1 mmol · L-1 的体系中,针铁矿的还原解离过程在2 d内基本达到平衡;而含10 mmol · L-1针铁矿的体系中,还原过程达到平衡的时间为第12d(图 1).
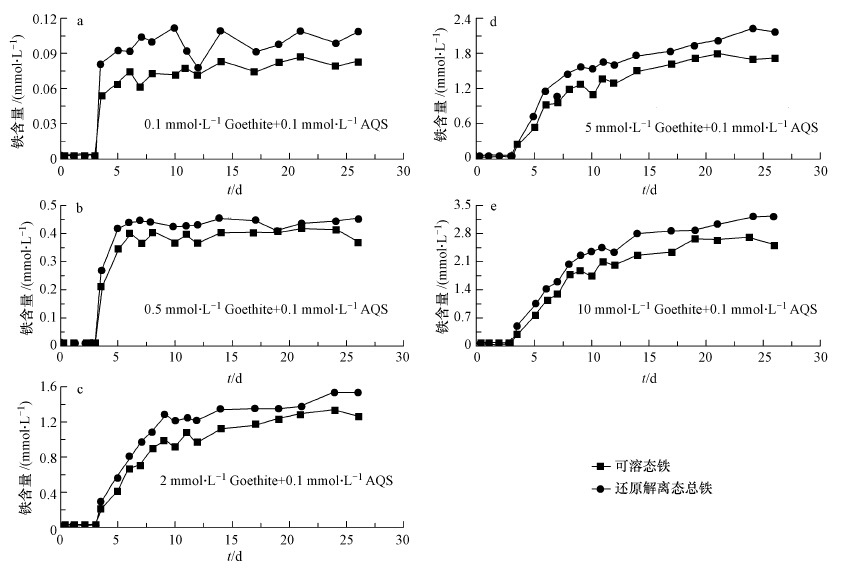 |
| 图 1 不同浓度针铁矿的异化还原过程中还原解离态总量和溶解态含量(各反应体系中AQS含量:0.1 mmol · L-1,针铁矿含量:0.1~10.0 mmol · L-1) Fig.1 Characteristics of reductively produced total and dissolved iron contents in reaction systems containing different goethite |
针铁矿还原解离达平衡后,各反应体系中Fedis和Fetot的比值均维持在80%左右(图 2),表明针铁矿含量对体系平衡后的Fedis/Fetot比值影响微弱,但对针铁矿的还原率有着显著地制约作用,体系中针铁矿的还原率随针铁矿含量增加而快速减小(图 2),针铁矿含量为0.1 mmol · L-1 的体系中,针铁矿的还原率可接近100%,当体系中针铁矿含量升至10 mmol · L-1以上,还原率下降至32.1%. 这主要是随着针铁矿浓度上升,相互聚集效应加强,胶体颗粒增加,比表面积减小(Liu et al., 2001),使得微生物-针铁矿相互接触难易程度减弱,导致针铁矿的微生物还原程度也相应下降.
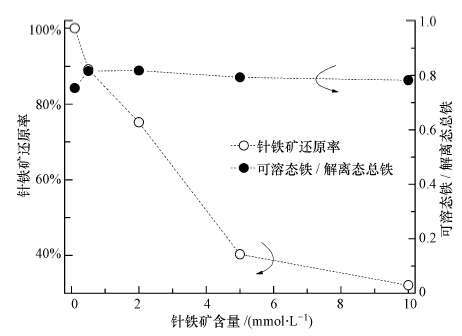 |
| 图 2 体系中针铁矿含量变化对针铁矿还原率和可溶态铁/解离态总铁比值的影响 Fig.2 Influence of goethite contents on values of Fedis/Feto and extent of goethite microbial reduction |
该部分实验中各反应体系中针铁矿含量均为2 mmol · L-1,厌氧培养8 d后,向体系中添加不同浓度(0.025、0.05、0.15、0.3 mmol · L-1)AQS,其他成分及浓度同2.2节.加入AQS后,反应速率得到明显增强,15 d后整个反应基本达到平衡(图 3).AQS作为电子运移载体,其含量增加使得对针铁矿还原促进的程度也得到相应加强(图 4),含0.3 mmol · L-1的AQS体系中最终平衡时的Fetot含量可达1.7 mmol · L-1,为低含量(0.025 mmol · L-1)AQS体系的约170%(图 3a,图 3b).
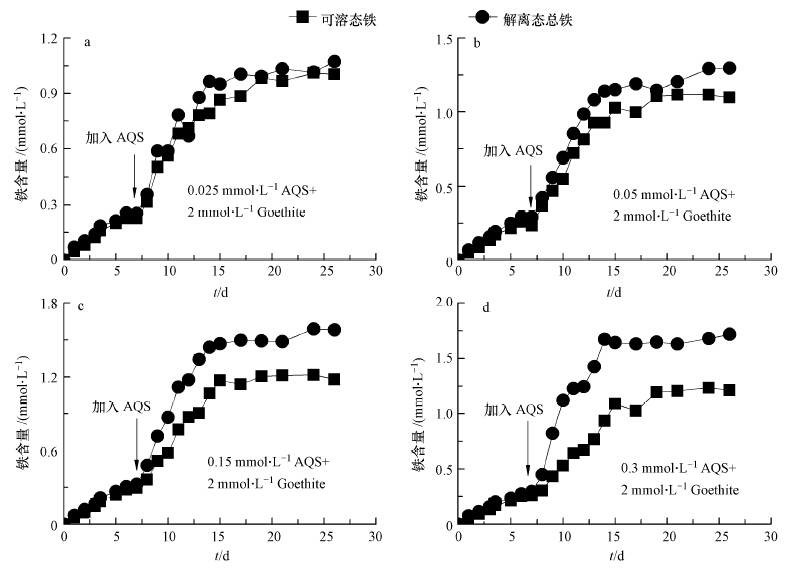 |
| 图 3 不同浓度AQS条件下针铁矿异化还原过程中还原解离态总量和溶解态含量(各反应体系中针铁矿含量:2 mmol · L-1,AQS含量:0.025~0.3 mmol · L-1) Fig.3 Characteristics of reductively produced total and dissolved iron contents in reaction systems containing different AQS |
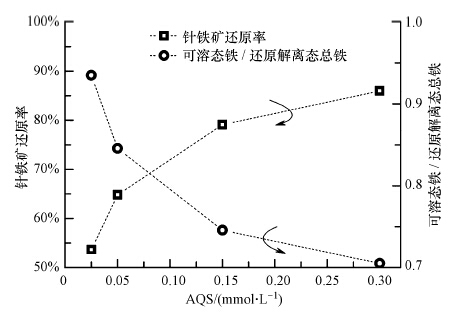 |
| 图 4 体系中AQS含量变化对针铁矿还原率和Fedis/Fetot比值的影响 Fig.4 Influence of AQS contents on values of Fedis/Feto and extent of goethite microbial reduction |
不同含量的AQS加入前后,针铁矿还原平均速率(ΔFeTotal(mmol · L-1)/incubation time(d))之比在2.4~4.0之间,且该比值和AQS含量呈显著的线性关系,可决系数为0.9947(图 5).电子运移载体参与下的铁氧化物还原解离过程大致为(Ross et al., 2009):电子运移载体首先获得菌呼吸过程中产生的电子,再将获得的电子传递给固体铁氧化物表面,从而加速铁氧化物发生还原解离作用.由电子运移载体加速铁氧化物还原过程机制可知(O′Loughlin,2008),AQS首先吸附在针铁矿表面,这样针铁矿才能有效获取电子运移载体传递来的电子,使得针铁矿解离得以有效进行,即在针铁矿未达到饱和吸附之前,AQS含量越高,针铁矿解离速率也越大,且两者之间呈现出良好的线性关系(图 5).
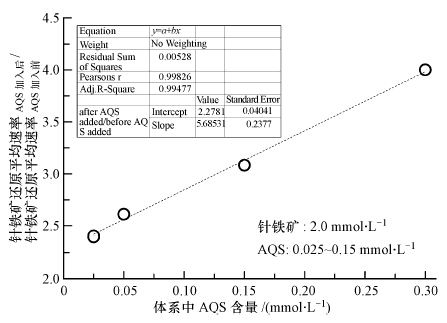 |
| 图 5 体系中AQS含量对针铁矿还原平均速率的影响 Fig.5 Influence of AQS contents on average rates of goethite microbial reduction |
AQS含量越高,体系中Fedis/Fetot比值随之越低(图 4).当体系中AQS含量为一定值(0.1 mmol · L-1),且针铁矿含量在0.1~10.0 mmol · L-1范围内变化时,Fedis/Fetot比值基本维持不变(图 2).以上现象表明AQS含量可能是制约Fedis/Fetot比值最直接的因素.Fedis/Fetot比值表征了解离态铁离子在固(针铁矿)-液两相间的分配平衡程度.电子运移载体(AQS)的加入,不仅改变了固液两相间的分配平衡常数,而且促进了针铁矿的还原解离程度,从而使得Fetot含量增加(图 3);另一方面针铁矿因还原解离从而粒径变小,比表面积相应增加,吸附铁离子的能力增强(Liu et al., 2001,Roden and Zachara, 1996),导致解离态铁离子向溶液中扩散趋势减弱,故Fedis在针铁矿还原过程中的增加趋势得到减缓(图 3).因此体系中Fedis/Fetot比值随AQS含量增加而减小.
体系中加入AQS后,还原解离态铁含量和反应时间的关系可用下式描述:
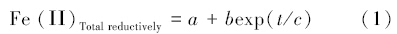
式中,a为反应最终趋于平衡时,体系中的解离态铁含量(mmol · L-1);b为与体系相关的常数;c可表征AQS含量对解离态铁含量的变化影响程度大小.由表 1可知,AQS含量越高,体系中最终平衡时的解离态铁含量也越高,拟合结果与图 3铁含量变化趋势基本一致,即AQS含量越高,c值也越大.
| 表 1 不同AQS含量下体系中解离态铁含量随时间的拟合结果 Table 1 Fitted parameters of relationship between reaction time and Fetot contents in reaction systems containing different AQS contents |
Fetot 含量和Fedis含量之差可视为吸附态铁离子(Feads)含量.添加AQS后,随着体系中AQS含量的逐渐增加,体系中Feads含量也随之增加(图 6). 但在未添加AQS的前7 d,Feads含量维持在较低的水平(<0.05 mmol · L-1).以上现象表明,1)AQS因加速针铁矿还原解离导致其粒径变小,如前所述,比表面积相应增加,吸附铁离子的能力增强,故Feads含量随AQS含量增加而增加;2)对于AQS而言,是以其钠盐(2-磺酸钠蒽二酚钠)的形式加入反应体系,AQS 相应的带负电荷的磺酸根阴离子首先吸附在针铁矿表面,这样针铁矿才能有效获取电子运移载体传递来的电子,使得针铁矿解离得以有效进行.AQS含量高的体系,针铁矿表面吸附的磺酸根阴离子含量也越高,针铁矿表面被修饰成带负电荷的胶体,对带正电荷的铁离子的吸附能力也相应增加.
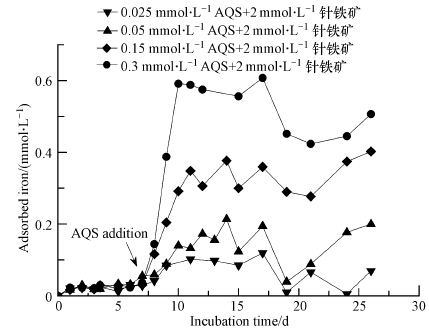 |
| 图 6 针铁矿还原过程中吸附态铁含量变化特征 Fig.6 The characteristics of absorbed iron contents during the course of microbial goethite reduction |
蒽醌类磺酸盐能作为电子转移载体,使得电子 在微生物与金属氧化物之间能发生高效的传递,从而促进铁的异化还原,而电子运移载体本身也因得失电子而以不同形态存在(Perminova et al., 2005,Zhang and Weber, 2009).对于AQS来说,其相应的还原态形式为AH2QS,AQS和AH2QS的最大吸收波长分别位于329 nm和380 nm处.在UV-VIS扫描图(图 7a)上也可观察到380 nm(AH2QS最大的吸收波长)处的吸光度持续增加,即S12菌代谢过程中将电子传递给电子转移载体AQS,从而将AQS转变为以还原态AH2QS形式存在.厌氧培养3.5 d后,各反应体系中开始加入不同浓度的针铁矿,因AH2QS具有一定的还原性,可与高价态的针铁矿反应(Shi et al., 2012),UV-VIS扫描图(图 7b)也可见329 nm(AQS最大的吸收波长)处的吸光度快速增加,表明还原态AH2QS含量快速降低,转变为以氧化态形式存在的AQS.第5 d后AH2QS含量开始持续回升(图 7b),这主要是在S12菌的代谢作用下驱动了AQS向AH2QS的转化.
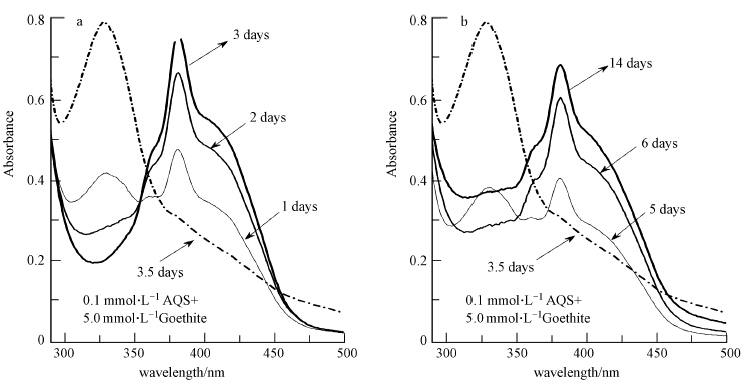 |
| 图 7 针铁矿异化还原过程中AQS 两种形态间的转化(1.AQS和AH2QS最大吸收波长分别为329和380 nm;2. 图中反应体系组成:0.1 mmol · L-1 AQS,5.0 mmol · L-1 针铁矿,其它组分见实验部分) Fig.7 Characteristics of the transformation between two species of electron shuttle,AQS and AH2QS |
综上,AQS参与下的铁异化还原过程实际上是由两个相互耦合的子过程组成,即生物代谢过程和非生物过程.在微生物代谢过程中,氧化电子供体从而将电子转移至AQS.在此过程中具有氧化还原敏感性官能团-蒽醌结构,因获得电子而以还原态的蒽二酚结构形式(AH2QS)存在.这一过程实际上是氧化还原中介体在吸纳因还原菌代谢作用而转移来的电子.在该阶段的电子转移反应达到平衡后,开始下一步反应,即AH2QS将接收的电子转移至针铁矿,使得针铁矿被还原而解离.AH2QS 转变为以缺电子的AQS氧化态形式存在.当这一非生物反应达平衡后,AQS因微生物代谢作用,转变为AH2QS,直至整个反应体系最终达到完全平衡.
4 结论(Conclusions)1)AQS作为电子运移载体,不仅加速了针铁矿的还原解离程度和速率,而且对体系中Fetot含量、Fedis含量、Feads含量以及Fetot/Fedis比值均产生显著的影响.
2)含氧化还原敏感性官能团结构的2-磺酸钠蒽二酚钠作为电子转移载体,促进铁的异化还原过程主要由两个相互耦合的子过程组成,即微生物呼吸作用驱动了AQS和还原态的AH2QS之间的循环转变过程以及AH2QS进一步还原解离针铁矿的非生物过程.
3)环境介质中大量存在的含氧化还原敏感性特定官能团的DOM积极参与了铁异化还原的过程,对该过程影响机制的阐明将有助于深入了解DOM调控下的铁异化还原特征和规律.
| [1] | Elsner M, Schwarzenbach R P, Haderlein S B. 2003. Reactivity of Fe(Ⅱ)-Bearing minerals toward reductive transformation of organic contaminants[J]. Environmental Science & Technology, 38(3): 799-807 |
| [2] | Gaberell M, Chin Y P, Hug S J, et al. 2003. Role of dissolved organic matter composition on the photoreduction of Cr(VI) to Cr(Ⅲ) in the presence of iron[J]. Environmental Science & Technology, 37(19): 4403-4409 |
| [3] | Liu C X, Kota S, Zachara J M, et al. 2001. Kinetic analysis of the bacterial reduction of goethite[J]. Environmental Science & Technology, 35(12): 2482-2490 |
| [4] | O'Loughlin E J. 2008. Effects of electron transfer mediators on the bioreduction of lepidocrocite (γ-FeOOH) by Shewanella putrefaciens CN32[J]. Environmental Science & Technology, 42(18): 6876-6882 |
| [5] | Perminova I V, Kovalenko A N, Schmitt-Kopplin P, et al. 2005. Design of quinonoid-enriched humic materials with enhanced redox properties[J]. Environmental Science & Technology, 39(21): 8518-8524 |
| [6] | Rakshit S, Uchimiya M, Sposito G. 2009. Iron(Ⅲ) bioreduction in soil in the presence of added humic substances[J]. Soil Science Society of America Journal, 73(1): 65-71 |
| [7] | Roden E E, Zachara J M. 1996. Microbial reduction of crystalline Iron(Ⅲ) oxides: Influence of oxide surface area and potential for cell growth[J]. Environmental Science & Technology, 30(5): 1618-1628 |
| [8] | Ross D E, Brantley S L, Tien M. 2009. Kinetic characterization of OmcA and MtrC, terminal reductases involved in respiratory electron transfer for dissimilatory iron reduction in Shewanella oneidensis MR-1[J]. Applied and Environmental Microbiology, 75(16): 5218-5226 |
| [9] | Schwertmann U, Cornell R M. 2000. Iron Oxides in the Laboratory: Preparation and Characterization[M]. 2nd ed. Wiley-VCH Verlag GmbH: Weinheim |
| [10] | Shi Z, Zachara J M, Shi L, et al. 2012. Redox reactions of reduced flavin mononucleotide (FMN): riboflavin (RBF): and anthraquinone-2, 6-disulfonate (AQDS) with ferrihydrite and lepidocrocite[J]. Environmental Science & Technology, 46(21): 11644-11652 |
| [11] | Uchimiya M. 2010. Reductive transformation of 2, 4-dinitrotoluene: Roles of Iron and natural organic matter[J]. Aquatic Geochemistry, 16(4): 547-562 |
| [12] | Xu M, Guo J, Cen Y, et al. 2005. Shewanella decolorationis sp. nov., a dye-decolorizing bacterium isolated from activated sludge of a waste-water treatment plant[J]. International Journal of Systematic and Evolutionary Microbiology, 55(1): 363-368 |
| [13] | Zhang H C, Weber E J. 2009. Elucidating the role of electron shuttles in reductive transformations in anaerobic sediments[J]. Environmental Science & Technology, 43(4): 1042-1048 |
| [14] | Zhu W, Nan Y, Huang T, et al. 2013. The mechanism, thermodynamic and kinetic characteristics of the microbial reduction of goethite mediated by anthraquinone-2-Sulfonate[J]. Geomicrobiology Journal, 30(10): 928-940 |
 2014, Vol. 34
2014, Vol. 34


