2. 河南科技大学食品与生物工程学院, 洛阳 471003;
3. 江西农业大学生物科学与工程学院, 南昌 330045
2. College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471003;
3. College of Bioscience and Bioengineering, Jiangxi Agriculture University, Nanchang 330045
2′,6′-甲乙基-2-氯乙酰苯胺(2′,6′-methylethyl-2-chloroacetanilide,CMEPA)是氯乙酰胺类除草剂乙草胺、异丙甲草胺等降解的主要产物(Jablonkai,2000; Xu et al., 2006),而乙草胺则是国际市场中销售量最大的酰胺类除草剂,也是目前我国使用量最大的3种除草剂之一(董滨等,2011). 大量研究表明,乙草胺及其代谢产物具有一定的生态毒性,可对动物机体神经内分泌系统、生殖系统和遗传变异等造成危害(Coleman et al., 2000; Green et al., 2000; Cheek et al., 1999; 李贤宾,2010; 胡伟军,2010); 并且乙草胺对鱼类有较强的毒性. 早在20世纪90年代,乙草胺就被美国环保局定为B-2 类致癌物(U.S. Environmental Protection Agency,1994).由于乙草胺施用量大,并且其水中溶解度也较大,所以在大多数农业地区的地表水和地下水中,都能监测到乙草胺及其代谢物的残留(Ye,2003; Kalkhoff et al., 1998; Clark and Goolsby, 1999); 而在乙草胺生产废水中,其浓度最高可达147.8 mg · L-1(酰胺类农药工业水污染物排放标准编制组,2008). 考虑到暴露在乙草胺每日摄取容许量以上对人体的潜在危害,以及地表水中乙草胺代谢物对人体的危害,我国国家环保部早在2003年即开始着手制定酰胺类农药工业废水排放标准(张一宾,2011); 而欧盟委员会则于2011年底决定不予除草剂乙草胺再登记,并下令欧盟成员国在2012年6月23日取消其登记(世界农化网,2011).
微生物降解是消除农药环境污染的重要途径,近年来,关于乙草胺的微生物降解问题逐渐成为研究热点(郭华和杨红,2006; Green et al., 2000; 胡伟军,2010; 倪盈盈等,2011; Zeng et al.,2011). 作为乙草胺的重要代谢产物,CMEPA与乙草胺一样对人和动物也具有一定的毒害性(Coleman et al., 2000),然而目前尚未有关于微生物菌株降解 CMEPA的报道. 本课题组在研究乙草胺的微生物降解过程中分离到一株Delftia sp.T3-6菌株,该菌株虽然不能降解乙草胺,但却能高效降解CMEPA. 此外,Delftia属细菌广泛分布于自然界,且该属细菌在有机污染物降解的研究已有大量报道(李金钟和刘利平,2008; 武洪杰等,2010;景岳龙等,2010; 沈雨佳等,2007). 因此,该属微生物在环境污染治理和生物修复方面具有重要的研究和应用价值. 本文旨在深入研究Delftia sp.T3-6菌株对CMEPA的生物降解特性,了解T3-6菌株降解体系中酶的分布特征、活菌体与粗酶液降解CMEPA最适反应条件的差异等,以期为利用该菌株及其酶液进行乙草胺与CMEPA污染土壤和水体的生物修复,特别是高浓度酰胺类农药生产废水中乙草胺和CMEPA的生物处理提供理论参考.
2 材料与方法(Materials and methods) 2.1 供试菌株菌株T3-6由本课题组分离,具有降解2′,6′-甲乙基-2-氯乙酰苯胺的能力,16S rRNA基因序列分析表明该菌株属于Delftia属.
2.2 培养基与试剂基础盐培养基(MSM,g · L-1): NH4NO3 1.0,KH2PO4 0.5,K2HPO4 1.5,NaCl 1.0,MgSO4 · 7H2O 0.1. 除特殊说明外,该培养基pH均为 7.0.
LB培养基(g · L-1): 酵母粉 5.0,胰蛋白胨 10.0,NaCl 10.0,pH自然.
2′,6′-甲基乙基-2-氯乙酰苯胺(CMEPA,98%)购于青岛沃克化学有限公司.
2.3 菌株种子液的制备从LB平板上挑取菌株T3-6单菌落,接种于3 mL LB液体培养基中于30 ℃、摇床180 r · min-1培养,培养12 h. 然后将培养液转接到20 mL新鲜的液体LB培养基中,继续培养12 h. 6000 g离心10 min,收集菌体,用灭菌的MSM洗涤3次后,制成OD600=1.0(9.1×108 cfu · mL-1)的菌悬液,即种子液.
2.4 菌株粗酶液的制备从LB平板上挑取菌株T3-6单菌落,接种于3 mL LB液体培养基中于30 ℃、摇床180 r · min-1培养,培养12 h. 然后将培养液转接到100 mL新鲜的液体LB培养基中,继续培养12 h. 6000 g离心10 min,分别收集菌体和上清液,此上清液即为胞外酶液. 然后用适量预冷的 PBS缓冲液(0.05 mol · L-1,pH 8.0)重悬菌体,4 ℃,6000 g离心10 min,收集菌体,弃上清; 最后用5 mL PBS重悬菌体; 将菌液在180 Hz下超声波破碎10 min,整个过程在冰浴下进行. 破碎液在4 ℃,12000 g离心20 min,收集上清液,此上清液即为胞内粗酶液.
2.5 T3-6菌株对CMEPA的降解试验在同一CMEPA初始浓度时,同时取3个反应瓶,向每个反应瓶中加入一定体积的10 g · L-1的CMEPA丙酮溶液. 在常压下使丙酮挥发至干后,向每个反应瓶中平行加入100 mL的基础盐培养基和T3-6种子液,在30 ℃、180 r · min-1条件下进行好氧培养,每隔2 h取样测定CMEPA的浓度,同时设不加菌悬液的对照组. 分别在不同的温度(20、25、30、37、42 ℃)、不同的pH值(4、5、6、7、7.5、8、8.5、9、10)以及不同的CMEPA初始浓度(50、100、200、500 mg · L-1)和不同接种量(V/V,0.5%、1%、2.5%、5%)条件下重复上述试验,研究温度、pH值、CMEPA初始浓度和接种量对菌株T3-6降解CMEPA的影响.
2.6 CMEPA的酶促降解试验取3个反应管,向每个反应管中平行加入10 g · L-1 CMEPA丙酮溶液20 μL,在常压下使丙酮挥发至干后,向每个反应管中平行加入0.1 mol · L-1 pH 8.0磷酸盐缓冲液3.98 mL,粗酶液20 μL,使各反应管中CMEPA的起始浓度为50 mg · L-1. 在25 ℃条件下静态反应10 min后,测定CMEPA的浓度变化. 相同条件下,同时做胞外酶对CMEPA的降解实验,并设不加酶的对照组. 酶活单位定义为: 在测定条件下,每min降解1 μmol CMEPA所需要的酶量.
2.6.1 粗酶液最适反应温度测定将20 μL粗酶加入0.1 mol · L-1 pH 8.0的磷酸缓冲液体系中测定酶活力,反应时间为10 min,温度设置从20 ℃到40 ℃,每隔5 ℃取点测定.
2.6.2 粗酶液最适反应pH值测定将粗酶液分别加入到不同pH值的缓冲液(柠檬酸缓冲液: pH 3.0~6.0,磷酸缓冲液: pH 5.8~9.0,甘氨酸-NaOH 缓冲液: pH 8.6~10.0)体系中测定酶活力,缓冲液浓度皆为0.1 mol · L-1. 酶活性测定反应温度为25 ℃,反应时间为10 min.
2.6.3 粗酶液温度稳定性测定酶的温度稳定性测定在粗酶液反应最适pH值和最适温度下进行. 先将粗酶液置于20 ℃到40 ℃(5 ℃一个间隔)水浴中分别放置30 min后,加入到酶活测定体系中测定酶的活力,反应时间为10 min.
2.6.4 粗酶液pH值稳定性测定酶的pH值稳定性测定在酶反应最适pH值和最适温度下进行. 先将粗酶液分别置于不同pH值的缓冲液中于4 ℃放置24 h后,加入到酶活测定体系中测定酶的活力,反应时间为10 min.
2.8 CMEPA的检测CMEPA的检测采用高效液相色谱法(HPLC,LC-20AD,SHIMADZU): 取4 mL培养液或酶活测定反应液,加入等体积的二氯甲烷,剧烈振荡1 min,静置10 min,去水相,加无水硫酸钠去除有机相中残余水分. 取1 mL抽提过的CMEPA样品,于常温常压下挥发至干,加入1 mL色谱纯甲醇溶解剩余物,并用0.2 μm有机滤膜过滤后利用HPLC检测. 液相色谱条件: 250 mm×4.6 mm C18反相色谱柱; HPLC流动相为90%甲醇,流速为1 mL · min-1,上样量为20 μL,柱温为40 ℃. Waters 2487紫外检测器,检测波长为228 nm.
3 结果与讨论(Results and discussion) 3.1 T3-6菌株的培养特征与生长特性本研究首先对T3-6菌株的培养特征与生长特性进行了初步研究,结果表明: 菌株T3-6在LB平板上形成乳白色菌落,菌落边缘整齐,无光泽,扁平,粘稠,湿润,光滑,半透明; 其菌体呈长杆状(0.8 μm×2.5 μm),无荚膜,有鞭毛(图 1). 菌株T3-6最适生长温度为37 ℃,且其在pH值5.0~9.0均可以很好的生长; 该菌株为好氧性生长,能耐受3%的NaCl浓度.
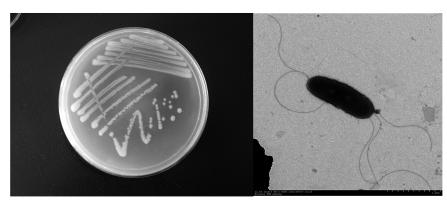 |
| 图 1 菌株T3-6 在LB 平板上的菌落照片和电镜照片(×20000) Fig. 1 The colony of strain T3-6 on LB plate and the electronic photograph(×20000) |
在CMEPA终浓度分别为50、100、200、500 mg · L-1的基础盐培养基中,按1%接种量接入OD600 nm=1.0菌株T3-6种子液,于30 ℃、180 r · min-1摇床培养,每2 h取样测定CMEPA的残留量,确定CMEPA初始浓度对菌株T3-6降解能力的影响,其结果如图 2所示. 由图中可以看出,在接种T3-6以后,CMEPA的浓度均随着时间的变化呈降低趋势. 即使CMEPA的初始浓度达到500 mg · L-1,其12 h的降解率亦可达到52.68%. 而当CMEPA初始浓度为50和100 mg · L-1时,则仅需4~6 h CMEPA即可被降解95%以上. 各浓度CMEPA被降解的平均速率分别为4.10、8.26、15.41和21.95 mg · L-1 · h-1. 虽然到目前为止,还未见关于微生物菌株对CMEPA降解能力的报道; 但与已报道的各乙草胺降解菌株对乙草胺降解能力的比较表明,菌株T3-6对CMEPA的降解能力应远远高于这些菌株(董滨等,2011; 倪盈盈等,2011; Zeng et al., 2011).
由图 2还可以看出,随着CMEPA初始浓度的增加,其降解反应速度亦加快; 且在CMEPA浓度≤200 mg · L-1时,反应速度随CMEPA初始浓度的增加而呈线性增加,其线性回归相关系数为0.999; 但当CMEPA初始浓度为500 mg · L-1时,其平均降解速率的增加不再与底物浓度的增加成正比,而是明显低于理论降解速率41 mg · L-1 · h-1,说明该浓度下,T3-6菌株对CMEPA的降解转化受到了明显的抑制作用. 这是由于在相同条件下,高浓度的CMEPA经降解产生了比低浓度CMEPA更多的相关代谢产物,更早的产生反馈抑制作用; 并且高浓度的CMEPA及其代谢产物对T3-6菌株的生长亦会有一定的抑制作用.
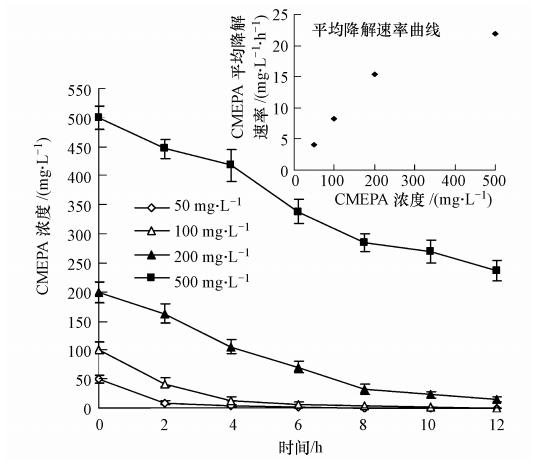 |
| 图 2 CMEPA初始浓度对T3-6菌株降解CMEPA的影响 Fig. 2 Effect of initial concentration of CMEPA on degradation of CMEPA by strain T3-6 |
鉴于菌株T3-6对CMEPA的高效降解能力,为避免低浓度CMEPA在试验时间内被完全降解,而无法确定接种量、温度和pH对菌株T3-6降解能力的影响,在以下研究中选择以500 mg · L-1的CMEPA为底物.
3.2.2 接种量对T3-6菌株降解CMEPA的影响在终浓度为500 mg · L-1CMEPA的基础盐培养基中,分别按0.5%、1.0%、2.5%和5.0%的接种量接入OD600nm=1.0 T3-6菌株种子液,于30 ℃、180 r · min-1摇床培养,每2 h取样测定CMEPA的残留量,确定菌株T3-6接种量对CMEPA降解的影响,结果如图 3所示. 由图中可以看出,CMEPA初始浓度为500 mg · L-1,接种量分别为0.5%、1.0%和2.5%时,反应后12 h内,CMEPA的浓度随时间的降低趋势均近似为线性关系,其相关系数分别为0.962、0.973和0.965; CMEPA的平均降解转化速率分别为9.44、21.01和30.04 mg · L-1 · h-1,即随着接种量的加大,CMEPA的降解速率明显增加. 这是因为接种量越大,菌体就会产生更多相关的降解酶,从而加快了CMEPA的降解. 但在接种量为2.5%时,CMEPA降解速率的增加与接种量的增加并不成正比关系,分析认为较高的接种量在增加降解速率的同时,也导致产生了更多的降解产物,从而抑制降解反应的发生. 而当接种量为5%时,其平均降解速率仅为41.59 mg · L-1 · h-1,这主要是由于反应体系中的菌量已达到过饱和,大量多余菌体无法发挥其降解能力所致.
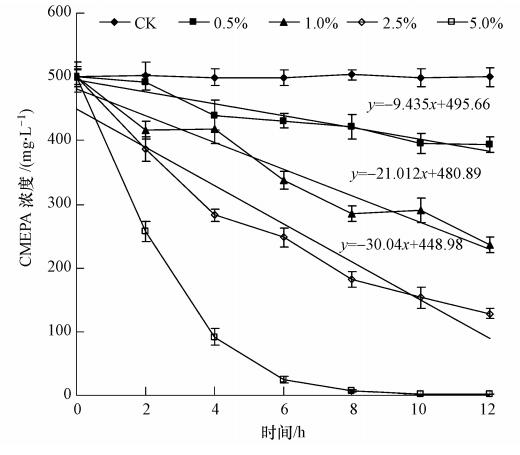 |
| 图 3 接种量对T3-6菌株降解CMEPA的影响 Fig. 3 Effect of inoculum size on degradation of CMEPA by strain T3-6 |
在CMEPA终浓度为500 mg · L-1的基础盐培养基中,按2.5%接种量接入OD600nm=1.0 T3-6菌株种子液,分别于20、25、30、37、42 ℃条件下,180 r · min-1 摇床培养,12 h后取样测定CMEPA残留量,确定温度对T3-6菌株降解CMEPA的影响. 结果如图 4所示. T3-6菌株降解CMEPA的最适温度为30 ℃. 当温度<30 ℃时,随着温度的增高,其对CMEPA的降解率逐渐增加; 当温度>30 ℃时,随着温度的增高,其对CMEPA的降解率明显降低,当温度为42 ℃时,T3-6对CMEPA的降解率仅为2%. 与T3-6菌株的生长温度相比,其最适生长温度为37 ℃,但其在37 ℃时的降解率仅为30 ℃时的60%,表明菌株T3-6产生的降解酶不如菌体本身对温度的耐受性高.
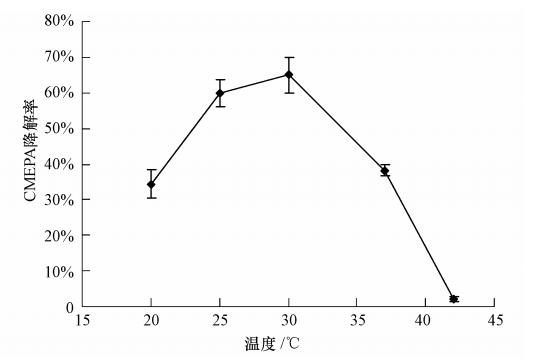 |
| 图 4 温度对T3-6菌株降解CMEPA的影响 Fig. 4 Effect of temperature on degradation of CMEPA by strain T3-6 |
在初始pH分别为4.0、5.0、6.0、7.0、7.5、8.0、8.5、9.0和10.0 的基础盐培养基中,加入CMEPA至终浓度500 mg · L-1,按2.5%接种量接入OD600nm=1.0 T3-6菌株种子液,于30 ℃、180 r · min-1摇床培养,12 h后取样测定CMEPA残留量,确定pH对菌株T3-6降解CMEPA的影响,结果如图 5所示. T3-6降解CMEPA的最适pH为7.0; 当pH<7时,随着pH的降低T3-6菌株对CMEPA的降解率明显下降; 而当pH>7时,pH的变化对其降解率影响较小; 即使在pH为10时,CMEPA的降解率亦可达到50%以上.
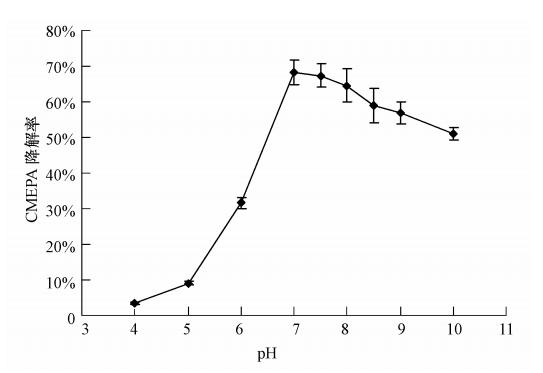 |
| 图 5 初始pH对T3-6菌株降解CMEPA的影响 Fig. 5 Effect of initial pH on degradation of CMEPA by strain T3-6 |
微生物对有机污染物的降解主要是依靠其产生酶的催化作用,因此本文对T3-6菌株降解酶在细胞内外的分布特征和粗酶液降解CMEPA的性质进行了研究.
分别将胞内粗酶液和胞外酶液加入含50 mg · L-1 CMEPA的磷酸缓冲液酶活测定体系中,每隔5 min测定CMEPA的浓度变化,结果见表 1. 表 1结果表明,胞内酶粗提液对CMEPA的催化降解迅速而有效,短时间内即达到分解平衡. 胞外酶液在30 min内只显示出很低的降解活性,可能是由于收获菌体时,使得上清液中留有少量菌体造成的. 故认为T3-6菌株对CMEPA的降解中,起催化作用的酶为胞内酶.
| 表1 胞内酶及胞外酶对CMEPA的降解情况 Table.1 Degradation of CMEPA by endoenzyme and exoenzyme |
分别在浓度皆为0.1 mol · L-1的柠檬酸缓冲液(pH 3.6~6.0),磷酸缓冲液(pH 5.8~9.0)以及甘氨酸-NaOH缓冲液(pH 8.6~10.0)酶活测定体系中研究粗酶液对CMEPA的降解能力,选取25 ℃为酶学反应温度,结果如图 6a所示. 粗酶液在pH 6.5~9.0时呈现出70%以上的活力,且在pH 8.0时发挥最大降解能力. 这与T3-6菌体降解CMEPA的适宜pH范围(7~10)基本相近,只是粗酶液对碱性条件(pH 9~10)的耐受性没有菌体的耐受性强,因此采用pH 8.0作为酶促反应的pH值. 将一定量的粗酶液分别加入到0.1 mol · L-1柠檬酸缓冲液(pH 3.6~6.0),磷酸缓冲液(pH 5.8~8.6)和甘氨酸-NaOH缓冲液(pH 8.6~10.0)中,于4 ℃处理24 h后,各取50 μL的稀释酶液,立即加入到酶活测定体系中测定酶活力,结果如图 6b所示. 该酶在pH 6.5~9.0范围内残留酶活力均在70%以上,表明该酶在中性偏碱环境中较稳定.
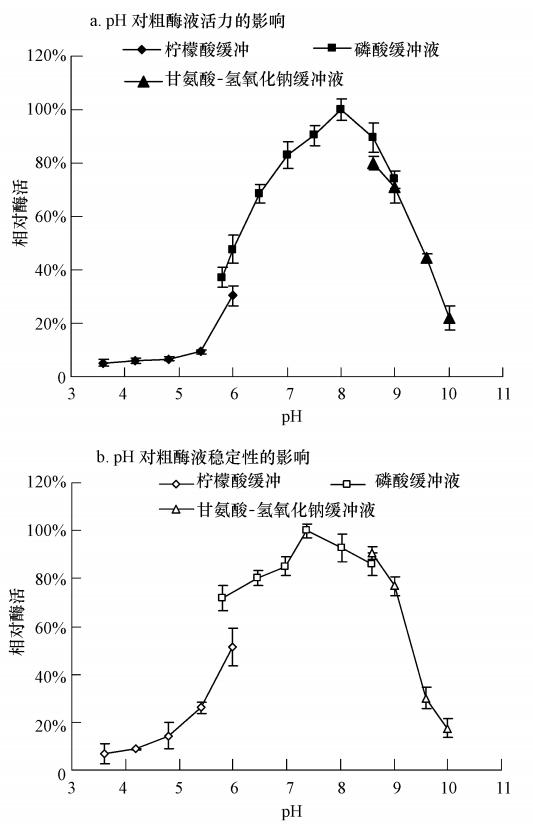 |
| 图 6 pH值对粗酶液活力和稳定性的影响 Fig. 6 Effect of pH on activity and stability of the crude enzyme |
在0.1 mol · L-1 pH 8.0的磷酸缓冲液酶活测定体系中,分别测定粗酶液在10、15、20、25、30、35、40 ℃条件下的活力,结果如图 7所示. 从图中可以看出,在25 ℃时该酶的活性达到最大,即其降解CMEPA最适反应温度为25 ℃; 在20~35 ℃之间胞内酶能保持较好的降解活性. 与T3-6菌体对CMEPA的降解相比,粗酶液的最适反应温度低于菌体反应的最适温度(30 ℃),此结果表明,失去细胞的保护后,降解酶对温度更敏感了. 将20 μL粗酶加入0.1 mol · L-1 pH 8.0的酶活测定体系中,在不同温度下保温30 min,迅速冷却后,在25 ℃测定酶活力,以未经保温的酶活力为100%,结果亦如图 7所示. 该酶在20 ℃以下稳定性良好,可以保留100%的活力; 在20 ℃以上酶活力急剧下降,于25 ℃保温30 min后,酶活力即降为初始值的44.28%左右; 于35 ℃保温30 min后就检测不到酶活力了. 该结果表明,粗酶液的温度稳定性较差,需低温贮存.
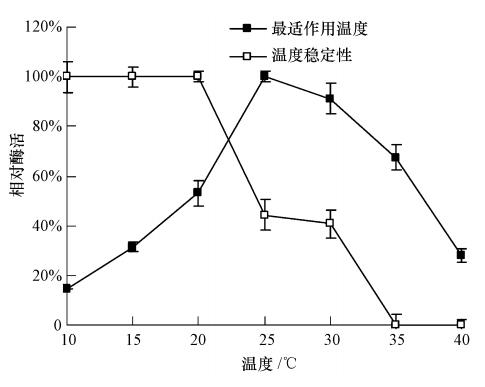 |
| 图 7 温度对粗酶液活力和稳定性的影响 Fig. 7 Effect of temperature on activity and stability of the crude enzyme |
本研究首次报道了微生物菌株对乙草胺代谢产物2′,6′-甲乙基-2-氯乙酰苯胺的降解,确定了菌株Delftia sp. T3-6降解CMEPA的最佳条件,以及其降解酶的分布特征与催化特性,其具体结论如下.
1)Delftia sp. T3-6菌株降解2′,6′-甲乙基-2-氯乙酰苯胺(CMEPA)的最适温度为30 ℃,且其在pH 7~10范围内均可以很好的降解CMEPA. 在固定接种量条件下,CMEPA的降解速率随CMEPA初始浓度的增加而增加,但高浓度的CMEPA(500 mg · L-1)亦会抑制其降解速率的增加. 在固定CMEPA初始浓度的条件下,CMEPA的降解速率亦随T3-6菌株接种量的增加而增加. 在30 ℃,pH=7.0条件下,5%接种量的T3-6在12 h对500 mg · L-1 CMEPA的降解率为99.81%.
2)T3-6菌株对CMEPA起催化作用的降解酶为胞内酶,其粗酶液降解CMEPA的最适温度为25 ℃,且其在pH 6.5~9.0范围内均可以很好的降解CMEPA. 该酶液对温度敏感,需在20 ℃以下贮存; 但其对pH的耐受性较好,在pH 6.0~9.0范围内均具有70%以上的相对酶活.
| [1] | Chee k A O,Ide C F,Bollinger J E,et al.1999.Alteration of leopard frog (Rana pipiens) metamorphosis by the herbicide acetochlor [J].Archives of Environmental Contamination and Toxicology,37(1):70-77 |
| [2] | Clark G M,Goolsby D A.1999.Occurrence and transport of acetochlor in streams of the Mississippi River basin [J].Journal of Environmental Quality,28(6):1787-1795 |
| [3] | Coleman S,Linderman R,Hodgson E,et al.2000.Comparative metabolism of chloroacetamide herbicides and selected metabolites in human and rat liver microsomes [J].Environmental Health Perspectives,108(12):1151-1157 |
| [4] | 董滨,王凤花,林爱军,等.2011.乙草胺降解菌A-3 的筛选及其降解特性[J].环境科学,32(2):542-547 |
| [5] | Green T,Lee R,Moore R B,et al.2000.Acetochlor-induced rat nasal tumors:further studies on the mode of action and relevance to humans [J].Regulatory Toxicology and Pharmacology,32(1):127-133 |
| [6] | 郭华,杨红.2006.乙草胺及其它酰胺类除草剂在环境中的降解与迁移[J].农药,45(2):87-91 |
| [7] | 胡伟军.2010.除草剂乙草胺对雄性小鼠生殖毒性的研究.长春:吉林大学 |
| [8] | Jablonkai I.2000.Microbial and photolytic degradation of the herbicide acetochlor [J].International Journal of Environmental Analytical Chemistry,78(1):1-8 |
| [9] | 景岳龙,朱凤晓,王军玲,等.2010.联苯菊酯降解菌的筛选、鉴定及其降解特性[J].西北农林科技大学学报(自然科学版),38(10):98-102 |
| [10] | Kalkhoff S J,Kolpin D W,Thurman E M,et al.1998.Degradation of chloroacetanilide herbicides:the prevalence of sulfonic and oxanilic acid metabolites in Iowa groundwaters and surface waters[J].Environmental Science and Technology,32(11):1738-1740 |
| [11] | 李金钟,刘利平.2008.代夫特菌属的研究进展[J].中国热带医学,8(12):2254-2255; 2262 |
| [12] | 李贤宾.2010.三种酰胺类除草剂对热带爪蟾(Xenopus tropicalis)早期发育致畸效应及DNA损伤研究.杭州:浙江大学 |
| [13] | 倪盈盈,郑金伟,张隽,等.2011.氯代酰胺类除草剂降解菌的分离及降解性能[J].应用与环境生物学报,17(5):711-716 |
| [14] | 沈雨佳,洪源范,洪青,等.2007.辛硫磷降解菌XSP-1的分离、鉴定及其降解特性研究[J].环境科学,28(12):2833-2837 |
| [15] | 世界农化网.2011.欧盟将逐步淘汰乙草胺.2011-12-16. |
| [16] | U.S.Environmental Protection Agency.1994.Question and answers.Conditional registration of acetochlor.U.S.EPA,Washington,D C.18 |
| [17] | 武洪杰,谭周亮,刘庆华,等.2010.一株高浓度苯胺、苯酚降解菌的分离鉴定及降解特性[J].应用与环境生物学报,16(2):252-255 |
| [18] | 酰胺类农药工业水污染物排放标准编制组.2008.《酰胺类农药工业水污染物排放标准》编制说明(征求意见稿).沈阳:沈阳化工研究院.19 |
| [19] | Xu J,Qiu X H,Dai J Y,et al.2006.Isolation and characterization of a Pseudomonas oleovorans degrading the chloroacetamide herbicide acetochlor [J].Biodegradation,17(3):219-225 |
| [20] | Ye C.2003.Environmental behavior of the herbicide acetochlor in soil [J].Bulletin of Environmental Contamination and Toxicology,71(5):919-923 |
| [21] | Zeng W A,Zhao S Y,Li H,et al.2011.Isolation and screening of acetochlor-degrading strain and its degradation characteristics [J].Applied Mechanics and Materials,79:318-323 |
| [22] | 张一宾.2011.酰胺类除草剂的全球市场、品种及发展趋向[J].现代农药,10(1):41-43; 50 |
 2013, Vol. 34
2013, Vol. 34


