2. 中国环境科学研究院, 北京 100012
2. China Environmental Science Research Institute, Beijing 100012
目前,我国是世界上化石能源消费量和温室气体排放量最大的国家,因此,发展可再生能源以替代化石能源是我国能源可持续发展的重要战略之一.种植能源植物生产燃料乙醇或生物柴油以替代汽油受到了人们的广泛关注,但种植能源作物生产燃料乙醇也存在“与人争粮、与粮争地”的困境(Ginneken et al., 2007).国内外研究表明,多种能源植物对重金属具有较好的耐性,可用于重金属污染土壤的修复(武文飞等,2012;Witters et al., 2009).因此,利用重金属污染土壤种植能源植物,可以在治理重金属污染土壤的同时生产可再生能源,兼具经济、能源和环境效益,具有较好的应用前景.
蓖麻(Ricinus communis L.)属大戟科一年或多年生草本植物,广泛种植于我国华北、东北地区,种子含油率为45%~55%,是我国重要的油料作物和能源作物(Wang et al., 2013).同时,有研究表明,蓖麻对镉、铅、铜等多种重金属具有较高的富集能力,但对于蓖麻对重金属的耐性与积累机制仍缺乏深入的认识(Shi et al., 2009;Liu et al., 2011;Bauddh et al., 2012).许多研究通过分析植物组织中重金属的亚细胞分布特征来揭示植物对重金属的耐性机制(Hou et al., 2013;He et al., 2013),但很少关注重金属亚细胞分布与重金属耐性指标之间的关系,更少关注重金属亚细胞分布对重金属在植物体内的富集与转移的影响.
因此,本研究采用营养液培养试验研究蓖麻对镉的耐性、富集与分配规律,以及镉在蓖麻根系和叶片中的亚细胞分布特征,探讨镉亚细胞分布对蓖麻镉耐性与积累的影响,为揭示蓖麻对镉的解毒机制,改善蓖麻对镉的耐性与积累能力,从而提高其在土壤修复中的应用潜力提供科学依据.
2 材料与方法(Materials and methods) 2.1 植物培养供试蓖麻种子为淄蓖麻3号,由山东淄博农业科学研究院提供.选择饱满的种子直接播种于潮湿的石英砂中,待其长出真叶后,移入1/4 Hoagl and 营养液中进行培养,试验容器为28 cm×19 cm×8 cm(长×宽×高)的塑料盆,每盆6个植株,15 d后选取生长状态较为一致的植株进行镉处理实验,镉以CdCl2 · 2.5H2O的形式加入到营养液,使镉处理浓度分别为0、10、25、50、100、200和400 μmol · L-1.全部实验处理置于全封闭光照培养箱中培养,光周期为12 h ∶ 12 h(L ∶ D),昼夜温度为25 ℃/18 ℃,试验设3次重复,每隔4 d更换一次营养液,培养第8 d后收获植株.先用自来水将植株冲洗干净,再用20 mmol · L-1 Na2-EDTA浸泡15 min,去除根系吸附的镉(Du et al., 2011),自来水冲洗3~4次,最后用去离子水润洗,吸干表面水分,分成根、茎、叶3个部分,保存于-20 ℃冰箱内备用.
2.2 测定指标及测定方法 2.2.1 植株镉含量的测定取收获植株的根、茎、叶于105 ℃下杀青0.5 h,75 ℃烘干至恒重,用电子天平称取各部分干质量.测定镉含量时,取300 mg粉碎烘干样品,加入65% HNO3 8 mL和30% H2O2 1 mL,采用微波消解仪(上海新仪,MDS-8G)进行消解,消解液中的镉含量采用原子吸收分光光度计(德国赛默飞,Multifuge X1R)测定并换算成植物各组织单位干重的镉含量.
2.2.2 光合色素含量测定取植株相同部位成熟功能叶,采用精密电子秤称取0.1 g,加入80%丙酮25 mL,研磨至匀浆,3000 r · min-1离心20 min,取上清液.以80%丙酮为空白对照,并用紫外分光光度计分别测定上清液在波长663、645、440 nm处的光密度OD值,计算叶片中叶绿素a、叶绿素b和类胡萝卜素的含量(张志良等,2009).
2.2.3 丙二醛(MDA)含量测定采用硫代巴比妥酸显色法测定MDA含量:精确称取成熟叶片0.5 g,加入5 mL三氯乙酸研磨至匀浆,3000 r · min-1离心10 min,上清液即为提取液.取2 mL提取液加入2 mL 0.5%硫代巴比妥酸,沸水浴中保温20 min 后,立即冷却,离心后取上清液测定.MDA含量以nmol · g-1(以FW计)表示(孙瑞莲,2006).
2.2.4 亚细胞组分的提取测定亚细胞组分的提取参照文献(Weigel et al., 1980)采用差速离心法,并作适当调整.取叶片(2.0 g)、根系(1.0 g)植物样品用预冷的匀浆液进行研磨,匀浆液组成为:蔗糖0.25 mol · L-1、Tris-HCl(pH=7.5)0.1 mol · L-1、二硫赤藓糖醇(C4H10S2)1 mmol · L-1.将组织匀浆液在高速冷冻离心机中于3000 r · min-1下离心30 s,下部沉淀、底层碎片为细胞壁组分(F1),上清液在12000 r · min-1下离心30 min,底层碎片为细胞器组分(F2),上清液为可溶组分(F3),包括细胞质、液泡内大分子及无机离子(杨樱等,2009).
2.3 数据处理本文采用转移系数来分析镉在蓖麻植株中的迁移特征,根-茎转移系数是指茎镉含量与根镉含量的比值,茎-叶转移系数是指叶片镉含量与茎镉含量的比值.采用滞留率来反映根系对镉的滞留作用,计算方法如下(程龙玲等,2013):
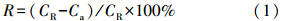
式中,R为根系对重金属的滞留率,CR和Ca分别为地下部分和地上部分重金属含量(mg · kg-1).
实验数据采用SPSS19统计软件进行回归分析、ANONA方差显著性分析和LSD检验,图形绘制采用Microsoft Excel 2010及SPSS19.0.
3 结果与分析(Results and analysis) 3.1 镉胁迫对蓖麻叶片光合色素和MDA含量的影响不同镉浓度处理下,蓖麻叶片中各光合色素和MDA含量见表 1.由表 1可知,低浓度处理下(10~50 μmol · L-1),镉胁迫对叶片光合色素含量的影响不显著,而高浓度镉处理下(100~400 μmol · L-1)光合色素含量显著降低.总体上,蓖麻叶片中叶绿素a、叶绿素b和类胡萝卜素含量均与营养液镉浓度呈线性负相关关系,其相关系数分别为-0.927、-0.907和-0.924(p<0.05).叶绿素a/叶绿素b值和叶绿素/类胡萝卜素值与对照相比均有所减小,说明不同镉处理对蓖麻叶片叶绿素a的影响最大,叶绿素b次之,对类胡萝卜素的影响最小.
| 表 1 镉处理对蓖麻叶片光合色素、MDA含量的影响 Table 1 Effect of Cd treatments on photosynthetic pigments and MDA contents in Ricinus communis leaves |
MDA是细胞膜脂过氧化作用的主要产物之一,其含量可表示膜脂过氧化作用.在植物逆境生理研究中,丙二醛含量被普遍作为一种表征伤害程度的指标.本研究中,不同镉浓度处理间丙二醛含量无显著差异,表明镉处理未对蓖麻叶片产生显著的细胞膜脂过氧化作用.
3.2 蓖麻对镉的富集与特征由表 2可知,植株根系和地上部镉含量均随溶液镉浓度的增加而呈上升趋势,但二者的上升趋势却存在着一定的差异.植株根系富集的镉含量随营养液中镉浓度增加呈线性上升趋势,在高镉浓度下,根系富集镉的能力并无下降或趋于饱和现象.而蓖麻地上部镉含量在低浓度处理时(≤50 μmol · L-1)上升较快,高浓度处理下(100~400 μmol · L-1),地上部镉含量差异不显著(p<0.05).
| 表 2 镉处理对蓖麻各组织镉含量的影响 Table 2 Effects of Cd treatments on Cd contents in different tissues of Ricinus communis |
不同镉处理条件下,蓖麻体内各组织中镉含量分布特征基本相同,均表现为根>茎>叶.根部是蓖麻富集镉的重要器官,对镉具有较强的滞留作用,平均滞留率高达87.92%,对镉的富集能力明显强于地上部.在400 μmol · L-1镉处理下,根系中镉含量高达1675.37 mg · kg-1,而茎和叶中的镉含量则远低于根系,分别为30.96 mg · kg-1和12.94mg · kg-1.蓖麻将大部分的镉富集在根部,限制镉从根系向地上部迁移,有利于减轻镉对地上部分特别是叶片的毒害效应,这可能是蓖麻耐受并缓解镉毒害的重要策略(Alexander et al., 2011;Jakovljevićet al., 2013).
3.3 镉在蓖麻中的亚细胞分布特征表 3为蓖麻根系和叶片各亚细胞组分中镉的含量(以鲜重计),蓖麻根系细胞壁、细胞器、可溶组分中的镉含量及其总量均随溶液中镉浓度的增加而显著增加,其相关系数分别为0.989、0.981、0.997、0.994(p<0.05).蓖麻叶片3个亚细胞组分中的镉含量随着营养液镉含量的增加而呈现增加后降低的趋势,这与前述蓖麻叶片镉富集规律是相一致的.
| 表 3 蓖麻根系和叶片亚细胞组分镉含量 Table 3 Cd contents in subcellular fractions in in Ricinus communis roots and leaves |
图 1是蓖麻根系和叶片各亚细胞组分中镉含量的分布比例,根系和叶片各亚细胞组分镉含量比例均呈现可溶组分>细胞壁>细胞器的总体特征.在蓖麻根系镉的亚细胞分布中(图 1a),镉主要分布于可溶组分中,占总量的58.0%~83.1%,其次为细胞壁,其镉含量占总量的11.8%~26.5%,细胞器中镉含量较少.在叶片镉的亚细胞分布中(图 1b),镉主要分布在细胞壁和可溶组分中,二者含量占总量的91.8%~100%,其中,在10 μmol · L-1镉处理下未检出细胞器中的镉含量.可见,无论是在蓖麻根系和叶片中,可溶组分和细胞壁是蓖麻贮存镉的主要位 点,细胞器中的镉含量都较低.同时,随着镉胁迫的加剧,根系细胞壁镉含量所占比重呈上升趋势,而可溶组分和细胞器中镉含量所占比重则有下降趋势,表明在镉胁迫加剧的情况下,细胞壁加强了对镉的固持作用,这有利于降低镉向地上部的迁移,从而保护地上部正常的生理活动.
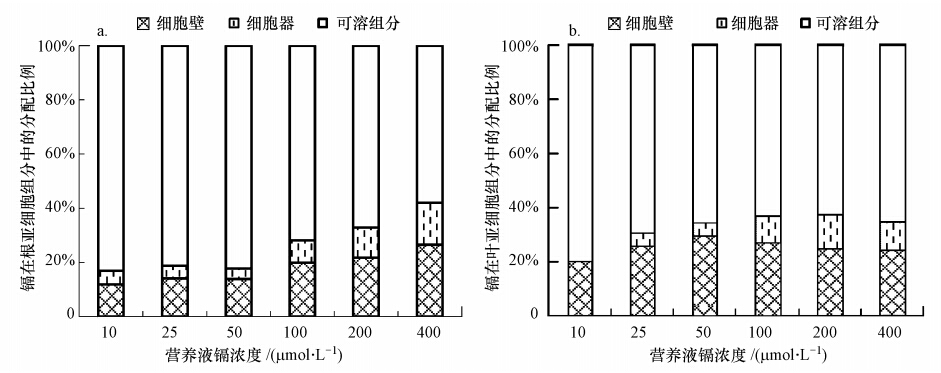 |
| 图 1 蓖麻根系和叶片各亚细胞组分中镉含量分配比例 Fig. 1 Distribution percentages of Cd in subcellular fractions of Ricinus communis roots and leaves |
叶绿素含量变化在一定程度上可以表征叶片衰老和损害程度(张银秋等,2011). MDA是衡量由非氧化还原类重金属引起的氧化胁迫程度的重要指标,其含量在一定程度上反映植物的伤害程度,也可反映植物的抗胁迫能力.在同一时期抗逆性强的植物MDA积累量低、变幅小;反之,抗逆性弱的植物MDA积累量高,变幅大(王爱云等,2011).本研究中,低浓度镉处理对蓖麻叶绿素含量没有显著影响,但高浓度处理条件下蓖麻叶绿素含量显著下降.MDA含量在各镉处理间的差异并不显著(p<0.05).可见,蓖麻叶片中叶绿素含量对镉胁迫的反应比MDA含量较为敏感,可作为蓖麻对镉胁迫耐性的评价指标.本文采用镉处理的叶绿素含量与对照叶绿素含量的比值(耐性指数)来反映蓖麻对镉的耐性,结果表明,在营养液镉浓度为10~100 μmol · L-1时,耐性指数高达0.86~0.98,因此,可以认为蓖麻对≤100 μmol · L-1的镉胁迫水平具有较好的耐性.
在高浓度镉处理条件下,蓖麻各光合色素含量显著下降,这可能是由于镉在叶内局部积累过多,与叶绿体中蛋白质上的—SH结合或取代其中的Fe、Zn、Mg等有关元素,破坏了叶绿体结构和功能活性(Mohammad et al., 2007).叶绿素a/叶绿素b值可以反映捕光色素复合体Ⅱ(LHCⅡ)在所有含叶绿素的结构中所占的比重,其值升高表明LHCⅡ含量的减少,光合组织遭受光氧化破坏的风险降低(计汪栋等,2008).本研究中,叶绿素a/叶绿素b值呈下降趋势,说明随着镉浓度的增加,光合机构破坏程度加大,叶片衰老程度逐渐提高,这与在200、400 μmol · L-1的镉浓度下叶片发黄失绿是相一致的.类胡萝卜素不仅是光系统中的集光色素,而且能够保护叶绿素免受强光破坏,同时还具有清除活性氧的作用(Mohameda et al., 2012).本研究中,镉胁迫诱导叶绿素/类胡萝卜素比值下降,说明镉胁迫对类胡萝卜素含量的影响小于叶绿素,其含量的相对稳定可能会减轻镉胁迫对蓖麻叶片的伤害,保护叶绿素,从而维持植株叶片的光合能力,使植物得以正常生长,增加植株对镉的忍耐性(冯世静等,2013).
4.2 蓖麻对镉胁迫的解毒机制镉在植物组织亚细胞的分布特征分析有助于识别植物细胞对镉的解毒与耐性机制.植物的可溶组分由细胞液和液泡两部分组成,细胞液是细胞新陈代谢的主要场所,液泡的主要功能是参与细胞的水分代谢,同时也是植物细胞代谢副产品及废物囤积的场所.液泡中含有的多种蛋白质、有机酸、有机碱等物质都能与重金属结合,使重金属离子在细胞内被区隔化(周守标等,2008).本研究中,蓖麻根系和叶片中大部分镉贮存于可溶组分中,因此,蓖麻可能主要是通过液胞的区隔化分布来减轻镉的毒性,减轻对植物的伤害,该结果与美洲商陆和长柔毛委陵菜叶片类似(周小勇等,2008;Fu et al., 2011).但也有研究发现细胞壁是镉贮存的主要场所,如在苎麻中48.2%~61.9%的镉贮存在细胞壁中(Wang et al., 2008),秋茄叶片中56%~60%的镉贮存在细胞壁(Wang et al., 2012).本研究中,在10~50 μmol · L-1镉处理下,根系细胞壁镉分配比例呈上升趋势,这与皖景天的镉细胞分布特征相似(周守标等,2008),它有助于加强根系对镉的固持作用,限制其从根系到地上部的转移.可见,区隔化作用或细胞壁固持均为植物细胞应对镉胁迫的重要解毒机制,而造成植物镉贮存位点不同的原因可能是植物的品种差异或基因型差异,也可能是由于镉的添加量和作用时间不同而引起.
对蓖麻叶片光合色素与叶片亚细胞组分镉含量的多元逐步回归分析发现,叶绿素a+叶绿素b含量与叶片细胞壁、细胞器镉含量存在显著的线性关系,可以采用下式表示:
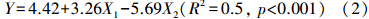
式中,Y为蓖麻叶绿素a+叶绿素b含量(mg · g-1,以干重计),X1为蓖麻叶片细胞壁镉含量(μg · g-1,以鲜重计),X2为蓖麻叶片细胞器镉含量(μg · g-1,以鲜重计).蓖麻叶片细胞器镉含量与叶绿素含量呈显著负相关关系,说明镉贮存于细胞器容易对植物造成伤害.蓖麻叶片细胞壁镉含量对叶绿素含量呈显著正相关关系,可能是由于细胞壁对镉的固持作用有助于降低镉的生理毒性和镉在细胞器中的分配,从而缓解镉对细胞器的毒害,减轻叶片损伤.
4.3 蓖麻地上部对镉的积累能力蓖麻根系对镉的积累能力较高,但镉从根系到地上部的转移能力较低,根-茎转移系数为0.02~0.11,茎-叶转移系数为0.35~0.62(表 2).可见,镉从根到茎的转移能力较弱是影响蓖麻地上部镉富集能力的重要原因,它可能与镉在蓖麻根系的亚细胞分布特征有关.本文以根系各亚细胞组分镉分配比例为自变量,以根-茎转移系数为因变量进行曲线拟合(图 2),结果发现,根-茎转移系数随着根系细胞壁和细胞器镉分配比例的增加而递减,随可溶组分镉分配比例的增加而递增.这可能是由于细胞壁镉分配比例的增加有助于加强细胞壁对镉的固持作用,从而限制镉向地上部迁移;细胞器镉分配比例的增加必将加剧对根系的生理毒害,从而影响其对镉的运移;而可溶组分中镉可能多以迁移能力较强的化学形态存在,有利于提高镉从根系到地上部的转移.可见,蓖麻根系镉的亚细胞分布特征对镉在蓖麻体内的迁移及地上部积累能力有着显著影响.
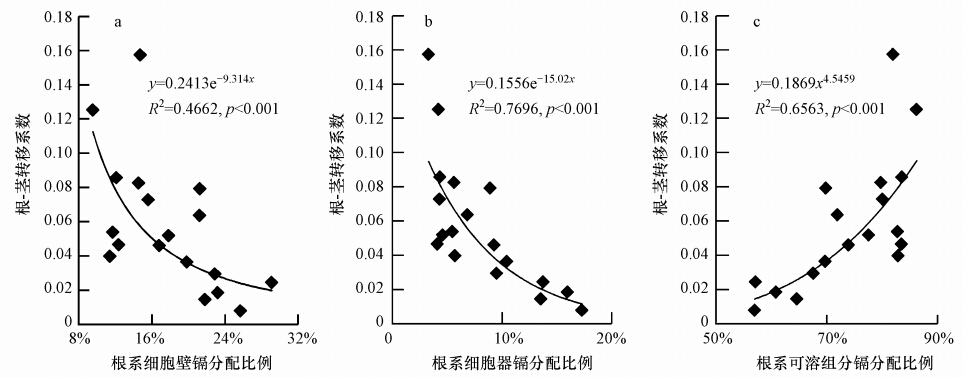 |
| 图 2 亚细胞中镉分配比例对转移系数的影响 Fig. 2 Effects of Cd in subcellular fraction distribution percentages on transfer factor of Ricinus communis |
1)镉胁迫对蓖麻叶片MDA含量没有显著影响,光合色素则对镉胁迫的响应较为敏感,其影响顺序为叶绿素a>叶绿素b>类胡萝卜素,因此,叶绿素含量可作为反映蓖麻镉胁迫水平的评价指标.
2)蓖麻植株镉含量随营养液镉浓度的升高而增加,并呈现根>茎>叶的积累特征,表明蓖麻根系对镉具有较强的富集能力,但其地上部的运移能力较弱,提高蓖麻地上部镉含量是提高蓖麻镉积累能力的关键.
3)蓖麻富集的镉主要集中于可溶组分中,其次是细胞壁,体现了在蓖麻根系和叶片中,液泡区隔化作用和细胞壁固持作用均为其重要的解毒机制.叶片中叶绿素含量与叶片细胞壁镉含量显著正相关,与细胞器镉含量显著负相关,表明叶片镉亚细胞分布特征对蓖麻镉耐性有着显著影响.
4)镉在蓖麻中的根-茎转移系数较低是限制地上部镉富集的重要原因,它随着根系细胞壁和细胞器镉分配比例的增加而递减,随可溶组分分配比例的增加而递增.可见,蓖麻根系镉的亚细胞分布特征对镉在蓖麻体内的分布及及地上部积累能力有着显著影响.
| [1] | Alexander L, Michal M, Vaculík M, et al.2011.Root responses to cadmium in the rhizosphere:a review[J].Journal of Experimental Botany, 62(1): 21-37 |
| [2] | Bauddh K, Singh R P. 2012. Cadmium tolerance and its phytoremediation by two oil yielding plants Ricinus communis (L.)from the contaminated soil[J]. International Journal of Phytoremediation, 14(8): 772-785 |
| [3] | 程龙玲, 周守标, 吴晓艳, 等. 2013. 弯囊苔草对Cd胁迫的响应及其Cd富集能力的研究[J].中国草地学报, 34(2): 16-22 |
| [4] | Du R J, He E K, Tang Y T, et al. 2011. How phytohormone IAA and chelator EDTA affect lead uptake by Zn/Cd hyperaccumulator Picres Divaricata[J]. International Journal of Phytoremediation, 13(10): 1024-1036 |
| [5] | 冯世静, 杨途熙, 张艳军, 等. 2013. 镉胁迫对杨树光合特性的影响[J].农业环境科学学报, 32(3): 539-547 |
| [6] | Fu X P, Dou C M, Chen Y X, et al.2011. Subcellular distribution and chemical forms of cadmium in Phytolacca americana L.[J]. Journal of Hazardous Materials, 186(1): 103-107 |
| [7] | Ginneken V L, Meers E, Guisson R, et al. 2007. Phytoremediation for heavy metal-contaminated soils combined with bioenergy production[J]. Journal of Environmental Engineering and Landscape Management, 15(4): 227-236 |
| [8] | He S Y, Wu Q L, He Z L. 2013. Effect of DA-6 and EDTA alone or in combination on uptake, subcellular distribution and chemical form of Pb in Lolium perenne[J]. Chemosphere, 93(11): 2782-2788 |
| [9] | Hou M, Hu C J, Xiong L, et al. 2013. Tissue accumulation and subcellular distribution of vanadium in Brassica juncea and Brassica chinensis[J]. Microchemical Journal, 110: 575-578 |
| [10] | Jakovljević T, Cvjetko M, Sedak M, et al. 2013. Balance of glucosinolates content under Cd stress in two Brassica species[J]. Plant Physiology and Biochemistry, 63: 99-106 |
| [11] | 计汪栋, 施国新, 徐勤松, 等.2008. Ni2+对槐叶苹叶片生理特征及亚显微结构的影响[J].环境科学, 29(8): 2308-2313 |
| [12] | Li F F, Qi J M, Zhang G Y, et al. 2013. Effect of cadmium stress on the growth, antioxidative enzymes and lipid peroxidation in two kenaf (Hibiscus cannabinus L.) plant seedlings[J]. Journal of Integrative Agriculture, 12(4): 610-620 |
| [13] | Liu C F, Guo J L, Cui Y L, et al.2011.Effects of cadmium and salicylic acid on growth, spectral reflectance and photosynthesis of castor bean seedlings[J]. Plant and Soil, 344(1): 131-141 |
| [14] | Mohameda A A, Castagna A, Ranieri A, et al. 2012. Cadmium tolerance in Brassica juncea roots and shoots is affected by antioxidant status and phytochelatin biosynthesis[J]. Plant Physiology and Biochemistry, 57: 15-22 |
| [15] | Mohammad M, Khan N A.2007.Photosynthetic activity, pigment composition and antioxidative response of two mustard (Brassica juncea) cultivars differing in photosynthetic capacity subjected to cadmium stress[J].Journal of Plant Physiology, 164(5):601-610 |
| [16] | Shi G R, Cai Q S.2009.Cadmium tolerance and accumulation in eight potential energy crops[J].Biotechnology Advances, 27(5):555-561 |
| [17] | 孙瑞莲. 2006. 镉超积累植物的生态特征及污染耐性机理分析[D].沈阳:中国科学院沈阳应用生态研究所. 97-112 |
| [18] | 王爱云, 钟国锋, 徐刚标, 等. 2011. 铬胁迫对芥菜型油菜生理特性和铬富集的影响[J].环境科学, 32(6): 1717-1725 |
| [19] | Wang B S, Xie X Y, Weiss D J, et al. 2012. Kandelia obovata (S., L.) Yong tolerance mechanisms to Cadmium: Subcellular distribution, chemical forms and thiol pools[J]. Marine Pollution Bulletin, 64(11): 2453-2460 |
| [20] | Wang C, Li G R, Zhang Z Y, et al. 2013. Genetic diversity of castor bean (Ricinus communis L.) in Northeast China revealed by ISSR markers[J]. Biochemical Systematics and Ecology, 51: 301-307 |
| [21] | Wang X, Liu Y G, Zeng G M, et al. 2008. Subcellular distribution and chemical forms of cadmium in Bechmeria nivea (L.)Gaud.[J]. Environmental and Experimental Botany, 62(3): 389-395 |
| [22] | Weigel H J, Jager H J.1980.Subcellular distribution and chemical form of cadmium in bean plant[J].Plant Physiology, 65(3): 480-482 |
| [23] | Witters N, Van Slycken S, Ruttens A, et al. 2009. Short-rotation coppice of willow for phytoremediation of a metal-contaminated agricultural area: a sustainability assessment[J]. BioEnergy Research, 2(3): 144-152 |
| [24] | 武文飞, 南忠仁, 王胜利, 等. 2012. 单一与复合胁迫下油菜对镉、铅的吸收效应[J].环境科学, 33(9): 3253-3260 |
| [25] | 杨樱, 张世熔, 李婷, 等. 2009. 铜、铅在车前草中的亚细胞分配[J].环境科学学报, 29(9): 1964-1969 |
| [26] | 张银秋, 台培东, 李培军, 等. 2011. 镉胁迫对万寿菊生长及生理生态特征的影响[J].环境工程学报, 5(1): 195-199 |
| [27] | 张志良, 翟伟菁, 李小芳. 2009. 植物生理学实验指导[M].北京:高等教育出版社.54-61 |
| [28] | 周守标, 徐礼生, 吴龙华, 等. 2008. 镉和锌在皖景天细胞内的分布及化学形态[J].应用生态学报, 19(11): 2515-2520 |
| [29] | 周小勇, 仇荣亮, 应蓉蓉, 等.2008.锌对长柔毛委陵菜体内镉的亚细胞分布和化学形态的影响[J].农业环境科学学报, 27(3): 1066-1071 |
 2014, Vol. 34
2014, Vol. 34


