2. 广西大学林学院,南宁 530004;
3. 亚热带农业生物资源保护与利用国家重点实验室,南宁 530004
2. College of Forestry,Guangxi University,Nanning 530004;
3. State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources,Nanning 530004
金属硫蛋白(Metallothionein,MT)是一类低分子量、富含半胱氨酸、无芳香族氨基酸且能与金属结合的蛋白质(Guo et al., 1999).MT广泛存在于生命体中,巯基含量丰富,其半胱氨酸上的巯基对重金属离子有极强的结合力,能够结合重金属形成无毒或低毒的络合物,具有解除重金属毒性的功能.研究发现,MT能被重金属诱导,其α结构域、β结构域能够富集或结合镉(Cd)、汞(Hg)、铅(Pb)、镍(Ni)、锌(Zn)等元素(Vasák,1991;Mason et al., 1995;Ren et al., 1998;袁燕等,2009).MT的合成受金属离子的诱导,该诱导作用通过调节MT的转录水平实现(Mckenna et al., 1996).人类MT分为MT-1、MT-2、MT-3和MT-4四类,各类均具有多种亚型,目前已确证为功能性的基因包括MT-1A、1B、1E、1F、1G、1H、1X、MT-2A、MT-3、MT-4共10种类型(Mididoddi et al., 1996);其中,MT-1E不仅具有重金属解毒、抗电离辐射、清除自由基等生物学功能(周杰昊等,1995),还与Wilson′s病、Alzheimer′s病及肿瘤的发生和耐药密切相关(殷慎敏等,1996;Jasani et al., 1997).
伴随着工农业的快速发展和城市化进程的加速,大量工业废水和生活污水被排放到环境中,造成水体重金属污染日趋严重.在作为饮用水水源的地表水河流、湖泊及水库中,重金属污染物主要为Hg,其次为Cd、Cr和Pb(杨爱玲等,2000).目前,我国各大江河湖库均受到不同程度的重金属污染,底质污染率高达80.1%,已经影响到水体的质量(周怀东等,2005).重金属污染不仅危及生态平衡,甚至直接影响人类的健康.对重金属废水的治理方法有多种,生物吸附法因具有原料来源丰富、操作简单、吸附速度快等优点而成为目前重金属废水最有效的处理方法之一(刘刚等,2002;Kumar et al., 2006).另外,土壤重金属污染和防治也是人们关注的环境问题之一,目前土壤中的重金属污染物主要为Cr、Co、Ni、Cu、Zn、Cd、Pb和Hg(方晰等,2012;张菊等,2012;王耀平等,2013).对土壤重金属污染的治理主要有物理/化学修复技术、农业生态修复技术和生物修复技术等,其中,生物修复技术主要包括植物修复和微生物修复(黄益宗等,2013).
近年来,微生物修复研究取得了一定的进展,其中包括用微生物表达重金属解毒蛋白MT.许多学者相继从大鼠、家兔等哺乳动物肝脏组织直接纯化MT,并对其理化性质及生物学功能进行了研究(潘爱华等,1992;黄仲贤等,1996).但迄今有关MT确切的生物学功能尚未完全明确.基于此,本文根据美国国家生物技术信息中心(NCBI)公布的MT1E 基因CDS序列(序列号:CCDS10764.2),按照酵母偏好密码子设计碱基序列,人工合成该基因.同时,将MT1E人金属硫蛋白基因重组表达构建pPIC9K-MT1E并转化毕赤酵母GS115,筛选高拷贝表达重组毕赤酵母GS115/pPIC9K-MT1E,高效表达MT1E基因,用ELISA检测重组蛋白活性,并研究重组工程菌株GSI15/pPIC9K-MT1E对重金属(Cu、Zn、Mn、Cr、Co)的抗性.以期为加强重金属污染治理与生态修复,促进生态环境健康发展提供科学依据.
2 材料与方法(Materials and methods) 2.1 材料聚合酶链式反应(PCR)所用的DNA聚合酶、dNTP,以及分子克隆所用的连接酶、限制性内切酶等购自美国普洛麦格生物产品有限公司;质粒提取试剂盒、纯化试剂盒、胶回收试剂盒购自美国Omega科技有限公司.
本文根据美国国家生物技术信息中心(NCBI)公布的MT1E基因CDS序列(序列号:CCDS10764.2),按照酵母偏好密码子设计碱基序列,12个寡聚核苷酸片段(表 1)委托上海生物工程技术服务有限公司合成.毕赤酵母表达质粒pPIC9K(Invitrogen,Carls-bad,CA,USA)、毕赤酵母GS115菌株(Invitrogen,Carls-bad,CA,USA)及整合有pPIC9K质粒的GS115/pPIC9K菌株由广西大学黄日波教授惠赠.重组质粒pUC119-MT1E和含有人金属硫蛋白基因的重组表达载体pPIC9K-MT1E及重组工程菌GS115/pPIC9K-MT1E由本研究构建.
| 表1 本研究所用的引物 Table 1 Primers used in this study |
标准的分子与遗传操作方法参照文献(Sambrook et al., 1989).根据美国国家生物技术信息中心(NCBI)公布的CDS序列(序列号:CCDS10764.2),按照酵母偏好密码子设计碱基序列,在基因两端加入EcoR I酶切位点,借助生物软件Vector NTI 7.0设计12条寡聚核苷酸片段(表 1).合成这12条寡聚核苷酸片段,并进行拼接,得到完整的MT1E基因.MT1E基因与质粒pUC119用T4 DNA连接酶连接,并转化DH5α,PCR筛选阳性转化子.构建含有完整MT1E基因的pUC119-MT1E重组质粒.
2.2.2 毕赤酵母重组载体pPIC9K-MT1E的构建提取重组质粒pUC119-MT1E,并用EcoR I酶切并纯化回收得到目的基因MT1E.目的基因与质粒pPIC9K用T4 DNA连接酶连接,并转化DH5α,构建得到含有完整MT1E基因的pPIC9K-MT1E重组质粒.提取重组质粒pPIC9K-MT1E,并用Sal I酶切线性化后,在电压1.5 kV、电阻200Ω、电容50 μF的条件下,电转化导入感受态毕赤酵母GS115中,PCR筛选阳性转化子.构建重组工程菌GS115/pPIC9K-MT1E.
2.2.3 高拷贝GS115/pPIC9K-MT1E重组毕赤酵母的筛选重组酵母用YPD(Yeast Extract Peptone Dextrose Medium)(Wolf,1996)液体培养基培养至同一生长周期,取2 μL菌液依次接种在0.25、0.50、0.75、1.0、1.5、2.0、3.0、4.0 mg · mL-1 G418的YPD 平板上.在耐受高质量浓度G418的YPD平板上筛选阳性高拷贝GS115/pPIC9K-MT1E重组酵母.
2.2.4 重组毕赤酵母分泌表达金属硫蛋白的活性检测和含量测定接种高拷贝重组酵母菌GS115/pPIC9K-MT1E(以GS115和GS115/pPIC9K菌株为对照)于BMGY(Yeast Extract Peptone Dextrose Medium)(Wolf,1996)液体培养基中,30 ℃、170 r · min-1下培养24 h(OD600值约为6),再转入BMMY液体培养基中,用0.5%甲醇诱导,每24 h补加1次甲醇.诱导发酵6 d后离心收集上清,-20 ℃保存备用.SDS-PAGE电泳检测检测表达产物,免疫酶标(ELISA)检测表达产物的活性.
2.2.5 重组毕赤酵母重金属抗性检测接种高拷贝重组酵母菌GS115/pPIC9K-MT1E(以GS115和GS115/pPIC9K菌株为对照)至10 mL YPD液体培养基中,于30 ℃、170 r · min-1条件下活化过夜.按10%接种量转接活化菌液至10 mL YPD液体培养基中,于30 ℃、170 r · min-1下培养至对数生长期.取2 mL培养菌液至离心管中,12000 r · min-1下离心5 min,收集菌体,用YPD液体培养基清洗2次菌体沉淀后,重悬细胞,用可见分光光度计测OD600值,用YPD液体培养基调整菌液体积,使各菌液的浓度一致.按10%接种量将调整好浓度的菌液接种于含不同重金属盐(CuSO4、ZnSO4、MnSO4、K2Cr2O7、CoCl2)的YPD液体培养基中,设0、250、500、750和1000 μmol · L-1 5个浓度梯度.在30 ℃、170 r · min-1条件下培养菌液,培养过程中测定和分析酵母的生长状况.
3 结果分析(Results and discussion) 3.1 金属硫蛋白基因合成和毕赤酵母重组载体pPIC9K-MT1E的构建MT1E人金属硫蛋白基因cDNA序列全长186 bp,编码61个氨基酸残基.鉴于该基因分子量小且在毕赤酵母中表达最好,因而先进行密码子优化,本研究选择人工合成该基因的途径.MT1E基因的拼接及构建的含有MT1E基因重组质粒pPIC9K-MT1E的验证见图 1.
由图 1a可知,将设计合成的寡聚核苷酸片段按照实验设计,经T4-DNA多核苷酸激酶使5′端磷酸化和T4-DNA连接酶连接可拼接得到MT1E基因.将MT1E基因与pUC119连接,构建得到pUC119-MT1E重组质粒,PCR验证如图 1b所示.经测序验证,证实pUC119-MT1E重组质粒含有完整的MT1E基因.该合成基因序列全长198 bp,两端加有EcoR I位点,由于采用了酵母偏好的密码子进行优化,经序列比对,其序列(gaattc atggacccaaactgttcttgtgccactgg tggttcttgtacctgtgccggttcttgtaagtgtaaggagtgtaagtgtacctcctgt aagaagtcctgttgttcctgctgtccagttggttgcgctaagtgtgctcaaggttgtg tctgtaagggtgcatctgaaaagtgttcctgctgtgcttga gaattc)与人MT1E基因cDNA序列的一致性为74.2%,ORF共编码61个氨基酸残基,所编码的氨基酸序列与MT-1E蛋白的氨基酸序列(MDPNCSCATGGSCTCA GSCKCKECKCTSCKKSCCSCCPVGCAKCAQGCVCKG ASEKCSCCA*)一致性为100%,分子量大小为6014.15 Da,等电点为8.38.
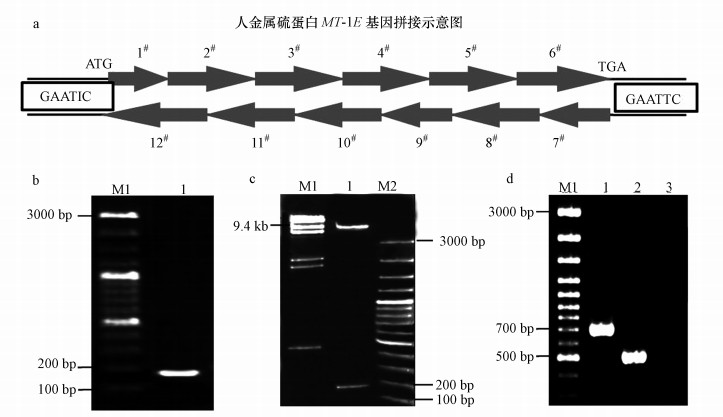 |
| 图 1 人金属硫蛋白MT1E基因体外片段连接示意图、PCR验证及重组构建酶切验证凝胶图 (a:人金属硫蛋白MT1E基因体外12个片段连接示意图;b:重组质粒pUC119-MT1E的PCR验证;M1:100 bp 标准DNA,片段大小从大到小依次为3、2、1.5、1.2、1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1 kb; 1:MT1E人金属硫蛋白基因(186 bp);c:重组质粒pPIC9K-MT1E的EcoR I酶切验证图;M1:λ/HindIII2标准DNA,片段大小从大到小依次为23.1、9.4、6.6、4.4、2.4、2.0 kb;M2:100 bp 标准DNA,片段大小从大到小依次为3、2、1.5、1.2、1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、 0.1 kb; 1:MT1E人金属硫蛋白基因(198 bp)EcoR I酶切重组质粒pPIC9K-MT1E;d:毕赤酵母工程菌GS115/pPIC9K-MT1E的PCR验证;M1:100 bp 标准DNA,片段大小从大到小依次为 3、2、1.5、1.2、1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1 kb; 1:含有外源MT1E基因毕赤酵母工程菌GS115/pPIC9K-MT1E的PCR验证(492 bp+198 bp);2:含有外源空载体pPIC9K毕赤酵母工程菌GS115/pPIC9K的PCR验证(492 bp);3:毕赤酵母GS115的PCR验证(对照)) Fig. 1 Principle of ligation the whole human metallothionein MT1E gene in vitro,PCR verification and enzyme digestion validation of the recombinant expression plasmid pPIC9K-MT1E |
由于MT1E基因是以EcoR I单酶切位点插入,DNA片段会以正反两个方向插入质粒载体pPIC9K,用源自表达载体序列的引物5′-AOX1、3′-AOX1与源自MT1E序列的引物1#、7#分别组合,PCR检测得到重组子,即可筛选到MT1E正向插入载体pPIC9K的目的质粒,并将其命名为pPIC9K-MT1E.由图 1c可知,pPIC9K -MT1E质粒经EcoR I酶切后电泳检测,观察到在约9300 bp和198 bp处各有一个特异性条带,与预期片段长度一致.酶切验证的电泳图表明,MT1E基因的毕赤酵母重组质粒pPIC9K-MT1E构建成功.
3.2 GS115/pPIC9K-MT1E重组毕赤酵母的构建及高拷贝表达重组毕赤酵母的筛选提取GS115/pPIC9K-MT1E重组毕赤酵母的染色体DNA作为模板(设GS115和GS115/pPIC9K为对照),以毕赤酵母外源基因插入部位两端的序列5′-AOX1和3′-AOX1为上下游引物,进行PCR 扩增分析,PCR 产物电泳结果如图 1d 所示.GS115/pPIC9K-MT1E基因组染色体进行PCR扩增,在690 bp处有一个特异条带,与预期一致(492 bp+198 bp);GS115/pPIC9K基因组染色体进行PCR 扩增,作为对照,在492 bp处有一个特异条带,与设计一致;GS115酵母基因组染色体进行PCR扩增,未见特异基因条带.此结果表明,目的基因MT1E 已整合到了毕赤酵母染色体上,成功构建得到MT1E基因的毕赤酵母重组工程菌株GS115/pPIC9K-MT1E.
在毕赤酵母表达系统中,目的基因整合进毕赤酵母,His+转化子出现多拷贝插入的概率为1%~10%.整合了多拷贝表达的重组酵母,有利于高效表达外源蛋白.利用G418质量浓度梯度筛选方法,在耐受高质量浓度G418的YPD平板上可以筛选阳性高拷贝GS115/pPIC9K-MT1E重组酵母.
由图 2可知,经过G418的8个浓度梯度(0.25~4.0 mg · mL-1)筛选得到耐受4.0 mg · mL-1 G418的GS115/pPIC9K-MT1E重组酵母菌株,表明本文筛选得到酵母基因组DNA上整合有多拷贝MT1E基因表达单元的重组酵母.
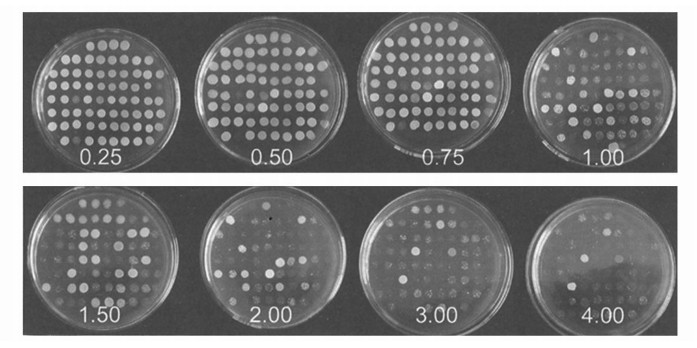 |
| 图 2 高拷贝重组毕赤酵母的筛选(图中数据为G418浓度(mg · mL-1)) Fig. 2 Screening of the recombinant stain of Pichia pastoris carrying pPIC9K-MT1E |
取高拷贝重组酵母菌株GS115/pPIC9K-MT1E进行甲醇诱导发酵(设GS115和GS115/pPIC9K为对照).如图 3a所示,各菌株发酵上清液经15%胶浓度的Tricine SDS-PAGE电泳,银染后可观察到高拷贝重组酵母GS115/pPIC9K-MT1E发酵液样品在分子量为6.5 kD处有一条蛋白条带,小鼠MT标准品也有同样大小的一条蛋白条带,而对照菌株GS115、GS115/pPIC9K发酵上清液样品则没有该大小的条带.
 |
| 图 3 人金属硫蛋白MT-1E表达的SDS-PAGE检测和ELISA检测 (a:人金属硫蛋白MT-1E表达的SDS-PAGE检测.1:低分子量标准蛋白Marker;2:小鼠金属硫蛋白标准品;3:GS115发酵上清液样品;4:GS115/pPIC9K发酵上清液样品;5:GS115/pPIC9K-MT1E重组菌11#菌株发酵上清液样品;6:GS115/pPIC9K-MT1E重组菌34#菌株发酵上清液样品.b:人金属硫蛋白MT-1E表达的ELISA检测.1:小鼠金属硫蛋白标准品;2:GS115/pPIC9K-MT1E重组菌11#菌株发酵上清液样品;3:GS115/pPIC9K-MT1E重组菌6#菌株发酵上清液样品;4:GS115/pPIC9K-MT1E重组菌8#菌株发酵上清液样品;5:GS115/pPIC9K-MT1E重组菌15#菌株发酵上清液样品;6:GS115/pPIC9K-MT1E重组菌18#菌株发酵上清液样品;7:GS115/pPIC9K-MT1E重组菌34#菌株发酵上清液样品;8:空白对照) Fig. 3 SDS-PAGE verification of the expression of human metallothionein MT-1E |
取各高拷贝重组酵母菌株GS115/pPIC9K-MT1E进行甲醇诱导发酵,发酵上清液经ELISA检测表达产物的生物活性.如图 3b所示,小鼠MT标准品和GS115/pPIC9K-MT1E菌株发酵液样品有呈色反应,而空白对照没有呈色反应,说明高拷贝重组酵母GS115/pPIC9K-MT1E菌株发酵液中含有能与小鼠MT单克隆抗体发生免疫反应的蛋白,证明构建的高拷贝重组酵母GS115/pPIC9K-MT1E菌株能够表达具有生物活性的MT-1E人金属硫蛋白.
3.4 重组毕赤酵母重金属抗性分析取高拷贝重组酵母菌株GS115/pPIC9K-MT1E进行Cu、Zn、Mn、Cr和Co重金属抗性检测(设GS115和GS115/pPIC9K为对照).由于毕赤酵母菌GS115在YPD液体培养基中,于30 ℃、170 r · min-1条件下培养14~20 h为对数生长期,因此,选定接种后培养16 h为测定时间点,测定GS115、GS115/pPIC9K和GS115/pPIC9K-MT1E菌株在各重金属浓度梯度培养液的OD600值,并以重金属离子浓度为横坐标,OD600值相对百分率为纵坐标做图,分析重组酵母菌GS115/pPIC9K-MT1E对不同重金属的抗性.实验结果表明,重组酵母菌GS115/pPIC9K-MT1E对Cr的抗性明显增强(图 4),对Cu、Zn、Mn、和Co的抗性没有明显改善.
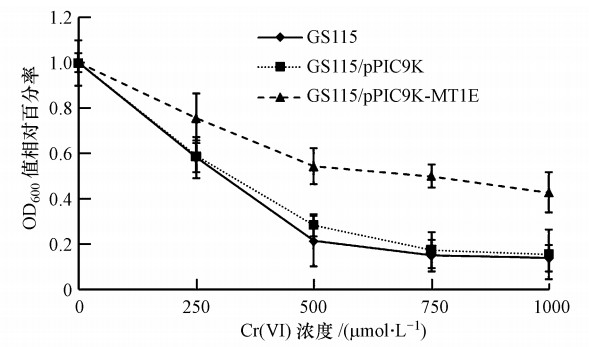 |
| 图 4 重组毕赤酵母GS115/pPIC9K-MT1E对重金属铬的抗性检测 Fig. 4 Detection of the heavy metal chromium resistance of the recombinant stain of Pichia pastoris GS115/pPIC9K-MT1E |
随着工业的迅速发展,我国重金属污染事件不断曝光,重金属毒害严重影响人体健康.重金属污染和防治成为人们关注的环境问题,Romeyer 等(1998)研究表明,人类MT基因的转基因大肠杆菌能够增强宿主对重金属的抗性和累积能力.MT在细胞中能与必需的微量金属元素结合,调节微量金属离子在细胞中的浓度,维持细胞反应进程中的动态平衡;也能与非必需的有毒金属元素结合,减少细胞与有毒金属的接触,从而保护细胞免遭金属离子的毒害(Amiard et al., 2006).利用MT的重金属解毒能力,构建含MT基因的转基因生物在修复受重金属污染的环境中发挥一定的作用.Thomas等(2003)将酵母MT基因转入烟草中,能显著提高烟草对污染土壤中Cu的吸收能力,将转基因烟草种植在金属污染的土壤中,可以改善土壤环境.邓旭等(2003)构建了高特异性镍转运蛋白和金属硫蛋白的基因工程菌,与原始宿主菌相比,最大Ni富集容量增加了5倍多.蔡颖等(2006)构建的高特异性镉结合转运蛋白和豌豆金属硫蛋白基因工程菌的镉离子富集能力达63.78 mg · g-1(以细胞干重计).人类MT1E基因已被确证为功能性的基因,具有重金属解毒、抗电离辐射、清除自由基等生物学功能(周杰昊等,1995;Mididoddi et al., 1996),还与Wilson′s病,Alzheimer′s病及肿瘤的发生和耐药密切相关(殷慎敏等,1996;Jasani et al., 1997).基于此,本研究人工合成了人金属硫蛋白MT1E基因,利用优良的毕赤酵母表达系统(韩雪清等,2003),构建得到含MT1E基因的毕赤酵母高效表达基因工程菌GS115/pPIC9K-MT1E,并成功分泌表达了具有生物活性的MT-1E蛋白.重金属的抗性检测结果表明,基因工程菌对铬的抗性与对照相比明显增强,但对铜、锌、锰、钴离子的抗性没有明显改善,说明转MT1E基因工程菌能够增强宿主对铬的抗性.以往的研究表明,MT与二价金属离子具有高的亲和力,结合力的强弱依次为Hg(Ⅱ)>Cu(Ⅱ),Ag(I),Bi(Ⅲ)>Cd(Ⅱ)>Pb(Ⅱ)>Zn(Ⅱ)>Co(Ⅱ)>Fe(Ⅱ)(Vasák,1991).在近期的研究中,苏郁洁(2007)构建了在大肠杆菌中表达金属硫蛋白的工程菌,并用于对As(Ⅲ)的吸附.结果表明,该工程菌的吸附能力提高3倍以上,认为As(Ⅲ)与MT结合后存在MT-As1到MT-As6六种形式,MT中含有20个Cys残基,每个As(Ⅲ)可结合3个Cys,所以每个MT最多可结合6个As(Ⅲ).MT-As复合物的形式取决于溶液中砷和MT的浓度.吕品(2011)构建的含大蒜金属硫蛋白AsMT2b 基因毕赤酵母表达基因工程菌能够增强宿主对Cu(Ⅱ)、Cr(Ⅵ)、Cd(Ⅱ)的抗性.邹学敏(2012)研究发现,金属硫蛋白对镍铬联合染毒致小鼠肝肾损伤具有保护作用,其中对低剂量联合染毒保护效果好,其保护机制与抗氧化损伤有关.王晓珊(2013)在利用金属硫蛋白改造工程菌吸附Cu(Ⅱ)和Cr(Ⅵ)的研究中,得到了无论是对Cr(Ⅵ)的还原能力还是总铬的吸附能力都优于出发菌株的工程菌,认为金属硫蛋白不仅能够特异性结合Cu(Ⅱ)这种二价阳离子,而且在Cr(Ⅵ)这种阴离子的还原速率上,金属硫蛋白的过表达也起到了一定的促进作用.据此推测,由于Cr(Ⅵ)很难穿过菌株细胞壁进入细胞内而滞留于培养基中,本研究构建MT1E基因工程菌过表达的MT-1E蛋白分泌至培养基中,将环境中高毒性的Cr(Ⅵ)还原为低毒性的Cr(Ⅲ),从而增强了宿主菌对Cr(Ⅵ)毒害的抗性.
5 结论(Conclusions)本研究人工合成了MT1E人金属硫蛋白基因,构建的MT1E基因高效毕赤酵母真核表达菌株GS115/pPIC9K-MT1E,能够正确分泌表达具有生物活性的人MT蛋白,菌株对Cr(Ⅵ)毒害的抗性得到增强,其在抗重金属Cr的机理方面还有待进一步研究,该菌有望在重金属解毒和修复重金属污染的环境中发挥作用.
| [1] | Amiard J C,Amiard-Triquet C,Barka S,et al.2006.Metallothioneins in aquatic invertebrates:their role in metal detoxification and their use as biomarkers[J].Aquatic Toxicology,76(2):160-202 |
| [2] | 蔡颖,赵肖为,邓旭,等.2006.基因工程菌生物富集废水中重金属镉[J].水处理技术,32 (1):26-28 |
| [3] | 邓旭,李清彪,卢英华,等.2003.基因工程菌大肠杆菌JM109富集废水中镍离子的研究[J].生物工程学报,19(3):343-348 |
| [4] | 方晰,唐志娟,田大伦,等.2012.长沙城市森林土壤7种重金属含量特征及其潜在生态风险[J].生态学报,32(23):7595-7606 |
| [5] | Guo X,Chan H M,Guevremont R,et al.1999. Analysis of metallothioneins by means of capillary electrophoresis coupled to electrospray mass spectrometry with sheathless interfacing[J]. Rapid Communications in Mass Spectrometry,13(6):500-507 |
| [6] | 韩雪清,刘湘涛,尹双辉.2003.毕赤酵母表达系统[J].微生物学杂志,23(4):35-40 |
| [7] | 黄益宗,郝晓伟,雷鸣,等.2013.重金属污染土壤修复技术及其修复实践[J].农业环境科学学报,32(3):409-417 |
| [8] | 黄仲贤,郑起,顾伟强,等.1996.银诱导大鼠肝脏金属硫蛋白的纯化与鉴定[J].高等学校化学学报,17(9):1349-1352 |
| [9] | Jasani B,Schmid K W.1997.Significance of metallothionein overexpression in human tumours[J].Histopathology,31(3):211-214 |
| [10] | Kumar U,Bandyopadhyay M.2006.Sorption of cadmium from aqueous solution using pretreated rice husk[J].Bioresource Technology,97(1):104-109 |
| [11] | 刘刚,李清彪.2002.重金属生物吸附的基础和过程研究[J].水处理技术,28(1):17-21 |
| [12] | 吕品.2011.金属硫蛋白基因工程菌的构建及其对重金属响应的研究 .太原:山西大学 |
| [13] | Mason A,Jenkins K.1995.Metal Detoxification in Aquatic Organisms// Tessier A, Turner D R.Metal Speciation and Bioavailability in Aquatic Systems[M].New York (NY):John Wiley & Sons.479-608 |
| [14] | Mckenna I M,Bare R M,Waal-kes M P.1996.Metallothionein gene expression in testicular interstitial cells and liver of rats treated with cadmium[J].Toxicology,107(2):121 -130 |
| [15] | Mididoddi S,McGuirt J P,Sens M A,et al.1996.Isoform-specific expression of metallothionein mRNA in the developing and adult human kidney[J].Toxicology Letters,85(1):17-27 |
| [16] | 潘爱华,茹炳根,李令媛,等.1992.锌诱导家兔肝脏金属硫蛋白的纯化与鉴定[J].生物化学与生物物理学报,24(6):509-515 |
| [17] | Ren L,Shi D J,Dai J X,et al.1998.Expression of the mouse metallothionein-I gene conferring cadmium resistance in a transgenic cyanobacterium[J].FEMS Microbiology Letters,158(1):127-132 |
| [18] | Romeyer F M,Jacobs F A,Masson L,et al.1988.Bioaccum-ulation of heavy metals in Escherichia coli expressing an inducible synthetic human metallothionein gene[J].Journal of Biotechnology,8(3):207-220 |
| [19] | Sambrook J,Fritsch E F,Maniatis T.1989.Molecular Cloning:A Laboratory Manual (2nd ed)[M].New York:Cold Spring Harbour Laboratory Press |
| [20] | 苏郁洁.2007.金属硫蛋白在原核生物中的表达及在环境治理中的应用 .济南:山东大学 |
| [21] | Thomas J C,Davies E C,Malick F K,et al.2003.Yeast metallothionein in transgenic tobacco promotes copper uptake from contaminated soils[J].Biotechnology Progress,19 (2):273-280 |
| [22] | Vasák M.1991.Metal removal and substitution in vertebrate and invertebrate metallothioneins[J].Methods in Enzymology,205:452 -458 |
| [23] | 王晓珊.2013.利用金属硫蛋白改造工程菌吸附Cu(Ⅱ)和Cr(Ⅵ)的研究 .大连:大连理工大学 |
| [24] | 王耀平,白军红,肖蓉,等.2013.黄河口盐地碱蓬湿地土壤-植物系统重金属污染评价[J].生态学报,33(10):3083-3091 |
| [25] | Wolf K.1996.Nonconventional Yeasts in Biotechnology[M].Berlin:Springer.203-253 |
| [26] | 杨爱玲,朱颜明.2000.城市地表饮用水源保护研究进展[J].地理科学,20(1):72-77 |
| [27] | 殷慎敏,李令媛,茹炳根.1996.金属硫蛋白在医学上的应用[J].生命科学,8(4):22-25 |
| [28] | 袁燕,卞建春,刘学忠,等.2009.环境中重金属污染的生物治理[J].中国兽医学报,29(8):1089-1092 |
| [29] | 张菊,陈诗越,邓焕广,等.2012.山东省部分水岸带土壤重金属含量及污染评价[J].生态学报,32(10):3144-3153 |
| [30] | 周怀东,彭文启.2005.水污染与水环境修复[M].北京:化学工业出版社 |
| [31] | 周杰昊,程时.1995.金属硫蛋白与医学[J].生理科学进展,26(1):29-34 |
| [32] | 邹学敏.2012.金属硫蛋白对镍、铬联合染毒致小鼠肝肾损伤的保护作用 .衡阳:南华大学 |
 2014, Vol. 34
2014, Vol. 34


