2. 南华大学铀矿冶生物技术国防重点学科实验室, 衡阳 421001
2. Key Discipline Laboratory for National Defence for Biotechnology in Uranium Mining and Hydromentallurgy, University of South China, Hengyang 421001
铀尾矿废石受雨淋作用,会随地表径流和地下渗流污染自然水体.研究发现,铀在生物体内积累,会导致人体或者其他生物体白血球增加,引起致癌致畸和其它放射性病变(Xu et al., 2007;Xie et al., 2009).因此,水体铀污染是亟待解决的重大而紧迫的环境问题.现常用的处理含铀废水的方法包括化学沉淀、离子交换、萃取、蒸发浓缩、膜法等物理化学方法(Bleise et al., 2003;Shin et al., 2002),虽能够有效地去除水体中的铀,但存在费用昂贵、处理工艺较复杂、难以推广应用等不足,有的甚至易造成二次污染.而吸附法由于工艺简单、除铀效率高被广泛用于含铀废水的处理(魏广芝等,2007).
目前,吸附铀(Ⅵ)的载体主要有粘土、金属的水合氧化物、炭材料、藻类及菌类等(李爽等,2007),其吸附容量见表 1.针铁矿(α-FeOOH)是土壤中广泛分布的无机胶体,由于具有稳定的化学性质、较高的比表面积及富含功能基团——羟基,成为一种良好的吸附剂,然而在酸性条件下其对铀的吸附性能并不理想.腐殖酸(HA)含有丰富的羧基、羟基等活性基团,这些基团能通过静电作用、络合作用和离子交换等增强阳离子的吸附能力(Li et al., 2010;Lin et al., 2012).有文献报道(Liao et al., 2007),HA对铀具有很强的富集作用,但它在弱酸性介质或碱性介质中可溶,限制了其应用.为获得在弱酸性环境下对铀具有优良吸附性能的材料,本文采用人工合成方法制得腐殖酸改性针铁矿(HA-α-FeOOH),探讨相关因素对其吸附U(Ⅵ)的影响,并优化吸附工艺条件,建立相应的吸附动力学、热力学模型,以揭示其吸附机理.
| 表 1 常见吸附铀(Ⅵ)材料的吸附容量 Table 1 Adsorption capacity of the uranium(Ⅵ)materials |
铀储备液由U3O8分析纯采用GBW04201方法配制.腐殖酸(天津市光复精细化工研究所,化学纯),经冷冻干燥,研磨过筛(200目),密封备用.试验用水为超纯水,试剂均为分析纯.
2.2 腐殖酸改性针铁矿的合成快速将180 mL氢氧化钾溶液(5 mol · L-1)滴加到100 mL硝酸铁溶液(1 mol · L-1)中,加入0.2225 g腐殖酸(针铁矿与腐殖酸的质量比为1:20),加蒸馏水至2 L,调节pH至12,慢速振荡(温度控制在20~50 ℃),然后置于烘箱中保持70 ℃陈化结晶72 h,离心分离、过滤,用蒸馏水冲洗至pH约为7;再在烘箱中保持40 ℃干燥40 h,得到腐殖酸改性针铁矿.
2.3 腐殖酸改性针铁矿吸附U(Ⅵ)前后表征比表面积和粒径分布表征: 将充分干燥的针铁矿混合均匀,取适量样品置于激光粒度仪(Mastersize2000,英国)进样口,在0.15~1000 μm范围内扫描,测得样品的粒径分布和比表面积.
SEM-EDS表征:将充分干燥并研磨后的改性针铁矿及吸附U(Ⅵ)后的材料喷金制备成电镜样品,置于扫描电子显微镜(FEI Quanta-200,美国)下扫描,观察样品形态,并用能谱仪(Genesis,美国)分析样品表面元素.
FT-IR表征:分别取定量吸附U(Ⅵ)前后的改性针铁矿与KBr充分混匀、压片,置于傅里叶变换红外光谱仪(NICOLET6700,美国)上,在400~4000 cm-1范围内进行扫描.
2.4 吸附试验考查了pH值、吸附剂投加量、吸附时间等因素对改性针铁矿吸附U(Ⅵ)的影响.取100 mL铀标准溶液于250 mL锥形瓶中,加定量的吸附剂,用0.1 mol · L-1 HCl和0.1 mol · L-1 NaOH溶液调节pH值,恒温振荡(120 r · min-1)一定时间后离心取上清液,用分光光度法测定溶液中剩余U(Ⅵ)浓度,根据吸附前后溶液中铀的浓度计算改性针铁矿对U(Ⅵ)的吸附量(q),计算公式如下:)

式中,Co、Ce分别为吸附前后溶液中铀的浓度(mg · L-1),V为吸附所用铀溶液的总体积(mL),m为吸附剂的质量(mg).
2.4.1 pH值的影响试验在吸附剂用量为1 g · L-1,模拟含铀废水浓度为5 mg · L-1,温度为25 ℃的条件下,在 2~8 范围内调节pH值,吸附60 min后进行过滤,取滤液测定残余U(Ⅵ)浓度,考察pH值对吸附效果的影响.
2.4.2 吸附剂投加量的影响试验当U(Ⅵ)浓度为5 mg · L-1,温度为25 ℃,pH值为4时,吸附剂投加量分别取0.2、0.5、1、2、5、10 g · L-1,考察吸附剂投加量对吸附效果的影响.
2.4.3 吸附动力学试验设置改性针铁矿投加量为1 g · L-1,U(Ⅵ)初始浓度分别为5、10、20 g · L-1,pH值为4,于25 ℃的条件下连续振荡,测定不同时段(5、10、20、30、60、120、240、480 min)的吸附量.
2.4.4 等温吸附试验称取0.1 g改性针铁矿加入到100 mL初始含U(Ⅵ)浓度分别为 5、10、15、20、25、50、75、100、150、200 mg · L-1的溶液中,在pH=4的条件下,在25 ℃恒温振荡箱中振荡4 h后达到平衡,过滤,测定滤液中U(Ⅵ)的浓度,考察初始浓度对吸附容量的影响.
2.5 解吸试验在35 ℃下,将投加量为1 g · L-1的改性针铁矿投加到pH=4、U(Ⅵ)初浓度分别为150、 200 mg · L-1的溶液中,振荡4 h后离心,取上清液测残余U(Ⅵ)浓度,并用去离子水洗涤吸附剂;将吸附后的改性针铁矿投入到400 mL 0.1 mol · L-1的HCl溶液中,振荡1 h,离心测得析出U(Ⅵ)浓度,再将解吸后的吸附剂用去离子水洗涤几次;重复上述步骤5次.
3 结果与讨论(Results and discussion) 3.1 针铁矿及改性针铁矿的特征图 1为针铁矿及改性针铁矿的粒径分布图.对比图 1a、b可以看出,改性针铁矿粒径呈正态分布,说明其粒径更加集中,均匀性较好,且平均粒径明显小于针铁矿.由激光粒度仪分析测得针铁矿及改性针铁矿的比表面积分别为18.01 m2 · g-1和39.89 m2 · g-1,表明改性针铁矿孔隙度与分散度明显得到提高,证实了其吸附性能比针铁矿更具优越性.
 |
| 图 1 针铁矿(a)、改性针铁矿(b)粒径分布图 Fig.1 Particle size distribution of α-FeOOH(a) and HA-α-FeOOH(b) |
图 2为针铁矿、改性针铁矿吸附U(Ⅵ)前后的扫描电镜图.对比图 2a、b可以看出,针铁矿由细长针状晶体密布成块,而改性后的针铁矿呈分散的小球,表面凹凸不平,整体呈不规则的多孔结构,比表面积大大增加,为吸附水中的金属离子提供了必要的通道及足够的吸附空间,便于金属离子向内部扩散.在图 2c中,吸附U(Ⅵ)后颗粒间的空隙被填平,表面变得较平整,这是由改性针铁矿的功能基参与U(Ⅵ)的吸附所致.
 |
| 图 2 针铁矿(a)、改性针铁矿吸附前(b)、吸附后(c)的扫描电镜图 Fig.2 SEM of α-FeOOH(a) and HA-α-FeOOH before(b) and after(c)U(Ⅵ)adsorption |
从图 3中可以看出,改性针铁矿中引入了C元素,这与腐殖酸中大量存在C极为吻合.改性针铁矿吸附U(Ⅵ)前后都有O、Fe、Al、Si、K 存在,其中,O、Fe含量较高,这与针铁矿和腐殖酸中含有大量Fe、O相符;而HA-α-FeOOH吸附U(Ⅵ)后含有较强的铀峰,证实了HA-α-FeOOH对铀的吸附性能;吸附后K的含量明显降低,表明吸附过程中K+与UO22+发生了离子交换.
 |
| 图 3 针铁矿(a)、改性针铁矿吸附前(b)、吸附后(c)的 X 射线谱图 Fig.3 EDS analysis of α-FeOOH(a) and HA-α-FeOOH before(b) and after(c)U(Ⅵ)adsorption |
图 4为针铁矿及改性针铁矿吸附U(Ⅵ)前后的红外光谱图.从图中a、b谱线可见,针铁矿在3446 cm-1左右存在一个强而宽的O—H 伸缩振动吸收带,在400~800 cm-1出现针铁矿的特征吸收峰.而改性针铁矿的O—H 伸缩振动由3442 cm-1扩展至3200 cm-1以下,说明引入了酚羟基,并在1639 cm-1处出现了羧基的C O 伸缩振动;1213、1065 cm-1处分别出现了羧基、醇的C—O 弯曲振动.表明改性针铁矿含有酚羟基、醇羟基、羧基等活性基团.吸附U(Ⅵ)后的光谱与吸附前相比,有部分峰发生了位移或消失.从图 4中c谱线可见,吸附U(Ⅵ)后3442 cm-1处的—OH消失了,可能是由于改性针铁矿的—OH在酸性溶液中发生质子化后被UO2+取代;羧基中C O特征伸缩振动峰(1575 cm-1)向低波数漂移,且峰强减弱,1069cm-1处的羟基的C—O峰强度减弱,说明改性针铁矿中羧基、羟基的H+与U(Ⅵ)发生了离子交换.
 |
| 图 4 针铁矿(a)、改性针铁矿吸附前(b)、吸附后(c)的红外光谱图 Fig.4 FT-IR of α-FeOOH(a) and HA-α-FeOOH before(b) and after(c)U(Ⅵ)adsorption |
pH值是影响改性针铁矿吸附U(Ⅵ)的重要因素之一.由图 5可知,在酸性环境中,改性针铁矿的处理效果明显优于针铁矿.在初始pH值为2~6时,吸附完成后,溶液pH值有所升高.一方面是改性针铁矿含有的—COOH等酸性基团及—OH、—NH2等碱性基团与溶液中的H+、OH-共同作用的结果;另一方面,在酸性介质中,改性针铁矿中的羟基Fe—OH被质子化成Fe—OH2+,所形成的配位体不稳定,配位基—OH2+很容易被UO22+、UO2(OH)+取代,与三价铁形成稳定的内层络合(孙进等,2005).从图 5中平衡pH值曲线可推断,当在pH小于6时,吸附主要是内层络合起作用.最高吸附率出现在pH=6处,此时U(Ⅵ)在水溶液中以UO2CO3的形式为主,UO2CO3分子表面无电荷,与改性针铁矿颗粒间电荷排斥作用较小,更易于与改性针铁矿中的其他活性基团发生络合作用(Schmeide et al., 2003).考虑到一般地浸含铀废水pH值小于5,此时U(Ⅵ)呈弥散状态,更利于吸附去除,同时改性针铁矿在pH=4时已显示出良好的去除效果,因而后续试验pH值均采用4.
 |
| 图 5 pH值对针铁矿及改性针铁矿吸附U(Ⅵ)的影响(图中箭头方向代表反应前后pH的升降情况) Fig.5 Effect of pH on U(Ⅵ)adsorption by α-FeOOH(a)、HA-α-FeOOH |
吸附剂投加量对U(Ⅵ)吸附率有直接的影响.如图 6所示,改性针铁矿对U(Ⅵ)的吸附率整体都在针铁矿之上,随着改性针铁矿投加量的增加,吸附率增大,当投加量为0~1 g · L-1时,吸附率突跃较大,之后增长缓慢.而针铁矿在2 g · L-1时才达到突跃最大点,说明改性针铁矿对U(Ⅵ)表现出更好的吸附效果,较针铁矿提高了吸附容量.牛志伟等报道,HA的存在大大提高了凹凸棒石粘土对铀的吸附性能(Niu et al., 2009).Anirudhan等(2010)的试验也表明,HA负载锆柱粘土比未经处理的锆柱粘土表现出更优越的铀吸附性能.根据试验结果,后续试验吸附剂投加量均采用1 g · L-1.
 |
| 图 6 投加量对针铁矿及改性针铁矿吸附U(Ⅵ)的影响 Fig.6 Effect of dosage on U(Ⅵ)adsorption by α-FeOOH(a)、HA-α-FeOOH |
吸附过程的动力学研究主要用来描述吸附剂吸附溶质的速率(Quan et al., 2010).如图 7所示,反应样液均在240 min时基本达到吸附平衡.吸附平衡时,5、10、20 mg · L-1的样液中改性针铁矿对U(Ⅵ)的吸附率分别达到100%、98.50%、92.32%.
 |
| 图 7 接触时间对吸附过程的影响 Fig.7 Effect of contact time on adsorption behavior |
运用准一级动力学方程(2)、准二级动力学方程(3)描述改性针铁矿吸附U(Ⅵ)的规律(Mark et al., 2011;Benguella et al., 2002),线性拟合结果见图 8,动力学参数见表 2.

式中,qe为平衡吸附量(mg · g-1),qt为t时的吸附量(mg · g-1),k1、k2分别为准一级(min-1)和准二级(g · mg-1 · min-1)吸附速率常数.
 |
| 图 8 准一级方程(a)和准二级方程(b)的线性拟合 Fig.8 The fitting curve for pseudo-first-order kinetic model(a) and pseudo-second-order kinetic model(b) |
根据表 2中的 R2值可以看出,准二级动力学模型对改性针铁矿吸附U(Ⅵ)过程的拟合效果优于准一级动力学模型,且吸附容量与试验所得值也非常接近,因此,准二级动力学模型拟合铀的吸附过程更具优越性.说明改性针铁矿对铀的吸附是化学吸附过程(Nanasivayam et al., 2007),而准二级动力学模型是建立在速率控制步骤为化学反应或通过电子共享或电子得失的化学吸附的基础上(Namasivayam et al., 2008;Bektas et al., 2004).
| 表 2 吸附动力学分析结果 Table 2 Adsorption kinetics parameters for U(Ⅵ)adsorption |
研究吸附等温线可确定吸附质与吸附剂之间的相互作用与吸附机理.本文采用Langmuir模型(4)和Freundlich模型(5)来拟合吸附过程(Yang et al., 2006),结果见图 9,相关参数见表 3.
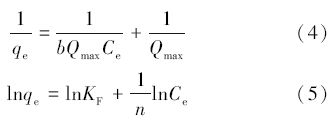
 |
| 图 9 Langmuir方程(a)和Freundlich方程(b)的线性拟合 Fig.9 The fitting curve for Langmuir equation(a) and Freundlich equation(b) |
| 表 3 等温吸附方程分析结果 Table 3 Langmuir and Freundlich parameters for U(Ⅵ)adsorption |
式中,Ce为平衡溶液浓度(mg · L-1),Qmax为每单位吸附剂的吸附容量(mg · g-1),b为吸附强度或是与结合位点密切相关的Langmuir系数,KF是与吸附容量有关的常数,n是与吸附强度有关的经验常数.
从表 3可以看出,R2F > R2L,Freundlich等温线方程的R2值更接近1,表明用Freundlich等温线模型来描述改性针铁矿对溶液中U(Ⅵ)的吸附更合适,说明改性针铁矿的主要吸附模式为多层吸附(Lee et al., 2009),并推断出改性针铁矿的各种基团相互交联,使其具有较大的内比表面积.Langmuir等温线模型的参数中最大单层吸附容量Qmax随着温度的升高而升高,说明吸附过程是吸热的,b随温度的升高而升高,说明改性针铁矿吸附铀的作用力随温度升高而增加.一般情况下,Freundlich等温线方程中的KF可反映吸附量的大小;n>1时,表明铀容易被改性针铁矿吸附(夏良树等,2010;Lin et al., 2011).在不同的温度下(298、308、318 K),n均大于1,表明在整个研究范围内有利于吸附进行.
3.6 吸附热力学吸附过程的热力学参数吉布斯自由能变ΔG0通过式(6)计算,焓变ΔH0和熵变ΔS0通过式(7)计算.热力学参数见表 4,在整个浓度范围内吸附吉布斯自由能ΔG0的值均为负数,表明吸附反应是自发的过程.温度越高,ΔG0的值越小,说明升温有利于吸附反应的进行;吸附焓变ΔH0为正值,说明改性针铁矿对铀的吸附过程是吸热过程;ΔS0为正值说明在吸附过程中固液界面的无序性(Hu et al., 2011).


式中,T为绝对温度(K);R为摩尔气体常数,取值为8.314J · mol-1 · K-1;KD为热力学平衡常数.
| 表 4 改性针铁矿吸附U(Ⅵ)的热力学参数 Table 4 The thermodynamic parameters for U(Ⅵ)adsorption |
解吸试验可以了解吸附行为、吸附剂循环次数及对U(Ⅵ)吸附的恢复率.由图 10可知,改性针铁矿的吸附容量随着解析次数的增多而不断增大,达到最大吸附容量307 mg · g-1后吸附解吸趋于平稳,经过计算吸附U(Ⅵ)后的改性针铁矿解吸率都在10%以下.由此可知,改性针铁矿对U(Ⅵ)的吸持作用很强,一般的酸碱解吸剂对其作用不大,解吸率较低,而经过0.1 mol · L-1的HCl振荡反应1 h后,能增加更多吸附位点,可对U(Ⅵ)进行再次吸附(Kl et al., 2008).
 |
| 图 10 改性针铁矿对U(Ⅵ)的吸附解吸 Fig.10 Adsorption-desorption cycles for HA-α-FeOOH |
1)改性针铁矿对水中U(Ⅵ)有较强的吸附作用和较大的吸附容量,在25 ℃、pH=4、吸附时间4 h的条件下,对5 mg · L-1的含铀废水的去除率几乎达到100%,此时溶液中铀的剩余浓度已低于国家排放标准(0.05 mg · L-1),显示出腐殖酸改性针铁矿处理含铀废水的性能显著优于针铁矿.
2)FTIR、SEM和EDS分析结果表明,U(Ⅵ)被成功地吸附在HA-α-FeOOH上,与U(Ⅵ)相互作用的基团主要是羟基、酚羟基、羧基等,主要吸附机理为内层络合作用,其次是离子交换.
3)在吸附过程中Freundlich吸附等温式的拟合效果优于Langmuir吸附等温式,可决系数均在0.9900以上,表明主要吸附模式为多层吸附.准二级动力学模型(R2>0.9999)比准一级动力学模型(R2<0.9819)能更好地拟合改性针铁矿吸附U(Ⅵ)的动力学规律.
4)HA-α-FeOOH吸附U(Ⅵ)是自发的吸热反应.吸附解吸试验说明HA-α-FeOOH对U(Ⅵ)的吸持作用很强,一般的酸碱解吸剂对其作用不大,解吸率较低,经过0.1 mol · L-1的HCl振荡1 h后,能增加更多吸附位点,可对U(Ⅵ)进行再次吸附,最大吸附容量可达到307 mg · g-1.
| [1] | Anir udhan T S, Bringle C D, Rijith S.2010.Removal of uranium(Ⅵ) from aqueous solutions and nuclear industry effluents using humic acid-immobilized zirconium-pillared clay[J]. Journal of Environmental Radioactivity, 101(3): 267-276 |
| [2] | Bektaş N, Ağim B A, Kara S.2004. Kinetic and equilibrium studies in removing lead ions from aqueous solutions by natural sepiolite[J]. Journal of Hazardous Materials, 112(1/2): 115-122 |
| [3] | Benguella B, Benaissa H. 2002. Cadmium removal from aqueous solution by chitin: kinetic and equilibrium studies[J]. Water Research, 36(10): 2463-2474 |
| [4] | Bleise A, Danesi R, Burkart W. 2003. Properties, use and health effects of depleted uranium (DU): a general overview[J]. Journal of Environmental Radioactivity, 64(2/3): 93-112 |
| [5] | Hu X J, Wang J J, Liu Y G, et al. 2011. Adsorption of chromium(Ⅵ) by ethylenediamine-modified cross-linked magnetic chitosan resin: Isotherms, kinetics and thermodynamics[J]. Journal of Hazardous Materials, 185(1): 306-314 |
| [6] | Kılıç M, Keskin M E, Mazlum S, et al. 2008. Hg (Ⅱ) and Pb (Ⅱ) adsorption on activated sludge biomass: Effective biosorption mechanism[J]. International Journal of Mineral Processing, 87(1/2): 1-8 |
| [7] | Lee S J, Chung S G, Kim D, et al. 2009. New method for determination of equilibrium/kinetic sorption parameters[J]. Current Applied Physics, 9(6): 1323-1325 |
| [8] | 李爽, 倪师军, 张成江. 2007. 铀吸附实验研究现状[J]. 四川环境, 26(1): 77-79, 84 |
| [9] | Li Y, Yue Q Y, Gao B Y. 2010. Adsorption kinetics and desorption of Cu(Ⅱ) and Zn(Ⅱ) from aqueous solution onto humic acid[J]. Journal of Hazardous Material, 178(1/3): 455-461 |
| [10] | Liao J L, Zhu H J, Zhang D, et al. 2007. Adsorption of U(Ⅵ) by humic acid extracted from soil[J]. Atomic Energy Science and Technology, 41(6): 683-688 |
| [11] | Lin D H, Tian X H, Li T T, et al. 2012. Surface-bound humicacid increased Pb2+ sorption on carbon nanotubes[J]. Environmental Pollution, 167: 138-147 |
| [12] | Lin J W, Zhan Y H. 2011. Adsorption characteristics of copper (Ⅱ) ions from aqueous solution onto humic acid-immobilized surfactant-modified zeolite[J]. Colloids and Surfaces (A: Physicochemical and Engineering Aspects), 384(1/3): 9-16 |
| [13] | Mark S H M, Irene M C L. 2011. Influences of redox transformation, metal complexation and aggregation of fulvic acid and humic acid on Cr(Ⅵ) and As(Ⅴ) removal by zero-valent iron[J]. Chemosphere, 84(2): 234-240 |
| [14] | Namasivayam C, Sureshkumar M V. 2008. Removal of chromium(Ⅵ) from water and wastewater using surfactant modified coconut coirpith as a biosorbent[J]. Bioresource Technology, 99(7): 221-222 |
| [15] | Nanasivayam C, Sureshkumar M V. 2007. Modelling thiocyanate adsorption onto surfactant-modified coir pith, an agricultural solid waste[J]. Process Safety and Environmental Protection, 85(B6): 521-525 |
| [16] | Niu Z W, Fan Q H, Wang W H, et al. 2009. Effect of pH, ionic strength and humic acid on the sorption of uranium(Ⅵ) to attapulgite[J]. Applied Radiation and Isotopes, 67(9): 1582-1590 |
| [17] | Quan G X, Yan J L. 2010. Binding constants of lead by humic and fulvic acids studied by anodic stripping square wave voltammetry[J]. Russian Journal of Electrochemistry, 46(1): 90-94 |
| [18] | Schmeide K, Sachs S, Bubner M, et al. 2003. Interaction of uranium(Ⅵ) with various modified and unmodified natural and synthetic humic substances studied by EXAFS and FTIR spectroscopy[J]. Inorganica Chimica Acta, 351: 133-140 |
| [19] | Shin D C, Kim Y S, Moon J Y, et al. 2002. International trends in risk management of groundwater radionuclides[J]. Journal of Environmental Toxicology, 17(4): 273-284 |
| [20] | 孙进, 王志国, 李龙海. 2005. 针铁矿吸附水中硫酸根离子的试验研究[J]. 黄金, 26(3): 43-46 |
| [21] | 魏广芝, 徐乐昌. 2007. 低浓度含铀废水的处理技术及其研究进展[J]. 铀矿冶, 26(2): 90-95 |
| [22] | 夏良树, 谭凯旋, 王晓. 2010. 铀在榕树叶上的吸附行为及其机理分析[J]. 原子能科学技术, 44(3): 278-284 |
| [23] | Xie S B, Zhang C, Zhou X H, et al. 2009. Removal of uranium (Ⅵ) from aqueous solution by adsorption of hematite[J]. Journal of Environmental Radioactivity, 100(2): 162-166 |
| [24] | Xu L C, Xue J X, Gao S X. 2007. Several issues on the decommissioning of uranium mining/milling facilities[J]. Radiation Protection, 27(2): 111-118 |
| [25] | Yang Y, Zhao Y Q, Babatunde A O, et al. 2006. Characteristics and mechanisms of phosphate adsorption on dewatered alum sludge[J]. Separation and Purification Technology, 51(2): 193-200 |
 2014, Vol. 34
2014, Vol. 34


