偶氮染料是目前使用量最大的一种人工合成染料,含有一个或多个偶氮基团及复杂的芳香环结构,因而具有化学稳定性高、生物可降解性低等特点,其已成为印染、纺织和造纸等工业废水的重要污染物.多数偶氮染料及其降解产物具强烈的致癌、致畸、致突变等毒性(Vandevivere et al., 1998; Kapustka and Reporter, 1993),由偶氮染料造成的水环境污染问题已引起广泛关注,其脱色和降解也已成为世界性的研究难点和热点(Ghodake et al., 2009; Saratale et al., 2011).
去除废水偶氮染料最为经济有效的手段是生物法,而生物处理的关键是高效脱色和降解微生物的筛选.到目前为止,已有大量偶氮染料脱色真菌和细菌被陆续报道(Hong et al., 2007; Dawkar et al., 2009; Singh and Pakshirajan, 2010; Annuar et al., 2009),但作为偶氮染料常见成员之一的甲基橙降解菌株较少见到报道(黎小军等,2006).在本研究中,我们从长期受染料污染的化工厂附近土壤中选育出一株能高效对甲基橙降解脱色的菌株Citrobacter sp. LW-3,对其生理生化特性和降解特性进行研究,探究了该菌株对甲基橙降解脱色的相关酶,观察了菌株的染料降解谱.
2 材料与方法(Materials and methods) 2.1 培养基与试剂无机盐培养基MSM-1(王莉,2010): 5.0 g葡萄糖,1.0 g NH4NO3,1.5 g K2HPO4·H2O,0.5 g KH2PO4,0.5 g NaCl,0.2 g MgSO4.7H2O,水1000 mL,pH 7.0~7.2.无机盐培养基MSM-2: 1.0 g NH4NO3,1.5 g K2HPO4·H2O,0.5 g KH2PO4,0.5 g NaCl,0.2 g MgSO4.7H2O,水 1000 mL,pH 7.0~7.2.缓冲液:0.1 mol · L-1 pH 4.9 醋酸钠,0.1 mol · L-1 pH 7.5 PBS,0.1 mol · L-1 pH 7.5 Tris-HCl.甲基橙、甲基红、刚果红、酸性橙Ⅱ、金莲橙O、直接蓝71、孔雀石绿、结晶紫、碱性艳蓝BO、活性艳蓝K-GR、茜素红和活性艳蓝KN-R均为分析纯,购自上海天津化学试剂三厂.
2.2 菌株的富集与分离富集土样取自江苏连云港某染料化工厂.土样 5.0 g 加入 50 mL 含 20 mg · L-1甲基橙的 MSM-1 中,30 ℃ 170 r · min-1振荡培养.每隔 1 周转接至新鲜MSM-1,逐渐提高甲基橙的浓度至 100 mg · L-1.经测定,连续 3 代能降解甲基橙达 80% 以上即为稳定的富集液.富集液梯度稀释后涂布于含 100 mg · L-1甲基橙的 MSM-1 平板.挑取形态差异的单菌接种液体MSM-1,采用紫外可见分光光度计验证其甲基橙降解脱色能力.
2.3 菌株的鉴定降解菌的形态和生理生化特性参照文献(东秀珠和蔡妙英,2001)进行.菌株总DNA的提取采用高盐法,并以此作为模板进行16S rDNA基因的扩增.PCR产物经上海生工生物工程有限公司测序,测序结果通过在线分析,与GenBank中的其他16S rRNA 基因序列进行相似性比较,构建系统进化树.
2.4 菌株 LW-3 对甲基橙的降解脱色分别在50 mL MSM-1和MSM-2中添加100 mg · L-1甲基橙,接种1 mL 预培养的LW-3 细胞(OD600 nm=0.60),观察菌株LW-3对甲基橙的降解.30 ℃ 170 m · min-1 摇床振荡培养.间隔时间取样,测定培养液中甲基橙的残留量.菌株的生长以OD600 nm来表示.所有处理设3个重复.
2.5 影响菌株 LW-3 对甲基橙降解脱色的因素在 50 mL 液体 MSM-1 中添加 100 mg · L-1 甲基橙,接种LW-3后,分别在不同条件下 170 r · min-1 振荡培养后测定甲基橙的降解脱色情况,观察温度、初始 pH 值和通气量对 LW-3 甲基橙脱色的影响.间隔时间取样,测定培养液中甲基橙的残留量.所有处理设3个重复.
2.6 菌株 LW-3 甲基橙降解脱色酶在1000 mL三角瓶装入250 mL MSM-1.实验分为两组,一组加入100 mg · L-1甲基橙,一组不加甲基橙,按1%接种量分别接入 LW-3 种子液(OD600 nm=1.0),30 ℃ 170 r · min-1培养 24 h.分别取两组菌液离心(4 ℃,6000 r · min-1,10 min),上清用于木质素过氧化物酶和漆酶的检测.用事先预冷的双蒸水洗涤细胞两遍,重悬.采用超声破碎法破除菌体的细胞壁,破3 s停3 s共10 min.破碎液12000 r · min-1 离心10 min,弃上清留沉淀.沉淀以适量相应缓冲液重悬后,用于偶氮还原酶、NADH-DCIP还原酶和核黄素还原酶活性的检测.所有处理设3个重复.
木质素过氧化物酶和漆酶酶活的检测参照 Jadhavb 等(2008)的方法.偶氮还原酶、NADH-DCIP还原酶和核黄素还原酶酶活的检测参照 Saratale等(2013)的方法.所有酶活体系总体积均为 5 mL,反应温度 30 ℃,反应时间 5 min.反应结束后检测相应底物的减少量或产物增加量.木质素过氧化物酶和漆酶酶活实验,一个酶活单位是指1 min 内 1 mg 蛋白质引起相应波长吸光值变化一个单位所需的酶量.偶氮还原酶、NADH-DCIP还原酶和核黄素还原酶酶活实验,一个酶活单位是指1 min 内 1 mg 蛋白质还原 1 μg 底物所需的酶量.
2.7 菌株 LW-3 的染料脱色谱在 50 mL 液体 MSM-1 中分别添加 20 mg · L-1的偶氮染料甲基橙、甲基红、刚果红、酸性橙Ⅱ、金莲橙 O和直接蓝 71,三苯甲烷类染料孔雀石绿、结晶紫和碱性艳蓝 BO,蒽醌类染料活性艳蓝 K-GR、茜素红和活性艳蓝.接种 LW-3 后,30℃ 170 r · min-1 摇床振荡培养 3 d,测定农药的残留量.所有处理设3个重复.
2.8 染料含量的测定培养液以6000 r · min-1 离心5 min,取上清液 3 mL 于岛津 UV-1800 紫外可见分光光度计检测培养液中的染料残留量.染料检测波长分别为:甲基橙 465 nm,甲基红 420 nm,刚果红 500 nm,酸性橙Ⅱ 480 nm,金莲橙O 480 nm,直接蓝71 590 nm,孔雀石绿 620 nm,结晶紫 590 nm,碱性艳蓝BO 600 nm,活性艳蓝K-GR 660 nm,茜素红 530 nm,活性艳蓝KN-R 590 nm.
3 结果与分析(Results and analysis) 3.1 降解菌株LW-3的分离、形态和生理生化特征采用富集培养的方式,从长期受染料污染的土样中分离到一株能够高效对甲基橙降解脱色的细菌菌株,命名为 LW-3.该菌株在含有100 mg · L-1甲基橙的50 mL MSM-1中,3 d内使甲基橙的降解率几乎达到 100%.
菌株 LW-3 在营养琼脂平板上生长 2 d 后,菌落呈灰色、光滑、半透明、圆形,边缘整齐、中间稍突,湿润,直径2~3 mm.光学显微镜下,菌株 LW-3 革兰氏染色阴性,呈杆状((0.8~1.0)μm×(3.0~5.0)μm),两端稍圆.
菌株 LW-3 氧化酶、脂肪酶和脲酶阴性,接触酶、精氨酸双水解酶和硫化氢产生阳性.不能水解明胶和淀粉.能利用D-葡萄糖、D-果糖、D-乳糖、D-半乳糖、L-果胶糖、D-甘露糖、D-麦芽糖、D-蔗糖、D-棉子糖、L-丙氨酸作唯一碳源生长,能利用D-乳糖、D-蔗糖、D-棉子糖、蜜二糖、甘油、D-甘露醇、D-山梨醇、L-果胶糖、D-海藻糖和L-鼠李糖产酸.菌株 LW-3 生长的温度和pH 范围分别为4~50 ℃和pH 4.0~9.0.
3.2 降解菌株LW-3系统发育位置的确定提取降解菌基因组DNA,用16S rDNA通用引物对降解菌的16S rDNA进行扩增,得到长度为1450 bp的片段.将测序结果提交至NCBI数据库,获得登录号KF734763.根据菌株 LW-3 的16S rRNA序列与其相关属种16S rRNA序列构建系统进化发育树(图 1),比较发现菌株LW-3与柠檬酸盐杆菌属 Citrobacter freundii T(AJ233408)同源性达 99.8%,与该属 Citrobacter murliniaeT(AF025369)、Citrobacter braakiiT(AF025368)和Citrobacter werkmaniiT(AF025373)均有99.7%的相似性.因此,结合形态和生理生化特征,将菌株 LW-3 归属到柠檬酸盐杆菌属(Citrobacter sp.).
 |
| 图 1 降解菌株 LW-3 的系统发育树 Fig. 1 Phylogenetic tree for strain LW-3 |
菌株 LW-3 利用甲基橙的生长和降解,如图 2所示.菌株 LW-3 不能以甲基橙为唯一碳源生长并对其脱色(MSM-2培养基),但 0.5%(w/v)葡萄糖可大大支持 菌株 LW-3 生长,同时菌株 LW-3 能对甲基橙有很好的降解脱色效果(MSM-1培养基).图中可见,16 h时,菌株的OD600 nm值已从0.02上升至1.66,相应的培养液甲基橙从94.96 mg · L-1下降至8.96 mg · L-1,降解率达 90.56%.
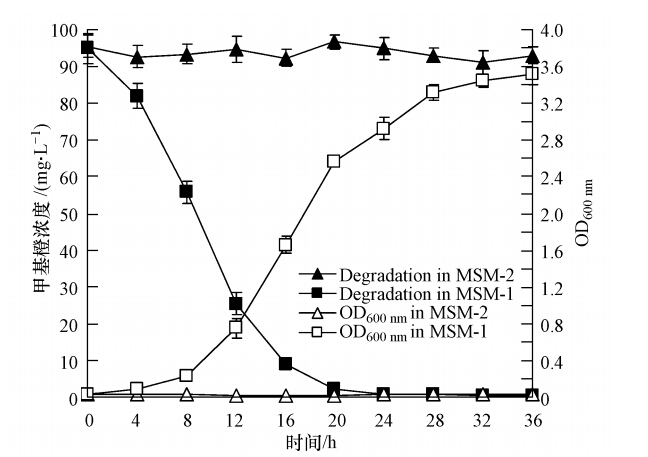 |
| 图 2 菌株LW-3以甲基橙为碳源的生长和降解 Fig. 2 Growth and degradation curves of strain LW-3 utilizing methyl orange as carbon sources |
温度、pH值和通气量对菌株LW-3降解甲基橙的影响结果如图 3所示.菌株LW-3降解甲基橙的适宜温度范围较广.20~40 ℃范围内,24 h,菌株LW-3均能使超过80%的甲基橙降解脱色.35 ℃为最适温度,8 h时甲基橙降解率已达62.97%,12 h降解掉92.64%(图 3a).菌株LW-3降解甲基橙的适宜pH范围为6.0~8.0.pH 6.0、pH 7.0时,甲基橙脱色效果最好,24 h以内两个条件下的各个取样点甲基橙残留量无明显差别(图 3b).在本实验中,以装液量的不同来反映不同的通气量.图 3c可见,通气量对菌株LW-3降解甲基橙影响较小,24 h以内,实验各装液量组甲基橙均降解掉近90%.装液量25~100 mL范围,甲基橙的降解速率随装液量增加而减小.但装液量≥100 mL时,几个组的甲基橙降解曲线无明显分离现象.
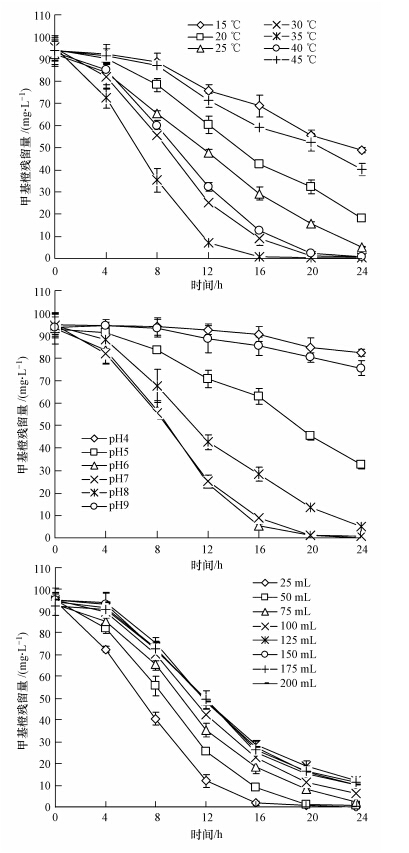 |
| 图 3 环境条件对菌株 LW-3 降解甲基橙的影响 Fig. 3 Effects of environment conditions on degradation of methyl orange by strain LW-3 |
菌株 LW-3 甲基橙降解脱色的相关酶活性结果如表 1表示.菌株 LW-3 对甲基橙的降解脱色,与一种胞外的氧化酶类木质素过氧化物酶和两种胞内的还原酶类—NADH-DCIP 还原酶、核黄素还原酶有关.和未加甲基橙的对照组比,加甲基橙诱导组木质素过氧化物酶、NADH-DCIP还原酶和核黄素还原酶的酶活增加均极其显著(p<0.01),分别是原酶活性的3倍、6.59倍和6.22,可能菌株LW-3具有高效的甲基橙降解脱色能力是由包括这几种酶在内的多种酶共同作用所致.实验中,无论是对照组还是诱导组,均未观察到菌株 LW-3 具有漆酶和偶氮还原酶活性.
| 表1 菌株 LW-3的脱色酶活性 Table 1 Activity of decolorization enzyme from the strain LW-3 |
菌株 LW-3 的染料降解谱如表 2所示.菌株 LW-3 有较广的染料降解谱,3 d 内使 MSM-1 中 20 mg · L-1偶氮染料甲基红、刚果红、酸性橙Ⅱ、金莲橙O,三苯甲烷类染料孔雀石绿、结晶紫的脱色率达 97% 以上.菌株 LW-3 对蒽醌类染料茜素红也有很好的脱色效果,3 d 脱色率达 83.27%.除此之外,对表中其它几种染料也有一定的脱色能力.
| 表2 菌株 LW-3 的染料降解谱 Table.2 Degradation spectrum for dyes by the strain LW-3 |
生物法去除废水偶氮染料的关键是高效脱色和降解微生物的分离纯化.自偶氮染料合成和使用以来,研究人员已筛选了有大量的偶氮染料脱色微生物(Hong et al., 2007; Feng et al., 2012; Chen,2009),但作为偶氮染料重要成员之一的甲基橙降解脱色菌株却一直较少见到报道.已有的几篇报道也只是集中在真菌的脱色和降解上(黎小军等,2006; 戴珅等,2009; 靖德军等,2011).就偶氮染料的脱色而言,细菌通常比真菌快速(Saratale et al., 2011),因而细菌菌株的分离对于偶氮染料的降解脱色显得更有意义.本研究中,我们筛选的柠檬酸盐杆菌属 Citrobacter sp. LW-3能在16 h以内使100 mg · L-1甲基橙降解率达 90.56%,这跟已报道的几株真菌相比,细菌菌株 LW-3的降解脱色效率更高.此外,这是首次从柠檬酸盐杆菌属中分离到甲基橙脱色菌株.
偶氮染料的微生物降解脱色涉及偶氮键(—N N—)的断裂,通常认为该键的断裂是在厌氧条件下受偶氮还原酶的作用(Hong et al., 2007; Feng et al., 2012; Chen et al., 2009; Xu et al., 2010).虽然前人也报道了许多好氧的偶氮脱色细菌,但这些细菌多数在好氧条件生长,脱色仍需厌氧环境(Dawkar et al., 2009; Chen et al., 2009; Bhatt et al., 2005),仅有几株菌可在完全好氧的情况下对其脱色(Blmel and Stolz, 2003).本实验中,菌株 LW-3 的生长和对甲基橙的降解脱色都是在好氧条件下,且酶活实验中,无论是诱导还是非诱导条件均未检测到菌株存在偶氮还原酶活性.该菌株的甲基橙降解脱色与一种胞外的氧化酶——木质素过氧化物酶以及两种胞内的还原酶——NADH-DCIP还原酶、核黄素还原酶(活性分别是非诱导组的3倍、6.59倍和6.22)有关,因此,菌株 LW-3 的分离将有助于进一步揭示偶氮染料的好氧脱色机制.
实验发现,菌株 LW-3 不能以甲基橙为唯一碳源生长和对甲基橙降解脱色,这跟大多数偶氮染料脱色菌株相似,需要添加辅助碳源(Xu et al., 2010; Isik and Sponza, 2005; Talarposhti et al., 2001).在MSM-1中添加 0.5% 葡萄糖,菌株 LW-3即对甲基橙有较强的降解脱色效果,16 h使100 mg · L-1甲基橙降解率达 90.56%.环境条件影响实验结果表明,菌株LW-3降解甲基橙的适宜温度范围较广,20~40 ℃ 24 h均能使超过 80% 的甲基橙降解脱色;适宜pH范围为6.0~8.0;通气量对菌株LW-3降解甲基橙影响较小,24 h实验各装液量组(25~200 mL)甲基橙均能降解近90%.菌株 LW-3 有较广的染料降解谱,在添加 0.5% 葡萄糖的MSM-1培养基中,3 d 内可使 20 mg · L-1偶氮染料甲基红、刚果红、酸性橙Ⅱ、金莲橙O,三苯甲烷类染料孔雀石绿、结晶紫的脱色率达 97% 以上,蒽醌类染料茜素红脱色率达 83.27%.菌株 LW-3 较为广谱的染料脱色活性,很可能和该菌株同时存在多种氧化、还原酶,尤其与非特异性的木质素过氧化物酶有关.这些结果说明,菌株 LW-3 在染料废水的生物处理方面有较强的实际应用价值.
| [1] | Annuar M S M, Adnan S, Vikineswary S, et al. 2009. Kinetics and energetics of azo dye decolorization by pycnoporus sanguineus[J]. Water, Air, and Soil Pollution, 202(1/4): 179-188 |
| [2] | Bhatt N K, Patel C, Keharia H, et al. 2005. Decolourisation of diazo-dye reactive blue 172 by pseudomonas aeruginosa NBAR12[J]. Journal of Basic Microbiology, 45(6): 407-412 |
| [3] | Blmel S, Stolz A. 2003. Cloning and characterization of the gene coding for the aerobic azoreductase from Pigmentiphaga kullae K24[J]. Applied Microbiology and Biotechnology, 62(2/3): 186-190 |
| [4] | Chen B Y, Lin K W, Wang Y M, et al. 2009. Revealing interactive toxicity of aromatic amines to azo dye decolorizer Aeromonas hydrophila[J]. Journal of Hazardous Materials, 166(1): 187-189 |
| [5] | 戴珅, 林书欣, 刘洪涛, 等. 2009. 白腐真菌裂褐菌F7对甲基橙和结晶紫的脱色研究[J]. 山东农业大学学报(自然科学版), 40(3): 341-344 |
| [6] | Dawkar V V, Jadhav U U, Ghodake G S, et al. 2009. Effect of inducers on the decolorization and biodegradation of textile azo dye Navy blue 2GL by Bacillus sp VUS[J]. Biodegradation, 20(6): 777-787 |
| [7] | 东秀珠, 蔡妙英. 2001. 常见细菌系统鉴定手册[M]. 北京: 科学出版社. 1-420 |
| [8] | Feng J H, Kweon O, Xu H Y, et al. 2012. Probing the NADH-and methyl red-binding site of a FMN-dependent azoreductase (AzoA) from enterococcus faecalis[J]. Archives of Biochemistry and Biophysics, 520(2): 99-107 |
| [9] | Ghodake G S, Telke A A, Jadhav J P, et al. 2009. Potential of Brassica juncea in order to treat textile effluent contaminated sites[J]. International Journal of Phytoremediation, 11(4): 297-312 |
| [10] | Hong Y G, Guo J, Xu Z C, et al. 2007. Reduction and partial degradation mechanisms of naphthylaminesulfonic azo dye amaranth by Shewanella decolorationis S12[J]. Applied Microbiology and Biotechnology, 75(3): 647-654 |
| [11] | Isik M, Sponza D T. 2005. Effects of alkalinity and co-substrate on the performance of an upflow anaerobic sludge blanket (UASB) reactor through decolorization of Congo Red azo dye[J]. Bioresource Technology, 96(5): 633-643 |
| [12] | Jadhavb S U, Kalmea S D, Govindwara S P. 2008. Biodegradation of Methyl red by Galactomyces geotrichum MTCC 1360[J]. International Biodeterioration & Biodegradation, 62(2): 135-142 |
| [13] | 靖德军, 黄剑波, 杨洲平, 等. 2011. 粗毛栓菌漆酶的诱导及其对中性染料和有机磷农药的降解[J]. 应用生态学报, 22(12): 3300-3306 |
| [14] | Kapustka L A, Reporter M. 1993. Handbook of ecotoxicology[M]. Oxford: Blackwell Scientific Publications. 1-900 |
| [15] | 黎小军, 林陈水, 许明, 等. 2006. 白腐菌 ZJ-6 的筛选及对合成染料的脱色研究[J]. 江西师范大学学报(自然科学版), 30(6): 543-546 |
| [16] | Saratale R G, Saratale G D, Chang J S, et al. 2011. Bacterial decolorization and degradation of azo dyes: A review[J]. Journal of the Taiwan Institute of Chemical Engineers, 42(1): 138-157 |
| [17] | Saratale R G, Gandhi S S, Purankar M V, et al. 2013. Decolorization and detoxification of sulfonated azo dye C I Remazol Red and textile effluent by isolated Lysinibacillus sp RGS[J]. Journal of Bioscience and Bioengineering, 115(6): 658-667 |
| [18] | Singh S, Pakshirajan K. 2010. Enzyme activities and decolourization of single and mixed azo dyes by the white-rot fungus Phanerochaete chrysosporium[J]. International Biodeterioration & Biodegradation, 64(2): 146-150 |
| [19] | Talarposhti A M, Donnelly T, Anderson G K. 2001. Colour removal from a simulated dye wastewater using a two phase anaerobic packed bed reactor[J]. Water Research, 35: 425-432 |
| [20] | Vandevivere P C, Bianchi R, Verstraete W. 1998. Treatment and reuse of wastewater from the textile wet-processing industry: review of emerging technologies[J]. Jounal of Chemical Technology and Bitechnology, 72(4): 289-302 |
| [21] | 王莉. 2010. 甲胺磷降解菌株的分离鉴定、降解特性及菌株MAP-1的应用研究[D]. 南京: 南京农业大学. 1-164 |
| [22] | Xu H Y, Heinze T M, Paine D D, et al. 2010. Sudan azo dyes and Para Red degradation by prevalent bacteria of the human gastrointestinal tract[J]. Anaerobe, 16(2): 114-119 |
 2014, Vol. 34
2014, Vol. 34


