2. 山西大同大学生命科学学院, 大同 037009
2. School of Life Science, Shanxi Datong University, Datong 037009
镉是环境和食物链中最常见且不易消除的重金属污染物,具有生物富集作用,在体内的半衰期长达20~35年.镉可通过摄食和呼吸作用进入生物体内,对机体造成损伤.一般情况下镉在淡水环境中含量比较低,但是在一些含镉丰富的自然矿区,水体沉积物中镉含量达231.7 mg · kg-1(赵传东等,2008).2012年1月15日广西河池龙江河段出现镉严重超标的水污染事件,宜州拉浪码头前200 m处,镉含量超过《地表水环境质量标准》Ⅲ类标准约80倍,致使附近及下游居民的饮水安全遭到严重威胁.研究发现镉可以引起多种生物体细胞发生凋亡,例如镉可以引起人类免疫细胞系(Tsangaris and Tzortzatou-Stathopoulou, 1998)、小鼠肝脏细胞(Habeebu et al., 1998)和虹鳟鱼(Oncorhynchus mykiss)细胞系(Krumschnabel et al., 2010)发生凋亡.目前,镉致细胞凋亡的研究成为镉分子毒理学研究的一个热点,并且越来越多的实验证明,镉的毒性与细胞内钙离子(Ca2+)浓度变化密切相关.
Ca2+是细胞内重要的第二信使并参与调控细胞内多种生命活动.在静息状态下,细胞内的Ca2+浓度约保持在10-7 mol · L-1,当细胞受到镉刺激时,会引起细胞Ca2+稳态失控(Nicotera et al., 1994; 刘瑞明和刘毓谷,1990).CaM是一种钙结合蛋白,它的作用是对任何微量的钙都能敏感的捕获,参与细胞内所有与Ca2+依赖性相关的事件,并在细胞信号转导中发挥作用.Ca2+-ATPase是一种对钙有高亲和力的膜结合蛋白,主要通过调控Ca2+的转运,来维持细胞钙稳态.近年来有文献报道,(Ca2+)振荡(Ca2+i)在许多毒理和病理过程中发挥作用(Vaienzeno and Tarr, 2007),比如(Ca2+i)参与了镉诱导HEK293细胞凋亡的调控(毛伟平等,2004).
河南华溪蟹(Sinopotamon henanense)生活在淡水中,作为十足目甲壳动物的代表,直接面对水环境的污染,是理想的检测环境污染指示生物(Schuw et al.,2001).肝胰腺是河南华溪蟹重要的解毒器官,在抵抗外来有毒物质的损害方面具有重要作用(王兰等,2003).本课题组前期就镉对河南华溪蟹的研究主要集中在氧化损伤、细胞凋亡、免疫毒性等方面,而对Ca2+信号是否参与镉诱导细胞凋亡的的研究还甚少.鉴于此,本研究采用生理生化和酶学组织化学等方法,分析镉处理对河南华溪蟹肝胰腺细胞内CaM、Ca2+-ATPase活性变化和细胞凋亡的影响,再用Ca2+抑制剂对溪蟹进行预处理,分析Ca2+信号在镉诱导细胞凋亡中的作用.该研究旨在阐明镉诱导细胞凋亡的途径和机理,揭示Ca2+信号与细胞凋亡、机体防护机制之间的关系.同时这一研究对于提高水生动物对环境污染的耐受性具有重要的科学意义.
2 材料与方法(Materials and methods) 2.1 实验材料河南华溪蟹购于山西省太原市五龙口水产批发市场,养殖两周,每2天换1次水,实验前24 h停止喂食.
2.2 试剂与仪器试剂:CaM检测试剂盒、Ca2+-ATPase检测试剂盒均购自南京建成科技有限公司;Caspase-3/9检测试剂盒,购自于碧云天生物技术研究所;EGTA和LaCl3购自上海生工;其他试剂均为国产分析纯.
仪器:酶标仪(Spectra Max M5),低温冷冻离心机(Thermo MR23),冷冻切片机(德国Leica,CM1850).
2.3 实验方法 2.3.1 实验设计挑选健康、体重相近的成年雄性溪蟹,采用镉体外暴露的方法进行染毒.实验分对照组和处理组,对照组采用曝气水养殖;处理组用浓度为14.5、29、58 mg · L-1镉溶液染毒,染毒浓度分别对应96 h LC50的1/16,1/8,1/4(Wang et al., 2008),处理时间分别为0、12、24、48、72和96 h.实验期间不喂食,水温(20 ± 2)℃,pH= 7.5,溶氧量在8 mol · L-1以上.
抑制剂实验:为研究Ca2+信号对镉诱导溪蟹肝胰腺细胞凋亡的影响,使用EGTA和LaCl3两种Ca2+的抑制剂,分别为Ca2+螯合剂和Ca2+通道阻断剂处理溪蟹.具体方法为:分别用5 mmol · L-1 EGTA和5 mmol · L-1 LaCl3预处理溪蟹4 h后,再用58 mg · L-1镉溶液处理48 h.
2.3.2 CaM含量测定分别在不同浓度镉处理溪蟹0、12、24、48、72和96 h后,取肝胰腺组织,加入预冷的CaM缓冲液(1 mmol · L-1 EDTA,0.5 mmol · L-1 DTT,0.5 mmol · L-1 PMSF,0.05 mmol · L-1 Tris-HCl,pH 7.5)(1 ∶ 2)匀浆,4 ℃、15000 r · min-1离心30 min,收集上清液.将上清液在95 ℃水浴中加热3 min,迅速冷却,4 ℃,12000 r · min-1离心30 min,收集上清.用纯化的小鼠钙调素(CaM)抗体包被微孔板,依次加入上清、HRP标记的CaM抗体,形成CaM-酶标抗体复合物,经洗涤后加入TMB显色,经过酸的作用形成黄色,在450 nm波长下测定OD值,通过标准曲线计算CaM含量.具体操作参照钙调素(CaM)检测试剂盒说明书.
2.3.3 Ca2+-ATPase活性检测分别在不同浓度镉处理溪蟹0、12、24、48、72和96 h后,取肝胰腺组织,按照1∶ 9(g · mL-1)加入预冷的生理盐水(0.7%)冰浴匀浆,匀浆液4 ℃离心10 min(3000 r · min-1),取上清液测酶活.ATP酶可分解ATP生成ADP及无机磷,测定无机磷的量可判断ATP酶活力的高低.具体操作参照Ca2+-ATPase检测试剂盒说明书.
2.3.4 组织酶学检测分别在58 mol · L-1镉处理0、12、24、48、72和96 h后活体解剖溪蟹,取新鲜的肝胰腺组织(未用PBS缓冲液冲洗),滴加冰冻切片包埋组织剂(OTC),-18 ℃包埋冷冻,用冷冻切片机连续切片(厚度约8 μm)来进行Ca2+-ATPase的组织酶学检测.Ca2+-ATPase被一些离子激活后可将三磷酸腺苷钠分解为ADP和磷酸,磷酸经过一系列化学反应最终生成黑灰色颗粒物硫化钴,并且该颗粒物沉淀在Ca2+-ATPase酶的存在位点.Ca2+-ATPase孵育液按照Niles改良法(陈啸梅等,1982)配置.室温下冰冻切片在孵育液中避光孵育40 min,再与2%氯化钴、1%硫化铵逐步反应.甘油明胶封片观察着色位点,每张片子选取5个视野.
2.3.5 Caspase-3/9活性检测分别在58 mg · L-1镉处理0、12、24、48、72和96 h后活体解剖溪蟹,用预冷的生理盐水清洗肝胰腺,滤纸吸走表面水分,称取肝胰腺约30 mg,加入300 μL裂解液匀浆,冰浴5 min;4 ℃、15000 r · min-1,离心20 min,取上清液测酶活.Caspase-3/9能分别催化特定底物Ac-DEVE-pNA/Ac-LEHD-pNA,生成黄色的pNA,在405 nm处测定其吸光度,可计算出Caspase-3/9活性.具体操作参照Caspase-3/9检测试剂盒说明书.
2.3.6 总蛋白含量测定蛋白含量测定采用考马斯亮蓝法(Bradford 法)测定,以牛血清蛋白为标准蛋白.
2.3.7 数据分析使用SPSS16.0统计软件进行分析,采用平均值±标准差表示结果,单因素方差(ANOVA)分析中,*p < 0.05显示差异显著,**p < 0.01显示差异极显著.
3 结果与分析(Results and analysis) 3.1 镉对河南华溪蟹肝胰腺细胞CaM含量的影响本实验对镉处理后CaM含量进行了分析,结果如图 1所示,不同浓度镉处理12 h,CaM含量明显升高,在24 h达到最大,之后CaM含量下降,与对照组相比无明显差异.在14.5、29、58 mg · L-1处理组,24 h GaM活力分别是对照组的3.74倍、3.21倍和2.85倍.
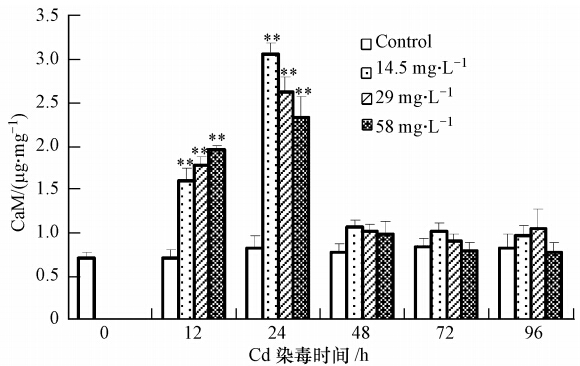 |
| 图 1 镉暴露对河南华溪蟹肝胰腺细胞CaM含量的影响 Fig. 1 Effect of Cd on CaM content in the hepatopancreas of the freshwater crab Sinopotamon henanense |
本实验对镉处理后Ca2+-ATPase含量进行了分析,结果如图 2所示,不同浓度镉处理溪蟹12 h,Ca2+-ATPase的活性显著升高,24 h酶活性持续增加,48 h达到最大,之后随着时间的延长,Ca2+-ATPase活性开始下降,在72 h和96 h其活性恢复到对照组水平.其中29 mg · L-1 镉处理12、24和48 h,Ca2+-ATPase活性分别是对照组的1.59倍、3.71倍和4.61倍.Ca2+-ATPase活性变化与浓度无明显相关性.
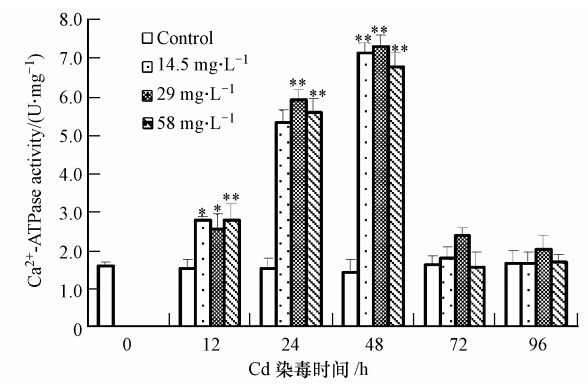 |
| 图 2 镉暴露对河南华溪蟹肝胰腺组织Ca2+-ATPase活性的影响 Fig. 2 Effect of Cd on Ca2+-ATPase activity in the hepatopancreas of the freshwater crab Sinopotamon henanense |
如图 3a~f所示,在肝胰腺细胞质中可观察到黑灰色颗粒物,颗粒物的附着位点和数量代表Ca2+-ATPase的存在位点和活性高低.对照组图a细胞中有极少量沉淀颗粒分布,即Ca2+-ATPase活性不高;58 mg · L-1镉溶液处理12 h,与对照组相比沉淀颗粒明显增多,即Ca2+-ATPase的活性明显升高,24 h酶活性持续上升,48 h活性达到最大.之后随着时间的延长,在72 h、96 h只有少量的沉淀颗粒,说明Ca2+-ATPase的活性降低.进一步证实了上述3.2节的实验结果.
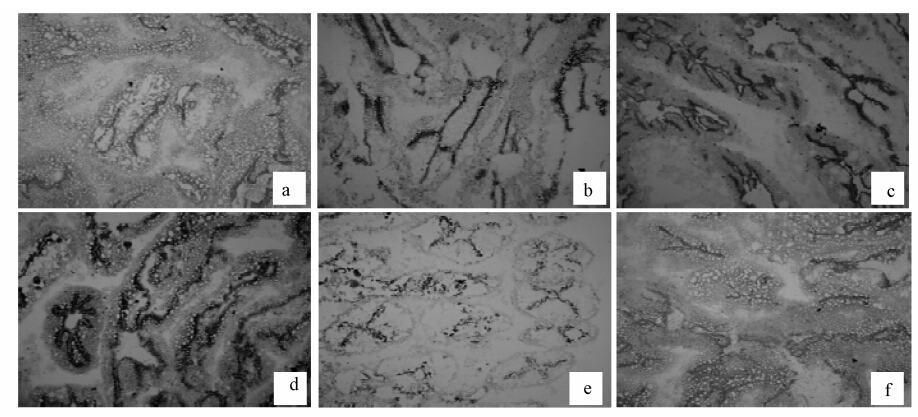 |
| 图 3 组织酶学检测镉(58 mg · L-1)对河南华溪蟹肝胰腺组织Ca2+-ATPase活性的影响(a. 0 h,× 100; b. 12 h,× 100; c. 24 h,× 100; d. 48 h,× 100; e. 72 h,× 100; f. 96 h,× 100) Fig. 3 Effects of Cd(58 mg · L-1)on Ca2+-ATPase activity in the hepatopancreas of the freshwater crab Sinopotamon henanense with histoenzymological stain(a. 0 h,× 100; b. 12 h,× 100; c. 24 h,× 100; d. 48 h,× 100; e. 72 h,× 100; f. 96 h,× 100) |
如图 4所示,镉处理引起溪蟹肝胰腺细胞Caspase-3和Caspase-9的活性升高;24 h两种酶的活性均高于对照组,但较对照组无显著性差异.Caspase-3的活性在48 h出现极显著升高,活性是对照组的1.5倍;在72 h、96 h出现显著性升高,活性分别是对照组的1.4倍和1.39倍.caspae-9的活性在48 h、72 h和96 h均出现极显著升高,活性分别是对照组的2.4倍、1.57倍和1.5倍.
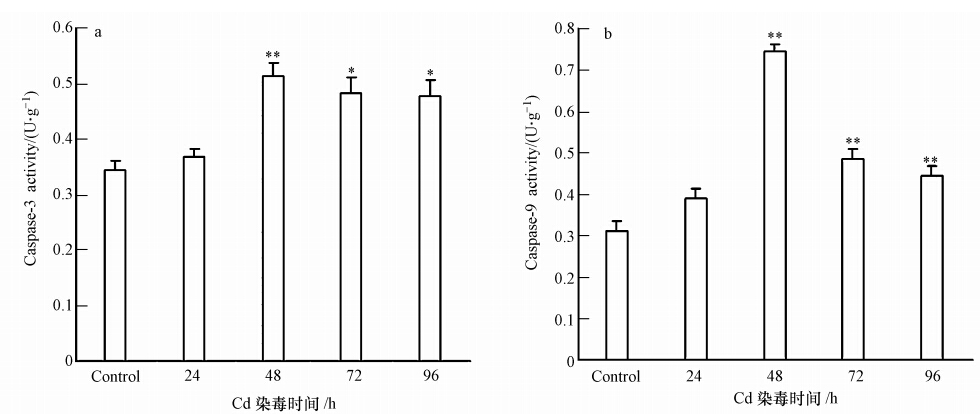 |
| 图 4 镉(58 mg · L-1)对河南华溪蟹肝胰腺组织Caspase-3/9活性的影响(a.Caspase-3活性;b. Caspase-9活性) Fig. 4 Effects of 58 mg · L-1 Cd on Caspase-3/9 activities in the hepatopancreas of the freshwater crab Sinopotamon henanense(a. Caspase-3 activity; b. Caspase-9 activity) |
本实验用两种Ca2+抑制剂分别预处理溪蟹4 h后再用58 mg · L-1 镉处理48 h,镉对凋亡的影响被检测.如图 5所示,单独镉处理使得Caspase-3和Caspase-9活性较对照组有极显著的升高,用Ca2+抑制剂预处理后则抑制了镉引起的Caspase-3和Caspase-9活性的增加.
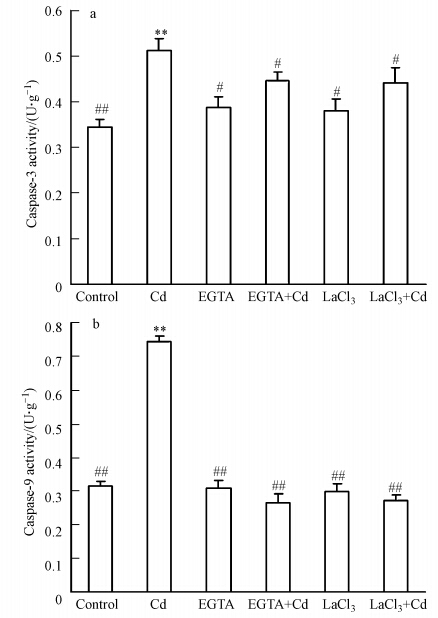 |
| 图 5 Ca2+抑制剂预处理对镉(58 mg · L-1)诱导河南华溪蟹肝胰腺细胞Caspase-3/9活性的影响(a. Caspase-3活性;b. Caspase-9活性; 注:用5 mmol · L-1 EGTA和5 mmol · L-1 LaCl3预处理溪蟹4 h后,再用58 mg · L-1镉溶液处理48 h) Fig. 5 Effects of pretreatment with EGTA and LaCl3 on Caspase-3/9 activities triggered by Cd(58 mg · L-1)in the hepatopancreas of the freshwater crab Sinopotamon henanense(a. Caspase-3 activity; b. Caspase-9 activity. Using one-way analysis of variance and on comparing with control,significance is shown by *p < 0.05,**p < 0.01; on comparing with Cd treatment group,#p < 0.05,##p < 0.01(Note:The crabs were pretreated with 5 mmol · L-1 EGTA or 5 mmol · L-1 LaCl3 for 4 h, and then exposed to 58 mg · L-1 Cd treatment for 48 h) |
镉在河南华溪蟹组织器官的积累由高到低的顺序是:鳃>肝胰腺>肌肉>卵巢(Ma et al., 2007),但鳃是镉积累的临时器官,而肝胰腺是最终蓄积镉的主要器官(Martín-Díaz et al., 2005; Amiard et al., 2001).目前有研究发现,镉暴露会引起肝细胞内Ca2+浓度发生剧烈变化(Ca2+振荡,简写为Ca2+i),而细胞内(Ca2+i)通常引发细胞凋亡(毛伟平等,2004).Ca2+是细胞内重要的第二信使,对细胞的存活、分泌、增殖及其他各个方面的功能有重要的调节作用(Chang and Meng,1995),包括细胞分裂、神经递质的释放、受精过程、以及新陈代谢(Xu et al., 2003).细胞质基质中Ca2+浓度在静态时大约为10-7 mg · L-1,细胞受到外界刺激时,会引起细胞Ca2+i,而Ca2+i在许多毒理和病理过程中发挥作用.因此本文采用急性镉暴露的方法研究Ca2+信号在镉诱导细胞凋亡中的作用.在此需要说明的是,本实验采用的镉浓度比环境中镉的允许排放值(0.01 mg · L-1)高出许多倍,具体原因如下:第一,河南华溪蟹是一种底栖无脊椎动物,长期活动在水和沉积物的界面,那里重金属如镉的含量更倾向于较高的水平;第二,沉积物是水体中重金属富集的主要场所,同时也可向水体再次释放重金属,形成二次污染(郑丙辉等,2012);第三,本实验研究镉对溪蟹的损伤,其中最长暴露时间为96 h,而溪蟹可能终其一生都生活在水体中,重金属长期富集作用导致的结果可能与短时间、高浓度效应一致,所以本文采用比环境镉浓度高出许多是有必要的.
钙调素(Calmodulin,CaM)是真核细胞中一种能与Ca2+结合的蛋白,相对分子质量为16.7,它参与细胞内所有与Ca2+依赖性相关的事件,主要负责翻译Ca2+浓度变化和传递Ca2+信号(Chin and Means, 2000).细胞外刺激可通过影响胞内Ca2+浓度变化来调控CaM的活性,活性Ca2+-CaM复合物通过与靶酶作用,使靶酶构象发生变化(Ca2+作用结果)而活化,活化的靶酶激活下游多个信号传导途径,比如蛋白激酶C(PKC)、CaMKⅡ(Liu and Templeton, 2007)、cAMP环化酶(Fimia and Sassone-Corsi, 2001)、促分裂原活化蛋白激酶(MAPK l/2),从而介导细胞增殖、受精、凋亡、炎症反应等多种代谢过程(Wang et al., 2013; 彭碧文和林建银,2001).本实验对镉处理后CaM含量进行了分析,发现镉胁迫诱导CaM转录,致使CaM在24 h内有了快速的上升和下降,CaM是感受Ca2+浓度变化的受体,负责翻译Ca2+浓度变化,CaM的快速变化间接反映了Ca2+浓度变化,说明在镉作用下细胞内钙稳态遭到破坏,进而可能引发机体一系列生理功能的紊乱,这种变化可以是镉诱导细胞反应的调控方式.
Ca2+-ATPase是ATP酶家族中的重要成员之一,有内质网膜钙ATP酶和质膜钙ATP酶两种类型,主要负责调控Ca2+转运,在信息传递、能量转换、维持细胞内钙稳态中发挥重要作用(顾香等,2008).在外界刺激物作用下,细胞质基质中Ca2+浓度高于基态浓度10-7 mg · L-1时,Ca2+-ATPase可被两种机制激活:①被Ca2+/CaM复合物激活;②被蛋白激酶C激活,进而直接参与Ca2+的转运,降低胞质Ca2+浓度.有文献报道,镉可以引起细胞内Ca2+-ATPase活性升高(Liu et al., 2011).在此首先使用生理生化方法对镉处理后细胞内Ca2+-ATPase含量进行了检测,结果发现不同浓度镉处理溪蟹12 h,Ca2+-ATPase的活性与对照组相比都明显升高,24 h酶活性持续增加,48 h达到最大,说明Ca2+-ATPase活跃的参与Ca2+的转运,之后随着时间的延长,Ca2+-ATPase活性开始下降,说明随着镉作用时间的延长,Ca2+-ATPase的活性被抑制(Li et al., 2011).同时,本研究还采用组织酶学的方法检测58 mg · L-1镉对细胞内Ca2+-ATPase活性的影响,发现镉处理使得肝胰腺细胞质中黑灰色颗粒物明显增多,此种现象可能表明镉处理后细胞内Ca2+-ATPase活性增加,这使得Ca2+-ATPase可将大量的钙转运到细胞外.进一步证实了上述生理生化的检测结果.
凋亡也称细胞程序性死亡(programmed cell death,PCD),是受基因调控的细胞自杀行为,具有主动生理性.当细胞接收到内源性或外源性的凋亡信号时,这种自杀程序将被激活(周桔等,2007).大量文献报道,镉可诱导多种细胞发生凋亡,比如镉诱导KO细胞(朱靳良等,2001)发生凋亡,镉致鸡脾淋巴细胞凋亡(田婷等,2007),并且不同细胞在受到镉胁迫时,引发的凋亡途径不同.细胞凋亡主要存在两条途径:线粒体起始的內源途径和死亡受体起始的外源途径(Green.,2000; Fulda and Debatin, 2006).本课题组前期研究发现,镉诱导河南华溪蟹肝胰腺细胞凋亡依赖于线粒体起始的內源途径(Wang et al., 2013),在此凋亡途径中Caspase家族中的Caspase-9和Caspase-3扮演重要角色.Caspase-9是上游凋亡起始重要信号分子,而Caspase-3是凋亡过程中的关键蛋白酶,是凋亡的执行者.细胞内的死亡信号可诱发线粒体释放细胞色素C,细胞色素C、Apa-f 1、dATP和Caspase-9 酶原结合形成凋亡复合(apoptosome),Caspase-9被释放并激活,接着下游的Caspase-3等被激活降解底物使细胞凋亡(Wu et al., 2005).另外刘冬梅等(Liu et al., 2013)研究发现镉可诱导河南华溪蟹肝胰腺细胞发生凋亡,并且在最高浓度镉处理时凋亡最明显.在此选取58 mg · L-1镉处理溪蟹,实验结果发现,58 mg · L-1镉处理可引起肝胰腺细胞Caspase-9和Caspase-3的活性升高,并且Caspase-3的活性在48 h出现极显著升高,说明镉诱导肝胰腺细胞发生凋亡与Caspase家族有着密切关系,且肝胰腺细胞的凋亡机制很可能与线粒体凋亡途径有关.
镉处理引起细胞内Ca2+-ATPase、CaM活性发生变化,说明镉处理致使细胞内Ca2+浓度发生变化,另外镉还可诱导肝胰腺细胞发生凋亡.众所周知Ca2+是细胞内重要的第二信使并参与调控细胞内多种生命活动.那么推测,Ca2+信号与细胞凋亡、机体防护之间可能存在一定的关联.EGTA是一种钙离子的螯合剂,能够螯合细胞质中游离的钙离子.LaCl3是钙离子通道阻滞剂可抑制钙离子内流,起到保护细胞的作用.因此,我们进一步研究了钙抑制剂(EGTA,LaCl3)预处理对镉诱导细胞凋亡(Caspase-3/9活性)的影响.结果发现用Ca2+抑制剂EGTA和LaCl3预处理溪蟹4 h再用58 mg · L-1 镉处理后,镉诱导的细胞内Caspase-3和Caspase-9活性增加等特征都被阻断了.这说明镉处理会引起细胞早期Ca2+浓度发生变化,而EGTA和LaCl3预处理阻止了细胞内Ca2+浓度的升高,进而阻止了镉诱导的凋亡发生,即Ca2+浓度升高这一早期事件是后续细胞发生改变(包括细胞凋亡)的关键前提.
5 结论(Conclusions)1)镉处理引起细胞早期Ca2+浓度发生变化,并通过CaM等信号分子调控Caspase-3/9活性,引发细胞线粒体起始的內源途径凋亡.2)该研究不仅能加深理解镉诱导细胞凋亡的信号机理,并为钙离子调控凋亡的分子机制研究提供新的科学依据,同时这一研究对于利用分子生物学和毒理学手段提高动物对水环境污染的耐受性具有重要的理论和实践意义.
| [1] | Amiard C,Amiard-Triquet C,Amiard J C,et al.2001.Comparison of metallothionein concentrations and tissue distribution of trace metals in crabs (Pachygrapsusma rmoratus) from a metal-rich estuary,in and out of the reproductive season [J].Comparative Biochemistry and Physiology (Part C:Toxicology & Pharmacology),129(3):193-209 |
| [2] | Chang D C,Meng C.1995.A localized elevation of cytosolic free calcium is associated with cytokinesis in the zebrafish embryo[J].The Journal of Cell Biology,131(6 Pt 1):1539-1545 |
| [3] | 陈啸梅,周文郁,彭俊云,等.1982.组织化学手册(第一册) [M].北京:人民卫生出版社 |
| [4] | Chin D,Means A R.2000.Calmodulin:a prototypical calcium sensor[J].Trends in Cell Biology,10(8):322-328 |
| [5] | Fimia G M,Sassone-Corsi P.2001.Cyclic AMP sigalling[J].Journal of Cell Science,114(Pt 11):1971-1972 |
| [6] | Fulda S,Debatin K M.2006.Extrinsic versus intrinsic apoptosis pathways in anticancer Chemotherapy[J].Oncogene,25(34):4798-4811 |
| [7] | Green D R.2000.Apoptotic pathways:paper wraps stone blunts cissors[J].Cell,102(1):1-4 |
| [8] | 顾香,陈阳美,张杰敏.2008.钙调蛋白结构及其神经生物学功能的研究进展[J].重庆医学,37(17):1995-1997 |
| [9] | Habeebu S S M,Liu J,Klaassen C D.1998.Cadmium-induced apoptosis in mouse liver[J].Toxicology and Applied Pharmacology,149(2):203-209 |
| [10] | Krumschnabel G,Ebner H L,Hess M W,et al.2010.Apoptosis and necroptosis are induced in rainbow trout cell lines exposed to cadmium[J].Aquatic Toxicology,99(1):73-85 |
| [11] | Li R J,Zhou Y Y,Wang L,et al.2011.Low-molecular-weight-chitosan ameliorates cadmium-induced toxicity in the freshwater crab,Sinopotamon yangtsekiense[J].Ecotoxicology and Environmental Safety,74(5):1164-1170 |
| [12] | Liu D M,Yan B,Yang J,et al.2011.Mitochondrial pathway of apoptosis in the hepatopancreas of the freshwater crab Sinopotamon henanense eoxposed to cadmium[J].Aquatic Toxicology,105(3/4):394-402 |
| [13] | Liu D M,Yang J,Li Y J,et al.2013.Cd-induced apoptosis through the mitochondrial pathway in the hepatopancreas of the freshwater crab Sinopotamon henanense[J].PLos One,8(7):68770 |
| [14] | 刘瑞明,刘毓谷.1990.钙稳态失调与镉肝细胞毒性关系的研究[J].环境科学学报,10(2):2-8 |
| [15] | Liu Y,Templeton D M.2007.Cadmium activates CaMK-II and initiates CaMK-II-dependent apoptosis in mesangial cells [J].FEBS Letters,581(7):1481-1486 |
| [16] | Ma W L,Wang L,He Y J,et al.2007.Tissue-specific cadmium and metallothionein levels in freshwater crab Sinopotamon henanense during acute exposure to waterborne cadmium[J].Environmental Toxicology,23(3):393-400 |
| [17] | 毛伟平,许峰,石晓娟,等.2004.镉诱导HEK293细胞胞内钙稳态的失调引发细胞凋亡[J].中国药理学与毒理学杂志,18(2):103-108 |
| [18] | Martín-Díaz M L,Villena-Lincoln A,Bamber S,et al.2005.An in tegrated approach using bioaccumulation and biomarker measurements in female shore crab,Carcinus maenas[J].Chemosphere,58(5):615-626 |
| [19] | Nicotera P,Zhivotovsky B,Orrenius S.1994.Nuclear calcium transport and the role of calcium in apoptosis[J].Cell Calcium,16(4):279-288 |
| [20] | 彭碧文,林建银.2001.钙离子与钙调蛋白在弓形虫侵染宿主细胞信号转导中的作用[J].国外医学寄生虫病分册,28(6):252-256 |
| [21] | Schuwerack P M,Lewis J W,Jones P.2001.The potential use of the South African river crab,Potamonautes warreni,as a bioindicator species for heavy metal contamination[J].Ecotoxicology,10(3):159-166 |
| [22] | 田婷,毛伟平,张超,等.2007.镉致HEK293细胞凋亡中氧化应激作用[J].中国公共卫生,23(10):1192-1193 |
| [23] | Tsangaris G T,Tzortzatou-Stathopoulou F.1998.Cadmium induces apoptosis differentially on immune system cell lines[J].Toxicology,128(2):143-150 |
| [24] | Vaienzeno D P,Tarr M.2007.Caicium as a moduiator of photosensitized killing of H9c2 cardiac cells[J].Photochemistry and Photobiology,74(4):605-610 |
| [25] | Wang J X,Zhang P P,Shen Q Q,et al.2013.The effects of cadmium exposure on the oxidative state and cell death in the gill of freshwater crab Sinopotamon henanense[J].Plos One,8(5):e64020 |
| [26] | 王兰,王定星,王茜,等.2003.镉对长江华溪蟹肝胰腺细胞超微结构的影响[J].解剖学报,34(5):522-526 |
| [27] | Wang L,Yan B,Liu N,et al.2008.Effects of cadmium on glutathione synthesis in hepatopancreas of freshwater crab,Sinopotamon yangtsekiense[J].Chemosphere,74(1):51-56 |
| [28] | Wu C C,Chan M L,Chen W Y,et al.2005.Pristimerin induces Caspase-dependent apoptosis in MDA-MB-231 cells via direct effects on mitochondria[J].Molecular Cancer Therapeutics,4(8):1247-1285 |
| [29] | Xu N,Luo K Q,Chang D C.2003.Ca2+ signal blockers can inhibit M/A transition in mammalian cells by interfering with the spindle checkpoint[J].Biochemical and Biophysical Research Communications,306(3):737-745 |
| [30] | 赵传东,陈富荣,陈兴仁,等.2008.长江流域沿江镉异常源追踪与定量评估的方法技术研究:以长江流域安徽段为例[J].地学前缘,15(5):179-193 |
| [31] | 郑丙辉,秦延文,张雷,等.2012.重金属污染沉积物质量评价研究——以太湖为例[J].中国环境科学,32(10):1860-1866 |
| [32] | 周桔,罗荣保,汤长发,等.2007.Bcl-2蛋白家族和P53基因在细胞凋亡中的调控效应[J].中国组织工程研究与临床康复,11(10):1950-1952 |
| [33] | 朱靳良,沈汉明,王俊南.2001.镉诱导OK细胞发生凋亡[J].卫生毒理学杂志,15(3):160-162 |
 2014, Vol. 34
2014, Vol. 34


