量子点(quantum dots,QDs)是一种半导体纳米晶体,通常由II~VI或III~V族元素组成,主要以CdSe或CdTe为核心、ZnS或ZnSe为表面薄层,粒径一般介于1~10 nm之间,受激后可以发射荧光(Alivisatos,1996),具有优良、独特的荧光性和光化学稳定性,广泛应用于生物医学(Tanke et al., 2005;Lacoste et al., 2000)、药物筛选(Liao et al., 2007;Liang et al., 2006)和环境检测(Chen and Rosenzweig, 2002)等研究领域.随着量子点的应用日益广泛,其生物安全性问题引起人们的关注.这种人工合成的纳米晶体可通过直接排放、废弃物排放、常规使用等多种途径进入水环境,将不可避免地对整个生态系统造成一定的危害.进入水环境的量子点又可通过食物链在鱼类等水生生物体内富集并最终进入人体,对人体健康构成威胁(Brant et al., 2005),因此,研究量子点对水生生物的毒性效应非常必要.然而,以往关于量子点的研究大多集中在利用鼠类为活体研究对象来探讨量子点的毒性机制(King-Heiden et al., 2009; Ballou et al., 2004).量子点对鱼类的毒理学研究资料较少(King-Heiden et al., 2009),黄凯等(2011)研究发现,以巯基乙酸修饰的CdTe 量子点可抑制斑马鱼胚胎的发育,并引起斑马鱼胚胎发生多种中毒症状,但未涉及到氧化应激方面的研究.
稀有鮈鲫(Gobiocypris rarus)为我国特有的一种小型鱼类,在实验室条件下能够周年繁殖,且对很多药物极具敏感性,是很好的指示生物.鉴于目前关于量子点对稀有鮈鲫的毒理学研究方面还未见报道,本文以稀有鮈鲫为实验对象,研究了 CdSe/ZnS QDs 对稀有鮈鲫胚胎发育的影响,旨在揭示QDs对稀有鮈鲫早期发育阶段的毒性效应,为鱼类的毒理学研究提供参考,也为量子点对生物的安全性评估提供基础资料.
2 材料与方法(Materials and methods) 2.1 实验用量子点本实验所用量子点为水溶性聚乙二醇(PEG)修饰的非靶向 CdSe/ZnS 量子点,浓度为 8 μmol · L-1,粒径为 8~12 nm,单分散性一致,颗粒之间独立性好,荧光最大发射波长为613 nm,购于武汉伽源量子点技术开发有限公司.
2.2 实验亲鱼饲养及受精卵获取实验亲鱼为本实验室长期饲养的稀有鮈鲫,从养殖群体中挑选出体质健壮、性成熟的健康成鱼作为亲鱼(体重:(0.53±0.15)g,体长:(3.66±0.37)cm),饲养于实验室循环养殖系统中,水中溶氧浓度大于 5 mg · L-1.每日定时投喂人工配合饵料2次,外加丰年虫1次.雌雄亲鱼以 1 ∶ 1 性比配对养殖,控制昼夜节律,通过人工授精获取受精卵.
2.3 实验设计根据预实验的结果,设置 1 个空白对照组(即浓度为 0 nmol · L-1)、1个Cd2+对照组(所用镉浓度等于50 nmol · L-1 QDs含镉量,即2 mg · L-1)和5个CdSe/ZnS QDs 浓度组:分别为 50、100、200、300和400 nmol · L-1,各组均设 3 个平行.为了减少实验误差以及避免受精过程的不确定性,在囊胚期时用显微镜挑选出发育正常的稀有鮈鲫胚胎,并从囊胚期(约受精 4.5 h)开始染毒. 用 24 孔细胞培养板作为染毒试验容器,每孔为1个浓度组,放入20 枚胚胎.每孔分别加受试液 1 mL,后将 24 孔培养板置于精密恒温水浴锅中,水温控制在(25.0±0.5)℃.实验期间,及时剔除死亡个体,每间隔12 h换 1/2 同等浓度的溶液,光照周期为 12 h ∶12 h(L ∶ D).
2.4 显微观察参照斑马鱼可观察毒理学终点和不同类型指标(朱琳和史淑洁,2002)及稀有鮈鲫胚胎的发育过程(常剑波等,1995),每间隔 6 h 记录各浓度组胚胎的死亡、畸形、孵化情况.胚胎发育至 36 hpf 时,表现出胚体的自主运动,每个浓度组随机选 6 枚胚胎记录 30 s胚体自主运动次数;发育至 60 hpf 时可观察到明显的心跳,每浓度组随机选 6 枚胚胎,记录 10 s胚胎内心率.LEICA Mz16FA荧光体视显微镜和Nikon SMZ1000体视显微镜观察并照相.用Image-pro plus 6.0 图像软件分析 96 hpf 时的仔鱼体长.
2.5 抗氧化物分析在稀有鮈鲫发育至 96 hpf 时,用 4 ℃ 的PBS缓冲液清洗受试后存活的稀有鮈鲫初孵仔鱼,除去药物,加入预冷的磷酸盐缓冲液(PBS,pH 7.4)冰浴中匀浆,4 ℃ 12000 r · min-1 离心15 min,取上清液并按照试剂盒说明书(南京建成生物工程研究所)测定样品总蛋白浓度、超氧化物歧化酶(SOD)活力和丙二醛(MDA)的含量.
2.6 统计分析用 SPSS 17.0进行数据统计和分析,结果以平均值 ± 标准误(Mean±SE)表示,实验组与空白对照组之间的差异采用t检验进行比较,p<0.05表示有显著性差异,p<0.01表示有极显著性差异.
3 结果(Results) 3.1 稀有鮈鲫胚胎的半致死浓度(LC50)和半致畸效应浓度(EC50)各组胚胎的死亡率和畸形率见表 1.Cd2+对照组的胚胎发育至 36hpf 时已全部死亡.与空白对照组相比,100、200、300和400 nmol · L-1浓度的 QDs 染毒组 72 hpf 时的死亡率和96 hpf 时畸形率均极显著的升高(p<0.01).采用概率单位法,得出稀有鮈鲫胚胎 72 hpf 的LC50为 319.629 nmol · L-1,其95%置信区间为:256.954~433.842 nmol · L-1;96 hpf 的EC50为 203.312 nmol · L-1,其95%置信区间为:159.947~262.327 nmol · L-1.
| 表 1 不同浓度 CdSe/ZnS QDs 对稀有鮈鲫胚胎死亡率和畸形率的影响 Table 1 Mortalities and malformation rates during embryonic development of rare minnow under CdSe/ZnS QDs exposure |
Cd2+对照组的胚胎发育至 36 hpf 时已全部死亡,故无法统计.50 nmol · L-1 QDs浓度组胚胎在 36 hpf 30s的自主运动频率虽高于空白对照组(图 1),但无显著性差异(p﹥0.05).而其他染毒组随 CdSe/ZnS QDs 浓度的增加,胚胎自主运动频率呈现降低的趋势.200 nmol · L-1浓度组自主运动频率显著性低于空白对照组(p<0.05),300和400 nmol · L-1浓度组胚胎的自主运动频率较空白对照组极显著的降低(p<0.01).
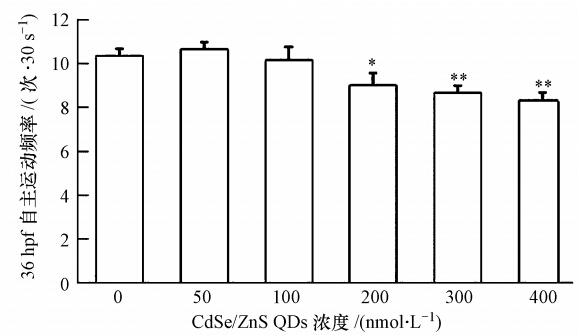 |
| 图 1 CdSe/ZnS QDs 对稀有鮈鲫胚胎36 hpf 自主运动的影响 (注: * 表示与空白对照组有显著性差异(p<0.05),**表示与空白对照组相比存在极显著差异(p<0.01)) Fig. 1 Effects of CdSe/ZnS QDs on spontaneous movement frequency of rare minnow embryos at 36 hpf |
50 nmol · L-1QDs浓度组胚胎内心率与空白对照组相比无显著差异,其他各QDs 浓度组均极显著地减缓了稀有鮈鲫胚胎的内心率(p<0.01)(图 2).此外,随着暴露时间延长,400 nmol · L-1浓度组胚胎显微镜下可观察到心律不齐的症状.
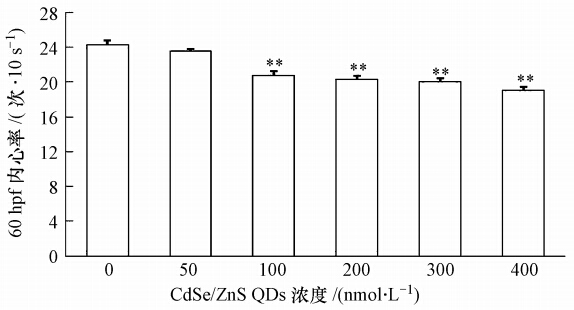 |
| 图 2 CdSe/ZnS QDs对稀有鮈鲫胚胎60hpf10s内心率的影响 (注: **表示与空白对照组相比存在极显著差异(p<0.01)) Fig. 2 Effects of CdSe/ZnS QDs on heart rate in 10 s of rare minnow embryos at 60 hpf |
空白对照组的胚胎 72 hpf开始孵化出膜,随后孵化率迅速上升,84 hpf 时孵化率基本达到最大值(图 3).50、100 nmol · L-1浓度组的稀有鮈鲫胚胎最早孵化时间却提前在 66 hpf,尤其是 50 nmol · L-1浓度组的孵化率已达到 40%,与空白对照组相比提前了 6 h,而 300、400 nmol · L-1 浓度组胚胎的最早孵出时间在 78 hpf,较空白对照组延迟了 6 h,且孵化率明显降低.说明 CdSe/ZnS QDs的暴露在较低浓度(50、100 nmol · L-1)下促使稀有鮈鲫胚胎提前孵化,高浓度(300、400 nmol · L-1)则延迟其出膜的时间.
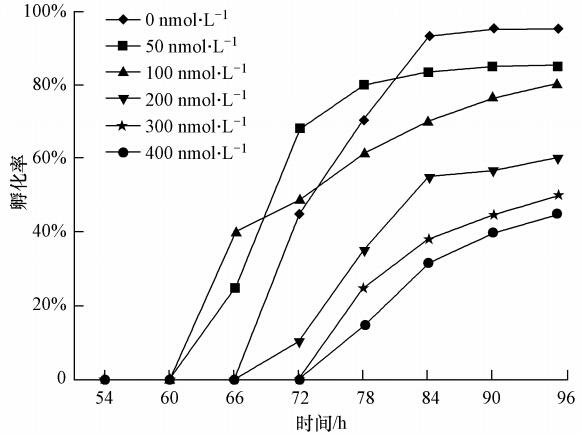 |
| 图 3 CdSe/ZnS QDs 对稀有鮈鲫胚胎 96 hpf 孵化率的影响 Fig. 3 Effects of CdSe/ZnS QDs on hatching success of rare minnow embryos at 96 h |
CdSe/ZnS QDs对稀有鮈鲫胚胎的影响还体现在仔鱼体长(图 4)上.在QDs 暴露至96 hpf 时,随实验组浓度的增加,除 50 nmol · L-1浓度组的仔鱼体长与空白对照组无显著性差异外,其他QDs 浓度组的仔鱼体长较空白对照组均极显著性的降低(p<0.01).
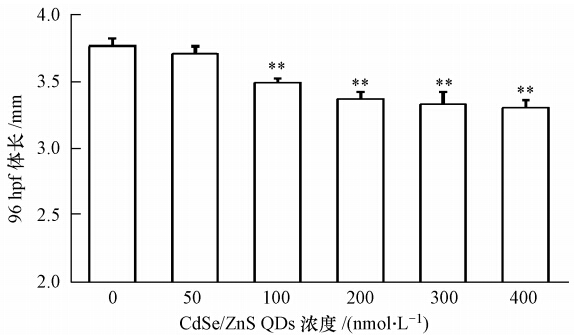 |
| 图 4 CdSe/ZnS QDs对稀有鮈鲫 96 hpf 仔鱼体长的影响 (注: **表示与空白对照组相比存在极显著差异(p<0.01)) Fig. 4 Effect of CdSe/ZnS QDs on body length of rare minnow larva at 96hpf |
CdSe/ZnS QDs 暴露对稀有鮈鲫胚胎发育有不同程度的影响,QDs 导致胚胎和孵出仔鱼产生多种毒性效应(图 5e~n).从毒物暴露开始到 12 hpf,Cd2+对照组的胚胎已出现明显的中毒症状,呈现出卵凝集现象.QDs 浓度组中可见QDs 已通过卵膜进入胚胎内(图 5a,b); 空白对照组和50 nmol · L-1 QDs 浓度组胚胎发育无明显异常,但其它 QDs 浓度组胚胎开始出现中毒症状,其中部分胚胎出现卵黄浑浊或自溶现象.36 hpf,QDs 浓度组部分胚胎出现胚体肿大,Cd2+对照组的胚胎此时时已全部死亡.60 hpf,300、400 nmol · L-1浓度组胚胎发育明显较空白对照组缓慢.暴露至 72 hpf 时 QDs 主要集中在孵出 仔鱼的头部及心脏周围(图 5c,d).胚胎发育至78 hpf 时,200、300和400 nmol · L-1浓度组孵出仔鱼体长普遍较空白对照组短,且出现不同程度上的畸形,主要表现为心包、卵黄囊水肿、脊柱弯曲、尾部弯曲等现象.96 hpf,实验组未出膜的胚胎大多数在膜内死亡,已孵出的仔鱼行动能力较弱,体长明显缩短,畸形加重,有些胚胎还出现多种畸形并存现象.随 QDs 暴露时间的增加,胚胎畸形率和死亡率也升高.
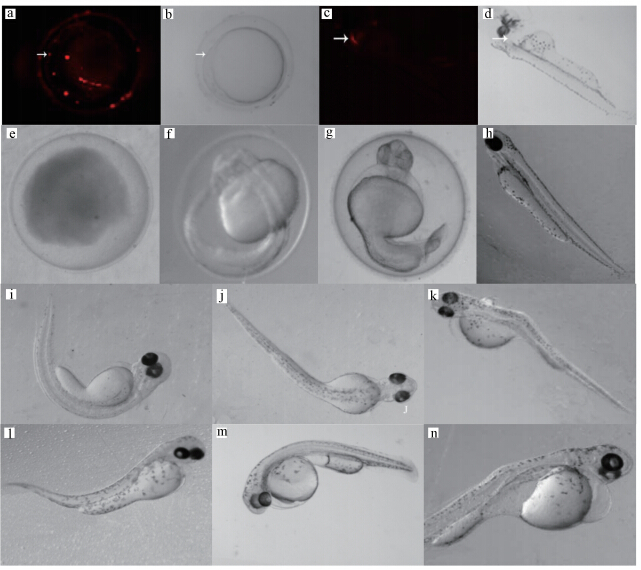 |
| 图 5 CdSe/ZnS QDs 对稀有鮈鲫畸胚胎/仔鱼的致死及致畸效应(a、b: 暴露至12hpf QDs 已进入胚胎内(箭头示同一位置); c、d:暴露至72 hpf时 QDs 在孵出仔鱼体内的 分布(箭头示同一位置);e: 卵凝集;f: 36 hpf 正常胚胎;g:胚体畸形;h:96 hpf 正常仔鱼;i、j:脊柱弯曲;k: 卵黄囊肿及脊柱波浪形弯曲;l:尾部弯曲;m:卵黄囊肿及体长缩短;n:心包水肿及卵黄囊肿) Fig. 5 Effects of exposure to CdSe/ZnS QDs in developing rare minnow embryos/larva |
对96 hpf 稀有鮈鲫初孵仔鱼的抗氧化酶测定显示,50和100 nmol · L-1QDs浓度组 SOD 活力较空白对照组有一定程度的升高(图 6),但无显著性差异(p﹥0.05).从200 nmol · L-1 QDs浓度组开始,SOD 活力明显下降,300 、400 nmol · L-1 QDs浓度组仔鱼的SOD 活力较空白对照组极显著降低(p<0.01).稀有鮈鲫仔鱼的 MDA 含量随QDs浓度升高而升高,50 nmol · L-1浓度组与空白对照组无明显差异(p﹥0.05),100、200 nmol · L-1浓度组MDA 含量均显著高于空白对照组(p<0.05),300、400 nmol · L-1较空白对照组极显著的升高(p<0.01).
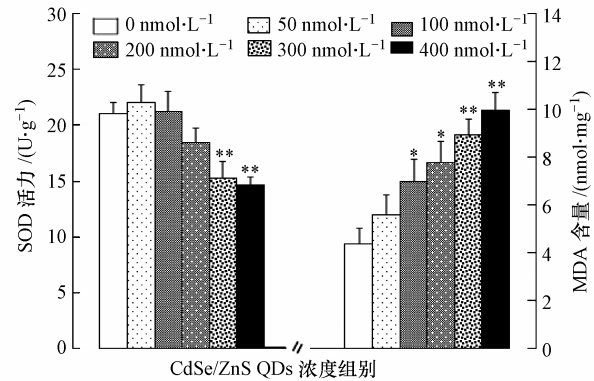 |
| 图 6 CdSe/ZnS QDs 对 96 hpf 稀有鮈鲫仔鱼 SOD 活性和MDA 含量的影响 (注: * 表示与空白对照组有显著性差异(plt;0.05),**表示与空白对照组相比存在极显著差异(p<0.01)) Fig. 6 Effects of CdSe/ZnS QDs on SOD activities and MDA contents of rare minnow larva |
有研究表明,毒物会导致胚胎发育阻滞和神经管缺损,使其体长缩短和尾部畸变,从而影响早期器官的形成(Oberemm,2000).化学物质诱导胚胎自主运动频率、心率、孵化时间和孵化率的变化也可作为胚胎发育缺陷的表现(Milan et al., 2003;朱琳和史淑洁,2002).Yamagami(1981)指出,胚胎畸形和死亡主要是影响胚胎孵化酶、渗透功能和生物物理学等因素所致.胚胎的孵化是由于孵化酶(包括低绒毛膜酶和高绒毛膜酶)作用,加上胚体的扭动,使卵膜破裂而完成,并且孵化酶的水平会影响到鱼类胚胎的孵化率(De et al., 1999;谢广云等,2013).本研究显示,50 nmol · L-1浓度组的自主运动频率较空白对照组有一定程度上的升高,然而其他染毒组胚胎随QDs 浓度增加,自主运动频率明显低于空白对照组;空白对照组胚胎最早出膜时间是 72 hpf,50、100 nmol · L-1浓度组比空白对照组提前了6 h,而 300、400 nmol · L-1浓度组却比空白对照组延迟了6 h.说明较低浓度QDs促使稀有鮈鲫胚胎提前孵化,高浓度(300、400 nmol · L-1)却延迟其出膜时间.这说明低剂量的QDs暴露对稀有鮈鲫胚胎产生了兴奋效应,使胚胎自主运动频率升高,提前出膜.各 QDs浓度组胚胎的96 hpf的孵化率(存活率)均低于空白对照组,这说明低剂量的QDs已经对孵化酶产生了影响,降低了胚胎的孵化酶水平,且浓度越大影响越大.此外,各QDs浓度组中胚胎的心率较空白对照组显著降低,400 nmol · L-1浓度组还出现心律不齐的症状,表明CdSe/ZnS QDs 暴露可能影响了稀有鮈鲫心脏的正常发育.
QDs 的毒性主要与其粒径的大小和核心 Cd2+的释放有关,对鱼类的胚胎发育有着明显的毒理学剂量效应,并可导致胚胎产生各种畸形现象(Lovric et al., 2005;Kirchner et al., 2005;Derfus et al., 2004;King-Heiden et al., 2009).本研究发现,CdSe/ZnS QDs暴露至12 hpf 时,可观察到QDs 已进入稀有鮈鲫胚胎内,从而导致胚胎自主运动频率改变、内心率减缓,体长缩短,以及心包、卵黄囊水肿、脊椎弯曲等多种毒性效应,尤其是畸形率和死亡率显著升高.本课题组亦研究了Cd2+暴露对稀有鮈鲫胚胎的发育毒性,发现Cd2+对稀有鮈鲫胚胎有着明显的毒性效应,可导致初孵仔鱼体长缩短,心率减缓,其72 hpf LC50 为0.387 mg · L-1,远低于本实验Cd2+对照组的浓度(2 mg · L-1).姜礼燔和曹萃禾(1984)指出染毒后的鱼体畸形是由于表皮细胞受到压迫而导致肌纤维排列不整齐所致;也有学者发现镉在一定程度上抑制了钙进入鱼体,导致鱼体发育阻滞.本研究中稀有鮈鲫的畸形主要表现为体长缩短和心包、卵黄囊水肿以及脊柱弯曲等现象,可能是由于部分CdSe/ZnS QDs 降解,释放的Cd2+抑制了钙进入鱼体,从而导致胚体畸形.
QDs的毒性可能源于两方面的原因:由于CdSe/ZnS QDs 粒径小(8~12 nm),较易通过卵膜渗透进入胚胎,影响了孵化酶、渗透功能和生物物理学等一方面或多方面的正常功能,从而导致胚胎畸形或死亡;并可能部分降解释放出 Cd2+,释放出的Cd2+对胚体造成了一定程度的伤害.
4.2 CdSe/ZnS QDs 对稀有鮈鲫的氧化应激作用无论是机体细胞还是胚胎细胞,在生命代谢过程都会产生活性氧(ROS).生物体在长期进化过程中,自身已形成了防御过氧化损害的系统,在胚胎早期发育过程中,以 SOD 为代表的酶性抗氧化系统就开始逐步建立,以维持胚胎组织细胞中的正常活性氧浓度,确保胚胎正常发育(Mohamed et al., 2004;黄勇和廖彪,2008).毒物在体内导致氧化还原反应时,机体会产生大量ROS,而 SOD 在 ROS 的转化中扮演着重要的角色.MDA是目前最能反映机体氧化损伤程度的指标之一,MDA 含量的变化可反映出机体内脂质过氧化程度,间接反映出细胞损伤程度.田文静等(2010)研究发现纳米 ZnO 引起斑马鱼胚胎SOD 活性降低和MDA 含量增加.本研究显示,稀有鮈鲫体内 MDA含量与QDs浓度呈正相关,随 QDs 浓度的增加,MDA 含量也显著增加;300和400 nmol · L-1QDs暴露显著降低了稀有鮈鲫胚胎 SOD 活性.这说明CdSe/ZnS QDs 暴露导致了稀有鮈鲫机体 O· -2增多,体内脂质过氧化反应加强,致使SOD大量消耗,机体受到损伤,引起了生理机能的改变.
5 结论(Conclusions)1)CdSe/ZnS QDs 对稀有鮈鲫胚胎发育有显著的影响,72 hpf LC50为 319.629 nmol · L-1,96 hpf EC50为 203.312 nmol·L-1.CdSe/ZnS QDs引起了稀有鮈鲫胚胎的自主运动频率改变、内心率减缓、体长缩短以及心包、卵黄囊水肿、脊柱弯曲和尾部弯曲等毒性效应,改变胚胎孵化出膜的时间,并导致胚胎孵化率降低.
2)CdSe/ZnS QDs可使稀有鮈鲫胚胎脂质过氧化产物 MDA 含量增加,最终导致机体抗氧化系统失衡进而遭受严重的氧化损伤.
3)CdSe/ZnS QDs 对稀有鮈鲫胚胎发育具有致畸、致死作用,而氧化应激可能是其引起胚胎致畸、致死的重要机制之一.
| [1] | Alivisatos A P. 1996. Semiconductor clusters, nanocrystals, and quantum dots[J]. Science, 271(5251): 933-937 |
| [2] | Ballou B, Lagerholm B C, Ernst L A, et al. 2004. Noninvasive imaging of quantum dots in mice[J]. Bioconjugate Chem, 15(1):79-86 |
| [3] | Bedaiwy M A, Falcone T, Mohamed M S, et al. 2004. Differential growth of human embryos in vitro: Role of reactive oxygen species[J]. Fertility and Sterility, 82(3): 593-600 |
| [4] | Brant J, Lecoanet H, Wiesner M R. 2005. Aggregation and deposition characteristics of fullerene nanoparticles in aqueous systems[J]. Journal of Nanoparticle Research, 7(4/5): 545-553 |
| [5] | 常剑波, 王剑伟, 曹文宣. 1995. 稀有鮈鲫胚胎发育研究[J]. 水生生物学报, 19(2): 97-103 |
| [6] | Chen Y F, Rosenzweig Z. 2002. Luminescent CdS quantum dots as selective ion probes[J]. Analytical Chemistry, 74(19): 5132-5138 |
| [7] | De Gaspar I, Blanquez M J, Fraile B, et al. 1999. The hatching gland cells of trout embryos: characterisation of N-and O-linked oligosaccharides[J]. Journal of Anatomy, 194(1): 109-118 |
| [8] | Derfus A M, Chan W C W, Bhatia S N. 2004. Probing the cytotoxicity of semiconductor quantum dots[J]. Nano Letters, 4(1): 11-18 |
| [9] | 黄凯, 林匡飞, 张卫, 等. 2011. 水溶性CdTe量子点对斑马鱼胚胎发育的影响[J]. 环境科学学报, 31(4): 854-859 |
| [10] | 黄勇, 廖彪. 2008. 超氧化物歧化酶在斑马鱼早期胚胎中的表达特点[J]. 陕西理工学院学报 (自然科学版), 24(3): 91-94 |
| [11] | 姜礼燔, 曹萃禾. 1984. 热污染对草鱼、鲍鱼胚胎发育的影响[J]. 中国环境科学, 4(6): 40-45 |
| [12] | King-Heiden T C, Wiecinski P N, Mangham A N, et al. 2009. Quantum dot nanotoxicity assessment using the zebrafish embryo[J]. Environmental Science & Technology, 43(5): 1605-1611 |
| [13] | Kirchner C, Liedl T, Kudera S, et al. 2005. Cytotoxicity of colloidal CdSe and CdSe/ZnS nanoparticles[J]. Nano Letters, 5(2): 331-338 |
| [14] | Lacoste T D, Michalet X, Pinaud F, et al. 2000. Ultrahigh-resolution multicolor colocalization of single fluorescent probes[J]. Proceedings of the National Academy Sciences of the United States of America, 97(17): 9461-9466 |
| [15] | Liang J G, Huang S, Zeng D Y, et al. 2006. CdSe quantum dots as luminescent probes for spironolactone determination[J]. Talanta, 69(1): 126-130 |
| [16] | Liao Q G, Li Y F, Huang C Z. 2007. A light scattering and fluorescence emission coupled ratiometry using the interaction of functional CdS quantum dots with aminoglycoside antibiotics as a model system[J]. Talanta, 71(2): 567-572 |
| [17] | Lovric J, Bazzi H S, Cuie Y, et al. 2005. Differences in subcellular distribution and toxicity of green and red emitting CdTe quantum dots[J]. Journal of Molecular Medicine, 83(5): 377-385 |
| [18] | Milan D J, Peterson T A, Ruskin J N, et al. 2003. Drugs that induce repolarization abnormalities cause bradycardia in zebrafish[J]. Circulation, 107(10): 1355-1358 |
| [19] | Oberemm A. 2000. The use of a refined zebrafish embryo bioassay for the assessment of aquatic toxicity[J]. Laboratory Animals, 29(7): 32-40 |
| [20] | Tanke H J, Dirks R W, Raap T. 2005. Fish and immunocytochemistry: towards visualising single target molecules in living cells[J]. Current Opinion in Biotechnology, 16(1): 49-54 |
| [21] | 田文静, 白伟, 赵春禄, 等. 2010. 纳米ZnO对斑马鱼胚胎抗氧化酶系统的影响[J]. 中国环境科学, 30(5): 705-709 |
| [22] | 谢广云, 杜庆成, 郑敏, 等. 2013. 碲化镉量子点对小鼠肝脏的氧化损伤作用研究[J]. 卫生研究, 42(1): 39-43 |
| [23] | Yamagami K. 1981. Mechanisms of hatching in fish: secretion of hatching enzyme and enzymatic choriolysis[J]. American Zoologist, 21(2): 459-471 |
| [24] | 朱琳, 史淑洁. 2002. 斑马鱼胚胎发育技术在毒性评价中的应用[J]. 应用生态学报, 13(2): 252-254 |
 2014, Vol. 34
2014, Vol. 34


