2. 南京理工大学化工学院, 南京 210094
2. School of Chemical Engineering, Nanjing University of Science and Technology, Nanjing 210094
二氧化硫(SO2)是目前危害仅次于可吸入颗粒物的主要大气污染物,但它同时也是一种资源.氨法脱硫以化学反应活性较高的氨(NH3)为脱硫剂吸收烟气中的SO2,系统动力消耗低,在脱除SO2的同时,还能实现硫资源的回收,且无废水和废渣的排放,成为缓解这一矛盾的有效途径,发展前景良好(He et al., 2003;贾勇等,2009;颜金培等,2011;Jia et al., 2011).氨法脱硫吸收生成的(NH4)2SO3和NH4HSO3稳定性较差,在空气中受热容易分解,直接利用价值不大,工程中往往将其氧化成稳定的(NH4)2SO4并加以回收,涉及的主要反应如下(Long et al., 2006):

如何高效、低能耗地将S(IV)氧化成为S(VI)是实现氨法脱硫稳定、经济运行的基础,并由此吸引了众多研究者的关注.Mishra等(1975)研究发现,亚硫酸铵的氧化速率对亚硫酸根浓度呈2/3级反应,对钴离子浓度呈0.5级反应,对氧浓度呈0级反应;Neelakantan等(1980)在搅拌反应器中,在温度为30 ℃、亚硫酸铵浓度为0.045~0.45 mol · L-1的条件下研究了亚硫酸铵的氧化过程,结果表明,氧化速率对亚硫酸根浓度呈2级反应,对氧浓度呈1级反应;Ahmad等(1987)研究发现,亚硫酸铵的氧化速率对氧浓度呈1级反应,在亚硫酸根浓度高于临界浓度时对其呈0级反应,在亚硫酸根浓度低于临界浓度时对其呈2级反应;Gŭrkan等(1992)将N2和O2的混合气体通入搅拌反应器内溶液的上方,让O2扩散进入溶液与亚硫酸铵发生氧化反应,研究发现,亚硫酸铵的氧化速率取决于氧和亚硫酸根的浓度比;Zhou等(2000)建立了与Gŭrkan等(1992)相似的实验装置,对高浓度亚硫酸铵的氧化动力学进行了实验,结果表明,亚硫酸铵的氧化速率对氧浓度呈1级反应,在亚硫酸根浓度低于临界浓度时对其呈-1级反应,在亚硫酸根浓度高于临界浓度时对其呈0.2级反应;Zhao等(2005;2007)建立单气泡反应装置对亚硫酸铵的氧化过程进行了实验研究,结果显示,亚硫酸铵的氧化速率在亚硫酸根浓度低于临界浓度时对其呈1级反应,在亚硫酸根浓度高于临界浓度时对其呈0级反应,亚硫酸铵的氧化速率随溶液pH值的增加而增大,当pH值在6~9时,pH值对氧化速率的影响呈线性规律.
尽管研究者们在亚硫酸铵氧化方面取得了一些很有科学意义的研究成果,但由于SO2-3和HSO-3的氧化速率不能分别单独测得,以往研究中未对氨法脱硫吸收液中中占S(IV)多数的HSO-3的氧化进行区分,另外,实验中采用酸或碱调节溶液的pH值(Gŭrkan等(1992)控制pH值范围为7.0~8.0,Zhou等(2000)控制pH范围为5.0~8.0,Zhao等(2005;2007)控制pH值范围为5.0~10.0),忽略了离子强度变化的影响,且SO2-3浓度和pH值与实际情况差别较大,因而氨法脱硫S(IV)的氧化规律并未得到合理的诠释.基于此,本文结合氨法脱硫反应原理,采用初始速率法对氨法脱硫S(IV)氧化动力学进行实验研究,并建立S(IV)氧化动力学模型.
2 实验(Experiment) 2.1 实验流程建立如图 1所示的实验装置,氧化槽内径10.8 cm,高度19 cm,近似将其看作全混鼓泡反应器.称取一定量的(NH4)2SO3和(NH4)2SO4于氧化槽内,用实验温度下的蒸馏水配成500 mL的溶液,再将氧化槽置于恒温水浴中并通入SO2调节pH值到预设值,以避免酸、碱调节pH值时引起离子强度的变化,最后开启空气压缩机,调节氧化空气量进行S(IV)氧化动力学实验,同时开始计时.
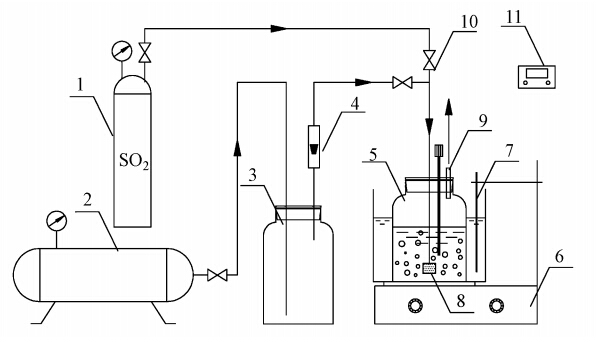 |
| 图 1 S(IV)氧化实验装置(1. SO2钢瓶;2. 空气压缩机;3. 缓冲瓶;4. 转子流量计;5. 鼓泡反应器;6. 恒温水浴;7. 热电偶;8. 曝气头;9. 取样口;10. 阀门;11. pH仪) Fig. 1 Experimental apparatus of oxidation of total sulfite |
结合氨法烟气脱硫工艺的特点,实验过程中控制溶液的pH值范围为4.5~6.5,溶液中存在如下离子平衡(He et al., 2003;Pisu et al., 2004):

在氨法脱硫控制的pH值范围内,吸收液中游离SO2的量可忽略不计(肖文德等,2001),溶液中的S(IV)主要是H2SO3、HSO-3和SO2-3,对应的分布系数δ0、δ1和δ2由式(9)~(11)可分别表述为(郝吉明等,2001):
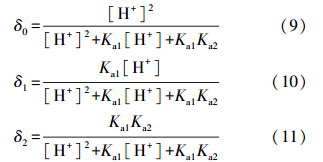
50 ℃时不同形式S(IV)的分布系数与pH值之间的关系如图 2所示.由式(9)~(11)和图 2可知,在pH值4.5~6.5的范围内,溶液中的S(IV)以SO2-3和HSO-3为主,H2SO3的浓度几乎为零,可忽略不计.S(IV)的浓度可由碘量滴定法(GB1576—2001)来测定,SO2-3与HSO-3的浓度比是pH值的单值函数.基于离子平衡关系式,SO2-3和HSO-3的浓度可按照分布系数计算得出.另外,当pH为4.5~6.5时,HSO-3的浓度分布系数远高于SO2-3,实验过程中控制SO2-3的初始浓度范围为4.4×10-3~2.6×10-2 mol · L-1.SO2-4的浓度由DIONEX ICS-90型离子色谱进行测定.由反应式(1)和(2)可知,任一时刻S(IV)的氧化速率(r(IV),mol · L-1 · min-1)和溶液中SO2-4浓度(CSO2-4,mol · L-1)的变化速率是一致的(r(IV)=dCSO2-4/dt),因而S(IV)的氧化速率可根据初始速率法计算(Fogler,2005).
 |
| 图 2 不同形式S(IV)的分布系数与pH值的关系(T=323.15 K) Fig. 2 Distribution coefficient of total sulfite in different forms |
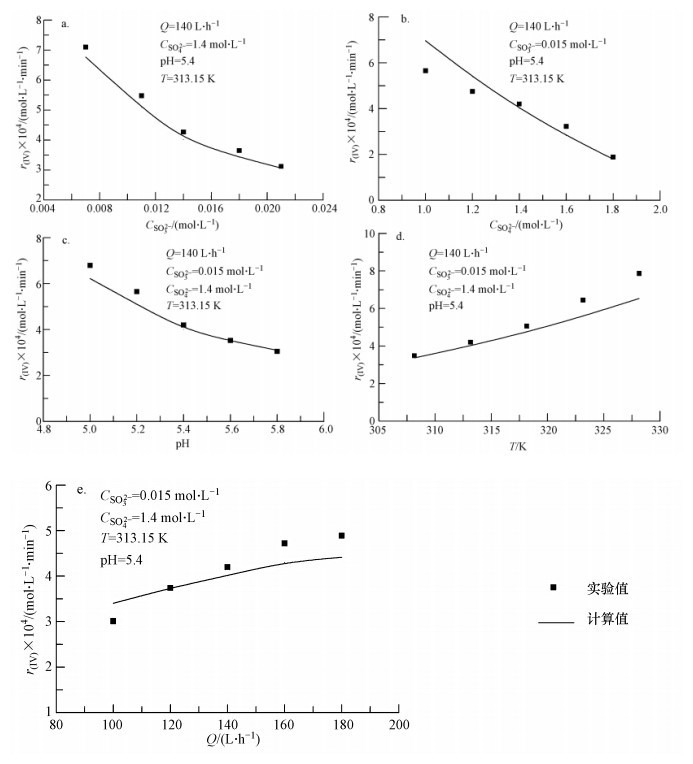
控制氧化槽溶液中SO2-4浓度为1 mol · L-1,pH=5.5,温度为313.15 K,氧化空气量为100 L · h-1,实验考察了SO2-3初始浓度(4.4×10-3~2.6×10-2mol · L-1)对S(IV)的氧化速率的影响.结果表明,S(IV)的氧化速率对SO2-3浓度的反应级数为-0.5.这与Neelakantan等(1980)研究得到的结果不一致,原因可能是Neelakantan等在研究过程中控制实验条件不同,SO2-3的浓度远高于工程实际,且没有对HSO-3的氧化进行区分.
3.1.2 SO2-4初始浓度的影响控制氧化槽溶液中SO2-3浓度为0.01 mol · L-1,pH=5.5,温度为313.15 K,氧化空气量为100 L · h-1,实验考察了SO2-4初始浓度(0.4~2.0 mol · L-1)对S(IV)的氧化速率的影响.结果表明,SO2-4对S(IV)的氧化起阻碍作用,S(IV)的氧化速率随SO2-4浓度的变化关系可表述为r(IV)=0.00121exp(-0.89CSO2-4),这与其他学者研究得到的结论相似(Gŭrkan et al., 1992; Zhou et al., 2000).溶液中的离子强度随SO2-4浓度的增大而增强,使得O2的溶解度系数下降,阻碍了气相中的O2溶解进入液相,因而S(IV)的氧化速率随SO2-4浓度的升高而下降.
3.1.3 初始pH值的影响pH值是氨法脱硫工艺中的一个重要工艺参数,影响溶液中+4价硫(SO2-3和HSO-3)的浓度比.控制氧化槽中SO2-3浓度为0.01 mol · L-1,SO2-4浓度为1 mol · L-1,温度为313.15 K,氧化空气量为100 L · h-1,实验考察了初始pH 值(4.5~6.5)对S(IV)氧化速率的影响.结果表明,S(IV)的氧化速率随pH值的升高而迅速下降,S(IV)的氧化速率与pH值的变化关系近似为r(IV)=10-0.39pH-1.14,这与Gerbec等(1995)得到的结论相类似.由式(7)~(9)和图 2可知,SO2-3和HSO-3的浓度比随pH值的升高而增大,这表明S(IV)中的HSO-3较SO2-3更容易被氧化.
3.1.4 温度的影响控制氧化槽中SO2-3浓度为0.01 mol · L-1,SO2-4浓度为1 mol · L-1,pH=5.5,氧化空气量为100 L · h-1,实验考察了温度(303.15~333.15 K)对S(IV)氧化速率的影响.结果表明,S(IV)的氧化速率随温度的升高而增大,这是因为温度越高,S(IV)氧化反应的速率也随之增大.S(IV)热稳定性实验结果显示,当温度在333.15 K以下升高时,溶液中S(IV)浓度缓慢下降;当温度超过333.15 K后,溶液中S(IV)的浓度随温度升高而迅速减小,同时有刺鼻的气体生成,说明此时亚硫酸根和亚硫酸氢根分解加剧,因而氨法脱硫S(IV)氧化温度控制在333.15 K以下较为合适.利用Arrhenius公式计算得到S(IV)氧化反应的活化能为28.0 kJ · mol-1,这与文献中报导的亚硫酸铵氧化活化能32.7 kJ · mol-1(Zhou et al., 2000)和18.8 kJ · mol-1(Gŭrkan et al., 1992)存在一定的差别.原因可能是以往研究中未对SO2-3和HSO-3的氧化进行区分,另外,Gŭrkan等(1992)在研究亚硫酸铵氧化时加入了催化剂.
3.1.5 氧化空气量的影响氧化空气量与溶液中的溶解氧密切相关,直接影响S(IV)的氧化.控制氧化槽中SO2-3浓度为0.01 mol · L-1,SO2-4浓度为1 mol · L-1,pH=5.5,温度为313.15 K,实验考察了氧化空气量(40~200 L · h-1)对S(IV)氧化速率的影响.结果表明,S(IV)的氧化速率随着氧化空气量的增加而增大,当氧化空气量在150 L · h-1以下增加时,S(IV)的氧化速率随空气量的增加增长迅速;当氧化空气量高于150 L · h-1,S(IV)的氧化速率随空气量的升高增加缓慢,这与其他学者的研究结果相类似(Zhao et al., 2005,2007; Wang et al., 2008).对于本实验系统,这可能是因为当空气量在150 L · h-1以下增长时,气泡数量增加明显,导致气液间的接触面积增大,有更多的氧从气相溶解进入液相,因此,S(IV)的氧化速率随着空气量的增加而增大.当空气量增大到150 L · h-1以上时,气泡之间发生碰撞凝并的现象加剧,气液间的接触面积随空气量的继续增加变化不大,因而S(IV)的氧化速率随着空气量的继续增加逐渐趋于稳定.
3.2 S(IV)氧化动力学模型 3.2.1 基本原理溶液中S(IV)的氧化速率r(IV)可表示成为反应速率常数k和反应涉及的各组分浓度函数fn(Cj)的乘积(Fogler,2005):
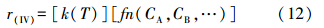
其中,反应速率常数k(T)可由Arrhenius公式进行关联:
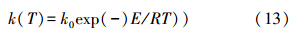
对式(13)两边取对数可以得到:
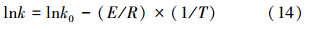
反应速率常数k并非真正的常数,它的值与温度有关,式(14)是lnk对1/T的直线方程.因此,在不同温度条件下进行实验,通过式(14)可以计算得到S(IV)氧化的反应活化能E和频率因子k0.fn(Cj)由实验进行确定.
3.2.2 模型的建立根据前人的研究成果(Neelakantan et al., 1980; Ahmad et al., 1987; Gŭrkan et al., 1992),认为S(IV)的氧化速率对氧浓度的反应级数为1,结合上述氧化动力学实验,建立S(IV)氧化动力学方程:

从化学反应过程来看,S(IV)的氧化实质上是空气中的O2从气相传递进入液相并与S(IV)发生反应的过程.在稳态条件下,O2的传质速率和S(IV)的氧化速率相等,根据双膜理论可以得到(Thomas et al., 2003):
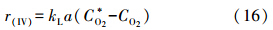
联立式(15)、(16)可得:
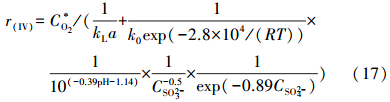
式中,CSO2-3为亚硫酸根浓度(mol · L-1),CO2为溶液中氧浓度(mol · L-1),C*O2为界面氧浓度(mol · L-1),kL为液相传质系数(m · s-1).
根据Henry定律,界面氧的平衡浓度可以由下式进行计算(Thomas et al., 2003;Ueyama et al., 1982; 朱炳辰,2012):

其中:
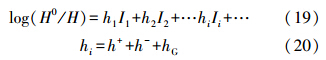
式中,H为溶液中SO2溶解度系数(mol · m-3 · Pa-1),p*O2为气液界面处氧的平衡分压(Pa),H0为水中SO2溶解度系数(mol · m-3 · Pa-1),h为溶解度降低系数(m3 · kion-1),即比例系数,它是电解质正、负离子对被溶解的气体所引起的数值,I是离子强度(kion · m-3).
根据Aktia等(1974)和伍钦等(2005)的研究成果,气-液间的传质系数可由下式进行计算:
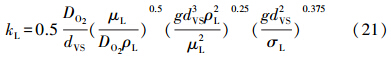

鼓泡反应器的气-液传质比表面积α(m2 · m-3)可由气含率和气泡直径按下式来确定(Ueyama et al., 2005;1982; Aktia et al., 1974):

鼓泡反应器的气含率εG可由式(24)进行关联(Aktia et al., 1974),其中,vL为运动粘度(m2 · s-1).
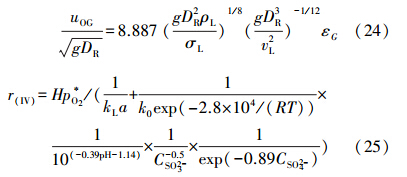
利用建立的数学模型,对氧化槽中S(IV)的氧化过程进行数值模拟,考察了SO2-3浓度、 SO2-4浓度、温度、氧化空气量和pH值对S(IV)氧化速率的影响,模型参数如表 1和表 2所示.
| 表1 模型参数(R,σL,μL和DR)(刘光启等,2002) Table.1 Parameters in model(R,σL,μL and DR) |
| 表2 模型参数(h+,h-和hG)(Ueyama et al., 1982) Table.2 Parameters in model(h+,h- and hG) |
将不同条件下的模型计算值和实验数据进行了对比,结果如图 3所示.其中,图 3a~c分别为SO2-3浓度、SO2-4浓度和pH值对S(IV)氧化速率的影响,由图可见,模型计算值和实验数据吻合较好.
 |
| 图 3 不同因素对氧化速率的影响(a.SO2-3浓度,b. SO2-4浓度,c. pH,d. 温度,e. 空气流量) Fig. 3 Effect of different factors on oxidation rate(a. sulfite concentration,b. sulfate concentration,c. pH,d.temperature,e. air flow) |
图 3d表明了S(IV)的氧化速率随温度的变化情况,从图中可以看出,模型计算值和实验数据随温度的变化趋势一致,S(IV)的氧化速率随着温度的升高而增大.值得注意的是,当温度在323.15 K以下时,模型计算值和实验数据能够较好地吻合,当温度高于323.5 K时,实验数据较模型计算值随温度的升高增加更为迅速.这是因为当温度高于323.15 K时,溶液中S(IV)的受热分解随温度的升高而加剧,导致溶液中参与反应的S(IV)浓度有所降低,而模型中很难对S(IV)的受热分解进行考虑.氨法脱硫实际工程中,吸收塔内的温度一般在323.15 K左右.图 3d中的模型计算值和实验数据之间的相对误差在323.15 K时为13.4%,能够满足工程上的要求.因此,利用该模型计算氨法脱硫过程中温度对S(IV)氧化的影响是可行的.
图 3e表明了S(IV)的氧化速率随氧化空气量的变化情况,从图中可以看出,模型计算值和实验数据随空气量的变化趋势基本一致,氧化速率均随着氧化空气量的增加而增大.另外,从图 3e中还可以看出,随着氧化空气量的增加,S(IV)氧化速率的实验值较模型计算值增加更为迅速.原因可能是氧化槽内气泡的生成过程比较复杂,气泡直径的分布较难用数学模型来进行精确表达,为了简化计算,模型中采用Sauter平均直径进行计算,因而模型计算值与实验值存在一定的误差.有关氧化槽中气泡直径的分布及气-液间的接触面积还有待进一步的研究.
4 结论(Conclusions)1)结合氨法脱硫工艺特点,在吸收生成的S(IV)氧化动力学研究中采用SO2调节溶液的pH值,消除了文献中采用酸或碱调节溶液pH值造成离子强度变化带来的误差.
2)调节溶液中SO2-3浓度、SO2-4浓度、pH值、温度和氧化空气量等条件,对S(IV)氧化动力学进行了研究,结果表明:S(IV)的氧化速率对SO2-3浓度呈-0.5级反应;S(IV)的氧化速率与SO2-4浓度之间的关系为 r(IV)=0.00121exp(-0.89CSO2-4) ;HSO-3和SO2-3的浓度比随pH值的降低而增大,HSO-3较SO2-3更容易被氧化,保持较低的pH值对S(IV)的氧化有利;S(IV)氧化速率随温度的升高而增大,当温度高于333.15 K时S(IV)分解加剧,计算得到S(IV)氧化的活化能约为28.0 kJ · mol-1;S(IV)的氧化速率随氧化空气量的增加而增大,对于本实验系统当氧化空气量达到150 L · h-1后,继续增大氧化空气量S(IV)氧化速率增加缓慢.
3)结合氧化动力学实验,建立数学模型对S(IV)氧化过程进行了数值模拟,并与实验值进行了对比,结果表明,S(IV)氧化速率随SO2-3浓度、SO2-4浓度、pH值和温度变化的模型计算值和实验值能够较好吻合.由于氧化槽内气泡直径不易用数学公式精确表达,S(IV)氧化模型中气泡直径采用Sauter平均直径,S(IV)氧化速率的模型计算值和实验值存在一定的误差,因而该模型中气泡直径的分布及气-液间的接触面积还有待进一步的研究.
| [1] | Ahmad N, Eroğ lu I, Gŭ rkan T. 1987. Factors affecting the kinetics of the heterogeneous oxidation of ammonium sulfite[J]. The Canadian Journal of Chemical Engineering, 65(1): 50-55 |
| [2] | Aktia K, Yoshida F. 1974. Bubble size interfacial area and liquid-phase mass transfer coefficient in bubble columns [J]. Industrial & Engineering Chemistry Process Design, 13(1): 84-91 |
| [3] | Fogler H S. 2005. Elements of Chemical Reaction Engineering(3rd ed)[M]. New Jersey: Prentice Hall International Series in the Physical and Chemical Engineering Science |
| [4] | Gerbec M, Stergarsek A, Kocjancic R. 1995. Simulation model of wet flue gas desulphurization plant[J]. Computer & Chemical Engineering, 19(1): 283-286 |
| [5] | Gŭ rkan T, Nufal A, Eroğ lu I. 1992. Kinetics of the heterogeneous oxidation of ammonium sulfite[J]. Chemical Engineering Science, 47(13/14): 3801-3808 |
| [6] | 郝吉明, 王书肖, 陆永琪. 2001. 燃煤二氧化硫污染控制技术手册[M]. 北京: 化学工业出版社 |
| [7] | He B S, Zheng X Y, Wen Y, et al. 2003. Temperature impact on SO2 removal efficiency by ammonia gas scrubbing[J]. Energy Conversion and Management, 44(13): 2175-2188 |
| [8] | 贾勇, 钟秦, 杜冬冬, 等. 2009. 填料塔氨法脱硫模型研究[J]. 中国电机工程学报, 29(14): 52-57 |
| [9] | Jia Y, Zhong Q, Fan X Y, et al. 2011. Modeling of ammonia-based wet flue gas desulfurization in the spray scrubber[J]. Korean Journal of Chemical Engineering, 28(4): 1058-1064 |
| [10] | 刘光启, 马连湘, 刘杰. 2002. 化学化工物性数据手册(无机卷)[M]. 北京: 化学工业出版社 |
| [11] | Long X L, Li W, Xiao W D, et al. 2006. Novel homogeneous catalyst system for the oxidation of concentrated ammonium sulfite[J]. Journal of Hazardous Materials, 129(1/3): 260-265 |
| [12] | Mishra G C, Srivastava R D. 1975. Kinetics of oxidation of ammonium sulfite by rapid-mixing method[J]. Chemical Engineering Science, 30(11): 1387-1390 |
| [13] | Neelakantan K, Gehlawat J K. 1980. Kinetics of absorption of oxygen in aqueous solutions of ammonium sulfite[J]. Industrial & Engineering Chemistry Fundamentals, 19(1): 36-39 |
| [14] | Pisu M, Cincotti A, Gao G, et al. 2004. Prediction of uncatalysed calcium bisulphate oxidation under operating conditions relevant to wet flue gas desulphurization plants[J]. Chemical Engineering Research and Design, 82(7): 927-932 |
| [15] | Thomas D, Colle S, Vanderschuren J. 2003. Kinetics of SO2 absorption into fairly concentrated sulphuric acid solution containing hydrogen peroxide[J]. Chemical Engineering Science, 42(6): 487-494 |
| [16] | Ueyama K, Hatanka J H. 1982. Mass transfer limitation in fischer-tropsch slurry reactions[J]. Chemical Engineering Science, 37(5/8): 790-791 |
| [17] | Wang L D, Zhao Y. 2008. Kinetics of sulfite oxidation in wet desulfurization with catalyst of organic acid[J]. Chemical Engineering Journal, 136(2/3): 221-226 |
| [18] | 伍钦, 钟理, 邹华生, 等. 2005. 传质与分离工程[M].广州:华南理工大学出版社 |
| [19] | 肖文德, 吴志权. 2001. 二氧化硫脱除与回收[M].北京:化学工业出版社 |
| [20] | 颜金培, 杨林军, 沈湘林. 2011. 氨法脱硫烟气中气溶胶凝结脱除动力学[J].中国电机工程学报, 31(29): 41-47 |
| [21] | Zhao B, Li Y, Tong H L, et al. 2005. Study on the reaction rate of sulfite oxidation with cobalt ion catalyst[J]. Chemical Engineering Science, 60(3): 863-868 |
| [22] | Zhao B, Li Y, Zhang X W, et al. 2007. Mass transfer and kinetics study on the sulfite forced oxidation with manganese ion catalyst[J]. Korean Journal of Chemical Engineering, 24(3): 471-476 |
| [23] | Zhou J H, Li W, Xiao W D. 2000. Kinetics of heterogeneous oxidation of concentrated ammonium sulfite[J]. Chemical Engineering Science, 55(23): 5637-5641 |
| [24] | 朱炳辰. 2012. 化学反应工程 (第5版)[M]. 北京: 化学工业出版社 |
 2014, Vol. 34
2014, Vol. 34


