镉(Cd)是一种广泛传播的重金属污染物,具有较长的半衰期,可通过施磷肥、采矿或者工业生产等所产生.由于其具有高度的水溶性,因此,土壤中的Cd非常容易被植物根系所吸收,经木质部运输到地上部分的叶片和果实中,进而进入食物链,对生态环境和人类健康均造成了严重的威胁(Bernard,2008).即使在低浓度时,Cd对大多数植物都是有毒性的,当叶片中Cd含量大于5~10 μg · g-1时,就会导致植物死亡(Verbruggen et al., 2009).植物Cd中毒主要表现为生长发育迟缓、叶片失绿黄萎、叶绿体超微结构破坏、CO2固定过程中的酶失活、光合作用抑制、花粉萌发和花粉管的生长受阻,以及导致N和S代谢紊乱(Anjum et al., 2008;Gill et al., 2012).此外,Cd过量还会扰乱抗氧化防御系统,引起活性氧(ROS)O- ·2、H2O2和OH- ·等的积累,从而导致氧化胁迫(Sanita et al., 1999).研究发现,植物体已经进化出不同的耐Cd机制,包括与细胞壁结合、植物络合素(PCs)的解毒作用、Cd区域化集中在液泡中,或富集在叶表皮中等(Verbruggen et al., 2009;Gill et al., 2013).其中,由氧化胁迫诱导的抗氧化防御系统发挥着重要作用.
一氧化氮(NO)是植物中的一种多功能信号分子,几乎参与了植物所有的生长发育和对生物、非生物逆境的响应进程(Besson-Bard et al., 2008;Siddiqui et al., 2011).对植物体施加Cd胁迫后,能够激发内源NO的形成(Gill et al., 2013),相反,适度的外源NO预处理可以明显缓解Cd胁迫下植物生理代谢的受阻和生长发育的抑制,并且伴随着剂量效应(Singh et al., 2008;Xiong et al., 2009),这说明NO参与了植物应答Cd胁迫的信号转导(Laspina et al., 2005;Arasimowicz-Jelonek et al., 2011).考虑到NO在植物生理活动中的重要性,另加至今在高等植物基因组中仍未分离到动物中的NO合成酶(NOS)的同源序列,因此,对于植物体中NO的合成机制长期以来一直是植物生物学家探索的目标.目前已明确植物中除了具有类似于动物中的NOS 合成途径(即氧化途径)之外,还具有还原途径.亚硝酸根(NO-2)是还原途径的主要底物,它除了被酶促催化合成NO外,还能非酶促化学合成NO(Yamasaki,2000;Gupta et al., 2011).已知在酸性条件下,NO-2很容易得到质子(H+),被还原成亚硝酸(HNO2).通过一系列的反应,两分子的HNO2会生成NO和NO2,NO2又可以转化成为NO和1/2O2(Yamasaki,2000;Stöhr et al., 2002; Bethke et al., 2004).其中,抗坏血酸(Vc)、谷胱甘肽(GSH)和类胡萝卜素是常用的还原剂.这种来源的NO在植物体内常发生在无氧条件下,尤其是根系的质外体中.
外施NO抵抗Cd胁迫的研究主要用NO的供体硝普钠(SNP)和亚硝基谷胱甘肽(GSNO)等(Singh et al., 2008;Xiong et al., 2009),但这些试剂价格昂贵,限制了其在生产中的应用.虽然在还原剂(Vc、GSH)存在条件下,NO-2可以释放出NO,并且已证明这种化学合成的NO也可以促进种子萌发等生理作用,但其在农作物抵抗非生物逆境中的应用研究还不多见(Stöhr et al., 2002; Bethke et al., 2004).考虑到还原剂存在条件下NO-2来源的NO不仅取材方便,而且价格低廉,具有潜在的生产推广价值.因此,本文以农作物玉米为材料,主要探讨Vc+NaNO2所产生的NO对Cd胁迫下玉米幼苗生长发育的缓解作用,并从ROS代谢、膜脂过氧化、叶绿体色素的稳定性,以及TAST(酸溶性硫醇)、GSH和PCs(络合素)含量的变化等方面揭示可能的生理学机制,为进一步的大田应用奠定理论基础.
2 材料与方法(Materials and methods) 2.1 材料培养及处理方法以“郑单958”玉米为试验材料,种子于2012年4月购自杨凌金诺种业公司.Vc和GSNO均购自Sigma公司,现用现配;NaNO2购自西陇制药公司.
幼苗培养:玉米培养采用水培法,选择饱满且胚完整的种子,用3%H2O2消毒15 min,蒸馏水反复冲洗几次后在蒸馏水中浸泡过夜,使其充分吸胀;然后将种子放在底部铺有湿润滤纸的培养皿中于28 ℃恒温培养箱中发芽,待芽长到2~3 cm(约3~4 d)后,将种子移栽到含有不同浓度Cd的自来水中,置于光照培养间3 d,其中,光照强度为100 μmol · m-2 · s-1,光暗时间为14h/10h,昼夜温度为28℃/20℃,空气相对湿度70%;然后更换到Cd浓度分别为0、500、1000、2000、3000、4000和5000 μmol · L-1 的1/2 Hoagl and 营养液培养中.4 d后对比生长势筛选出合适的Cd处理浓度.
NO溶液的制备:通过添加HCl或者NaOH将蒸馏水pH调整到4.5~6.0之间,随后加入浓度为10 mmol · L-1的Vc,NaNO2分别以0、500、1000、1500、2000、3000、4000和5000 μmol · L-1的浓度加入到溶液中,其反应式为:C6H8O6 + 2NO-2 + 2H+ = C6H6O6 + 2NO + 2H2O(Bethke et al., 2004).将不同浓度的NO与1000 μmol · L-1的Cd同时浇灌于水培溶液中,分别于24 h、48 h、96 h及7 d后开始测定各个指标.
2.2 指标测定方法 2.2.1 幼苗地上部分株高、茎粗和叶面积的测定采用Francis等(1969)的方法进行幼苗地上部分株高、茎粗和叶面积测量,每组数据都测量了8个单独植株(或植株上的叶片),取平均值.实验前后重复3次.
2.2.2 叶绿素含量的测定采用丙酮浸提法,用UV-2450型紫外可见分光光度计检测,分别在波长663、645和470 nm处测定吸光度值.
2.2.3 抗氧化酶活性的测定采用Elavarthi和Martin(2010)的分光光度法测定抗氧化酶如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)的活性.
2.2.4 H2O2、O- ·2含量的测定O- ·2含量的测定根据Zhang等(2007)的方法,即在O- ·2存在时检测XTT的量.H2O2定量分析根据Brennan和Frenkel(1977)的方法,即根据415 nm波长下的吸光度值A415,检测氧化钛复合物浓度,以不加根系样品为对照,用已知浓度H2O2作标准曲线.
2.2.5 MDA含量的测定采用赵生杰等(1994)的方法,即根据532 nm波长下的吸光度值A532,检测TBA-MDA复合物浓度.
2.2.6 TAST的提取和含量的测定称取0.5 g左右的玉米根系,加入0.02 mol · L-1 EDTA溶液5 mL,冰上研磨,12000 g下离心10 min,所得上清即为TAST.取2 mL上清与0.4 mol · L-1 Tris缓冲液(pH=8.2)和0.1 mL 0.01 mol · L-1 DTNB混合,加入3.95 mL甲醇,20 ℃保温10 min,在412 nm下比色.
2.2.7 GSH含量的测定GSH含量测定参照高俊凤(2006)的方法,PCs的含量为TAST含量与GSH含量的差值.
2.3 统计分析结果以3次试验的平均值±标准误表示,这些平均值在α=5%的水平上用DPS软件进行方差分析和新复极差法比较,用Origin软件做图.
3 结果(Results) 3.1 对玉米幼苗敏感的Cd浓度筛选对发芽3~4 d的玉米幼苗施加0~5000 μmol · L-1的Cd胁迫,7 d后比较植株生长情况.如图 1所示,随Cd浓度的增加,植株生长受抑制越严重,具体表现为植株矮小,叶片卷曲、黄化;根部根毛数量急剧减少,颜色发黑,Cd浓度越高颜色越重.以浓度5000 μmol · L-1 Cd处理最为严重,其叶片均为卷曲状,无法正常伸展开,其根部不仅成深黄色且发硬.在本研究的浓度范围内,可逆的浓度阈值为1000 μmol · L-1,即解除胁迫后,玉米幼苗生长发育能够快速恢复(数据未显示),故选择1000 μmol · L-1为后续研究的胁迫浓度.
 |
| 图 1 不同浓度Cd处理对玉米幼苗生长的影响 Fig. 1 Effect of different concentrations of Cd on the growth of maize seedlings |
由图 2可知,10 mmol · L-1 Vc与不同浓度的NaNO2混合对1000 μmol · L-1 Cd胁迫下玉米幼苗的生长具有剂量作用.处理7 d后,伴随NaNO2浓度的不断增大,植株叶片黄化程度减轻,叶片数量有所增加,在2000~3000 μmol · L-1 NaNO2处理中达到最佳生长状态,之后又随NaNO2浓度的增加黄化程度加剧,植株个头矮小,生长状态呈下降趋势.表 1显示了植株地上部分的形态指标株高、茎粗和叶面积都在3000 μmol · L-1 NaNO2处理时呈最大值,对照分别比其减少了41.17%、51.00%和72.99%,都达到了显著差异(p<0.05).
 |
| 图 2 Vc+不同浓度NaNO2处理对1000 μmol · L-1 Cd胁迫7 d后玉米幼苗生长的影响 Fig. 2 Effect of Vc in addition of different concentrations of NaNO2 on the growth of maize seedlings under 1000 μmol · L-1 Cd stress for 7 days |
| 表 1 Vc+不同浓度NaNO2处理对1000 μmol · L-1 Cd胁迫7 d后玉米幼苗形态指标的影响 Table 1 Effect of Vc in addition of different concentrations of NaNO2 on the morphological characteristics of maize seedlings under 1000 μmol · L-1 Cd stress for 7 days |
叶绿素是植物进行光合作用的重要色素,因此,叶绿素含量的多少能够反映植物叶片光合作用的强弱.10 mmol · L-1Vc与不同浓度NaNO2处理对1000 μmol · L-1 Cd胁迫7 d后玉米叶片黄化作用的影响见图 3.同时,本文分别测定了10 mmol · L-1 Vc与0、1000、3000、5000 μmol · L-1 NaNO2混合处理3、5和7 d时,叶片的叶绿素含量(图 4).由图 4可以发现,虽然在处理初期(3 d),对照组和各处理组间的总叶绿素、叶绿素a、叶绿素b和类胡萝卜素含量(以FW计)就产生了明显差异,但差异最显著的是处理后期(7 d).说明当长时间Cd胁迫使对照的叶绿体色素含量显著降低时,Vc+ NaNO2来源的NO能够维持叶绿体色素的相对稳定.这种效应也具有浓度依赖性,其中以3000 μmol · L-1 NaNO2的效果最好.
 |
| 图 3 Vc+不同浓度NaNO2处理对1000 μmol · L-1 Cd胁迫7 d后玉米叶片黄化作用的影响 Fig. 3 Effect of Vc in addition of different concentrations of NaNO2 on the situation of maize leaves yellowing under 1000 μmol · L-1 Cd stress for 7 days |
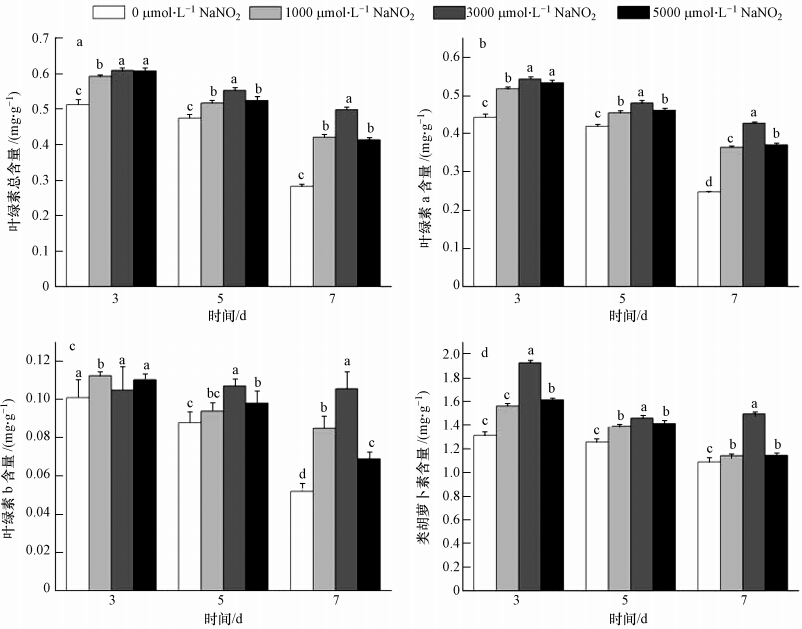 |
| 图 4 Vc+不同浓度NaNO2处理对1000 μmol · L-1 Cd胁迫玉米幼苗叶绿体色素含量的影响 Fig. 4 Effect of Vc in addition of different concentrations of NaNO2 pretreatments on chloroplast pigments content under 1000 μmol · L-1 Cd stress in maize seedlings |
根系是植物吸收水分和营养的主要器官,根系的生长发育直接影响植株地上部分的生长状况.图 5显示,NO能不同程度地缓解Cd胁迫对玉米幼苗根系生长造成的伤害,与对照组相比,10 mmol · L-1 Vc+1000 μmol · L-1 NaNO2既可以促进主根的伸长,又能够促进侧根的发育;NaNO2浓度为3000 μmol · L-1时,侧根发育达到最佳状态,其长度已快接近主根长度,但过高的NaNO2处理浓度又会抑制根的生长和发育.
 |
| 图 5 Vc+不同浓度NaNO2处理对1000 μmol · L-1 Cd胁迫3 d后玉米幼苗根系生长的影响 Fig. 5 Effect of Vc along with different concentrations of NaNO2 on the growth of maize roots that were exposed to 1000 μmol · L-1 Cd for 3 days |
图 6a表明,在1000 μmol · L-1 Cd胁迫24 h内,10 mmol · L-1 Vc+不同浓度NaNO2处理组较对照组SOD活性显著增高,1000、3000和5000 μmol · L-1 NaNO2处理组间相比,3000 μmol · L-1NaNO2处理组显著高于其他2个处理组,1000和5000 μmol · L-1 NaNO2处理组之间没有显著差异,即也具有浓度依赖性;随着处理时间的延长,各处理组的SOD活性均显著下降,但各处理组SOD活性绝对值均高于对照组,尤其在处理96 h后,对照组的SOD活性骤然降低,3个NaNO2浓度的处理组的酶活分别高于对照68.7%、70.0%和50.5%.CAT(图 6b)、APX(图 6c)和GR(图 6d)的活性与SOD活性具有相似的规律.以上结果都说明Vc+NaNO2来源的NO能够增强和优化Cd胁迫下玉米幼苗根系的抗氧化酶的活性.
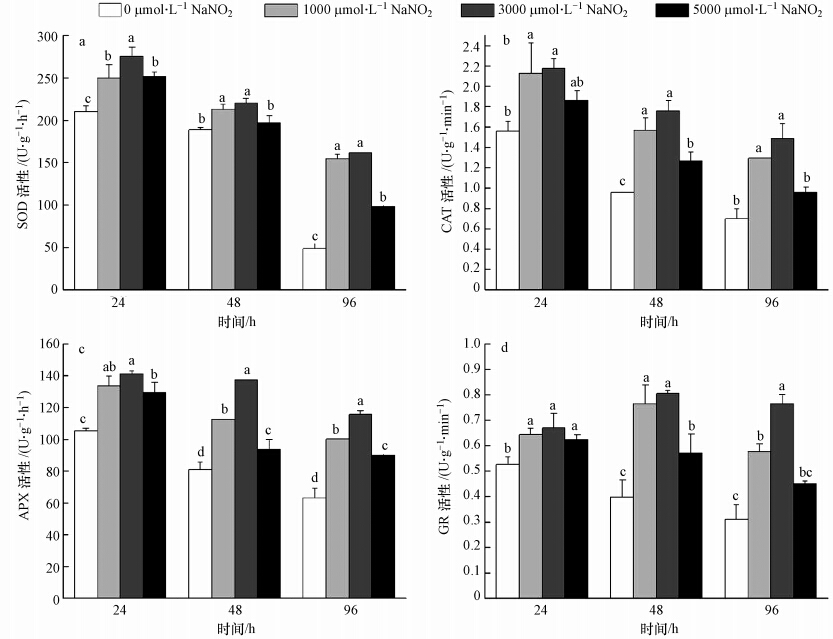 |
| 图 6 Vc+不同浓度NaNO2处理对1000 μmol · L-1 Cd胁迫下玉米幼苗根部抗氧化酶活性的影响 Fig. 6 Effects of Vc in addition of different concentrations of NaNO2 pretreatment on antioxidant enzymes activity of maize seedlings under 1000 μmol · L-1 Cd stress |
如图 7所示,在处理24、48和96 h期间,对照组玉米幼苗根系的H2O2、O- ·2和MDA含量(均以FW计)的变化基本一致,呈上升趋势;而10 mmol · L-1 Vc+不同浓度NaNO2处理组的O- ·2含量在胁迫后期变化平缓,1000和3000 μmol · L-1 NaNO2处理组的O- ·2含量略有下降;H2O2和MDA含量虽有所上升,但仍明显低于对照组.在胁迫96 h后,3000 μmol · L-1 NaNO2处理组较对照组的H2O2、O- ·2和MDA含量分别减少了28.5%、35.8%和37.1%,差异达到显著水平(p<0.05).
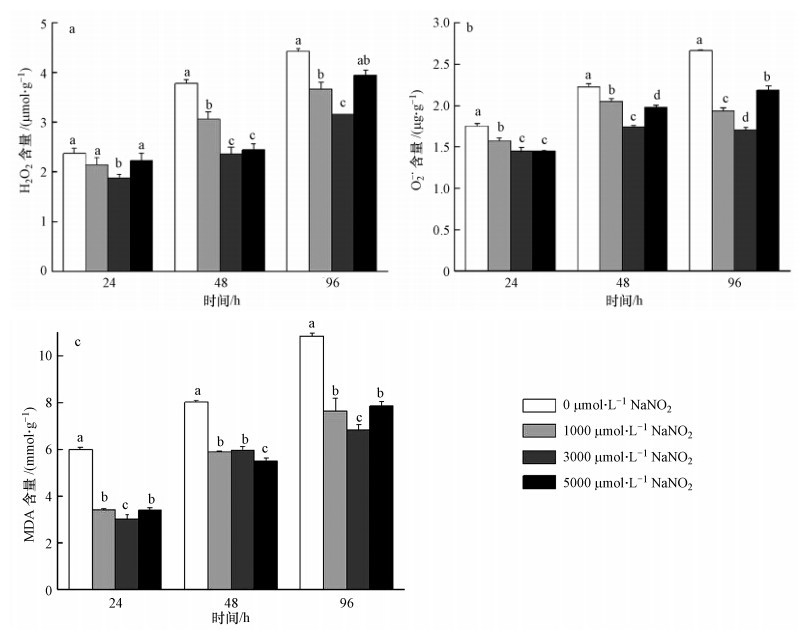 |
| 图 7 Vc+不同浓度NaNO2处理对1000 μmol · L-1 Cd胁迫幼苗根部H2O2、O- ·2和MDA含量的影响 Fig. 7 Effect of Vc in addition of different concentrations of NaNO2 pretreatments on hydrogen peroxide(H2O2)of maize seedlings,superoxide anion(O- ·2)production and malondialdehyde(MDA) |
在本实验中,随着处理时间的延长,各处理组玉米根系的酸溶性硫醇(TAST)和谷胱甘肽(GSH)的含量(均以FW计)均呈稳步上升,在96 h达到最高值,且3000 μmol · L-1 NaNO2处理组的含量均显著高于其他处理组(表 2).所不同的是,TAST含量在胁迫后期上升明显,而GSH含量在胁迫中期就显著上升.对照组的TAST含量在胁迫期间基本不变,GSH含量则呈持续上升的趋势,处理中期时对照组GSH含量仍分别低于10 mmol · L-1 Vc+1000、3000、5000 μmol · L-1 NaNO2处理组64.26%、69.16%和66.20%.络合素(PCs)含量为TAST和GSH之差,在同一处理时间下,各处理组的PCs含量均显著高于对照组的值.说明Vc+NaNO2来源的NO能够显著提高玉米根系络合素的含量,增强植株解除重金属毒害的能力.其中,以10 mmol · L-1 Vc+3000 μmol · L-1 NaNO2处理组的PCs含量最高,其PCs含量分别在胁迫期间比对照组高出了42.31%、30.17%和83.07%.
| 表 2 Vc+不同浓度NaNO2处理对Cd胁迫下玉米根系TAST、GSH和PCs含量的影响 Table 2 Effect of Vc in addition of different concentrations of NaNO2 pretreatment on the content of TAST,GSH and PCs of maize seedlings |
植物对Cd胁迫的抗性牵涉到许多响应进程的整合网络,其中,抗氧化防御能力与Cd抗性成正相关.尽管最近几年在此领域取得了很大进展,但诸如植物Cd响应的具体的信号转导机制和基因表达的调控仍不是很清楚.正因为如此,调节植物不同生理进程(包括保护Cd诱导的毒性)的NO信号分子得到了广泛的关注.大量研究表明(Laspina et al., 2005;Singh et al., 2008;Xiong et al., 2009;Arasimowicz-Jelonek et al., 2011; Zhang et al., 2012),外源NO可以减缓由Cd引起的氧化胁迫.其一,NO自身具有抗氧化剂性质,可以直接清除O- ·2和ONOO-;其二,NO能够激活抗氧化酶,如SOD、CAT、APX和GR等,间接清除ROS,即NO通过调节ROS毒性的水平在细胞保护中发挥着重要的作用,以此来阻止植物受到氧化损伤.本研究发现,化学合成的NO-2来源的NO甚至能够使玉米幼苗避免遭受高达1000 μmol · L-1 Cd毒害,这比Singh等(2008)报道的NO供体SNP所发挥作用的Cd浓度上限300 μmol · L-1还要高几倍.而且我们发现此来源的NO也能显著增加Cd胁迫下玉米幼苗根系的抗氧化酶SOD、CAT、APX和GR的活性,相反降低了H2O2和O- ·2的净含量,减小了膜脂的过氧化伤害,维持了叶绿体色素的稳定,进而缓解了对植株生长发育的抑制.这与用SNP作为外源NO供体在水稻叶片(Hsu et al., 2004)、向日葵叶片(Laspina et al., 2005;Saxena et al., 2013)、小麦根系(Groppa et al., 2008;Singh et al., 2008)、大麦幼苗(Chen et al., 2010)及芸薹属植物(Verma et al., 2013)上的结果一致.本研究中外源NO处理缓解了Cd胁迫对玉米幼苗根系生长的抑制,可能是因为NO优化了抗氧化防御能力进而减少根系中生长素降解的缘故(Xu et al., 2010).
除了在 Cd胁迫的缓解中起抗氧化防御的功能之外,NO还充当引起基因表达变化级联事件的信号分子,诱导Cd响应相关基因的表达.其中,PCs是最为常见的植物固定重金属的螯合肽,它具有较低的分子量,可以与各种金属离子形成硫醇结合蛋白(Maestri et al., 2010).PCs的合成是从GSH的γ-谷氨酰半胱氨酰二肽转肽而来(Gupta,2010).Kim等(2009)研究发现,PCs含量的增加可能是因为植物体内的抗氧化剂GSH含量的增加.而对植物体施加NO就能够促进GSH含量的增加,这是因为NO会与植物体内的GSH结合,启动植物体抗胁迫机制.Estrella-Gomez等(2009)对水生蕨类植物水槐(Salvinia minima)的耐Pb性的研究发现,NO能够促进PCs固定Pb2+的能力;Gadapati和Macfie(2006)研究发现,芥菜(Brassica juncea)会通过增加体内PCs的生物合成来增强自身抗Cd的能力;还有研究者证实,PCs能够降低植物体内Cd胁迫诱导产生的ROS含量,提高重金属耐受力((Mishra et al., 2006).本文通过测定1000 μmol · L-1 Cd胁迫下,化学合成NO对玉米根系TAST、GSH和PCs含量变化的影响,发现随着胁迫时间的延长,NO对三者的含量都有促进作用,其中以10 mmol · L-1 Vc+3000 μmol · L-1 NaNO2最为显著.说明化学合成的NO能够增强植物螯合重金属的能力,固定重金属离子,避免伤害延续,对Cd胁迫起到了缓解作用,这与前人的研究结果基本一致(Xiong et al., 2009).
本文主要从玉米幼苗的生长发育和生理代谢方面探讨了由Vc+NaNO2合成的NO对Cd胁迫的缓解作用,同时证明了此来源的NO也能增强玉米幼苗的抗旱性,说明这种来源的NO在玉米抵抗非生物逆境中可能具有普遍作用.当然正如NO分子依赖于浓度和细胞定位的不同,可以在细胞中引起有益和有害两方面的作用,本研究发现,NO-2来源的化学合成的NO在缓解玉米幼苗Cd毒性方面也具有浓度依赖性.如前所述,低浓度的外源NO可能通过解除ROS引起的氧化胁迫而增强植物的Cd抗性,相反,高浓度的NO可能引起根部活性氮(Reactive Nitrogen Species,RNS)含量的增加,从而对植物体造成硝化胁迫(Corpas et al., 2011; Siddiqui et al., 2011; Saxena et al., 2013).因此,在具体应用中的浓度非常重要.本研究以水培条件下玉米幼苗胁迫症状可逆的最大Cd浓度1000 μmol · L-1为处理浓度,发现解除Cd胁迫的最有效NO-2浓度为3000 μmol · L-1,那么自然条件下的使用浓度如何,还需进一步去探索.此外,由于根系和叶片NO的来源不尽相同(Lux et al., 2011),所以还需进一步揭示根施和叶喷施NO对缓解Cd胁迫的差异.总之,将来的研究重点应该放在NO-2来源的化学合成的NO对作物农艺性状的影响及在大田中的残留情况,建立适用于大田条件的技术体系(包括适用时期、使用浓度和使用部位等).
5 结论(Conclusions)1)抗坏血酸存在条件下,NO-2以浓度依赖的方式缓解了Cd对水培玉米幼苗生长发育的抑制效应,NO-2 的最佳浓度范围为2000~3000 μmol · L-1.
2)抗坏血酸存在条件下,NO-2通过优化玉米幼苗根系酶促抗氧化防御系统,进而降低ROS的迸发和膜脂的过氧化而抵御Cd胁迫.
3)抗坏血酸存在条件下,NO-2通过维持叶绿体色素(叶绿素总量、叶绿素a、叶绿素b和类胡萝卜素)含量的相对稳定,有效地缓解了叶片的失绿黄化现象.
4)抗坏血酸存在条件下,NO-2通过增加玉米根系的TAST和GSH含量,进而增加金属螯合素的含量来减轻Cd的危害.
| [1] | Anjum N A, Umar S, Ahmad A, et al. 2008. Ontogenic variation in response of Brassica campestis L. to cadmium toxicity[J]. Journal of Plant Interactions, 3(3): 189-198 |
| [2] | Arasimowicz-Jelonek M, Floryszak-Wieczorek J, Gwó ź d ź E A. 2011. The message of nitric oxide in cadmium challenged plants[J]. Plant Science, 181(5): 612-620 |
| [3] | Bernard A. 2008. Cadmium and its adverse effects on human health[J]. Indian Journal of Medicine Research, 128: 557-564 |
| [4] | Besson-Bard A, Pugin A, Wendehenne D. 2008. New insights into nitric oxide signaling in plants[J]. Annual Review of Plant Biology, 59: 21-39 |
| [5] | Bethke P C, Gubler F, Jacobsen J V, Jones R L. 2004. Dormancy of Arabidopsis seeds and barley grains can be broken by nitric oxide[J]. Planta, 219(5): 847-855 |
| [6] | Brennan T, Frenkel C. 1977. Involvement of hydrogen peroxide in the regulation of senescence in pear[J]. Plant Physiology, 59(3): 411-416 |
| [7] | Chen F, Wang F, Sun H Y, et al. 2010. Genotype dependent effect of exogenous nitric oxide on Cd-induced changes in antioxidative metabolism, ultrastructure, and photosynthetic performance in barley seedlings (Hordeum vulgare)[J]. Journal of Plant Growth Regulation, 29(4): 394-408 |
| [8] | Corpas F J, Leterrier M, Valderrama R, et al. 2011. Nitric oxide imbalance provokes a nitrosative response in plants under abiotic stress[J]. Plant Science, 181(5): 604-611 |
| [9] | Elavarthi S, Martin B. 2010. Spectrophotometric assays for antioxidant enzymes in plants[J]. Methods in Molecular Biology, 639: 273-280 |
| [10] | Estrella G N, Mendoza C D, Moreno S R, et al. 2009. The Pb-hyperaccumulator aquatic fern Salvinia minima Baker, responds to Pb2+ by increasing phytochelatins via changes in SmPCS expression and in phytochelatin synthase activity[J]. Aquatic Toxicology, 91(4): 320-328 |
| [11] | Francis C A, Rutger J N, Plamer A F E. 1969. A rapid method for plant leaf area estimation in maize (Zea Mays L.)[J]. Crop Science, 9(5): 537-539 |
| [12] | Gadapati W R, Macfie S M. 2006. Phytochelatins are only partially correlated with Cd-stress in two species of Brassica[J]. Plant Science, 170(3): 471-480 |
| [13] | 高俊凤. 2006.植物生理学试验指导[M].北京:高等教育出版社. 192-201 |
| [14] | Gill S S, Khan N A, Tuteja N. 2012. Cadmium at high dose perturbs growth, photosynthesis and nitrogen metabolism while at low dose it up regulates sulfur assimilation and antioxidant machinery in garden cress (Lepidium sativum L.)[J]. Plant Science, 182: 112-120 |
| [15] | Gill S S, Hasanuzzaman M, Nahar K, et al. 2013. Importance of nitric oxide in cadmium stress tolerance in crop plants[J]. Plant Physiology & Biochemistry, 63: 254-261 |
| [16] | Groppa D, Rosales E P, Iannone M F, et al. 2008. Nitric oxide, poly-amines and Cd-induced phytotoxicity in wheat roots[J]. Phytochemistry, 69(14): 2609-2615 |
| [17] | Gupta D K, Huang H G, Yang X E, et al. 2010. The detoxification of lead in Sedum alfredii H. is not related to phytochelatins but the glutathione[J]. Journal of the Hazardous Materials, 177(1/3): 437-444 |
| [18] | Hsu Y T, Kao C H. 2004. Cadmium toxicity is reduced by nitric oxide in rice leaves[J]. Plant Growth Regulation, 42(3): 227-238 |
| [19] | Gupta K J, Fernie A R, Kaiser W M, et al. 2011. On the origins of nitric oxide[J]. Trends in Plant Science, 16(3): 1360-1385 |
| [20] | Kim D Y, Park H, Lee S H, et al. 2009. Arsenate tolerance mechanism of Oenothera odorata from a mine population involves the induction of phytochelatins in roots[J]. Chemosphere, 75(4): 505-512 |
| [21] | Laspina N V, Groppa M D, Tomaro M L, et al. 2005. Nitric oxide protects sunflower leaves against Cd induced oxidative stress[J]. Plant Science, l69: 323-330 |
| [22] | Lux A, Martinka M, Vaculík M, et al. 2011. Root responses to cadmium in the rhizosphere: a review[J]. Journal of Experiment Botany, 62(1): 21-37 |
| [23] | Maestri E, Marmiroli M, Visioli G, et al. 2010. Metal tolerance and hyperaccumulation: costs and trade-offs between traits and environment[J]. Environment & Experiment Botany, 68(1): 1-13 |
| [24] | Sanita di Toppi L, Gabbrielli R. 1999. Response to cadmium in higher plants[J]. Environmental & Experimental Botany, 41(2): 105-130 |
| [25] | Saxena I, Shekhawat G S. 2013. Nitric oxide (NO) in alleviation of heavy metal induced phytotoxicity and its role in protein nitration[J]. Nitric Oxide, 32: 13-20 |
| [26] | Siddiqui M H, Al-Whaibi M H, Basalah M O. 2011. Role of nitric oxide in tolerance of plants to abiotic stress[J]. Protoplasma, 248(3): 447-455 |
| [27] | Singh H P, Batish D R, Kaur G, et al. 2008. Nitric oxide (as sodium nitroprusside) supplementation ameliorates Cd toxicity in hydroponically grown wheat roots[J]. Environment & Experiment Botany, 63(1/3): 158-167 |
| [28] | Stöhr C, Ullrich W R. 2002. Generation and possible roles of NO in plant roots and their apoplastic space[J]. Journal of Experiment Botany, 53(379): 2293-2303 |
| [29] | Verbruggen N, Hermans C, Schat H. 2009. Mechanisms to cope with arsenic or cadmium excess in plants[J]. Current Opinion in Plant Biology, 12(3): 364-372 |
| [30] | Verma K, Mehta S K, Shekhawat G S. 2013. Nitric oxide (NO) counteracts cadmium induced cytotoxic processes mediated by reactive oxygen species (ROS) in Brassica juncea: cross-talk between ROS, NO and antioxidant responses[J]. Biometals, 26(2): 255-269 |
| [31] | Xiong J, An L, Lu H, et al. 2009. Exogenous nitric oxide enhances cadmium tolerance of rice by increasing pectin and hemicellulose contents in root cell wall[J]. Planta, 230(4): 755-765 |
| [32] | Xu J, Wang W Y, Yin H X, et al. 2010. Exogenous nitric oxide improves antioxidative capacity and reduces auxin degradation in roots of Medicago truncatula seedlings under cadmium stress[J]. Plant and Soil, 326(1/2): 321-330 |
| [33] | Yamasaki H. 2000. Nitrite-dependent nitric oxide production pathway: Implications for involvement of active nitrogen species in photoinhibition in vivo[J]. Philosophical Transactions of the Royal Society (B: Biological Sciences), 355(1402): 1477-1488 |
| [34] | Zhang A, Jiang M Y, Zhang J H, et al. 2007. Nitric oxide induced by hydrogen peroxide mediates abscisic acid-induced activation of the mitogen-activated protein kinase cascade involved in antioxidant defense in maize leaves[J]. New Phytologist, 175(1): 36-50 |
| [35] | Zhang L, Chen Z, Zhu C. 2012. Endogenous nitric oxide mediates alleviation of cadmium toxicity induced by calcium in rice seedlings[J]. Journal of Environmental Sciences, 24(5): 940-948 |
| [36] | 赵生杰, 许长成, 邹琦, 等. 1994. 植物组织中丙二醛测定方法的改进[J]. 植物生理学通讯, 30(3): 207-210 |
 2014, Vol. 34
2014, Vol. 34


