水生生物由于栖息于江河流域而容易受到水环境中多种重金属的联合污染.锌和镉是两种常见的重金属,在自然水体中,由于其具有相似的原子结构和离子半径而共存.镉是目前已知最易在生物体内蓄积的有毒重金属(郭笃发,1994),而锌是生物体的必需元素,作为生物体内多种重要酶的金属辅基维持着生物蛋白质在细胞中的结构与功能.镉锌联合污染往往会出现与镉单独污染不同的毒性效应.近年来,镉锌联合污染已成为重金属污染研究的热点之一.
重金属联合作用发生在生物对重金属的吸收、排泄、分布等阶段.目前,国内外对重金属在生物机体整体组织水平上的吸收蓄积作用已有较多研究(Rainbow et al., 2000;郭莹莹等,2008).然而研究表明,重金属对生物机体的作用也会发生在细胞和亚细胞水平上,例如,镉能作用于细胞生物膜或者一些蛋白质的结合位点(Hemelraad et al., 1987),也可能与细胞的金属敏感成分如线粒体和溶酶体及高分子蛋白质(例如酶)结合,从而产生毒性效应(Goto et al., 2007).一些学者也报道了重金属在亚细胞水平上对双壳类动物的作用(Wallace et al., 2003a;Liu et al., 2013b),然而迄今为止,关于重金属在亚细胞水平上对甲壳类动物作用的相关研究尚未见报道.
溪蟹等甲壳动物主要分布于我国黄河及长江流域,对污染物的敏感度较高,是水环境污染检测的理想指示生物(Schuwerack et al., 2001).鳃是甲壳类动物的呼吸器官,也是重金属吸收、排泄及转移的主要场所.本课题组前期就单一镉的毒性作用有较多研究(Lei et al., 2011;金芬芬等,2012;马文丽等,2008).然而对于镉锌联合污染的研究却未曾涉及.鉴于此,本文选择河南华溪蟹(Sinopotamon henanense)作为实验材料,通过镉及镉锌联合亚慢性毒性实验,在亚细胞水平上研究锌对镉在鳃中蓄积的影响.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 实验动物河南华溪蟹(简称“溪蟹”),于2012年9月购自山西省太原市五龙口水产批发市场,置水族缸(45 cm×35 cm×30 cm)中暂养2周.
2.1.2 主要试剂氯化镉(CdCl2)试剂为分析纯,硝酸、高氯酸为优级纯,标准镉溶液(100 mg · L-1)由国家环境保护总局标准样品研究所提供.
2.2 实验材料 2.2.1 实验设计实验前对河南华溪蟹鳃中的镉、锌含量进行测定,分别为(2.98±0.32)μg · g-1和(20.99±2.50)μg · g-1(n=3).本实验采用体外暴露镉锌的方法,设置3个CdCl2浓度组:50、100、500 μg · L-1,6个镉锌联合浓度组:50 μg · L-1 CdCl2+100 μg · L-1 ZnSO4、100 μg · L-1 CdCl2+100 μg · L-1 ZnSO4、500 μg · L-1 CdCl2+100 μg · L-1 ZnSO4、50 μg · L-1 CdCl2+1000 μg · L-1 ZnSO4、100 μg · L-1 CdCl2+1000 μg · L-1 ZnSO4、500 μg · L-1 CdCl2+1000 μg · L-1 ZnSO4,以及1个对照组(曝气水).根据亚慢性毒性实验特点,处理时间设置为14 d和28 d.
随机选取个体大小一致的溪蟹,置于处理缸中,每缸10只,每个处理组设3个重复.实验用水为曝气48 h的自来水,水温20~24 ℃,pH=6.8,溶氧量6 mg · L-1以上.用任国锐(2013)饲喂鲤鱼的基础饲料,处理期间每隔2 d喂1次食物,每周换水1次.
2.2.2 样品制备正式实验开始后的第14 d、28 d分别从各组中取3只溪蟹,冲洗、解剖、取鳃,用滤纸将表面水分吸干净,称重,记录,冷冻至-80 ℃冰箱中以备使用.
2.2.3 鳃亚细胞组分的分离参照Wallace等(2003a)和Kamunde等(2011)的方法,采用差速离心法分离不同组分:以1 ∶ 3(g · mL-1)的比例在组织中加入PBS缓冲液(内含0.1 mmol · L-1 PMSF,1 mmol · L-1 DTT),用电动匀浆仪(FLUKO F6/10)冰浴匀浆,匀浆后将组织匀浆液于低温冷冻离心机(Eppendorf 5804R)离心10 min(800 g,4 ℃),分离出沉淀(p1)和上清液(s1);沉淀(p1)中加入500 μL双蒸水,吹打悬浮后在沸水中加热2 min,加入1 mol · L-1 NaOH 500 μL并充分混匀,在70 ℃水浴箱中加热60 min后10000 g离心30 min,沉淀部分(p2)为富含金属颗粒物质(metal-rich granules,MRG),上清部分(s2)为细胞碎片部分(celluar debris,CD);上清液(s1)以3000 g离心15 min(4 ℃),分离出沉淀(p3)和上清液(s3).上清液(s3)在10000 g下离心30 min(4 ℃),分离出沉淀(p4)和上清液(s4),其中,沉淀p3和p4为线粒体组分;上清液(s4)用超高速冷冻离心机(日立CP 70MX)离心60 min(100000 g,4 ℃),沉淀部分(p5)为溶酶体组分,将上清部分(s5)在80 ℃水浴箱中加热10 min后,冰浴60 min,以50000 g离心10 min(4 ℃),沉淀部分(p6)为热变性蛋白组分(heat-denaturable proteins,HDP)(含酶),上清部分(s6)为热稳定蛋白组分(heat-stable proteins,HSP),其中,HSP和MRG组成生物解毒部分(biologically detoxified metals,BDM),线粒体、溶酶体和HDP组成生物活性部分(biologically active metals,BAM).
2.2.4 各组分中镉含量的测定各组分经硝酸和高氯酸消化完全,定容后用火焰原子吸收分光光度计(VARIAN,AA240OFS)测定镉的含量(μg · g-1).
2.2.5 统计分析数据用Excel和SPSS17.0软件分析处理,所得结果为平均值±标准差(mean±SD),处理组与对照组的差异比较采用单因素方差分析(One-Way ANOVA), *p<0.05、# p<0.05为有显著差异,* * p<0.01、## p<0.01为有极显著差异.
3 结果(Results) 3.1 镉及镉锌联合处理14 d和28 d后镉在河南华溪蟹鳃亚细胞组分中的富集情况如表 1所示,相同处理时间内,各处理组镉的蓄积量均高于对照组,且处理28 d时镉的蓄积量均低于14 d.处理时间为14 d,CdCl2浓度为50 μg · L-1时,加入1000 μg · L-1 ZnSO4后,镉在MRG和CD中的蓄积量与镉单独处理组相比呈极显著升高(* *p < 0.01),在其他组分均无明显变化;CdCl2浓度为100 μg · L-1时,随着ZnSO4浓度的增加,镉在MRG中的蓄积量逐渐升高,并出现极显著差异(* *p <0.01);而在HSP、BAM、CD中,只有加入100 μg · L-1 ZnSO4后镉蓄积量较镉单独处理组极显著升高(* *p < 0.01);当CdCl2浓度为500 μg · L-1时,加锌后各组分中镉蓄积量呈下降趋势或没明显变化,其中,MRG中的镉蓄积量在500 μg · L-1CdCl2+ 100 μg · L-1 ZnSO4处理组中显著降低(*p < 0.05);而在CD中,不同浓度锌均导致镉蓄积量较镉单独组极显著下降(* *p < 0.01).
| 表 1 重金属处理14 d和28 d锌对镉在河南华溪蟹鳃亚细胞组分中富集的影响 Table 1 Effects of Zinc on the subcellular fractions of Sinopotamon henanense gills following 14 days and 28 days of exposure to heavy metals for concentrations of cadmium |
处理时间为28 d,CdCl2浓度为50 μg · L-1时,加入ZnSO4后,镉在MRG中的蓄积量较镉单独处理组极显著升高(##p < 0.01);在HSP、BAM中,随着ZnSO4浓度的增加,镉蓄积量先升高后降低,其中,50 μg · L-1 CdCl2+100 μg · L-1 ZnSO4处理组较镉单独处理组差异极显著(##p < 0.01),且HSP中50 μg · L-1CdCl2+1000 μg · L-1ZnSO4处理组差异显著(#p < 0.05);而CD中镉蓄积量无明显变化.CdCl2浓度为100 μg · L-1时,MRG中的镉蓄积量在100 μg · L-1CdCl2+100 μg · L-1ZnSO4处理组中显著降低(#p < 0.05);HSP和CD中镉的蓄积量在100 μg · L-1 CdCl2+1000 μg · L-1ZnSO4处理组极显著升高(##p <0.01);加入不同浓度锌后,BAM中镉的蓄积量均显著上升(#p < 0.05).CdCl2浓度为500 μg · L-1时,加入锌后,镉在HSP中的蓄积量有所下降,并出现极显著差异(##p < 0.01);BAM和CD中镉的蓄积量在500 μg · L-1CdCl2+100 μg · L-1ZnSO4处理组中显著升高(#p < 0.05);而在MRG中镉蓄积量没有明显变化.
3.2 镉及镉锌联合处理14 d后镉在河南华溪蟹鳃亚细胞组分中的分布如图 1所示,500 μg · L-1 CdCl2处理组中,镉在BDM中所占比例为37%;除此之外,其它浓度处理组中镉在BDM中所占比例达到50%左右.其中,在各浓度镉处理组中,随着ZnSO4浓度的增加,镉在HSP中的分布比例呈先升高后降低趋势;加入1000 μg · L-1 ZnSO4后,镉在MRG中的分布比例较镉单独处理组和100 μg · L-1 ZnSO4联合组有所上升;BAM中,镉的分布比例随着ZnSO4浓度的增加也呈先升高后降低趋势;CD中,ZnSO4浓度一致的情况下,镉的分布比例随着CdCl2浓度的增加而升高,并且镉在这一组分中所占比例,大约约22%~55%.
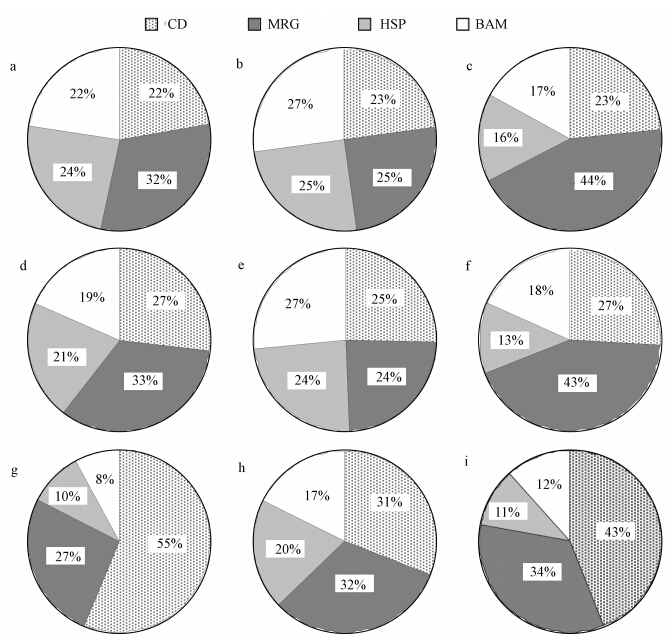 |
| 图 1 重金属处理14 d锌对镉在河南华溪蟹鳃亚细胞组分中分布的影响(a.50 μg · L-1CdCl2;b.50 μg · L-1 CdCl2+100 μg · L-1ZnSO4;c.50 μg · L-1 CdCl2+1000 μg · L-1 ZnSO4;d.100 μg · L-1 CdCl2;e.100 μg · L-1 CdCl2+100 μg · L-1 ZnSO4;f.100 μg · L-1 CdCl2+1000 μg · L-1 ZnSO4;g.500 μg · L-1 CdCl2;h.500 μg · L-1 CdCl2+100 μg · L-1 ZnSO4;i.500 μg · L-1 CdCl2+1000 μg · L-1 ZnSO4) Fig. 1 Effects of zinc exposed for 14 days to heavy metals on the distribution of Cd in the subcellular fractions of Sinopotamon henanense gills |
如图 2所示,CdCl2浓度为50 μg · L-1和100 μg · L-1时,加入ZnSO4后,镉在HSP中所占比例有所上升;CdCl2浓度为500 μg · L-1时,镉在HSP中所占比例在加入锌后有所下降,且均高于相应处理14 d时镉在这个组分中的分布比例;而在MRG中,对于大多处理组镉的分布比例低于相应处理14 d时的分布比例;镉在BAM中所占比例随着ZnSO4浓度的增加先升后降.
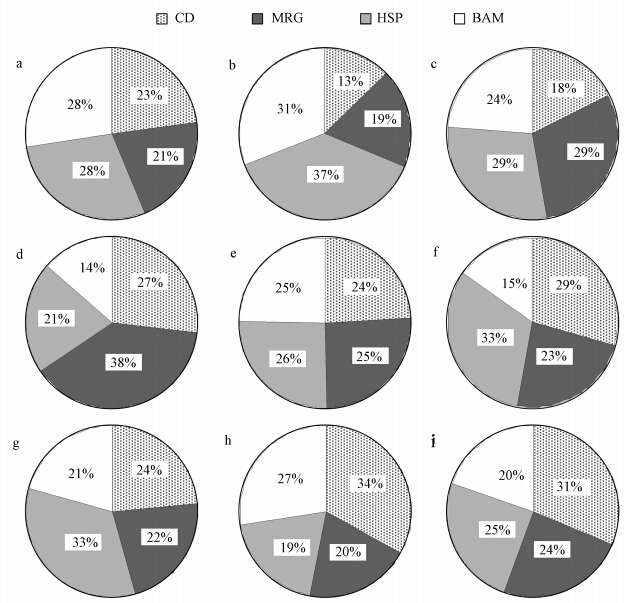 |
| 图 2 重金属处理28d锌对镉在河南华溪蟹鳃亚细胞组分中分布的影响(a.50 μg · L-1CdCl2;b.50 μg · L-1 CdCl2+100 μg · L-1ZnSO4;c.50 μg · L-1 CdCl2+1000 μg · L-1 ZnSO4;d.100 μg · L-1 CdCl2;e.100 μg · L-1 CdCl2+100 μg · L-1 ZnSO4;f.100 μg · L-1 CdCl2+1000 μg · L-1 ZnSO4;g.500 μg · L-1 CdCl2;h.500 μg · L-1 CdCl2+100 μg · L-1 ZnSO4;i.500 μg · L-1 CdCl2+1000 μg · L-1 ZnSO4) Fig. 2 Effects of zinc exposed for 28 days to heavy metals on the distribution of Cd in the subcellular fractions of Sinopotamon henanense gills |
甲壳动物对重金属离子吸收的一种重要途径是:经过鳃不断吸收溶解在水体中的重金属离子,然后通过体液运输到机体各个部位或是积累在表皮细胞中(张美琴等,2010).镉进入生物机体后可通过生物积累对各细胞器官产生损伤作用.当镉锌共同作用于生物机体时,由于二者相似的化学性质,它们之间的相互作用会影响溪蟹体内镉的富集与亚细胞分布.实验结果显示,镉在BDM中所占比例高达50%,说明HSP和MRG是镉蓄积的重要场所.
HSP是水生生物体内重要的生物解毒组分,金属硫蛋白(metallothionein,MT)是其主要成分(Liu et al., 2013b).MT富含半胱氨酸残基,对金属有高度亲和力(李培军等,2003).当生物体内有过多金属时,可以诱导MT生成与其结合,从而缓解金属毒性.镉和锌都能诱导机体产生MT(Amiard et al., 2006).当溪蟹体内有过多的锌时,锌诱导合成MT并形成Zn-MT络合物,Zn-MT络合物容易降解,从而为镉提供了更多的结合位点和贮存空间.因此,MT或MT类似物的合成增加了镉在HSP中的富集.Waalkes(1984)研究发现,镉与锌相比,镉与金属硫蛋白有更强的结合能力.因此,镉能取代锌与MT结合而导致镉在HSP中富集.其他研究发现,在动物的金属硫蛋白类似物中,经常会检测出金属混合物如镉锌、锌铜或镉锌铜的存在(Sutherl and et al., 2011).
亚细胞组分内的另一种重要解毒部分是MRG,MRG也是镉在溪蟹鳃中蓄积的重要场所.从本文研究结果中可以看出,镉在MRG中的富集达到20%~40%,且高浓度锌能促进镉在MRG中的蓄积.研究表明,MRG与MT的周转有密切的关系,Zn-MT络合物降解释放的锌能够继续行使其细胞生物功能,而镉与MT结合后将被氧化成难溶性的多聚体复合物,以MRG的形式贮存在溶酶体中,最后通过胞吐作用排出体外.而且,高浓度锌会提高MT的周转率(Liu et al., 2013b).Goto等(2010)研究表明,MRG对自然环境中的金属污染高度敏感,可以作为金属污染检测指标.
此外,在处理时间较长时或高浓度镉作用下,加锌会抑制镉在HSP和MRG中的富集.一方面,生物机体内MT的诱导表达有一定的限度,当重金属浓度持续增加,暴露时间持续延长,其诱导表达呈下降趋势,从而影响镉金属硫蛋白的合成(马文丽等,2008);另一方面,当生物机体长期处于较高浓度镉中,其生理生化功能发生严重损伤,此时,锌作为一种重金属,阻断了镉对MT等结合蛋白的诱导表达的信息传导途径,抑制了镉结合蛋白生物合成和周转的过程,从而加深镉对生物机体的毒害作用(Kamunde et al., 2011).
4.2 镉在BAM中的富集BAM包括3部分:线粒体、溶酶体和HDP,对重金属较为敏感,是生物机体内易表达重金属毒性的场所.例如,镉暴露可导致河南华溪蟹的线粒体损伤破裂(Liu et al., 2013a),溶酶体在镉作用后会在细胞中释放水解酶(Viarengo et al., 1987).实验结果表明,锌能促进镉在BAM中的蓄积,且随着ZnSO4浓度的增加,镉在BAM中的富集及所占比例均呈先升高后降低趋势.
研究表明,镉通过细胞器膜上的载体转运至细胞器中,金属锌的暴露增加了载体的表达(Liu et al., 2013b),从而促进镉在细胞器中的富集,而且Zn-MT是体内含锌酶的锌供体,由于镉和锌具有相同的核外电子构型及相似的化学性质(李森林等,1990),镉进入细胞后与锌竞争酶的结合部位,进而取代锌,使锌由线粒体、胞质向胞核内转移,从而降低了酶对锌的利用,导致含锌酶的活性降低.因此,低剂量锌使镉进入BAM的转运率升高,加深了镉对机体的损伤作用;而较高浓度锌条件下,虽然镉进入细胞的转运率增加,但高浓度锌的竞争力相对较大,而且锌是具有抗氧化能力物质(如超氧化物歧化酶)的必要组成成分,对于保护细胞具有十分重要的作用(Powell,2000).因此,更多的锌仍能与酶结合而使酶保持原有的活性,使其免遭镉的氧化损伤;另外,大量的锌加快了镉复合物的合成,镉复合物借助其丰富的巯基把进入机体内的镉络合起来,使之处于“非活性”状态,从而缓解了镉对机体的毒害作用(王吉秀等,2010).因此,高浓度锌对镉与细胞器及一些酶的结合起到了一定的抑制作用,某种程度上减轻了镉的毒性损伤.
4.3 镉在CD中的富集CD包括组织碎片、细胞膜及一些其它功能未知的成分.由于其功能的不确定性,细胞碎片组分既不属于BDM,也不属于BAM.镉能与细胞膜作用发生脂质过氧化反应,改变细胞膜的流动性(Lucu et al., 1996).然而当镉与CD中对重金属不敏感的成分结合时,CD对细胞中的生物活性部分又起到了保护作用(Wallace et al., 2003b).
实验结果显示,同等锌浓度条件下,随着镉处理浓度的增加,镉在CD中所占的比例基本呈逐步增加的趋势,最大时达到50%以上.因此,CD在生物机体处于重金属环境中的作用不容小觑,而对于这一组分的组成及其功能,有待于进一步研究.
5 结论(Conclusions)不同的亚细胞组分中,锌对镉富集的影响不同.低浓度镉处理时,锌能促进镉在生物解毒部分中的蓄积;而镉处理浓度较高且处理时间延长时,锌逐渐表现为抑制作用.对于生物活性部分,锌能促进镉在此组分中的蓄积,且低浓度锌的促进作用更加显著.总之,通过亚细胞分离法分离溪蟹鳃组织,在亚细胞水平研究锌对镉富集的影响,更加深入地探究了锌镉联合的复杂作用机制,为今后的重金属复合污染研究提供一定的新思路.
| [1] | Amiard J C,Amiard-Triquet C,Barka S,et al.2006.Metallothioneins in aquatic invertebrates:Their role in metal detoxification and their use as biomarkers[J].Aquatic Toxicology,76(2):160-202 |
| [2] | Goto D,Wallace W G.2007.Interaction of Cd and Zn during uptake and loss in the polychaete Capitella capitata:Whole body and subcellular perspectives[J].Journal of Experimental Marine Biology and Ecology,352(1):65-77 |
| [3] | Goto D,Wallace W G.2010.Metal intracellular partitioning as a detoxification mechanism for mummichogs (Fundulus heteroclitus) living in metal-polluted marshes[J].Marine Environmental Research,69(3):163-171 |
| [4] | 郭莹莹,翟毓秀,张翠,等.2008.不同形态镉在养殖对虾体内蓄积及其毒性的对比研究[J].海洋水产研究,29(2):34-40 |
| [5] | 郭笃发.1994.环境中铅和镉的来源及其对人和动物的危害[J].环境科学进展,2(3):71-76 |
| [6] | Hemelraad J,Kleinveld H A,de Roos A M,et al.1987.Cadmium kinetics in freshwater clams.III.Effects of zinc on uptake and distribution of cadmium in Adonata cygnea[J].Archives of Environmental Contamination and Toxicology,16(1):95-101 |
| [7] | 金芬芬,王兰.2012.镉对河南华溪蟹肝胰腺线粒体自由基代谢的影响[J].环境科学学报,32(2):457-464 |
| [8] | Kamunde C,MacPhail R.2011.Subcellular interactions of dietary cadmium,copper and zinc in rainbow trout (Oncorhynchus mykiss) [J].Aquatic Toxicology,105(3/4):518-527 |
| [9] | Lei W W,Wang L,Liu D M,et al.2011.Histopathological and biochemical alterations of the heart induced by acute cadmium exposure in the freshwater crab Sinopotamon yangtsekiense[J].Chemosphere,84(5):689-694 |
| [10] | 李培军,熊先哲,杨桂芬,等.2003.动物生物标志物在土壤污染生态学研究中的应用[J].应用生态学报,14(12):2347-2350 |
| [11] | 李森林,王焕校,吴玉树.1990.凤眼莲中锌对镉的拮抗作用[J].环境科学学报,10(2):249-254 |
| [12] | Liu D M,Yang J,Wang L.2013a.Cadmium induces ultrastructural changes in the hepatopancreas of the freshwater crab Sinopotamon henanense[J].Micron,47:24-32 |
| [13] | Liu F J,Wang W X.2013b.Facilitated bioaccumulation of cadmium and copper in the oyster Crassostrea hongkongensis Solely Exposed to Zinc[J].Environmental Science and Technology,47(3):1670-1677 |
| [14] | Lucu C,Obersnel V.1996.Cadmium influx across isolated Carcinus gill epithelium:interaction of lanthanum and calcium with cadmium influxes[J].Journal of Comparative Physiology B,166(3):184-189 |
| [15] | 马文丽,王兰,何永吉,等.2008.镉诱导华溪蟹不同组织金属硫蛋白表达及镉蓄积的研究[J].环境科学学报,28(6):1192-1197 |
| [16] | Powell S R.2000.The antioxidant properties of zinc[J].Journal of Nutrition,130(5S):1447S-1454S |
| [17] | Rainbow P S,Amiard-Triquet C,Amiard J C,et al.2000.Observations on the interaction of zinc and cadmium uptake rates in crustaceans (amphipods and crabs) from coastal sites in UK and France differentially enriched with trace metals[J].Aquatic Toxicology,50(3):189-204 |
| [18] | 任国锐,李瑞金,王兰.2013.低分子质量壳聚糖对鲤鱼生长和消化酶活性的影响[J].食品科学,34(1):8-12 |
| [19] | Schuwerack P M,Lewis J W,Jones P.2001.The potential use of the South African river crab,Potamonautes warreni,as a bioindicator species for heavy metal contamination[J].Ecotoxicology,10(3):159-166 |
| [20] | Sutherland D E K,Stillman M J.2011.The "magic numbers" of metallothionein[J].Metallomics,3(5):444-463 |
| [21] | Viarengo A,Moore M N,Mancinelli G,et al.1987.Metallothioneins and lysosomes in metal toxicity and accumulation in marine mussels:the effect of cadmium in the presence and absence of phenanthrene[J].Marine Biology,94(2):251-257 |
| [22] | Waalkes M P,Harvey M J,Klaassen C D.1984.Relative in vitro affinity of hepatic metallothionein for metals[J].Toxicology Letters,20(1):33-39 |
| [23] | Wallace W G,Luoma S N.2003a.Subcellular compartmentalization of Cd and Zn in two bivalves.II.The significance of trophically available metal (TAM)[J].Maring Ecology Progress Series,257:125-137 |
| [24] | Wallace W G,Lee B G,Luoma S N.2003b.Sub-cellular compartmentalization of Cd and Zn in two bivalves.I.Significance of metal-sensitive fractions (MSF) and biologically detoxified metal (BDM)[J].Marine Ecology Progress Series,249:183-197 |
| [25] | 王吉秀,祖艳群,李元.2010.镉锌交互作用及生态学效应研究进展[J].农业环境科学学报,29(1):256-260 |
| [26] | 张美琴,陈海仟,吴光红,等.2010.水体中锌与镉在中华绒螯蟹体内吸收蓄积的相互作用[J].水产学报,34(8):1270-1276 |
 2013, Vol. 34
2013, Vol. 34


