2. 北京工业大学环境与能源工程学院, 北京 100022
2. College of Environmental and Energy Engineering, Beijing University of Technology, Beijing 100022
作为产生NO的前体物质,N2O能够消耗臭氧、破坏臭氧层,对全球环境及气候变化具有重要影响.污水处理过程是N2O的一个重要产生源,据初步估计,该过程每年排放的N2O量约0.3 ×1012~3×1012 kg,占全球N2O总排放量的2.5%~25%(Khalil et al., 1992).鉴于此,2006年IPCC将污水处理厂出水中N2O的含量标准由1%减至0.5%(IPCC,2006).与全程生物脱氮过程相比,短程生物脱氮过程的N2O释放量将会增加30%(巩有奎等,2011).而NO-2-N 积累是导致系统N2O释放量增加的重要因素(Yang et al., 2009; Zhou et al., 2008; Kampschreur et al., 2008,Jia et al., 2013).因此,控制短程生物脱氮过程中N2O的产量,对短程生物脱氮过程的实际应用具有重要的现实意义.
脉冲式SBR是在传统SBR 基础上对其运行方式进行改进后的一种新型污水脱氮处理工艺,该工艺通过分段多次将原水加入到反应器内,可充分利用原水中的有机物作为反硝化碳源,节省了外加碳源投加量.对分段进水的相关研究表明,系统脱氮率是进水流量分配的函数,同时受到进水C/N(COD/TKN)的影响(Shigeo,1996;Guo et al.,2007).Yang等(2009)首次考察了分段进水SBR短程生物脱氮系统处理生活污水过程中N2O的产生特性,发现与一次进水方式相比,采用两次分段进水方式,其N2O释放量可减少30%以上.然而,目前关于进水次数对脱氮过程中N2O释放量的影响研究尚不多见.
pH值、氧化还原电位(ORP)等在线控制参数的应用,提高了脉冲进水SBR系统的稳定性,但对分段次数对脉冲式SBR 工艺特性及N2O产生过程的比较研究尚未见报道.因此,本文利用在线pH控制策略,在成功实现短程硝化反硝化过程的基础上,考察进水次数和进水量对工艺脱氮效率及N2O产生过程的影响,以确定降低系统N2O产量的策略.
2 材料及方法(Materials and methods) 2.1 实验用水水质及种泥试验用水取自北京某大学家属区生活污水,原水COD平均值为120 mg · L-1,NH+4-N平均值为65 mg · L-1,NO-x-N小于1 mg · L-1.试验用接种污泥取自北京某污水厂回流污泥,试验初期以生活污水培养近 3个月,试验期间系统短程脱氮效果达96%以上.
2.2 试验装置及运行试验采用等量进水的方式,即在操作过程中每次投加的原水量相等.反应器总有效容积为11 L,排水后污泥层为3 L,分别进行了2次等量进水和3次等量进水的操作.图 1分别为2次和3次等量进水SBR 的操作过程示意图.在最后一个反硝化阶段一次性投加适量无水乙醇作为反硝化碳源.脉冲式SBR好氧和缺氧的持续时间由实时控制策略控制(Yang et al., 2009).试验装置如图 2所示.
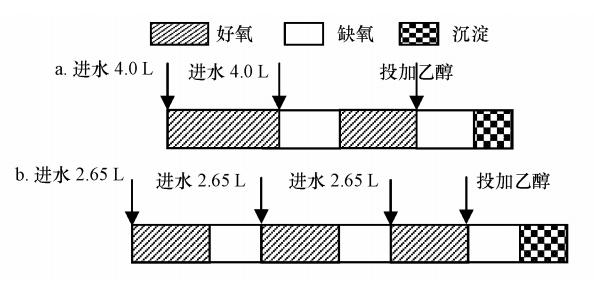 |
| 图 1 脉冲式SBR操作过程(a. 2次等量进水,b. 3次等量进水) Fig. 1 Operational mode of the pulsed SBR(a. two step equal influent flows,b. three step equal influent flows) |
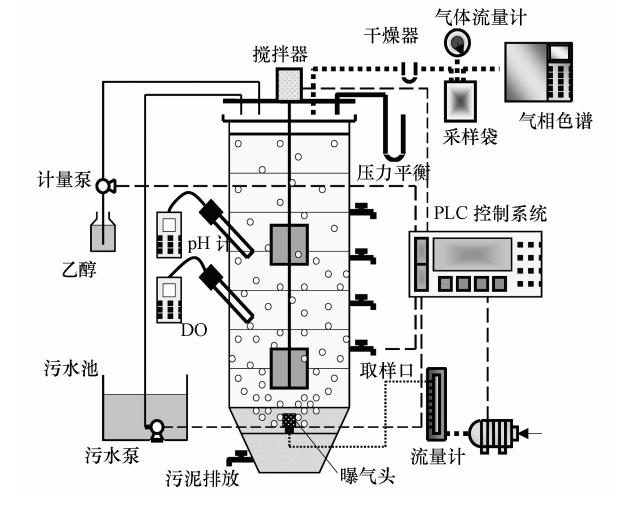 |
| 图 2 试验装置示意图 Fig. 2 Schematic diagram of experimental system |
反应器均采用密闭方式运行,好氧曝气阶段产生的气体经干燥器干燥去除水分后,间隔0.5 h收集至气体采样袋,利用湿式流量计测定气体体积,以气相色谱仪测定所收集气体中的N2O浓度.在密闭条件下,取污泥混合液并测定溶解态N2O浓度.
2.4 分析方法DO和pH分别使用Multi340i 型(WTW公司)便携式多功能DO和pH值测定仪测定;试验中 COD、NH+4-N、NO-2-N、 NO-3-N和MLSS的分析均采用标准方法(APHA,1998);采用气相色谱仪检测气体样品中的N2O 浓度(Gong et al., 2012).
3 结果(Results) 3.1 两次等量进水脉冲式SBR的脱氮效果两次等量进水过程中,每次进水量均为4.0 L.由图 3可知,进水反应开始30 min后,COD从105 mg · L-1降到80 mg · L-1,氨氮只降低 3 mg · L-1.在该阶段,微生物大量吸附有机物,利用有机物同化合成细胞物质,该过程中需要少量氮,因此,氨氮略有降低.同时,有机物降解过程中提供了部分碱度,系统pH略有上升.此后,pH由上升转为下降,系统进行硝化过程,氨氮迅速降低,同时伴随有NO-2-N的大量积累,而COD变化不大.整个曝气过程中DO逐渐增加,但始终小于1.0 mg · L-1.195 min后,pH达最低点,即“氨谷”点,此时,系统NO-2-N积累量达33.2 mg · L-1,剩余氨氮<1 mg · L-1,氨氮去除率大于95%;此后,停止曝气,同时加入4.0 L生活污水进行反硝化.反硝化过程中,pH逐渐增加.由于原水碳氮比较低,在第一阶段反硝化过程中,pH曲线上并没“硝酸盐膝”的出现,反硝化结束后,系统仍残留有10 mg · L-1NO-2-N,此时,系统COD已降至70 mg · L-1左右,无法被反硝化细菌利用.此后进行第二阶段曝气过程.
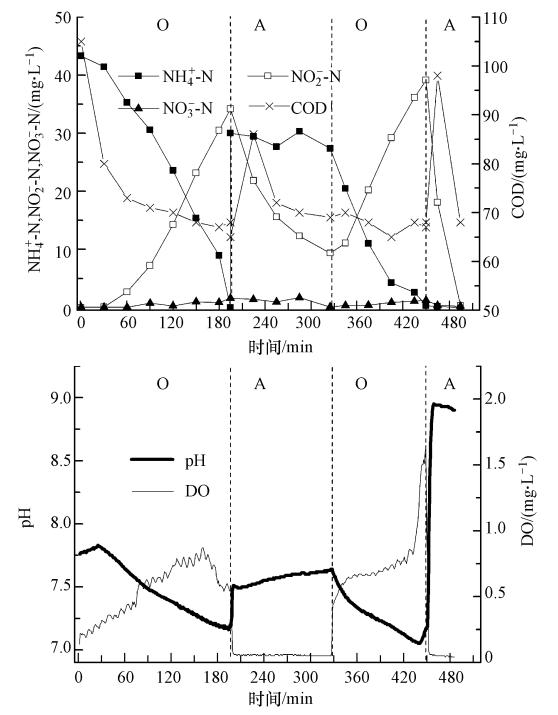 |
| 图 3 2次等量进水SBR反应过程中COD、氮、pH和DO的变化规律(O: 好氧,A: 缺氧) Fig. 3 Profile of COD,nitrogen,pH and DO with two step equal influent flows |
与第一阶段不同,第二阶段曝气伊始即出现氨氮的大量降低,同时,pH开始下降.与第一阶段相比,第二阶段曝气硝化过程在100 min内即完成,这主要是由于第二阶段进水中大部分COD被反硝化细菌所利用,减少了有机物对硝化过程的影响;而在第一阶段曝气过程中,异养菌首先利用进水中的有机物生长繁殖,抑制了自养菌对氨氮的利用,硝化过程在有机物降解完成后得以进行.整个硝化过程结束后,投加0.8 mL无水乙醇作为反硝化碳源,仅用了60 min就将NO-2-N从30.13 mg · L-1降至1.0 mg · L-1以下.
3.2 三次等量进水脉冲式SBR脱氮过程图 4所示为3次等量进水方式系统脱氮效果及pH、DO变化曲线.整个脱氮过程进水量为8 L,分3次等量进水.与2次等量进水类似,反硝化菌能够利用后一阶段进水中的有机物作为反硝化碳源,将前一阶段硝化过程中积累的NO-2-N还原至N2,第二、三阶段进水中有机物能够被充分利用作为反硝化碳源,因此,此两个阶段硝化过程所需时间明显降低(图 4).与2次等量进水类似,由于原水碳氮比较低,第一、二阶段反硝化结束后均残留有部分NO-2-N,至第二阶段硝化结束后,加入0.6 mL乙醇,反应60 min后,pH曲线出现“亚硝酸盐膝”,出水NO-x-N<1.0 mg · L-1.
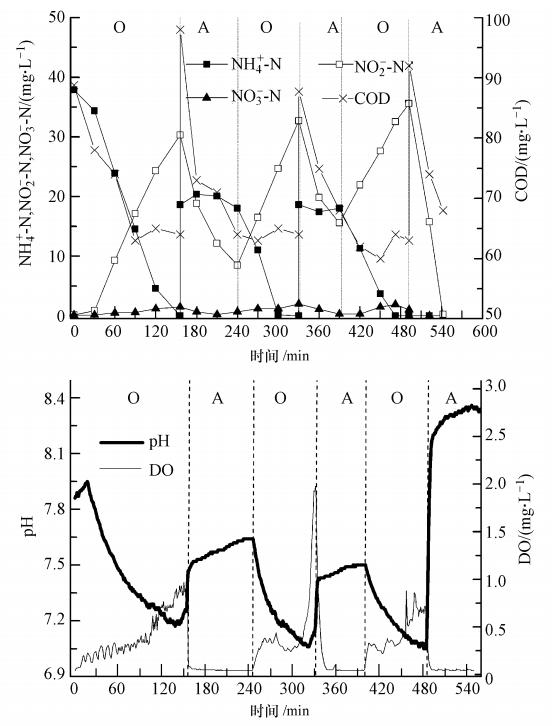 |
| 图 4 3次等量进水SBR反应过程中COD、氮、pH和DO的变化规律 Fig. 4 Profile of COD,nitrogen,pH and DO with three step equal influent flows |
图 5所示为不同进水方式下生物短程反硝化过程中N2O产生及释放过程.2次和3次等量进水脱氮过程中,N2O释放量分别为8.86 mg · L-1和5.04 mg · L-1(以N计,下同).在脱氮过程的最初60 min内,系统主要进行COD的降解,氨氮变化不大,同时未出现NO-2-N的大量积累,因此,2种进水方式中N2O产量及释放量均相差不大.60 min后,系统进行硝化过程,此后,系统进行氨氮的氧化,反应器内部开始出现NO-2-N累积(图 3和图 4),同时,N2O释放量均出现不同程度的增加.2次等量进水方式下,第一阶段氨氧化结束时(195 min),系统N2O产生量出现极大值为3.48 mg · L-1(以N计),同时,N2O释放量达3.12 mg · L-1.此后,系统进行第二次进水过程,脱氮过程进入反硝化阶段,系统内部溶解态N2O在30 min内迅速由0.36 mg · L-1(以N计)降至0.01 mg · L-1,N2O产生量略有减少,N2O释放量不再增加,表明反硝化过程中能够将硝化阶段产生的N2O还原至N2.第一阶段反硝化结束后,继续曝气完成第二阶段硝化,此阶段曝气过程中没有出现N2O释放滞后的现象,曝气开始后,N2O产生量和释放量均呈迅速增加的趋势.主要原因是第一阶段反硝化过程不完全,曝气伊始即存在NO-2,同时,第二阶段进水中的有机物在第一阶段反硝化过程中被消耗殆尽,第二阶段曝气伊始即进行硝化过程.第二阶段硝化结束后,N2O产生量和释放量均达到最大值,分别为9.24 mg · L-1和8.86 mg · L-1.此后,投加0.8 mL无水乙醇进行反硝化,反硝化过程中无N2O释放.与2次等量进水方式类似,3次等量进水方式下,系统N2O产生量极大值均出现在各个硝化阶段结束时,分别为1.40、2.95和5.59 mg · L-1;反硝化开始后,溶解态N2O迅速降低,30 min内均降至0.01 mg · L-1以下.与2次等量进水方式相比,3次等量进水方式下N2O产量明显降低(图 5).
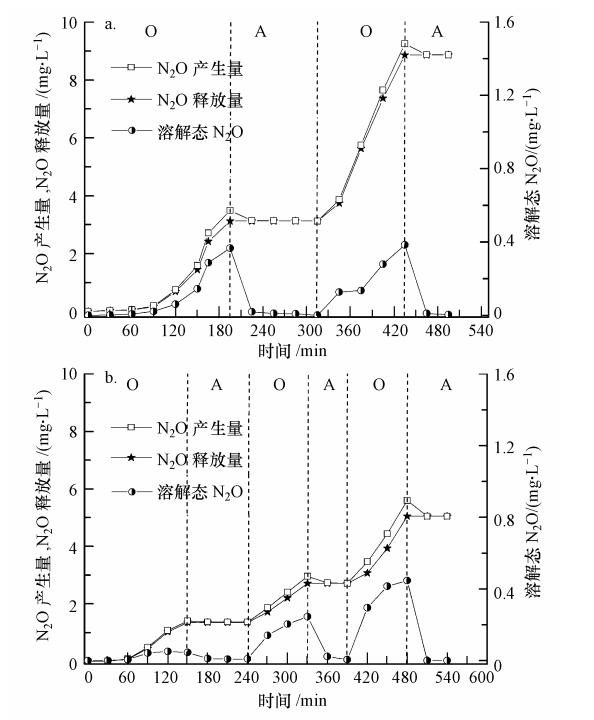 |
| 图 5 不同进水方式下N2O释放量变化曲线(a:2次等量进水,b: 3次等量进水) Fig. 5 Variation of N2O emission with different feeding pattern(a: two step equal influent,b: three step equal influent) |
不同进水方式下,溶解态N2O产量不同,但均遵循同样的规律.由图 3和图 4可见,反应最初的一段时间内,系统主要进行有机物的氧化过程,未发现NO-2-N的积累,图 5中几乎没有溶解态N2O的积累.随后,系统进行硝化过程,NO-2-N产生量逐渐增加,系统内部开始出现N2O的产生并释放.
4 讨论(Discussion)采用分段进水方式,通过调节各段进水流量,在原水COD/N较低的情况下,使得每段进水中可生物降解的COD能够被前一段硝化过程中产生的NO-x-N 消耗掉,从而降低了后续曝气过程中COD和硝化菌对DO的竞争,减少了系统的曝气量,提高了系统的脱氮效率.因此,本研究中第二、第三曝气阶段中,并没有发现氨氮氧化滞后的现象.随进水次数的增加,投加碳源前系统积累的NO-2-N 依次减少,分别为39.1 mg · L-1和35.6 mg · L-1;最后一次反硝化阶段投加的乙醇量也依次递减,其乙醇的投加量也由0.8 mL降至0.6 mL,原水中的可生物降解的COD全部作为反硝化碳源被利用.同时,有机碳源浓度低则会导致反硝化速率下降,从而导致反应时间的延长.理论上进水次数越多越好,但次数越多操作越复杂,给实时控制带来麻烦,并需频繁地切换曝气搅拌,从而增加水力停留时间.因此,在分段进水SBR实际应用过程中,可选择3次等量进水方式.
图 6为2次和3次等量进水方式下系统NO-2-N积累量和系统溶解态N2O的变化过程.由图可知,系统硝化阶段溶解态N2O的变化和系统NO-2-N积累具有同步变化趋势.2次等量进水方式下,初始60 min内,系统完成COD的降解过程,几乎无溶解态N2O的积累.60 min后,硝化过程开始,溶解态N2O积累量逐渐增加,至第一段硝化过程结束时,系统NO-2-N积累量为34.2 mg · L-1,系统溶解态N2O达0.36 mg · L-1;此后进行第二阶段进水,系统进入反硝化过程,亚硝态氮逐渐减低,而溶解态N2O迅速降低至0.1 mg · L-1以下.表明在可降解COD充足的情况下,N2O能迅速被还原至N2O.巩有奎等(2011)的研究也表明,COD/N充足,反硝化过程无N2O积累;在第二阶段曝气过程中,并没有发现NO-2(以N计)和溶解态N2O产生滞后的现象,而是在硝化开始后迅速增加,表明溶解态N2O伴随硝化过程中NO-2-N积累量的增加而同步增加;与2次等量进水过程类似,3次等量进水方式下,系统溶解态N2O与NO-2-N的积累量同样存在明显的同步变化趋势.
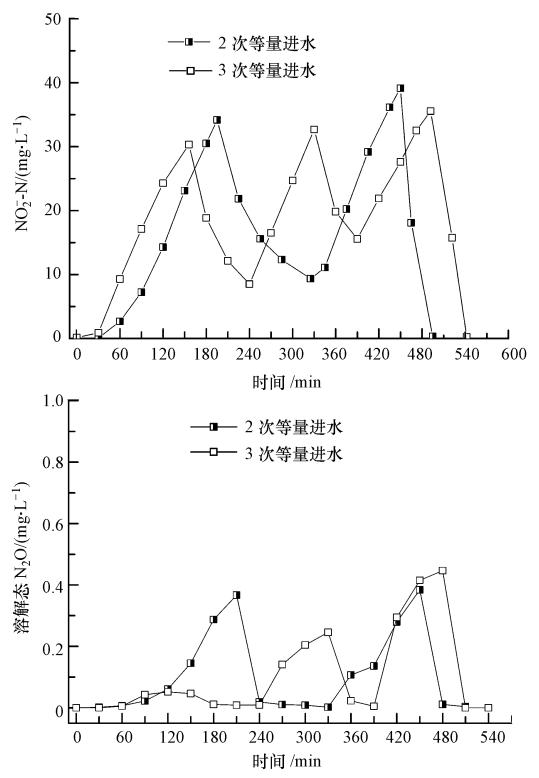 |
| 图 6 不同进水方式下溶解态氧化亚氮及亚硝态氮变化曲线 Fig. 6 Profile of dissolved N2O and nitrite accumulation in different feeding pattern |
在N2O的产生过程中,NO-2起着重要的作用,硝化阶段NO-2-N积累量愈大,N2O产生量愈大,此部分N2O在曝气阶段能够迅速被吹脱出来,从而导致N2O的释放量增加.硝化细菌如Nitrosomonas europaea和Nitrosomonas eutropha利用羟胺、氢气及有机物质作为电子供体将亚硝酸盐还原成氮气是好氧脱氨的途径之一,也即AOB 的反硝化过程(Wrage et al.,2001),这个过程中能够产生大量的N2O.Kampschreur等(2008)利用SBR反应器考察了运行过程中NO-2对NO和N2O逸出量的影响后也发现,脉冲加入NO-2,将会导致系统NO和N2O的增加,其中,NO逸出量与加入的NO-2成线性正相关,NO和N2O均来自于AOB的反硝化作用.Kim等(2010)也指出,废水生物处理过程中N2O 的释放取决于NH+4的氧化,或产生于AOB 反硝化过程.Wrage等(2001)研究认为,NH+4 氧化为NO-2后即被AOB的还原酶系还原成 NO、N2O和N2,整个过程由自养菌来完成.
耿军军等(2010)认为在反硝化阶段,由于N2O 还原酶较NO-x-N 还原酶竞争电子的能力弱,因此,当电子供体缺乏时,由于无外加碳源,微生物利用胞内PHA 进行反硝化,N2O 还原酶获得的电子不足,从而导致N2O 的积累和释放.本研究中,不同进水过程的各个反硝化阶段均未发现N2O的积累(图 5),分段进水对反硝化阶段N2O变化特性影响不大.硝化过程结束后,通过加入原水或者乙醇作为反硝化碳源,进行反硝化过程,硝化阶段滞留在液体中的N2O被迅速还原至N2(图 5).当原水中COD降低后(<70 mg · L-1),即开启曝气阀门,进行曝气过程,因此,并没有发生微生物的内源反硝化过程.当反硝化过程中COD/N、微生物种群、废水水质等条件适宜反硝化过程时,系统不会有N2O积累(巩有奎等,2011).研究发现,保证充足的碳源,反硝化阶段并不会导致N2O的产生(Yang et al.,2009;Wicht,1996).本研究以实际生活污水作为进水驯化脱氮过程,污水成分复杂,微生物种群具有多样性,碳源和微生物种群都适宜于系统反硝化过程中N2O的还原.因此,本研究并没有发现反硝化阶段有N2O的产生.
5 结论(Conclusions)1)采用分段进水方式处理低碳氮比生活污水,可减少外碳源投加量和曝气量,能够节约运行成本.随着分段次数增加,反硝化所需碳源投加量降低,对于普通城市污水的处理,建议采用3 次等量进水方式.
2)低碳氮比生活污水分段进水过程中,进水分段次数对生物脱氮过程中N2O产生量具有明显的影响,进水次数增加,各阶段硝化过程中NO-2-N降低,系统N2O产生量降低.N2O主要产生于硝化阶段.2次等量进水和3次等量进水方式下,N2O释放量分别为8.86 mg · L-1和5.05 mg · L-1(以N计),其最终外碳源(无水乙醇)投加量分别为0.8 mL和0.6 mL.增加分段进水次数,可降低系统内部NO-2积累量,能够有效降低系统N2O-N释放量.碳源充足时,反硝化阶段无N2O的产生.
| [1] | APHA (American Public Health Association). 1998. Standard Methods for the Examination of Water and Wastewater (20th edition)[M]. Washton DC: American Public Health Association |
| [2] | 耿军军,王亚宜,张兆祥,等. 2010.污水生物脱氮革新工艺中强温室气体N2O 的产生及微观机理[J].环境科学学报, 30(9): 1-9 |
| [3] | 巩有奎,王赛,彭永臻,等. 2010.生活污水不同生物脱氮过程中N2O产量及控制[J].化工学报, 61(5): 1286-1292 |
| [4] | 巩有奎,王淑莹,王莎莎,等. 2011. 碳氮比对短程反硝化过程中N2O产生的影响[J].化工学报, 62(7): 2049-2054 |
| [5] | Gong Y K, Peng Y Z, Yang Q, et al. 2012. Formation of nitrous oxide in a gradient of oxygenation and nitrogen loading rate during denitrification of nitrite and nitrate[J]. Journal of Hazardous Materials, 227-228(2): 453-460 |
| [6] | Guo J H, Yang Q, Peng Y Z. 2007. Biological nitrogen removal with real-time control using step-feed SBR technology[J]. Enzyme and Microbial Technology, 40(6): 1564-1569 |
| [7] | Jia W L, Liang S, Zhang J, et al. 2013. Nitrous oxide emission in low-oxygen smultaneous nitrification and denitrification process: Sources and mechanisms[J]. Bioresource Technology, 136: 444-451 |
| [8] | Kampschreur M J, Tan N C G, Picioreanu C, et al. 2008. Effect of dynamic process conditions on nitrogen oxides emission from a nitrifying culture[J]. Environmental Science & Technology, 42(2): 429-435 |
| [9] | Khalil M A K,Rasmussen R A.1992. The global sources of nitrous oxide[J]. Journal of Geophysical Research, 97(D13): 14651-14660 |
| [10] | Kim S W, Miyahara M, Fushinobu S, et al. 2010. Nitrous oxide emission from nitrifying activated sludge dependent on denitrification by ammonia-oxidizing bacteria[J]. Bioresource Technology, 101(11): 3958-3963 |
| [11] | Shigeo F. 1996. Theoretical analysis on nitrogen removal of the step-feed anoxic-oxic activated sludge process and its application for the optimal operation[J]. Water Science and Technology, 34(1/2): 459-466 |
| [12] | Wicht H. 1996. Model for predicting nitrous oxide production during denitrification in activated sludge[J]. Water Science and Technology, 34(5/6): 99-106 |
| [13] | Wrage N, Velthof G L, Beusichem M L, et al. 2001. Role of nitrifier denitrification in the production of nitrous oxide[J]. Soil Biology & Biochem, 33(12/13): 1723-1732 |
| [14] | Yang Q, Liu X H, Peng Y Z, et al. 2009. Advanced nitrogen removal via nitrite from municipal wastewater in a pilot-plant sequencing batch reactor[J]. Water Science & Technology, 59(12): 2371-2377 |
| [15] | Zhou Y, Pijuan M, Yuang Z G, et al. 2008. Development of a 2-sludge, 3-stage system for nitrogen and phosphorous removal from nutrient-rich wastewater using granular sludge and biofilms[J]. Water Research, 42(12): 3207-3217 |
 2014, Vol. 34
2014, Vol. 34


