镉(Cd)是环境中常见的对人体毒性很强的重金属污染物,工业生产、汽车尾气排放、含镉污水排放及土壤积累等均可导致大气、水体和土壤的镉污染.研究发现,环境中的镉可通过被污染的食物、饮水和粉尘等进入人体,引发人肺组织、肝脏、肾、心血管、泌尿生殖系统、骨骼等的损伤,且镉蓄积还可致癌(Waalkes,2003).调查显示,人体长期接触镉会导致体内蛋白分子巯基和氨基与镉结合,影响细胞内正常钙代谢和基因表达(Nordberg,2009).研究表明,镉暴露能影响细胞的增殖、分化、DNA复制和修复(Fang et al., 2002),可致实验动物体内代谢紊乱、生殖细胞畸形,并可产生致死作用(Brookes et al., 2004;Wang et al., 2012).目前,关于镉毒性作用的研究多集中于氧化损伤方面.镉暴露可引起胞内活性氧(Reactive oxygen species,ROS)水平增高,由此可引发膜脂、蛋白质、DNA等生物大分子的氧化损伤,或激活细胞凋亡途径(Bertin et al., 2006).ROS和Ca2+在引发动物、植物和酵母细胞(Brookes et al., 2004;Yi et al., 2012;Zheng et al., 2007)死亡过程中具有重要的信号分子作用,但胞内ROS和Ca2+是否在镉诱导的酵母细胞毒性中起作用及如何参与介导镉诱导的毒性尚不明确.
目前,酵母细胞已作为细胞毒性作用研究的模式生物,且对其细胞凋亡诱因、核心分子、传导通路等均有了较深的了解(Wu et al., 2013;Zheng et al., 2007).因此,本文以酵母细胞作为实验材料,研究镉对细胞的毒性效应,以期为揭示镉毒性作用机理提供实验依据.
2 材料与方法(Materials and methods) 2.1 材料酵母(Saccharomyces cerevisiae)EGY48菌株保存于本实验室.YPD培养基:酵母粉 1%,蛋白胨 2%,葡萄糖 2%,pH 自然;固体培养基:在YPD培养基基础上加入2%的琼脂.
2.2 菌株培养与药物处理 2.2.1 菌株培养挑取酵母菌单菌落至 YPD 液体培养基中活化过夜,然后取适量活化菌液至YPD液体培养基中,在30 ℃、200 r · min-1下培养12~15 h后用于实验.
2.2.2 药物处理离心收集细胞,用浓度为0.25~5 mmol · L-1的CdCl2制成细胞悬液(细胞终浓度106 cell · mL-1),于30 ℃、200 r · min-1条件下孵育.
干预组分别采用0.5 mmol · L-1的泛caspase 抑制剂(Z-Asp-CH2-DCB)、0.5 mmol · L-1的抗坏血酸(AsA)、0.5 mmol · L-1的过氧化氢酶(CAT)、0.5 mmol · L-1的乙二醇双四乙酸(EGTA)和0.5 mmol · L-1的LaCl3与CdCl2同时作用.
2.2.3 细胞死亡率测定采用美兰染色法测定细胞死亡率,具体操作为:药物处理一定时间后,进行细胞染色,置于光学显微镜下观察并统计着色细胞和总细胞数目,计算细胞死亡率(死亡细胞数/总细胞数×100%).每个处理观察至少1000个细胞,设3个生物学重复.
2.2.4 胞内ROS水平测定收集5 mmol · L-1 CdCl2处理6 h的酵母细胞及同期无镉对照组细胞,用PBS洗涤并悬浮后加入终浓度为5 μmol · L-1的二氯荧光黄双乙酸酯(DCFH-DA),30 ℃避光孵育30 min,流式细胞仪检测胞内ROS水平.每个样品测量50000个细胞,数据采集用CellQuest 3.1f软件,数据分析用ModFitLT 3.0软件.
2.3 数据统计分析采用SPSS16.0对所得结果进行ANOVA分析,用Duncan方法比较镉处理组与对照组间的差异显著性(*表示差异显著,p<0.05;**表示差异极显著,p<0.01)及干预组与处理组间的差异显著性(&表示差异显著,p<0.05;&&表示差异极显著,p<0.01).
3 结果(Results) 3.1 镉处理对酵母细胞活性的影响经美蓝染色后显微镜观察发现,对照组有个别细胞呈淡蓝色,而镉处理组中有较多细胞被染成蓝色,说明镉可降低酵母细胞活性,引发细胞死亡.从图 1可看出,经0.05 mmol · L-1镉处理后,细胞活性无明显变化;浓度大于0.25 mmol · L-1的镉处理组的细胞死亡率显著高于对照,并随镉处理浓度的提高而增大;不同浓度镉处理组的细胞死亡率均随着作用时间的延长而提高;5 mmol · L-1 镉处理24 h后,细胞死亡率达到约60%.该结果表明,镉对酵母细胞的毒性随着镉浓度的提高和作用时间的延长而增强.
 |
| 图 1 镉诱发酵母细胞死亡 Fig. 1 Cadmium induced yeast cell death |
由图 2可知,镉处理液中加入泛caspase抑制剂Z-Asp-CH2-DCB后,酵母细胞死亡率降低.用0.5 mmol · L-1的Z-Asp-CH2-DCB与0.5 mmol · L-1或5 mmol · L-1镉共同作用6 h后,细胞死亡率显著低于镉单独处理组(p<0.05);作用时间延至24 h时,镉处理组与干预组的差异增大(p<0.01).该结果表明,泛caspase抑制剂Z-Asp-CH2-DCB能显著降低镉引发的酵母细胞死亡,说明镉诱导的细胞死亡过程中有类caspase蛋白酶的参与.
 |
| 图 2 泛caspase抑制剂对镉诱导酵母细胞死亡的影响 Fig. 2 Effects of caspase inhibitor on cadmium-induced cell death in yeast |
利用流式细胞仪检测酵母细胞内的ROS水平,发现5 mmol · L-1镉处理6 h后胞内ROS水平显著增高(图 3),约为对照组的6倍(p<0.01).为证实ROS升高与镉毒性作用中的关系,本文在镉处理液中加入一定量的外源抗氧化剂AsA和CAT降低胞内ROS水平后检测细胞死亡率,发现0.5 mmol · L-1的AsA与0.5 mmol · L-1或5 mmol · L-1的镉共同处理 后,细胞死亡率降低(图 4),存活率提高,并与镉单
 |
| 图 3 镉对酵母胞内ROS水平的影响 Fig. 3 Effects of cadmium on intracellular ROS levels in yeast cells |
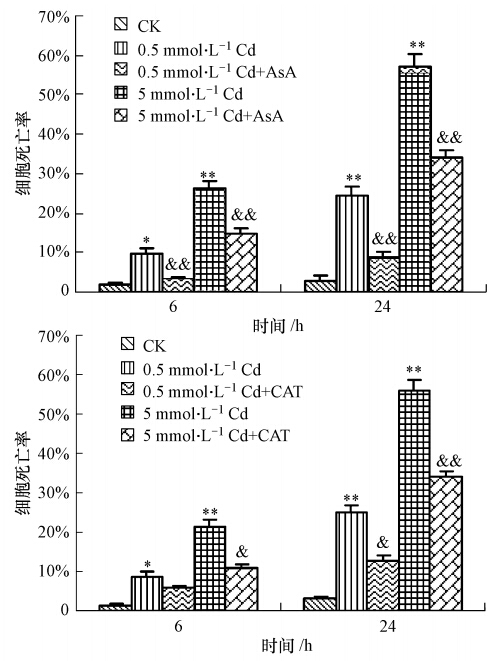 |
| 图 4 抗氧化剂抗坏血酸(AsA)和过氧化氢酶(CAT)对镉诱导酵母细胞死亡的抑制作用 Fig. 4 Antagonistic effects of ascorbic acid and catalase on cadmium-induced yeast cell death |
独处理组产生显著差异(p<0.01);用500 U的CAT与0.5 mmol · L-1或5 mmol · L-1的镉共同处理后,细胞死亡率亦显著低于同浓度镉单独处理组.上述结果说明镉处理组胞内ROS水平升高与镉对酵母细胞的毒性作用相关.
3.4 Ca2 +参与镉诱导的酵母细胞死亡在镉处理液中加入Ca2 +特异性螯合剂EGTA或Ca2+通道特异性抑制剂LaCl3后,镉诱发的细胞死亡率显著下降(图 5).用0.5 mmol · L-1的EGTA 或LaCl3与0.5 mmol · L-1或5 mmol · L-1的镉共同处理后,酵母细胞死亡率显著低于镉单独处理组,说明镉诱导的酵母细胞死亡过程与镉处理组胞内Ca2+水平的升高有关.加入质膜Ca2+通道特异性抑制剂LaCl3后镉毒性明显降低,说明胞外Ca2+内流在处理组胞内Ca2+升高中发挥了重要作用.
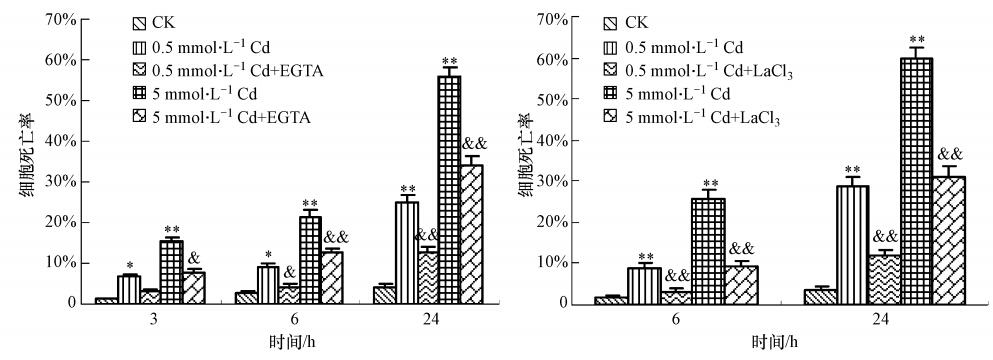 |
| 图 5 EGTA和LaCl3对镉诱导酵母细胞死亡的抑制作用 Fig. 5 Antagonistic effects of EGTA and LaCl3 on cadmium-induced yeast cell death |
镉是一种极其重要的工业和环境化学污染物,在生物体内可与蛋白分子的氨基和巯基结合,使许多酶系统受到抑制,进而影响生物体的正常生理功能.本研究发现,镉能诱导酵母细胞活性下降,甚至死亡.细胞凋亡的标志是caspase的激活,有研究证明,caspase 抑制剂 Z-Asp-CH2-DCB、TLCK、TPCK 等可抑制胁迫引发的细胞死亡(Iakimova et al., 2008;Yakimova et al., 2007).本文采用泛caspase蛋白酶抑制剂后显著提高了酵母菌株EGY48镉处理组细胞的活性,这与Nargund 等(2008)在酵母BY4741菌株中的研究结果一致,说明镉诱导酵母细胞死亡过程中有类caspase蛋白酶的参与.
非生物胁迫引发胞内ROS水平升高可以启动细胞的凋亡级联反应(Ryter et al., 2007),也可引发生物大分子氧化损伤,使细胞代谢功能紊乱甚至死亡(Lopez et al., 2006).研究表明,镉可导致人、动物和植物细胞内ROS水平升高,外源性给予ROS清除剂可降低镉暴露对细胞的毒作用(Lemarie et al., 2004;Yang et al., 2008;Bi et al., 2009).本研究在检测到镉对酵母细胞的毒作用后,采用流式细胞仪检测证实了镉处理组酵母细胞内ROS水平的显著升高,将胞内ROS升高与镉毒性作用关联;之后,用外源ROS清除剂AsA或CAT降低镉处理组细胞内ROS水平后检测细胞死亡率,证实胞内ROS水平降低后细胞死亡率下降,从而说明镉毒性与胞内ROS水平呈正相关,镉引起ROS水平升高导致毒性作用,胞内ROS升高是诱发细胞死亡的重要原因.
Pei等(2000)的研究表明,ROS能激活质膜Ca2+通道,引起胞外Ca2+内流,导致胞内Ca2+水平升高;而Ca2+失衡可导致细胞内基因表达、能量代谢等发生改变,继而引发细胞凋亡(Zhivotovsky et al., 2011).Ca2+特异性螯合剂EGTA能通过螯合作用降低细胞外Ca2+浓度,从而有效阻止胞外Ca2+内流;LaCl3作为钙离子通道特异性抑制剂,能有效阻止胞外Ca2+进入细胞(Yi et al., 2012).在本文中,加入EGTA或LaCl3后,能有效地阻止镉诱发的酵母细胞死亡,即胞内Ca2+下降可缓解镉对酵母细胞的毒性,说明胞内Ca2+的升高介导了镉的毒作用,而胞外Ca2+内流是胞内Ca2+升高的重要原因.所以,镉染毒诱发的酵母细胞内ROS水平升高可能是通过激活质膜Ca2+通道,使胞质内Ca2+水平升高,从而激活相关下游信号,引发酵母细胞的死亡.
酵母细胞对环境毒物具有灵敏快速的反应,有人用酵母细胞研究了铝和砷的毒性效应,揭示了其毒性作用的分子机制(Wu et al., 2013;Zheng et al., 2007),表明酵母细胞与动物细胞的凋亡过程有高度的保守性.本文结果与前人利用人和动物离体细胞研究镉细胞毒性中发现的胞内ROS和Ca2+水平升高的结果相似(Lemarie et al., 2004;Yang et al., 2008),说明镉毒性在动物细胞和酵母细胞中具有较高的一致性.而酵母细胞具有生长周期短、易培养、遗传背景简单等优点,有望作为研究环境化学物毒性作用的模式系统.
5 结论(Conclusions)浓度为0.25~5 mmol · L-1的镉可使酵母细胞活性下降,诱发细胞死亡.镉胁迫可致酵母细胞内ROS水平升高,过量的ROS可能会激活质膜Ca2+通道,导致胞外Ca2+内流,胞内Ca2+水平升高,从而引发caspase介导的细胞程序性死亡.
| [1] | Bertin G, Averbeck D. 2006. Cadmium: cellular effects, modifications of biomolecules, modulation of DNA repair and genotoxic consequences(a review)[J]. Biochimie, 88(11): 1549-1559 |
| [2] | Bi Y H, Chen W L, Zhang W N, et al. 2009. Production of reactive oxygen species, impairment of photosynthetic function and dynamic changes in mitochondria are early events in cadmium-induced cell death in Arabidopsis thaliana[J]. Biology of the Cell, 101(11): 629-643 |
| [3] | Brookes P S, Yoon Y S, Robotham J L, et al. 2004. Calcium, ATP, and ROS: a mitochondrial love-hate triangle[J]. American Journal of Physiology-Cell Physiology, 287(4): 817-833 |
| [4] | Fang M Z, Mar W, Cho M H. 2002. Cadmium affects genes involved in growth regulation during two-stage transformation of Balb/3T3 cells[J]. Toxicology, 177(2/3): 253-265 |
| [5] | Iakimova E T, Woltering E J, Kapchina-Toteva V M, et al. 2008. Cadmium toxicity in cultured tomato cells-role of ethylene, proteases and oxidative stress in cell death signaling[J]. Cell Biology International, 32(12): 1521-1529 |
| [6] | Lemarie A, Lagadic G D, Morzadec C, et al. 2004. Cadmium induces Caspase-independent apoptosis in liver Hep3B cells: Role for calcium in signaling oxidative stress-related impairment of mitochondria and relocation of endonuclease G and apoptosis-inducing factor[J]. Free Radical Biology and Medicine, 36(12): 1517-1531 |
| [7] | Lopez E, Arce C, Oset-Gasque M J, et al. 2006. Cadmium induces reactive oxygen species generation and lipid peroxidation in cortical neurons in culture[J]. Free Radical Biology and Medicine, 40(6): 940-951 |
| [8] | Nargund A M, Avery S V, Houghton J E. 2008. Cadmium induces a heterogeneous and Caspase-dependent apoptotic response in Saccharomyces cerevisiae[J]. Apoptosis, 13(6): 811-821 |
| [9] | Nordberg G F. 2009. Historical perspectives on cadmium toxicology[J]. Toxicology and Applied Pharmacology, 238(3): 192-200 |
| [10] | Pei Z M, Murata Y, Benning G, et al. 2000. Calcium channels activated by hydrogen peroxide mediate abscisic acid signaling in guard cells[J]. Nature, 406(6797): 731-734 |
| [11] | Ryter S W,Kim H P,Hoetzel A,et al. 2007. Mechanisms of cell death in oxidative stress[J]. Antioxidants Redox Signaling, 9(1): 49-89 |
| [12] | Waalkes M P. 2003. Cadmium carcinogenesis[J]. Mutation Research, 533(1/2): 107-120 |
| [13] | Wang W X, Sun Y, Liu J, et al. 2012. Protective effect of theaflavins on cadmium-induced testicular toxicity in male rats[J]. Food and Chemical Toxicology, 50(9): 3243-3250 |
| [14] | Wu L H, Yi H L, Zhang H F. 2013. Reactive oxygen species and Ca2+ are involved in sodium arsenite-induced cell killing in yeast cells[J]. FEMS Microbiology Letters, 343(1): 57-63 |
| [15] | Yakimova E T, Kapchina-Toteva V M, Woltering E J. 2007. Signal transduction events in aluminum-induced cell death in tomato suspension cells[J]. Journal of Plant Physiology, 164(6): 702-708 |
| [16] | Yang C S, Tzou B C, Liu Y P, et al. 2008. Inhibition of cadmium-induced oxidative injury in rat primary astrocytes by the addition of antioxidants and the reduction of intracellular calcium[J]. Journal of Cellular Biochemistry, 103(3): 825-834 |
| [17] | Yi H L, Yin J J, Liu X, et al. 2012. Sulfur dioxide induced programmed cell death in Vicia guard cells[J]. Ecotoxicology and Environmental Safety, 78: 281-286 |
| [18] | Zheng K, Pan J W, Ye L, et al. 2007. Programmed cell death-involved aluminum toxicity in yeast alleviated by antiapoptotic members with decreased calcium signals[J]. Plant Physiology, 143(1): 38-49 |
| [19] | Zhivotovsky B,Orrenius S.2011.Calcium and cell death mechanisms: A perspective from the cell death community[J].Cell Calcium, 50(3): 211-221 |
 2014, Vol. 34
2014, Vol. 34


