2. 长春市农业科学院, 长春 130111;
3. 吉林大学动物科学学院, 长春 130062
2. Changchun City Academy of Agricultural Sciences, Changchun 130111;
3. College of Animal Science, Jilin University, Changchun 130062
甾族化合物(又称类固醇)由3个六碳环己烷和1个五碳环组成的稠合四环化合物,在C10和C13上各有一甲基,C17上有一个侧链或含氧基团.污水处理厂出水和畜禽养殖场粪尿是环境中甾族化合物的两大主要来源(Snyder et al., 2001; Kolodyiej et al., 2004).由于极其微量的水平便可强烈干扰人类和其它动物的内分泌系统,改变机体在发育和成年阶段胞内信号肽过程,并从而导致发育、行为和生殖问题(Hashimoto and Murakanmi, 2009),因此甾族化合物的环境污染问题已经引起了人们的重视,并且基于微生物降解作用的生物修复理论和技术研究正成为当前的研究热点(Van der Geize et al., 2008; Zhang et al., 2010; Sang et al., 2011).睾丸酮丛毛单胞菌由于能够以多种甾族化合物及具有芳香烃结构的化合物为碳源和能源进行生长代谢活动,因此不少学者利用这一点研究甾族化合物的微生物降解机制以及降解基因的表达调控(Gong et al., 2012; 艾育芳等,2010; 李明堂等,2011).其中,3,17β-HSD是睾丸酮丛毛单胞菌降解睾丸酮等雄性激素的第一个酶,因此在环境中雄性激素的污染控制方面具有重要的价值,其表达水平和活性对环境中雄性激素的污染控制具有重要意义(Cabrera et al., 2000; Pruneda-Paz et al., 2004).对已经公布的睾丸酮丛毛单胞菌(Comamonas testosteroni ATCC19966)ATCC19966的基因序列分析发现在睾丸酮丛毛单胞菌3,17β-HSD的编码基因上游2290 bp处有一个聚羟基脂肪酸酯合成抑制子(Gong et al., 2012).因此,本文在其可能抑制3,17β-HSD表达的理论假设基础上,利用分子生物学技术构建该菌的PhaR基因敲除菌株,并研究了野生型和突变菌株3,17β-HSD表达对甾族化合物的响应特征,以期为构建高效的甾族化合物降解基因工程菌株和对睾丸酮丛毛单胞菌3,17β-HSD基因的表达调控研究提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验用菌种、培养基、培养条件睾丸酮丛毛单胞菌(Comamonas testosteroni ATCC11996)、E. coli HB101和E. coli BL21 由德国Kiel大学Xiong博士惠赠.LB液体培养基的配方为:1 L培养基中含胰化蛋白胨 10 g,酵母提取物 5 g,NaCl 10 g,固体培养基中加入1%的琼脂.抗性培养基中氨苄青霉素和卡那霉素的最终浓度分别为100 μg · mL-1和30 μg · mL-1.野生型和突变型睾丸酮丛毛单胞菌的培养条件为150 r · min-1和27 ℃.大肠杆菌的培养条件为150 r · min-1和37 ℃.
2.2 实验材料PCR纯化试剂盒(QIAGEN),DNA凝胶回收试剂盒(QIAGEN),Taq酶(New Engl and Biolabs),限制性内切酶(Invitrogen),Shrimp alkaline phosphatase(Affymetrix/USB),T4 DNA连接酶(Invitrogen),TOPO TA克隆试剂盒(Invitrogen),质粒提取试剂盒(QIAGEN),辣根过氧化物酶(HRP)标记的羊抗兔多克隆抗体和显色剂ABTS(Sigma),96孔板.睾丸酮、雌二醇、胆固醇(Sigma),抗生素和其他化学试剂均为分析纯.
2.3 PhaR基因敲除的C. testosteroni突变菌株的构建 2.3.1 PhaR基因前300 bp突变片段的获得采用CTAB方法从培养过夜的睾丸酮丛毛单胞菌中提取菌体总DNA.根据GenBank中的基因序列,在PhaR基因5′端的第3个碱基的后面额外增加一个碱基G来设计正向引物,即正向引物为5′- ATGGCAAGAAAACAAAGAG-3′,反向引物为5′-CTGCATGGCATGACCATA-3′ .以总DNA为模板,进行PCR扩增,反应条件为:95 ℃变性3 min,然后95 ℃ 30 s,45 ℃30 s,72 ℃30 s,29个循环,最后72 ℃ 3 min.用0.8%的琼脂糖凝胶电泳分析PCR产物的大小,若与预期相符,剩余PCR产物纯化后于-20 ℃保存.
2.3.2 含300 bp基因片段的重组质粒的构建根据试剂盒说明书,将获得的基因片段连接至pCR2.1-TOPO质粒上,然后利用化学法将其转入感受态的E. coli HB101细胞中,通过氨苄青霉素和卡那霉素双抗来筛选出阳性菌株,利用酚-氯仿抽提和乙醇沉淀获得重组质粒后用0.8%的琼脂糖凝胶电泳对重组质粒和其EcoRI酶切后的产物大小进行分析(Sambrook and Russel, 2001),选择其中的一个正确重组质粒,将其命名为pPK-8,用质粒提取试剂盒进行提取后用于同源重组.
2.3.3 睾丸酮丛毛单胞菌PhaR基因的同源重组向LB液体培养基中接种睾丸酮丛毛单胞菌,过夜培养.然后再向2 mL新的LB液体培养基中接种20 μL的过夜培养物,37 ℃培养3~4 h,将吸光度为0.5~0.6的培养物放置冰上1 h,取1 mL在1.3×104 r · min-1下离心20 s,菌体细胞悬浮于1 mL 10%的甘油中,冰上5 min. 1.3×104 r · min-1离心10 s,去掉上清液,后再加1 mL 10%的甘油,冰上5 min,备用.取感受态细胞100 μL加入到含10 μg脱盐pPK-8质粒的转化杯,在1.8 kV和4.8 ms下进行电转化.然后加入400 μL的 LB培养基,在110 r · min-1和27 ℃下培养 1 h,最后涂于含有氨苄青霉素和卡那霉素的LB固体平板上,27 ℃过夜培养.由于多加了一个碱基,重组后PhaR蛋白的阅读框会发生位移,从而使得PhaR蛋白失去活性,达到了基因敲除的目的.
2.3.4 突变型菌株的挑选从上述抗性LB平板上挑取阳性克隆,在无诱导和1 mmol · L-1睾丸酮诱导下利用具有氨苄青霉素和卡那霉素抗性的液体LB培养基培养,培养24 h后,利用蒸馏水将培养物稀释10倍后测定600 nm处的吸光度,用以表征菌体细胞的生长,同时做野生型菌株的同步对照培养和测定.对可能的阳性克隆利用PCR做进一步验证.
2.3.5 同源重组检验利用分别含有载体pCR2.1-TOPO和野生型菌株染色体上的碱基序列的正向引物5′-GAACATAAAGGACTTGCG-3′和反向引物5′-GTAACGGCCGCCAGTGTG-3′,以突变菌株PK-4的总DNA为模板进行PCR反应,获得597 bp大小的基因片段后,对其进行纯化和测序.
2.4 甾族化合物对突变菌株3,17β-HSD的诱导效应研究 2.4.1 不同甾族化合物对3,17β-HSD表达的诱导效应向含有双抗性的LB培养基中分别加入1 mmol · L-1睾丸酮、0.5 mmol · L-1雌二醇、0.5 mmol · L-1胆固醇,接入突变株PK-4和野生型菌株后培养24 h,采集菌体细胞,提取粗蛋白,采用ELISA方法测定3,17β-HSD的表达量.
2.4.2 雌二醇和胆固醇对睾丸酮诱导3,17β-HSD表达的影响向含有双抗性的LB培养基加入终浓度为1 mmol · L-1的睾丸酮,然后分别加入0.5 mmol · L-1的雌二醇和0.5 mol · L-1的胆固醇,同时做只有1mmol · L-1睾丸酮和无诱导物的对照,接种突变株PK-4和野生型菌株后培养24 h,采集菌体细胞,提取粗蛋白,采用ELISA方法测定3,17β-HSD的表达量.
2.4.3 突变菌株遗传稳定性分析将在-80 ℃保存8个月后的突变菌株PK-4的第一代接入含氨苄青霉素和卡那霉素抗性的LB培养基中活化培养,然后再接种于含有抗生素的新鲜LB培养基中进行培养,连续继代培养6 d,每天测定3,17β-HSD的表达量,利用野生型菌株做对照,分析菌株回复突变可能性.
2.5 菌体细胞粗蛋白的提取与定量分析取1 mL培养物在1.3×104 r · min-1下离心30 s,去掉上清液,加入100 μL水,旋涡混均,加入100 μg · mL-1的溶菌酶,反复冻融3次(-20 ℃,30 min;20 ℃,30 min).在1.3×104 r · min-1下离心20 min,上清液为粗提的蛋白质.蛋白质的定量测定采用Bradford法(Bradford,1976).
2.6 3,17β-HSD的过量表达和纯化利用化学法将pET-17β-HSD30(德国Xiong博士馈赠)转化入E. coli BL21的感受态细胞后,在含氨苄青霉素的LB培养基中培养过夜.取100 μL过夜培养物加入到3 mL氨苄青霉素抗性的LB培养基中,培养至吸光度为0.4~0.6,添加IPTG至终浓度为1 mmol · L-1,37 ℃诱导4 h,收集菌体,提取总蛋白,然后按照说明书利用Ni柱进行纯化,获得纯的可溶性3,17β-HSD酶蛋白质,利用SDS-PAGE进行纯度分析以及分子量大小的判断.将高质量的3,17β-HSD酶蛋白质用于抗性血清的制备和作为ELISA测定的标准品.
2.7 测定3,17β-HSD表达量的ELISA法的建立培养基接种后培养20 h,取1 mL培养物在1.3×104 r · min-1下离心20 s,去掉上清液,加入100 μL蒸馏水,加入100 μg · mL-1的容菌酶,在-20 ℃(30 min)和20 ℃(30 min)下反复冻融3次,1.3×104 r · min-1离心20 min,获得粗测定蛋白.测定蛋白质含量后,利用蒸馏水将蛋白质含量统一调整至1 mg · mL-1.利用包被液(pH9.6)稀释至2.5 μg · mL-1,每孔加入200 μL,放入37 ℃恒温箱30 min.洗完后,每孔先后加入1 : 1000稀释的自制抗体(利用200 μg纯化的3,17β-HSD蛋白免疫兔子,获得的抗血清)和辣根过氧化物酶标记的羊抗兔多克隆抗体各200 μL,显色剂100 μL(李明堂等,2011).每次加液前清洗3次,其他操作参考ELISA试剂盒. 将抗体血清分装多个小管后-20 ℃保存,每管的最多冻融次数不超过6次.所有实验均使用同一批次制备的3,17β-HSD标准蛋白和抗体血清,整个实验周期内,标准曲线的变化不大.
3 结果(Results) 3.1 重组质粒和PhaR基因敲除突变菌株的构建通过在正向引物5′端ATG后多加一个碱基G来获得了PhaR基因(546 bp)前300 bp片段的突变片段,如图 1所示,然后将该突变基因片段克隆至表达载体pCR2.1-TOPO上,获得含有突变基因片段的表达载体pPK-8,并通过质粒大小和EcoRI酶切片段证明质粒pPK-8为目标质粒(图 1).利用电穿孔法将该质粒重组至睾丸酮丛毛单胞菌的染色体DNA中,利用带有卡那霉素和氨苄青霉素抗性的平板获得了多个阳性克隆.从卡那霉素和氨苄青霉素抗性的平板上随机挑取6个阳性克隆,在诱导和无诱导下培养24 h,利用蒸馏水将培养物稀释10倍,测定600 nm处的吸光度,同时做野生型菌株的同步对照培养和测定,结果如图 2所示.经过反复培养,6个克隆生长特征几乎完全一致,即诱导后菌体细胞的数量明显增加,与野生型相比,在诱导和无诱导条件下,突变菌株的生长能力明显降低,推测可能是因为双抗作用或者PhaR基因对野生型菌株的生长起到调节作用,导致在相同的培养基中,突变型菌株弱于野生型,具体机制还有待于进一步研究证明.其中4号克隆由于生长比较稳定,因此利用PCR方法对其中的4号克隆进行鉴定,获得了大约为597 bp的片段(图 1),并对该片段的基因序列进行分析,表明597 bp的基因片段包括载体pCR2.1-TOPO和野生型菌株染色体上的部分基因,与理论假设一致.因此认为4号克隆为PhaR基因被敲除的突变菌株.
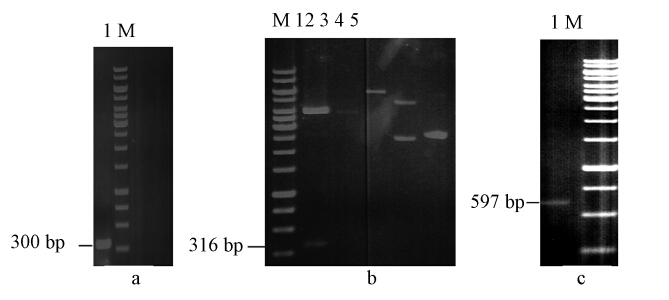 |
| 图 1 PhaR基因敲除菌株构建过程中的PCR产物、重组质粒和酶切产物的琼脂糖凝胶电泳(a:1,通过PCR反应获得的300bp突变基因片段;M,Marker.b:M,Marker;1,重组质粒pPK-8的EcoRI酶切产物;4,质粒pCR2.1-TOPO;5,重组质粒pPK-8.c:1,验证同源重组结果的PCR反应产物;M,Marker.) Fig. 1 Agarose gel electrophoresis of PCR product,recombinant plasmid, and endonuclease digestion product during the construction of PhaR knock-out mutants(a: 1,300 bp mutant DNA fragment by PCR); M,Marker. b: M,Marker; EcoRI digestion product of recombinant plasmid pPK-8; 4,plasmid pCR2.1-TOPO; 5,recombinant plasmid pPK-8. c: 1,PCR product for the proof of homologous recombination; M. Marker) |
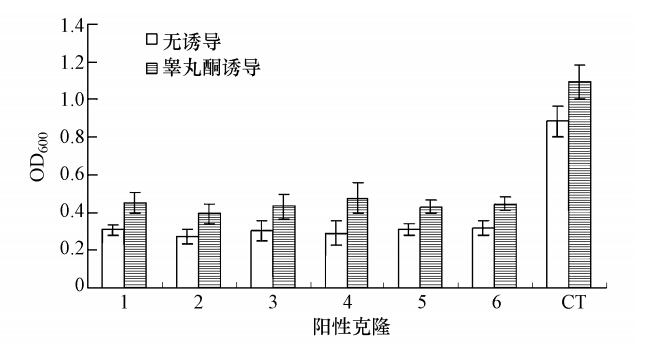 |
| 图 2 PhaR基因敲除菌株的生长特性 Fig. 2 Growth of PhaR gene knock-out mutants |
将质粒转化E. coli BL21后,利用1 mmol · L-1的 ITPG诱导,提取粗蛋白,采用His Tag蛋白纯化方法进行纯化,利用15% SDS-PAGE方法来分析蛋白的分子量大小和验证纯度,结果如图 3所示.从图中可以看出,纯化后的蛋白分子量为29 kDa,与理论值相符,并且提纯后,纯度较高,可满足ELISA测定的需要.
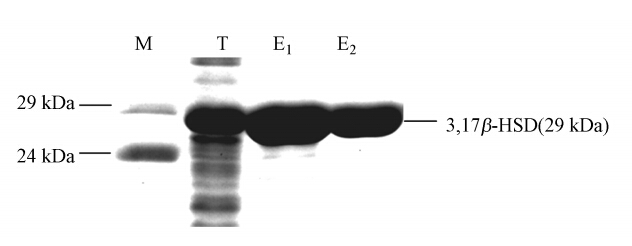 |
| 图 3 3,17β-HSD蛋白的过量表达和纯化(M:蛋白Marker;T:总蛋白;E1和E2:第1次和第2次洗脱的蛋白) Fig. 3 Overexpression and purification of the 3,17β-HSD protein(M,protein marker; T,total protein of; E1 and E2:eluted protein) |
向具有抗性的LB培养基中加入终浓度分别为1、0.5、0.5 mmol · L-1的睾丸酮、雌二醇、胆固醇,培养24 h后采集菌体细胞,测定3,17β-HSD的表达量,同时利用LB培养基和野生型菌株做同步对照培养和测定,结果如图 4所示.从图中可以看出,无诱导条件下突变菌株PK-4体内的3,17β-HSD的平均表达量比野生型菌株体内的高38.5%,1 mmol · L-1的睾丸酮诱导后突变菌株PK-4体内的3,17β-HSD的表达量迅速增加,并且远远高于相同条件下野生型菌株体内3,17β-HSD的表达量.利用0.5 mmol · L-1的雌二醇和0.5 mmol · L-1的胆固醇诱导后突变菌株PK-4和野生型菌株体内的3,17β-HSD的表达量之间无明显差异.结果说明,在无甾族化合物存在时PhaR能够明显降低睾丸酮丛毛单胞菌体内3,17β-HSD的表达,但不能完全抑制,即PhaR是3,17β-HSD表达的抑制因子,但不是唯一的抑制因子或者还有其它机制调节3,17β-HSD的表达,具体的调节机理需要更深入的研究加以验证.同时还说明,0.5 mmol · L-1的睾丸酮对野生型和突变型菌株体内3,17β-HSD的表达都可产生诱导效应,但诱导后突变型菌株体内3,17β-HSD的表达量远远高于野生型的,即突变型菌株在睾丸酮类污染物,如甲基睾丸酮污染的生物修复方面具有明显的应用潜力.
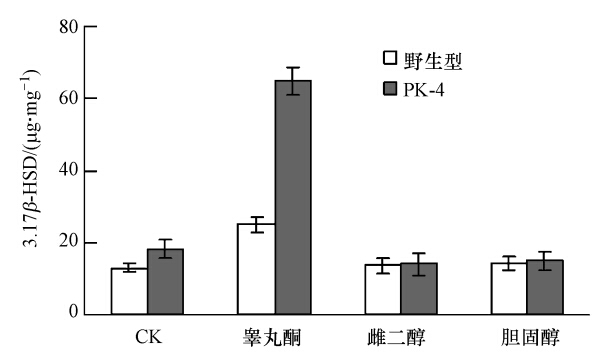 |
| 图 4 甾族化合物对野生型和突变株PK-4中3,17β-HSD表达的诱导效应 Fig. 4 Induction effect of steroid compounds on expression of 3,17β-HSD in wild-type and mutant PK-4 |
环境中各种激素类物质往往同时存在,这些物质之间往往相互作用,对微生物体内关键酶的活性或表达量产生明显影响(Cabrera et al., 2000).虽然睾丸酮丛毛单胞菌能够利用雌二醇和胆固醇为基质进行生长代谢,但二者不能诱导突变菌株和野生型菌株体内的3,17β-HSD的表达,那这两种甾族化合物能不能对睾丸酮的诱导效应产生影响?图 5表明,在1 mmol · L-1睾丸酮和0.5 mmol · L-1雌二醇以及0.5 mmol · L-1 胆固醇分别共存时,雌二醇和胆固醇几乎完全抑制了睾丸酮对野生型和突变菌中3,17β-HSD的诱导效应,说明雌二醇和胆固醇可能和睾丸酮之间存在受体竞争,导致睾丸酮的诱导效应丧失,但具体机制尚需进一步研究.同时还可以发现,不论诱导与否,突变菌株菌体内的3,17β-HSD的表达量都高于野生型菌株,再一次证明了野生型睾丸酮丛毛单胞菌中的PhaR蛋白对3,17β-HSD基因的表达具有明显的抑制效应.
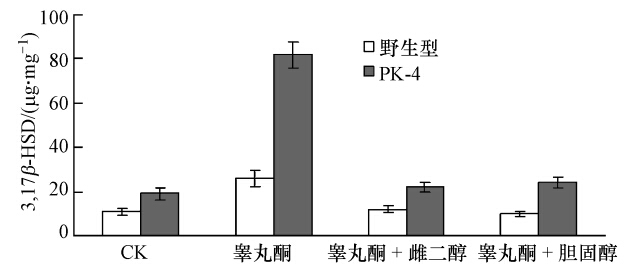 |
| 图 5 雌二醇和胆固醇对睾丸酮诱导野生型和突变株PK-4中3,17β-HSD诱导表达的影响 Fig. 5 Effect of estradiol and cholesterol on testosterone inducible expression of 3,17β-HSD in wild-type and mutant PK-4 |
将-80 ℃保存8个月后的第一代PhaR基因敲除菌株PK-4活化,连续继代培养6 d,每天测定对数生长期菌体细胞中3,17β-HSD的表达量,同时利用野生型菌株做同步对照培养和测定,结果如图 6所示.从图中可以看出,6代连续培养过程中突变菌株菌体细胞中3,17β-HSD的表达量比较稳定,且都明显高于野生型菌株菌体细胞中的3,17β-HSD表达量.结果说明,PhaR基因敲除菌株PK-4具有较高的遗传稳定性,在理论研究和实际应用方面具有潜在的价值.
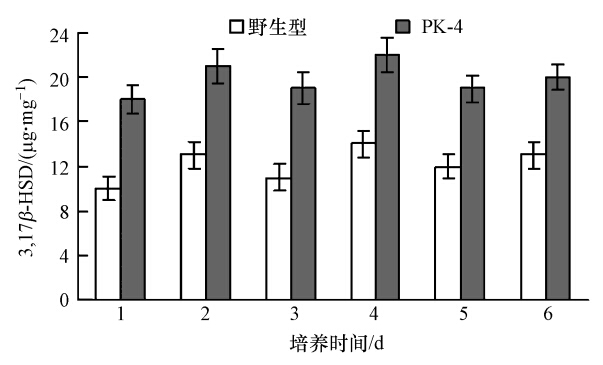 |
| 图 6 突变菌株PK-4的遗传稳定性 Fig. 6 Genetic stability of mutant strain PK-4 |
1)基于同源重组理论,利用电转化法获得了睾丸酮丛毛单胞菌PhaR基因敲除的突变菌株PK-4,该菌株具有较高的遗传稳定性.
2)分离纯化了睾丸酮丛毛单胞菌的3,17β-HSD,建立了测定3,17β-HSD表达量的ELISA方法.
3)睾丸酮丛毛单胞菌的野生株和突变株细胞内的3,17β-HSD蛋白都可被睾丸酮诱导,但不能被雌二醇和胆固醇诱导.在诱导和无诱导条件下,睾丸酮丛毛单胞菌PhaR基因敲除的突变菌株PK-4产生的3,17β-HSD蛋白量明显高于野生型菌株,表明PhaR为3,17β-HSD基因表达的抑制子.雌二醇和胆固醇可明显抑制睾丸酮对睾丸酮丛毛单胞菌3,17β-HSD的诱导效应,但在相同条件下,睾丸酮丛毛单胞菌PhaR基因敲除的突变菌株PK-4产生的3,17β-HSD蛋白量仍然明显高于野生型菌株.结果表明该突变菌株PK-4在睾丸酮类雄性激素的环境污染治理方面具有潜在的应用价值.
| [1] | 艾育芳, 潘大仁, 周以飞, 等. 2010. 改良睾丸酮丛毛单胞菌降解鸡粪甾体化合物的研究[J]. 中国农学通报, 26(2): 34-37 |
| [2] | Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 72(1/2): 248-254 |
| [3] | Cabrera J E, Pruneda Paz J L, Genti-Raimondi S. 2000. Steroid-inducible transcription of the 3β/17β-hydroxysteroid dehydrogenase gene (3β/17β-HSd) in Comamonas testosteroni[J]. The Journal of Steroid Biochemistry & Molecular Biology, 73(3/4): 147-152 |
| [4] | Gong W J, Kisiela M, Schilhabel M B, et al. 2012. Genome sequence of Comamonas testosteroni ATCC 11996, a representative strain involved in steroid degradation[J]. Journal of Bacteriology, 194(6): 1633-1634 |
| [5] | Hashimoto T, Murakanmi T. 2009. Removal and degradation characteristics of natural and synthetic estrogens by activated sludge in batch experiments [J]. Water Research, 43(3): 573-582 |
| [6] | Kolodyiej E P, Harter T, Sedlak D L. 2004. Dairy wastewater, aquaculture, and spawning fish as sources of steroid hormones in the aquatic environment [J]. Environmental Science and Technology, 38(23): 6377-6384 |
| [7] | 李明堂, 王清爽, 于源华. 2011. 睾丸酮丛毛单胞菌LysR基因的克隆及对3α-HSD/CR表达的调节[J]. 吉林农业大学学报, 33(6): 624-627 |
| [8] | Pruneda-Paz J L, Linares M, Cabrera J E, et al. 2004. Identification of novel steroid inducible gene associated with the βhsd locus of Comamonas testosteroni [J]. The Journal of Steroid Biochemistry & Molecular Biology, 88(1): 91-100 |
| [9] | Sambrook J, Russel D W. 2001. Molecular Cloning: A Laboratory Manual[M]. New York: Cold Spring Harbor Laboratory Press |
| [10] | Sang Y Y, Xiong G M, Maser E. 2011. Steroid degradation and two steroid-inducible enzymes in the marine bacterium H5 [J]. Chemico-Biological Interactions, 191(1/3): 89-94 |
| [11] | Snyder S A, Villeneuve D L, Snyder E M, et al. 2001. Identification and quantification of estrogen receptor agonists in wastewater effluents [J]. Environmental Science and Technology, 35(18): 3620-3625 |
| [12] | Van der Geize R, Hessels G I, Nienhuis-Kuiper M, et al. 2008. Characterization of a second Rhodococcus erythropolis SQ1 3-ketosteroid 9α-hydroxylase activity comprising a terminal oxygenase homologue, KshA2, active with oxygenase-reductase component KshB [J]. Applied and Environmental Microbiology, 74(23): 7197-7203 |
| [13] | Zhang T D, Xiong G M, Maser E. 2010. Characterization of the steroid degrading bacterium S19-1 from the Baltic Sea at Kiel, Germany [J]. Chemico-Biological Interactions, 191(1/3): 83-88 |
 2014, Vol. 34
2014, Vol. 34


