近年来,我国SO2和NOx的年排放量均超过2000万t,对环境造成了严重的污染(2012年《中国环境状况公报》).钢铁联合企业是除电力行业外的SO2和NOx的主要来源,尤其是铁前系统的烧结工序,其SO2和NOx排放量分别占据了钢铁联合企业SO2和NOx排放的90%和48%(廖继勇等,2008),同时还是二 英和其它含重金属粉尘的重要来源.随着烧结矿产量的大幅度增加,烧结机的大型化发展,烧结污染物的排放会进一步增加,因此,钢铁工业的减排压力日益剧增.但同时我国的烧结烟气脱硫工业刚刚起步,高效、稳定和经济运行的脱硫脱硝技术尚未过关,随着《钢铁工业污染物排放标准》的实施,对多污染物进行协同控制成为烧结烟气污染物治理的目标.目前,烧结烟气污染物治理技术还是秉承了传统的、单一功能的烟气污染治理方法,而长流程的治理工艺系统具有装置占地面积大、运行成本高的特点,对老的烧结工艺系统而言发展空间成为烧结烟气治理的主要限制因素.不同于电力行业,烧结工艺属于中间工艺,烧结烟气的特点是SO2浓度负荷变化大、烟气温度波动范围宽、水分体积大且不稳定、污染物组分多,其处理的难度要比电力行业大.因此,开发稳定有效的多污染物协同治理的烧结烟气治理技术成为国内外研究的热点.
目前,湿法烟气脱硫技术的应用已在电力行业较为成熟,并以钙法和氨法为主,在不同条件下各具优势.烟气脱硝技术目前以干法为主,主要有SCR和SNCR工艺,但由于其高温和催化剂的反应,在烧结烟气脱硝中的应用还具有一定难度.从烧结系统出来的烟气中NOx 95%以上都是NO,其溶解度很低,以至于湿法脱氮技术也受到限制.针对NO的物理化学特点,国内外学者在湿法脱硝上也进行了大量的研究,尤其是在采用FeⅡEDTA络合剂单独吸收NO及同时脱硫脱硝的方法方面做了较多研究(Zhang et al., 2012; Chien et al., 2009; Wu et al., 2008; Zhu et al., 2010; Wang et al., 2007).研究结果表明,FeⅡEDTA络合剂对NO络合吸收反应为快速的拟一级反应过程,因此,具有较高的络合吸收效率.基于此,本文结合氨法脱硫效率高且无污染物形成的特点,采用硫酸亚铁与乙二胺四乙酸二钠配成FeⅡEDTA络合剂,并用氨水复配FeⅡEDTA络合剂,进行复配氨水对烧结烟气协同脱硫脱硝过程的研究,以实现高效同步脱硫脱硝,提出协同治理烧结烟气SO2和NO的新技术路线.
2 实验部分(Experiment section) 2.1 试剂与仪器试剂:乙二胺四乙酸二钠(EDTA-二钠,质量分数≥99.0%),FeSO4 · 7H2O,氨水(质量分数25%~28%),NO(体积分数为10%,高纯N2和NO的混合气体),N2,SO2(体积分数≥99.9%).
仪器:pHS-25酸度计、质量流量计(CS200)、KM-940烟气分析仪.
2.2 吸收液的配置将FeSO4 · 7H2O晶体溶解在以物质的量比1∶1配置的100 mL的EDTA水溶液中,配置成FeⅡ EDTA络合剂溶液.根据计算值用移液管取适量(10、30、40、50、60 mL)的浓氨水至80 mL的去离子水中,用硫酸调节pH值到9左右,然后将之前配置好的络合剂与配置的稀氨水混合均匀,再用稀硫酸调节pH到规定值(4.5、5.5、6.5、7.5、8.5),最后用250 mL的容量瓶定容.
2.3 实验装置及流程吸收实验在250 mL的鼓泡圆底烧瓶中进行,吸收液体积250 mL,实验流程如图 1所示.模拟烟气的流量为1.5 L · min-1,NO的进口浓度为250 ppm,SO2的进口浓度为1700 ppm.NO和SO2的进、出口浓度由烟气分析仪检测.
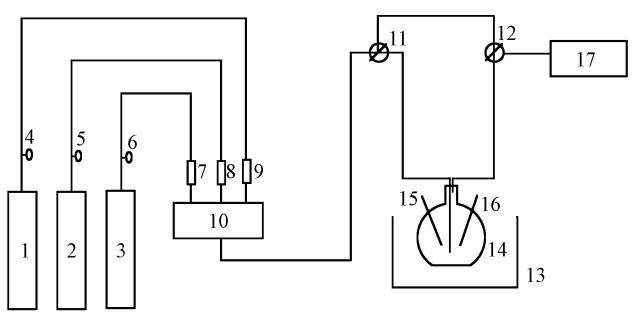 |
| 图 1 实验流程示意图(1,2,3: 氮气、SO2、NO气体钢瓶;4,5,6: 钢瓶减压阀;7,8,9: 质量流量计;10: 缓冲瓶;11,12: 玻璃三通;13: 油浴;14: 鼓泡反应器;15: 温度计;16: pH计;17: 烟气分析仪) Fig. 1 Schematic diagram of the experimental set-up |
氨水复配FeⅡEDTA同时吸收SO2和NO是分别利用氨水吸收SO2和FeⅡEDTA络合NO的原理,吸收液中的组分进一步反应产生N-S化合物(Sada et al.,1987),该过程的主要化学反应为:
1)氨水吸收SO2:

以上反应式中,氨水脱硫生成的SO2-3和HSO3-对FeⅡEDTA(NO)和FeⅢEDTA还原为FeⅡEDTA有促进作用,并且氨水脱硫和络合剂脱硝之间并没有干扰作用,给氨水和FeⅡEDTA复配液同时脱硫脱硝提供了理论基础.
3.2 NH3-NH+4总浓度的影响分别取25%的氨水10、30、40、50和60 mL与FeⅡEDTA复配后,调节pH值到6.5,定容至250 mL.其中,FeⅡEDTA的浓度为0.01 mol · L-1,NH3-NH+4的总浓度分别为0.5542、1.6057、2.1412、2.6764和3.4572 mol · L-1,游离氨的浓度分别为0.0038、0.0113、0.0556、0.1004和0.1204 mol · L-1,相邻浓度间剩余游离氨浓度的相对增长率分别为197%、392%、81%、20%,在NH3-NH+4的总浓度达到2.1412 mol · L-1时,游离氨的相对增长率达到最大值.如图 2a所示,在吸收反应的初始阶段,脱硫率均在95%以上,随着反应吸收过程的进行,吸收效率均会出现急剧下降的拐点.在NH3-NH+4总浓度小于2.1412 mol · L-1时,随着NH3-NH+4浓度的增加,维持较高脱硫率的时间有所延长;当NH3-NH+4浓度增加到2.1412 mol · L-1后,随着NH3-NH+4浓度的进一步增加,维持较高脱硫率的时间增加不明显.根据计算结果,当NH3-NH+4浓度达到2.1412 mol · L-1以后,剩余游离氨浓度的相对增长率急剧下降,此时吸收液的脱硫容量相近,达到实验吸收拐点的时间几乎相同.图 2b所示为NH3-NH+4浓度对脱硝率的影响,在本体系所考虑的NH3-NH+4浓度范围内,随NH3-NH+4浓度的增加,脱硝率先增后降,在NH3-NH+4浓度为2.1412 mol · L-1时具有最大的脱硝率.根据pH值调节后游离氨浓度的计算,当NH3-NH+4的浓度大于2.1412 mol · L-1以后,吸收液对SO2的吸收容量相近,因此,脱硫后总的S(Ⅳ)浓度基本相同,S(Ⅳ)组分对FeⅢEDTA的还原能力相近;但随着NH3-NH+4浓度的增加,吸收液中的SO2-4浓度就越高,过多的SO2-4会占用一部分的FeⅡEDTA配体(董立,2011),导致脱硝率下降.综合考虑NH3-NH+4浓度对脱硫率和脱硝率的影响,选择最适宜的NH3-NH+4浓度为2.1412 mol · L-1,最大脱硫率和脱硝率分别达到99%和53%左右.
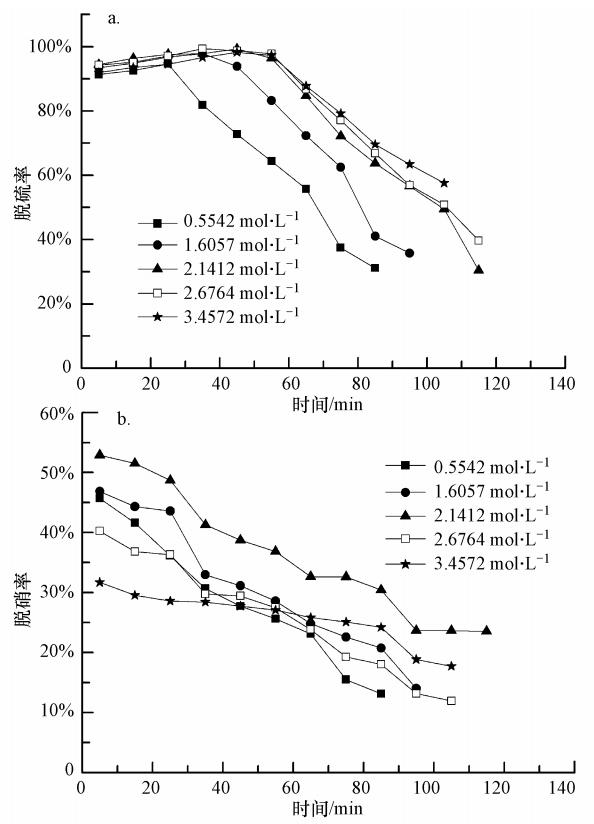 |
| 图 2 NH3-NH+4浓度对脱硫率和脱硝率的影响(C(FeⅡEDTA)=0.01 mol · L-1,pH=6.5,50 ℃,CNO=250 ppm,CSO2=1700 ppm) Fig. 2 Effect of total concentration of NH3 and NH+4 on SO2 removal and NO removal |
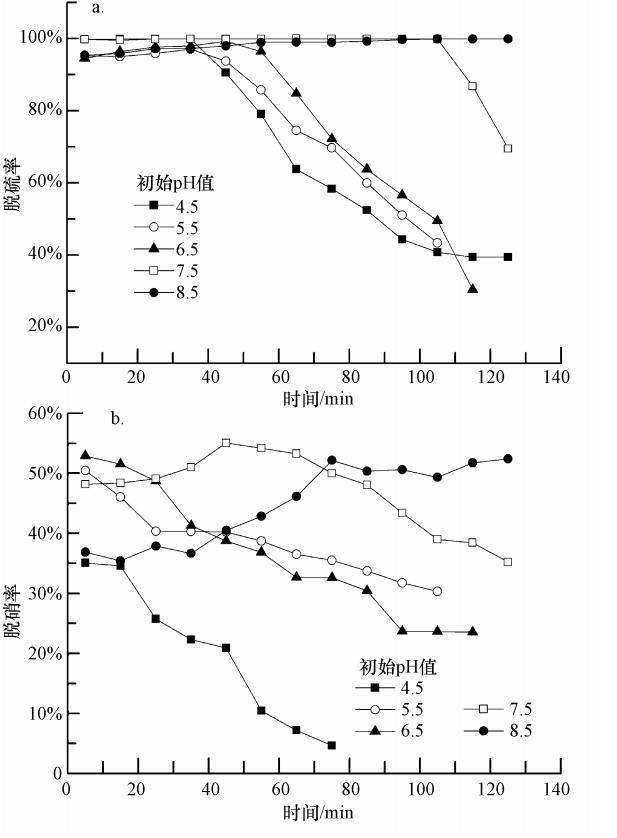
根据实际烟气工况,研究中选择反应吸收温度为30、40、50、60和70 ℃,取25%的氨水40 mL与FeⅡEDTA复配后,调节pH值为6.5,NH3-NH+4浓度为2.1412 mol · L-1,FeⅡEDTA的浓度为0.01 mol · L-1,实验结果见图 3.图 3a表明,当温度在30、40和50 ℃时,前60 min内脱硫率保持在90%以上;随着温度的升高,脱硫率下降较快,当温度达到60 ℃和70 ℃时,脱硫率在20 min后就开始快速下降.这主要是因为氨水脱硫反应是放热反应,因此,温度升高不利于吸收SO2.同时图 3b所示的实验结果表明,温度升高同样也不利于NO吸收.FeⅡEDTA络合NO是放热反应,如式(12)(Chang et al.,1983)所示,温度升高不利于反应正向进行;其次,NO在水中的溶解度随着温度的升高而减小,因此,温度升高增大了气-液相之间的传质阻力,会降低NO的吸收效率.但升高温度也能增大FeⅡEDTA络合NO的吸收速度,因此,50 ℃条件下,前60 min的脱硝率高于30 ℃时,且在整个吸收过程中的吸收效率一直高于40 ℃时的原因就是温度升高加快络合吸收速度的有利因素占据了主导地位.马碧瑶(2004)研究发现,当吸收液温度从40 ℃升高到50 ℃时,FeⅡ(CyS)2络合吸收NO的吸收速度加快了35%左右.推测同一类络合剂FeⅡEDTA有类似性质,才导致在本研究的前100 min内,50 ℃时的脱硝率一直高于40 ℃时的脱硝率.综合考虑烧结烟气的实际工况及脱硫脱硝率,确定50 ℃为最佳的协同吸收温度.
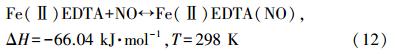
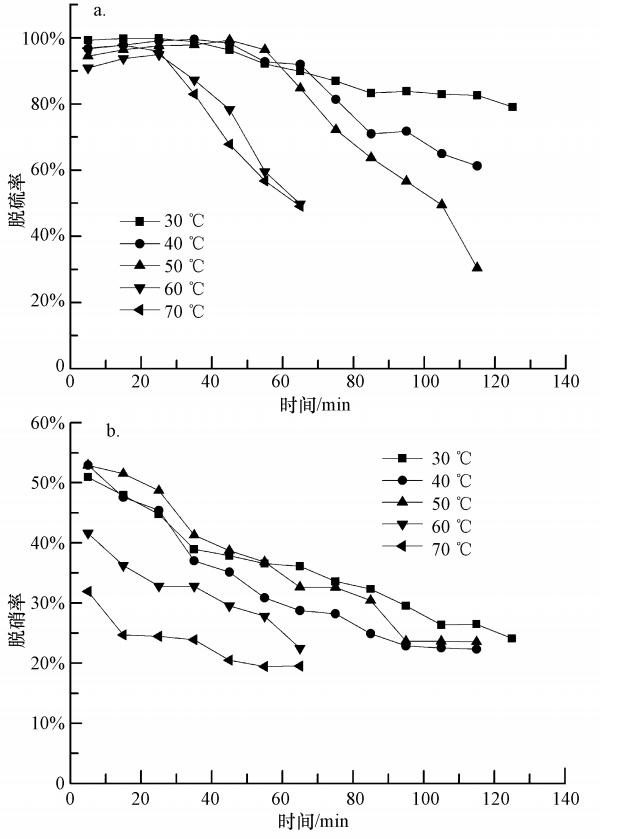 |
| 图 3 温度对脱硫率和脱硝率的影响(C(NH3-NH+4)=2.1412 mol · L-1,C(FeⅡEDTA)=0.01 mol · L-1,pH=6.5,CNO=250 ppm,CSO2=1700 ppm) Fig. 3 Effect of temperature on SO2 and NO removal |
本研究中取25%氨水40 mL与FeⅡEDTA溶液复配后,调节pH值分别为4.5、5.5、6.5、7.5和8.5,FeⅡEDTA浓度为0.01mol · L-1,实验结果见图 4.由图 4a可知,pH值越大,脱硫率越高.这是因为氨水脱硫实质上就是酸碱中和反应,因此,pH值越高,吸收液中游离氨浓度越大,进而脱硫率越高.由图 4b可知,pH为4.5时脱硝率较低,pH为5.5和6.5时脱硝率较好,pH为7.5和8.5时脱硝率开始时较低,随着反应的进行,脱硝率开始上升,达到最大值后又开始下降.EDTA中非离子化的羧酸不是一个有效的供电子,但当pH值提高使羧基解离后所形成的羧酸离子就能有效地提供电子,从而提高螯合效率,因此,螯合作用常在偏酸性条件下随着pH值的增加得到加强(凌关庭等,2003).随着pH变化到碱性范围,OH-与Fe2+的反应过程导致络合吸收NO的有效组分降低,从而导致脱硝率下降.不同pH值下EDTA(下式以Y表示)络合亚铁的存在形式见式(13)(丁毓怡等,1986).
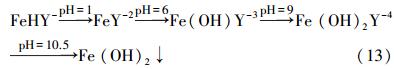
 |
| 图 4 吸收液初始pH值对脱硫率和脱硝率的影响(C(NH3-NH+4)=2.1412 mol · L-1,C(FeⅡEDTA)=0.01 mol · L-1,50 ℃,CNO=250 ppm,CSO2=1700 ppm) Fig. 4 Effect of solution initial pH value on SO2 and NO removal |
在酸性条件下,FeⅡEDTA主要以FeⅡHEDTA形式存在,对NO没有络合能力,因此,pH为4.5时,吸收效率明显较低;随着pH升高至6附近,溶液主要以FeⅡEDTA形式存在,从络合反应过程来看,此时吸收液中具有最大的FeⅡEDTA浓度,该pH值条件下吸收液对NO具有最大的络合吸收能力,因此,当pH为6.5时,初始的瞬时脱硝率最高;随着pH继续升高,相应络合剂的稳定常数有较大的降低(表 1),游离的Fe2+和溶液中的OH-生成没有络合能力的Fe(OH)2,因此,随着pH值升高吸收液逐渐失去吸收NO的能力.实验结果表明,为保证较高的脱硝率,复配溶液适宜的pH值条件应选择为偏酸性,从工业应用角度而言,由于吸收液的停留时间较短,仅2.5 s左右,根据图 4b选择初始pH为6.5.吸收一段时间后溶液pH值的变化见图 5,可以看出,吸收液pH值主要随脱硫率的变化而变化.
| 表1 在不同pH下EDTA络合亚铁组成稳定常数(丁毓怡等,1986) Table.1 Stability constant of EDTA complexing ferrous at different pH value |
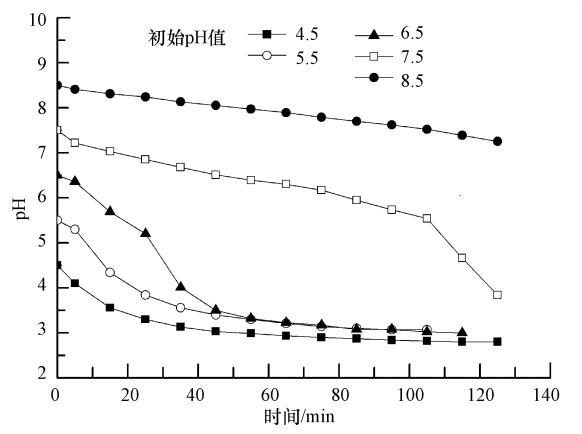 |
| 图 5 吸收液吸收SO2和NO过程中溶液pH的变化 Fig. 5 Plots of pH value with time during absorption of SO2 and NO by solution |
实验中取25%的氨水40 mL复配FeⅡEDTA溶液,设置pH值为6.5,吸收液中NH3-NH+4浓度为2.1412 mol · L-1,FeⅡEDTA络合剂浓度分别为0.005、0.01、0.02、0.03、0.05和0.08 mol · L-1,实验结果见图 6.由图 6a可见,随着FeⅡEDTA络合剂浓度的增大,脱硫率长时间保持在较高的水平.这是因为生成的SO2-3和HSO2-3会与更多的FeⅡEDTA(NO)反应,使得NH3与SO2的正向反应更快.由图 6b可见,随着络合剂浓度增加,脱硝率逐渐升高,在其浓度增加到0.03 mol · L-1时,脱硝率达到69%左右,和0.05 mol · L-1时的脱硝率相差不大.考虑到脱硝率和经济性,宜选择络合剂的浓度为0.03 mol · L-1.
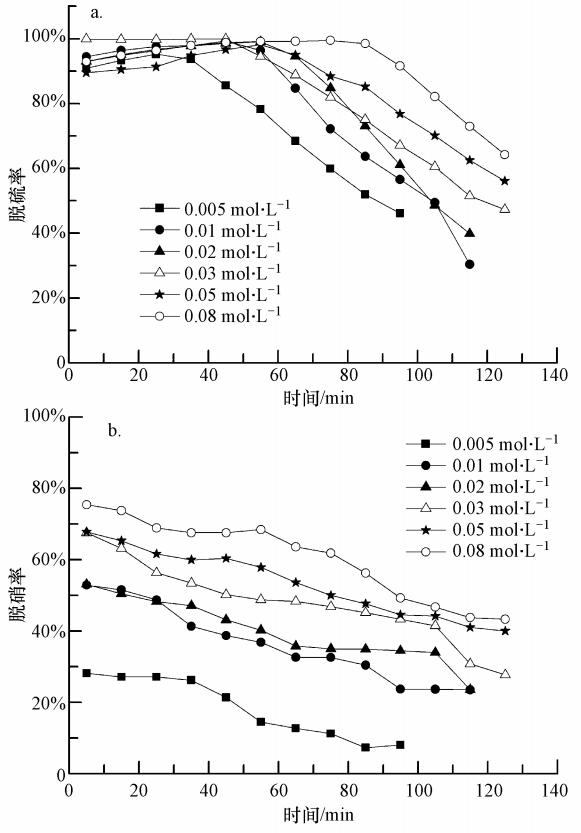 |
| 图 6 EDTA亚铁络合剂浓度对脱硫率和脱硝率的影响(C(NH3-NH+4)=2.1412 mol · L-1,pH=6.5,50 ℃,CNO=250 ppm,CSO2=1700 ppm) Fig. 6 Effect of FeⅡEDTA concentration on SO2 and NO removal |
为了比较与氨水复配的其它添加剂对脱硝率的影响,选择了高锰酸钾、尿素、三乙醇胺、氯化钴这4种催化剂.由图 7可见,当添加剂为尿素、三乙醇胺、氯化钴时,脱硝率均只有25%左右.尿素和氨水脱除NO的原理一样,将NO还原为N2(Fang et al.,2011),在氨水体系中继续加还原剂,效果不明显.三乙醇胺作为有机类缓冲溶剂(陆雅静等,2008),在氨水体系中脱硝只是一个中间反应物,起催化作用,但催化效果并不明显.氯化钴和氨水可以生成钴类络合物,对NO也有络合效果,但50 ℃时,仅有73.43%的六氨合钴形成,80 ℃时络合剂的形成才比较完全(Long et al., 2004),但温度越高对装备要求及能量消耗会越高.添加剂为高锰酸钾时,高锰酸钾将NO氧化为NO2(雷鸣等,2006),最高脱硝率达到31%左右.添加剂为FeⅡEDTA时,最高脱硝率达到了52%左右,结合实际烧结烟气脱硫的工艺条件,气液接触温度在55 ℃左右,因此,FeⅡEDTA作为氨水的复配组分更适合.综上所述,在氨水体系中实现同时脱硫脱硝最适宜的NO络合剂为FeⅡEDTA.
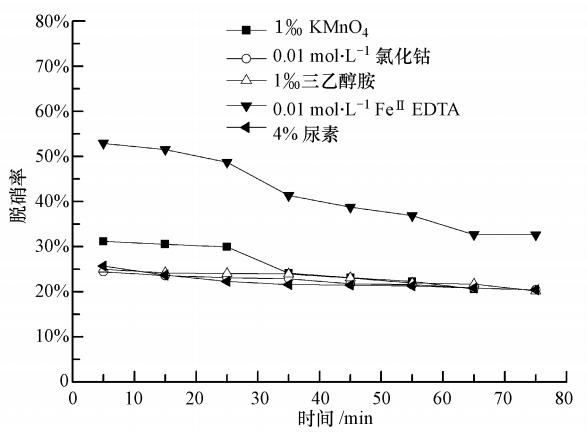 |
| 图 7 不同添加剂对脱硝率的影响(pH=6.5,50 ℃,CNO=250 ppm,CSO2=1700 ppm) Fig. 7 Effect of NO removal with different absorbents |
1)在硫酸为pH值调节剂的条件下,NH3-NH+4浓度达到2.1412 mol · L-1时,游离氨的相对增长率达到最大值,再增加NH3-NH+4浓度,其脱硫容量增加不大;温度升高,脱硫率减小;pH值增大,脱硫率增大;FeⅡEDTA的浓度越大,脱硫率能更长时间地保持在较高水平.
2)当NH3-NH+4浓度达到2.1412 mol · L-1以后,pH值调节引入的SO2-4对NO吸收有明显的抑制作用,尤其在高浓度氨水中其抑制作用越明显;温度升高,脱硝率减小;当pH值在6左右时,亚铁离子与EDTA的络合常数最大,此时液相中以FeⅡEDTA形式存在,其浓度达到最大值,此时吸收液具有良好的脱硝性能;FeⅡEDTA浓度增加到0.03 mol · L-1以后,脱硝率的增大趋势随着络合剂浓度的增大变缓.
3)在pH为6.5,温度为50 ℃条件下,通过与氯化钴、KMnO4、三乙醇胺、尿素和氨水复配后的溶液吸收NO的过程比较研究,发现 FeⅡEDTA是氨水在工业条件下的最佳复配剂,可实现烟气中SO2和NO双组份协同去除.
4)综合以上结论,获得本研究体系氨水/FeⅡEDTA溶液同时脱硫脱硝的适宜工艺条件是:NH3-NH+4浓度为2.1412 mol · L-1,FeⅡEDTA浓度为0.03 mol · L-1,温度为50 ℃,吸收液初始pH值为6.5,此条件下可达到最高的脱硫率和脱硝率分别为100%和69%.
| [1] | Chan g S G,Littlejohn D,Lynn S.1983.Effects of metal chelates on wet gas scrubbing chemistry[J].Environment Science and Technology,17(11):649-653 |
| [2] | Chien T W,Hsueh H T,Chu B Y,et al.2009.Absorption kinetics of NO from simulated flue gas using Fe(Ⅱ)EDTA solutions[J].Process Safety and Environmental Protection,87(5):300-306 |
| [3] | 丁毓怡,刘小东,方文骥.1986.EDTA络合铁法脱硫试验研究总结[J].河南化工,(1):13-20 |
| [4] | 董立.2011.Fe(Ⅱ)NTA同时脱硫脱硝过程研究.上海:华东理工大学 |
| [5] | Fang P,Cen C P,Tang Z X,et al.2011.Simultaneous removal of SO2 and NOx by wet scrubbing using urea solution[J].Chemical Engineering Journal,168(1):52-59 |
| [6] | 雷鸣,岑超平,胡将军.2006.尿素/KMnO4湿法烟气脱硫脱氮的试验研究[J].环境科学研究,19(1):43-46 |
| [7] | 廖继勇,储太山,刘昌齐,等.2008.烧结烟气脱硫脱硝技术的发展与应用前景[J].烧结球团,33(4):1-5 |
| [8] | 凌关庭,唐述潮,陶明强.2003.食品添加剂手册[M].北京:化学工业出版社.639 |
| [9] | Long X L,Xin Z L,Wang H X,et al.2004.Simultaneous removal of NO and SO2 with hexamminecobalt(Ⅱ) solution coupled with the hexamminecobalt(Ⅱ) regeneration catalyzed by activated carbon[J].Applied Catalysis (B:Environmental),54(1):25-32 |
| [10] | 陆雅静,熊源泉,高鸣,等.2008.尿素/三乙醇胺湿法烟气脱硫脱硝的试验研究[J].中国电机工程学报,28(5):44-50 |
| [11] | 马碧瑶.2004.络合吸收NO传质-反应动力学及Fe(Ⅲ)生物还原研究.杭州:浙江大学 |
| [12] | Sada E,Kumarawa H,Takada Y.1987.Chemical reactions accompanying absorption of NO into aqueous mixed solutions of FeⅡ-edta and Na2SO3[J].Industrial & Engineering Chemistry Fundamentals,23(1):60-64 |
| [13] | Wang L,Zhao W R,Wu Z B.2007.Simultaneous absorption of NO and SO2 by FeⅡEDTA combined with Na2SO3 solution[J].Chemical Engineering Journal,132(1/3):227-232 |
| [14] | Wu Z B,Wang L,Zhao W R.2008.Kinetic study on regeneration of FeⅡEDTA in the wet process of NO removal[J].Chemical Engineering Journal,140(1/3):130-135 |
| [15] | Zhang L L,Wang J X,Sun Q,et al.2012.Removal of nitric oxide in rotating packed bed by ferrous chelate solution [J].Chemical Engineering Journal,181-182:624-629 |
| [16] | Zhu H S,Mao Y P,Yang X J,et al.2010.Simultaneous absorption of NO and SO2 into FeⅡ-EDTA solution coupled with the FeⅡ-EDTA regeneration catalyzed by activated carbon [J].Separation and Purification Technology,74(1):1-6 |
 2014, Vol. 34
2014, Vol. 34


