2. Department of Civil and Environmental Engineering, Rice University, Houston 77005, USA
2. Department of Civil and Environmental Engineering, Rice University, Houston 77005, USA
三氯乙烯(TCE)是无色透明、具有氯仿气味的重质非水相液体(DNAPLs)(Zhang et al.,2011),在众多领域得到广泛使用,但由于使用不当和任意排放,已对土壤和地下水环境产生了严重的污染(Barrabés et al., 2010).目前已有多种TCE修复技术,其中,主要有汽提法(Kim et al., 2007)、抽出处理技术(Rivett et al.,2006)、渗透性反应墙技术(Thiruvenkatachari et al.,2008)、原位生物修复((Rabbi et al.,2000;Hazen et al.,2009)和原位金属修复技术(Johnson et al.,2008)等.原位生物修复因具有费用低、脱氯彻底、不造成二次污染等优势,引起了人们的广泛关注.
在地下水环境中有众多能将TCE还原脱氯的脱氯菌,研究发现,许多厌氧菌可以直接将TCE还原脱氯到顺二氯乙烯,如Dehalospirillum multivorans(Miller et al., 1997)、Dehalobacter(Nelson et al.,2011).而Science中报道的产乙烯脱卤拟球菌(Dehalococcoides ethenogenes)可以将四氯乙烯(PCE)和TCE完全脱氯为无毒的乙烯(Maymó-Gatell et al.,1997),其产物的无毒性引起学者们的广泛关注,并已被成功地应用于四氯乙烯污染的生物强化实验研究(Da Silva et al.,2006).但产乙烯脱卤拟球菌具有特殊的代谢特性,仅利用氢作为电子供体(Chung et al.,2008).因此,有学者将纳米铁与产乙烯脱卤拟球菌进行耦合,利用纳米铁与水反应生成的活性氢为脱氯菌提供电子,来维持其脱氯活动,结果表明,纳米铁对脱氯活动有促进作用(修宗明等,2009).但另一方面,零价纳米铁具有抗菌活性(Auffan et al., 2009;Noubactep,2011;Auffan et al.,2008).研究表明,零价纳米铁对大肠杆菌(Escherichia coli.)纯培养液具有杀菌作用,主要是由于膜吸附作用及腐蚀产生的Fe2+诱发产生活性氧(Lee et al.,2008;Kim et al.,2010).王学等(2012)研究发现,零价纳米铁对大肠杆菌的毒性机制为氧化损伤.Chen等(2012)研究表明,零价纳米铁对Bacillus subtilis具有灭活作用.因此,零价纳米铁为脱氯菌提供电子供体的过程中会不会对土著微生物产生负面影响,是否会对脱氯菌的功能和结构具有生物效应,这些都是亟需解决的问题.
鉴于此,本文以产乙烯脱卤拟球菌为主体的产乙烯脱卤菌群(Dehalococcoides spp.)为研究对象,通过气相色谱、PCR-DGGE等技术研究纳米铁对其脱氯性能和物种多样性产生的影响,综合分析纳米铁对产乙烯脱卤菌群的潜在效应,以期为纳米铁与产乙烯脱卤菌群的联合应用的可行性提供理论依据,并为从基因水平上研究纳米材料对微生物的毒性效应奠定基础.
2 材料与方法(Materials and methods) 2.1 产乙烯脱卤菌群实验采用的产乙烯脱卤菌群为从氯乙烯污染场址土壤中提取、富集、培养的菌群,能够有效地将TCE等有机氯污染物还原脱氯(Zheng et al., 2001).实验所有的产乙烯脱卤菌群采用间歇式培养的方法,每隔一段时间更换部分培养液,以使其水力停留时间维持在80 d左右,并以0.1 mol · m-3 · d-1的量投加TCE(溶于甲醇溶液,TCE与甲醇的摩尔比为1 ∶ 10)对其进行培养.菌群以甲醇为基质与TCE进行共代谢,且TCE易挥发,将其溶解在甲醇溶液中既可减少其挥发又提供了共代谢基质.菌群的初始浓度保持在5.0×106 cell · mL-1左右,其还原脱氯能力为240 μmol · L-1 · d-1(以TCE计).
2.2 化学试剂及仪器试剂:FeSO4 · 7H2O、聚乙二醇、KBH4、NaOH、无水乙醇等试剂均为国产分析纯试剂;三氯乙烯(99%)、二氯乙烯(99.1%)、甲醇(Super Pure)均为J& K Chemical产品;HEPES缓冲试剂(AR,生工);气体标准样品(体积比)为乙烯(1%)、乙烷(99.95%),均以氦气平衡.
仪器:厌氧培养箱(上海福玛),气浴恒温振荡器(上海比朗仪器),Clarus 500气相色谱(Perkin-Elmer),SevenEasy Plus pH计/电导率仪(METTLER TOLEDO),离心机(瑞江),Tanon EPS 300电泳仪(Tanon),全自动数码凝静图像分析系统(Tanon),PTC-100 Thermal Cycler(BIO-RAD),DcodeTM universal mutation detection system(BIO-RAD),CFX Connect Real-Time System(BIO-RAD),透射电子显微镜(T-20,飞利浦).
2.3 分析方法TCE及其还原脱氯产物用Clarus 500气相色谱仪采用顶空法测定.采用FID火焰离子化检测器,检测温度为300 ℃.色谱柱类型:6 ft. × 1/8 in. o.d.,60/80 Carbopack B/1% SP-1000(Xiu et al.,2010a).气相色谱柱温度程序为:50 ℃保持2 min,以35 ℃ · min-1速度升温至200 ℃,在200 ℃持续6 min.氦气作为载气,载气流速为2 mL · min-1.
TCE及其还原脱氯产物用Clarus 500气相色谱仪采用顶空法测定.采用FID火焰离子化检测器,检测温度为300 ℃.色谱柱类型:6 ft. × 1/8 in. o.d.,60/80 Carbopack B/1% SP-1000(Xiu et al.,2010a).气相色谱柱温度程序为:50 ℃保持2 min,以35 ℃ · min-1速度升温至200 ℃,在200 ℃持续6 min.氦气作为载气,载气流速为2 mL · min-1.
2.4 纳米Fe0粒子的制备采用Wang等(2006)提出的液相还原法制备纳米Fe0粒子.在氮气保护下,在醇-水体系(V/V,4 ∶ 1)中以聚乙二醇为分散剂,用KBH4液相还原FeSO4 · 7H2O,反应方程式为:Fe2+ + 2BH-4 + 6H2O → Fe0 + 2B(OH)3 + 7H2(g).待反应完成后,用脱氧去离子水洗涤3次,最后在氮气保护下烘干,得到纳米Fe0粒子.
2.5 产乙烯脱卤菌群脱氯实验实验均在手套式厌氧培养箱内进行操作,并使温度保持在25 ℃的恒温状态下,以保证菌群在恒温下的稳定生长.接种前采用混合气体(10% CO2、10% H2,以N2平衡)曝气30 min,吹脱掉所有残留的有机氯污染物,随后将10 mL菌群接种到250 mL棕色顶空瓶中,加入HEPES缓冲溶液(终浓度为60 mmol · L-1),用厌氧培养液补充至100 mL,加入37.1 μmol的TCE,使反应体系的TCE初始浓度约为50 mg · L-1.实验中以高温高压杀菌后的菌液作为空白对照.
随后将在厌氧培养箱内建立的反应瓶移出厌氧培养箱,置于振荡器上,在25 ℃、200 r · min-1的条件下进行反应.间隔一定时间取顶空瓶内气体样品测定TCE及其还原脱氯产物的量随时间的变化趋势.
2.6 纳米Fe0粒子与菌群联合脱氯实验在纳米Fe0粒子与菌群联合脱氯实验中,接种前处理过程与产乙烯脱卤菌群脱氯实验相同.接种后加入不同浓度纳米Fe0粒子的悬浮液和HEPES缓冲溶液,用厌氧培养液补充至100 mL,相应地加入37.1 μmol的TCE.整个反应体系中含有10 mL产乙烯脱卤菌群混合菌液、60 mmol · L-1的HEPES缓冲溶液、TCE及纳米Fe0粒子,用培养液定容至100 mL.TCE的浓度约为50 mg · L-1(37.1 μmol),纳米Fe0粒子的浓度分别为0.10、0.25、0.50、0.75和1.00 g · L-1.
将反应瓶移出厌氧培养箱,在25 ℃、200 r · min-1的条件下振荡反应.间隔一定时间从顶空瓶内取气体样品测定TCE及其还原脱氯产物的量随时间的变化趋势.
2.7 基因组DNA提取、PCR扩增及DGGE分析在以上各反应体系反应20 d后取反应菌液1.5 mL,采用Ezup柱式细菌基因组DNA抽提试剂盒(上海生工)提取总DNA.采用GC-341F(5′- CCTACGGGAG GCAGCAG -3′)和517R(5′- ATTACCGCGGCT GCTGG -3′)作为引物进行聚合酶链式反应(PCR)来扩增 16S rRNA V3 区基因片段(Muyzer et al., 1993).反应体系体积为50 μL,反应体系中含有正反向引物(终浓度0.2 μmol · L-1)、Taq酶(1.25 U)、dNTPs(终浓度0.2 mmol · L-1)、MgCl2(终浓度1.5 mmol · L-1),灭菌水定容至50 μL.PCR反应条件为:94 ℃预变性5 min,然后94 ℃变性1 min,55 ℃复性1 min,72 ℃延伸1 min,30循环,72 ℃延伸5 min.用1×TAE琼脂糖凝胶(1%,g · mL-1)电泳检测 PCR产物.
对PCR扩增产物进行变性梯度凝胶电泳,分析物种多样性.配制6%聚丙烯酰胺浓度、30%~50%变性梯度的聚丙烯凝胶,采用DcodeTM Universal Mutation Detection System在65 ℃、60 V电压下电泳 16 h.电泳结束后用SYBR Green I染色剂对凝胶染色30 min,并用凝胶图像系统分析.同时对各条带进行测序分析.
2.8 产乙烯脱卤拟球菌形态变化表征通过PCR-DGGE技术从宏观上分析纳米Fe0粒子对产乙烯脱卤菌群物种多样性的影响,为进一步探索纳米Fe0粒子对细菌细胞结构完整性的影响,本文利用透射电子显微镜(TEM)观察产乙烯脱卤拟球菌与纳米Fe0粒子(0.50 g · L-1)接触前和接触后细胞的形态变化.
3 结果(Results) 3.1 产乙烯脱卤拟球菌形态变化表征结果图 1为产乙烯脱卤拟球菌与纳米Fe0粒子(0.5 g · L-1)接触前后的TEM图.由图 1a可知,无纳米Fe0粒子存在时,产乙烯脱卤拟球菌细胞为椭球状,细胞周围均匀、光滑,有鞭毛.由图 1b和1c可知,产乙烯脱卤拟球菌与纳米Fe0粒子接触后,产乙烯脱卤拟球菌吸附了纳米Fe0粒子,与纳米Fe0粒子接触的细胞表面变得模糊,轻度破损,而未与纳米Fe0粒子接触的细胞表面仍比较均匀,且细胞没有破裂.
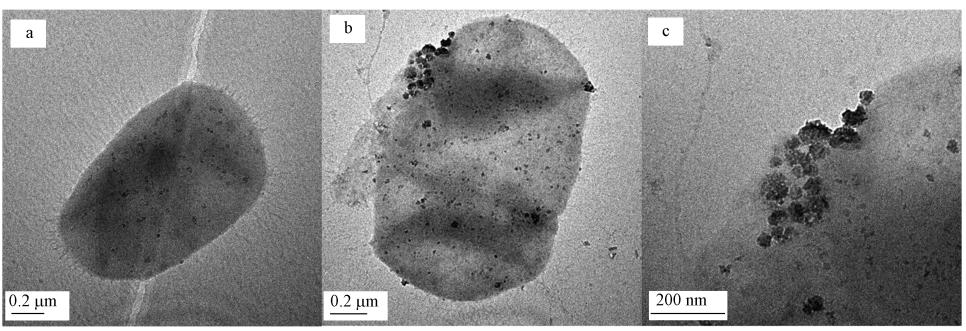 |
| 图 1 产乙烯脱卤拟球菌与纳米Fe0粒子接触前(a)和接触后(b、c)的TEM图 Fig. 1 TEM images of Dehalococcoides ethenogenes(a.untreated,b,c.mixed with NZVI) |
实验采用的反应体系中TCE的浓度为50 mg · L-1(37.1 μmol),TCE的还原脱氯结果如图 2所示.由图 2可知,相同时间内TCE的去除率与纳米Fe0粒子的投加有关,随投纳米Fe0粒子浓度的增加明显增大:产乙烯脱卤菌群几乎可在 120 h内将37.1 μmol 的TCE完全脱氯,纳米Fe0粒子浓度为0.25 g · L-1时几乎可在72 h 内将TCE完全脱氯,纳米Fe0粒子浓度为0.50、0.75和1.00 g · L-1时均几乎可在48 h内将TCE完全脱氯.
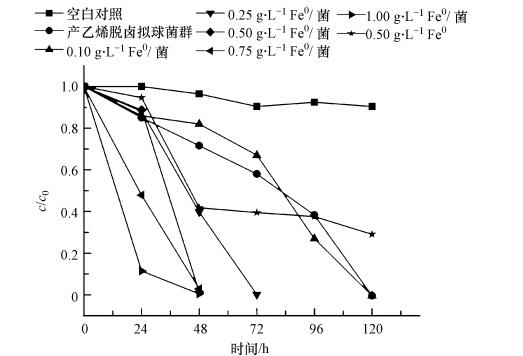 |
| 图 2 不同浓度纳米Fe0粒子对产乙烯脱卤菌群还原脱氯效果影响 Fig. 2 Effects of different concentrations of NZVI on the reductive dechlorination of Dehalococcoides spp. |
由图 2可知,纳米Fe0粒子对TCE亦具有还原脱氯作用,但纳米Fe0粒子在短时间内不能将TCE完全脱氯.纳米Fe0粒子与产乙烯脱卤菌群联合脱氯的效率高于两者单独作用的还原脱氯效率,却低于两者单独还原脱氯效率的简单加和,说明纳米Fe0粒子与产乙烯脱卤菌群联合脱氯的作用是非加成作用.综上,纳米Fe0粒子对产乙烯脱卤菌群具有的脱氯性能有明显促进作用,但其促进作用并不是两者的加成作用.
3.3 DGGE图谱分析图 3为不同浓度纳米Fe0粒子与产乙烯脱卤菌群联合脱氯20 d后菌群16S rRNA V3区PCR扩增产物的DGGE图谱.表 1为DGGE对应条带测序的BLAST比对结果.由图 3可知,纳米Fe0粒子对产乙烯脱卤菌群的物种多样性具有影响,不同浓度纳米Fe0粒子接触下产乙烯脱卤菌群的种类和数量发生了相应的变化.在纳米Fe0粒子浓度低于0.50 g · L-1时,物种多样性主要表现为优势菌种的差异,同时个别菌种因纳米Fe0粒子的投加而消失,如图 3中的B and 1(β-proteobacterium)和B and 21(Clostridia)条带;但当纳米Fe0粒子浓度达到0.50 g · L-1以上时,物种多样性明显减少;而B and 6(Methylobacter sp.)、B and 10(Methylobacter sp.)、B and 19(Dehalococcoides ethenogenes)条带对应的菌种在所有样品中一直处于稳定的优势地位.
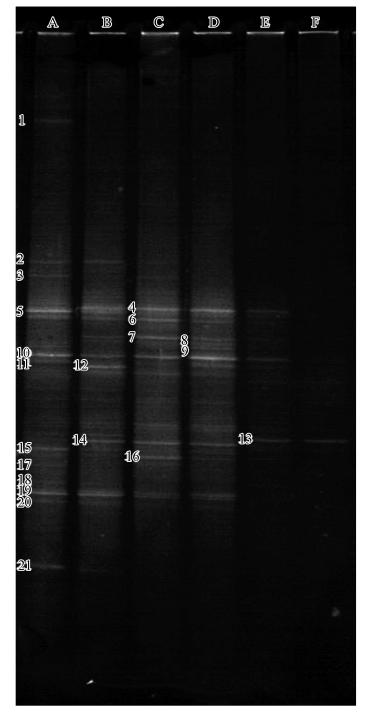 |
| 图 3 产乙烯脱卤菌群的DGGE 图谱(A~F分别指纳米Fe0粒子的浓度分别为0、0.10、0.25、0.50、0.75和1.00 g · L-1时所对应的样品) Fig. 3 DGGE fingerprint of Dehalococcoides spp. culture |
| 表1 DGGE条带的BLAST对比结果 Table.1 The contrast results of DGGE b and on BLAST e |
由结合表 1和图 4可知,产乙烯脱卤菌群中除产乙烯脱卤拟球菌属(Dehalococcoides)外还有较多的变形菌门(Proteobacteria),同时还有放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)的细菌.由图 3和图 4比较结果可知,投加纳米Fe0粒子对产乙烯脱卤菌群的物种多样性具有影响,其影响主要表现在细菌门类基本没有变化,而菌种数量减少,并且对产乙烯脱卤拟球菌属(Dehalococcoides)的生长影响不明显.以变形菌门(Proteobacteria)为例,纳米Fe0粒子浓高于0.50 g · L-1时,菌群中β-proteobacteria和δ-proteobacteria对应的条带仍然存在,而γ-proteobacteria对应的条带消失,多样性减少.
 |
| 图 4 系统发育树 Fig. 4 The phylogenetic tree |
纳米Fe0粒子对该产乙烯脱卤菌群物种多样性的影响与其浓度有关,当纳米Fe0粒子浓度为0.50~1.00 g · L-1时,物种多样性减少,而体系仍具有较好的脱氯效果.说明体系中的纳米Fe0粒子对产乙烯脱卤拟球菌的毒性不明显,反而对其生长具有一定的促进作用,而对菌群中其他菌属具有毒性抑制作用.
4 讨论(Discussion)本实验采用0.50 g · L-1纳米Fe0粒子与产乙烯脱卤拟球菌相接触,其中,纳米Fe0粒子粒径在20~50 nm,粒径小、比表面积高,易于吸附到产乙烯脱卤拟球菌表面.TEM观察结果表明,无纳米Fe0粒子存在时,产乙烯脱卤拟球菌细胞为椭球状,细胞周围均匀、光滑;产乙烯脱卤拟球菌与纳米Fe0粒子接触后,产乙烯脱卤拟球菌吸附了纳米Fe0粒子,与纳米Fe0粒子接触的细胞表面变得模糊,轻度破损,而未与纳米Fe0粒子接触的细胞表面仍比较均匀,且细胞没有破裂.
投加纳米Fe0粒子对产乙烯脱卤拟球菌的还原脱氯作用有影响,脱氯速率因纳米Fe0粒子的投加明显增大.产乙烯脱卤菌群对TCE的脱氯速率为0.31 μmol · h-1,当纳米Fe0粒子浓度为0~0.50 g · L-1时,脱氯速率提高较小,速率提高不足40%.当纳米Fe0粒子浓度高于为0.50~1.00 g · L-1时,TCE的脱氯速率由0.31 μmol · h-1提高到0.77 μmol · h-1,脱氯速率提高了60%.
投加纳米Fe0粒子后反应体系的氧化还原电位(ORP)如表 2所示,纳米Fe0粒子的投加使体系的ORP降低.低ORP的环境很适宜产乙烯脱卤菌群的生长,这为纳米铁与脱氯菌的联合修复创造了适宜的条件,加快了有机氯代烃的去除速率(修宗明,2009).因此,投加纳米Fe0粒子后ORP的降低恰好为产乙烯脱卤菌群提供了优良的脱氯环境,对产乙烯脱卤菌群的还原脱氯作用非常有利.
| 表2 不同浓度纳米Fe0粒子体系中氧化还原电位值 Table.2 The ORP value in the system with different concentrations of NZVI |
反应体系中的纳米Fe0粒子与水反应产生氢气,同时降低了反应体系的氧化还原电位,为产乙烯脱卤菌群提供了电子供体和适宜的强还原性环境,对产乙烯脱卤拟球菌的生长及氢气利用具有促进作用,从数量增加了产乙烯脱卤拟球菌的量,从动力学上推动了脱氯反应进程,从而提高了产乙烯脱卤拟球菌的脱氯性能,促进了产乙烯脱卤拟球菌对TCE的还原脱氯.同时,纳米Fe0粒子对TCE也具有一定的还原作用(Li et al., 2012),投加纳米Fe0粒子后TCE脱氯效率优于两者单独作用的脱氯效率,却低于两者单独脱氯效率的简单物理加和.说明纳米Fe0粒子的投加是从根本上改变了产乙烯脱卤菌群原有的脱氯机制,提高TCE的脱氯效率,而非物理加成作用.
Barnes等(2010)研究了0.10 g · L-1纳米铁对河水土著微生物多样性和群落结构的影响,通过对与纳米铁接触36 d后微生物16S rRNA基因的PCR-DGGE分析,发现纳米铁浓度为0.10 g · L-1时,对微生物的生长具有一定的促进作用,对微生物群落并没有明显的影响,同时会降低水体的氧化还原电位.Diao和Yao(2009)采用NaBH4还原 Fe(NO3)3 · 9H2O 制备的零价纳米铁,研究了0.10、1.00和10 g · L-1的零价纳米铁对革兰氏阳性菌Bacillus subtilis var. niger和革兰氏阴性菌Pseudomonas fluorescens的灭活作用,实验结果表明,随着零价纳米铁浓度从0.10 g · L-1增加到1.00 g · L-1时,其毒性作用增加;零价纳米铁浓度为10 g · L-1时,两种微生物完全失活;而当零价纳米铁浓度降低到1.00和0.10 g · L-1时,P.fluorescens完全失活,而B. subtilis var. niger失活率分别为95%和80%.说明零价纳米铁对微生物的灭菌活性因零价纳米铁浓度和微生物菌种不同而有所差异.
纳米Fe0粒子对产乙烯脱卤菌群物种多样性具有影响,其影响因纳米Fe0粒子浓度不同而有所差异.当纳米Fe0粒子浓度为0~0.50 g · L-1时,产乙烯脱卤菌群的菌种数量无明显变化,其影响主要表现在优势菌种的差异;但当纳米Fe0粒子浓度为0.50~1.00 g · L-1时,部分菌种的生长受到严重的影响,致使多种菌种失活,多样性减少.Xiu等(2010b)对大肠杆菌与纳米铁接触前后进行了TEM图谱分析,发现大肠杆菌周围吸附了很多零价纳米铁颗粒,细胞凹陷,对细胞造成氧化损伤.在本实验所有反应体系中,产乙烯脱卤拟球菌种一直是优势菌种,说明纳米Fe0粒子的投加促进了优势菌种——产乙烯脱卤拟球菌的生长.结合TEM图谱分析可知,纳米Fe0粒子未对产乙烯脱卤拟球菌的细胞造成破坏性损伤,且投加纳米Fe0粒子增强了产乙烯脱卤拟球菌的脱氯性能,在短时间内纳米Fe0粒子对产乙烯脱卤菌群中产乙烯脱卤拟球菌属无明显的毒性抑制作用,而对菌群中其他菌属具有一定的毒性抑制作用,致使物种多样性发生变化.
5 结论(Conclusions)纳米Fe0粒子通过与水反应产生氢气,降低氧化还原电位,为产乙烯脱卤菌群提供了电子供体和适宜的强还原性环境,提高了产乙烯脱卤菌群的脱氯性能.纳米Fe0粒子对产乙烯脱卤拟球菌的损伤作用仅在于细胞接触表面,细胞没有破裂,同时产乙烯脱卤菌群的脱氯性能增强.因此,纳米Fe0粒子对产乙烯脱卤菌群中产乙烯脱卤拟球菌种无明显的毒性抑制作用,反而对其生长具有一定的促进作用,而对其他菌种具有一定的毒性抑制作用,致使物种多样性减少.
| [1] | Auffan M,Achouak W,Rose J,et al.2008.Relation between the redox state of iron-based nanoparticles and their cytotoxicity toward Escherichia coli[J].Environmental Science & Technology,42(17):6730-6735 |
| [2] | Auffan M,Rose J,Wiesner M R,et al.2009.Chemical stability of metallic nanoparticles:a parameter controlling their potential cellular toxicity in vitro[J].Environmental Pollution,157(4):1127-1133 |
| [3] | Barnes R J,van der Gast C J,Riba O,et al.2010.The impact of zero-valent iron nanoparticles on a river water bacterial community[J].Journal of Hazardous Materials,184(1/3):73-80 |
| [4] | Barrabés N,Föttinger K,Llorca J,et al.2010.Pretreatment effect on Pt/CeO2 catalyst in the selective hydrodechlorination of trichloroethylene[J].The Journal of Physical Chemistry C,114(41):17675-17682 |
| [5] | Chen Q,Gao M,Li J,et al.2012.Inactivation and magnetic separation of bacteria from liquid suspensions using electrosprayed and nonelectrosprayed nZVI particles:observations and mechanisms[J].Environmental Science & Technology,46(4):2360-2367 |
| [6] | Chung J,Krajmalnik-Brown R,Rittmann B E.2008.Bioreduction of trichloroethene using a hydrogen-based membrane biofilm reactor[J].Environmental Science & Technology,42(2):447-483 |
| [7] | Da Silva M L B,Daprato R C,Gomez D E,et al.2006.Comparison of bioaugmentation and biostimulation for the enhancement of dense nonaqueous phase liquid source zone bioremediation[J].Water Environment Research,78(13):2456-2465 |
| [8] | Diao M H,Yao M S.2009.Use of zero-valent iron nanoparticles in inactivating microbes[J].Water Research,43(20):5243-5251 |
| [9] | Johnson R L,Thoms R B,Johnson R O,et al.2008.Field evidence for flow reduction through a zero-valent iron permeable reactive barrier[J].Groundwater Monitoring & Remediation,28(3):47-55 |
| [10] | Hazen T C,Chakraborty R,Fleming J M,et al.2009.Use of gene probes to assess the impact and effectiveness of aerobic in situ bioremediation of TCE[J].Archives of Microbiology,191(3):221-232 |
| [11] | Kim J Y,Park H J,Lee C,et al.2010.Inactivation of Escherichia coli by nanoparticulate zerovalent iron and ferrous ion[J].Applied and Environmental Microbiology,76(22):7668-7670 |
| [12] | Kim H M,Hyun Y,Lee K K.2007.Remediation of TCE-contaminated groundwater in a sandy aquifer using pulsed air sparging:Laboratory and numerical studies[J].Journal of Environmental Engineering,133(4):380-388 |
| [13] | Lee C,Kim J Y,Lee W I L,et al.2008.Bactericidal effect of zero-valent iron nanoparticles on Escherichia coli[J].Environmental Science & Technology,42(13):4927-4933 |
| [14] | Li S J,Fang Y L,Romanczuk C D,et al.2012.Establishing the trichloroethene dechlorination rates of palladium-based catalysts and iron-based reductants[J].Applied Catalysis (B:Environmental),125:95-102 |
| [15] | Maymó-Gatell X,Chien Y T,Gossett J M,et al.1997.Isolation of a bacterium that reductively dechlorinates tetrachloroethene to ethene[J].Science,276(5318):1568-1571 |
| [16] | Miller E,Wohlfarth G,Diekert G.1997.Studies on tetrachloroethene respiration in Dehalospirillum multivorans[J].Archives of Microbiology,166(6):379-387 |
| [17] | Muyzer G,de Waal E C,Uitterlinden A G.1993.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied and Environmental Microbiology,59(3):695-700 |
| [18] | Nelson J L,Fung J M,Cadillo-Quiroz H,et al.2011.A role for Dehalobacter spp.in the reductive dehalogenation of dichlorobenzenes and monochlorobenzene[J].Environmental Science & Technology,45(16):6806-6813 |
| [19] | Noubactep C.2011.On the mechanism of microbe inactivation by metallic iron[J].Journal of Hazardous Materials,198:383-386 |
| [20] | Rabbi M F,Clark B,Gale R J,et al.2000.In situ TCE bioremediation study using electrokinetic cometabolite injection[J].Waste Management,20(4):279-286 |
| [21] | Rivett M O,Chapman S W,Allen-King R M,et al.2006.Pump-and-treat remediation of chlorinated solvent contamination at a controlled field-experiment site[J].Environmental Science & Technology,40(21):6770-6781 |
| [22] | Thiruvenkatachari R,Vigneswaran S,Naidu R.2008.Permeable reactive barrier for groundwater remediation[J].Journal of Industrial and Engineering Chemistry,14(2):145-156 |
| [23] | Wang W,Jin Z H,Li T L,et al.2006.Preparation of spherical iron nanoclusters in ethanol-water solution for nitrate removal[J].Chemosphere,65(8):1396-1404 |
| [24] | 王学,李勇超,李铁龙,等.2012.零价纳米铁对大肠杆菌的毒性效应[J].生态毒理学报,7(1):49-56 |
| [25] | Xiu Z M,Gregory K B,Lowry G V,et al.2010a.Effect of bare and coated nanoscale zerovalent iron on tceA and vcrA gene expression in Dehalococcoides spp.[J].Environmental Science & Technology,44(19):7647-7651 |
| [26] | Xiu Z M,Jin Z H,Li T L,et al.2010b.Effects of nano-scale zero-valent iron particles on a mixed culture dechlorinating trichloroethylene[J].Bioresource Technology,101(4):1141-1146 |
| [27] | 修宗明.2009.纳米铁与脱氯菌耦合修复地下水中三氯乙烯及其毒理试验研究.天津:南开大学.22-35 |
| [28] | 修宗明,李铁龙,金朝晖,等.2009.纳米铁为脱氯菌供电降解三氯乙烯实验研究[J].环境科学,30(6):1791-1796 |
| [29] | Zhang M,He F,Zhao D Y,et al.2011.Degradation of soil-sorbed trichloroethylene by stabilized zero valent iron nanoparticles:Effects of sorption,surfactants,and natural organic matter[J].Water Research,45(7):2401-2414 |
| [30] | Zheng D D,Carr C S,Hughes J B.2001.Influence of hydraulic retention time on extent of PCE dechlorination and preliminary characterization of the enrichment culture[J].Bioremediation Journal,5(2):159-168 |
 2014, Vol.34
2014, Vol.34


