水体重金属污染已经成为一个全球性的环境问题,尤以发展中国家较为突出.随着经济的迅速发展,工农业生产过程中排放的有害重金属日益增加.环境污染中所指的重金属主要包括汞(Hg)、镉(Cd)、铅(Pb)、铬(Cr)和类金属砷(As)等生物毒性显著的元素及锰(Mn)、钼(Mo)、镍(Ni)、铜(Cu)、钴(Co)、锡(Sn)等微量元素(孟春晓等,2009).重金属污染物进入水体,不仅影响水体生态环境,还通过食物网传递,给人类的身体健康造成严重伤害.
微藻作为水生生态系统及水生食物链中的初级生产者,是其它生物赖以生存的物质基础.微藻吸收重金属离子后不易被降解,且通过食物链放大作用进入人体,并在器官中积累造成慢性中毒,危害人体健康(金羽等,2013).因此,研究重金属离子对微藻的毒害作用,在此基础上进行水污染生物监测具有十分重要的意义(梁英等,2009).斜生栅藻(Scenedesmus obliquus)是一种水体安全标准指示生物,容易培养且对毒物反应敏感.研究发现,重金属离子胁迫会导致该藻细胞分裂,光合放氧和细胞膜透性等受到抑制(Omar,2002).
传统方法通过测定72 h或96 h的藻细胞密度的半抑制浓度(IC50)或半致死浓度(LC50)等指标来评价藻类对重金属胁迫的敏感程度,但该法存在测量时间长、测量结果不准确和不全面等缺陷.因此,准确、全面地测量评价重金属对微藻各个指标的影响,对于开发出一种对重金属胁迫灵敏响应的生物探针有重要理论意义.目前,光合放氧、叶绿素荧光、氧化压力评估及抗氧化酶活测定等广泛应用于评估植物的生长状态及受到的环境压力.
基于此,本研究通过对重金属(Pb2+、Cr3+、Cr6+)胁迫下斜生栅藻生物量(干重法)的IC50、叶绿素a含量、光合效率(放氧速率、呼吸速率)、叶绿素荧光参数(Fv/Fm、Yield、ETR、qP等)及抗氧化酶活的测定和计算,对斜生栅藻在重金属胁迫下的生理生化响应进行综合评估,以期为水体重金属污染物监测和治理提供一定的理论支持.
2 材料与方法(Materials and methods) 2.1 实验材料实验藻种斜生栅藻(Scenedesmus obliquus JNU49)(以后均用JNU49代指Scenedesmus obliquus)为实验室保存藻株.培养条件:以改良的BG-11培养基为基础培养基,3 cm×60 cm的柱状光生物反应器为培养容器,通入含1.0% CO2的压缩空气通气培养,光照强度为(100±10)μmol · m-2 · s-1(以photons计),温度为(25±1)℃,持续光照,藻种初始浓度为OD750=0.3(生物量为(0.21±0.01)g · L-1),培养时长为8 d,每组均设定3个平行.
2.2 实验设计按照2.1节所设定的培养条件培养斜生栅藻,并于培养起始点添加不同浓度的重金属:Pb2+(4、8、16、24、32、40、48 mg · L-1)、Cr3+(3、4、5、6、7、8、9 mg · L-1)、Cr6+(0.25、0.50、0.75、1.00、1.25、1.50、1.75 mg · L-1).培养起始点记为第0 d,每天取样测定生物量,计算得到96 h的半数抑制浓度(IC50).以改良的BG-11培养基为对照,加入半数抑制浓度的各重金属离子胁迫培养斜生栅藻,每天测定重金属胁迫下斜生栅藻的生物量积累情况、叶绿素a含量、光合效率、叶绿素荧光参数,并于前96 h每24 h收取藻泥(4 ℃,10000× g,10 min),液氮速冻,存放于-80 ℃冰箱中,用于分析MDA含量及抗氧化酶活.
2.3 实验方法 2.3.1 生物量测定每隔24 h 取藻液10 mL,利用真空泵抽滤至预先烘干至恒重(M0)的0.45 μm孔径的微孔滤膜上;滤膜放入105 ℃烘箱烘至恒重(M1).生物量(DW,g · L-1)计算公式为:DW=(M1-M0)×100.
2.3.2 IC50的计算测定培养时长为96 h的斜生栅藻生物量,分别计算每组重金属胁迫下斜生栅藻生物量相对于对照培养的抑制率,并计算胁迫浓度和抑制率的线性关系,得出抑制率为50%时对应的重金属浓度(IC50).
2.3.3 叶绿素a含量测定利用甲醇热提法(Azov,1982)测定叶绿素a的含量:移取1 mL藻液放置在15 mL的离心管中,3500 r · min-1离心 5 min,去上清液;然后加入5 mL甲醇振荡混匀,将离心管放置在70 ℃的水浴中加热提取 5 min,3500 r · min-1离心 5 min,取上清液在665 nm和750 nm下测定吸光值.叶绿素a含量(mg · L-1)计算公式为:[Chl.a]=13.9(OD665-OD750)U/V,其中,U为甲醇体积(mL),V为藻液体积(mL).
2.3.4 光合速率的测定用Clark氧电极(Hansatech Oxygraph,英国)测定微藻的光合放氧速率和暗呼吸速率,以氧饱和的蒸馏水标定氧电极的满刻度,加入适量Na2S2O3标定零刻度.反应体系的温度由超级恒温水浴(Grant,英国)控制,LED提供光源.测定时,以100 μmol · m-2 · s-1(以photons计)光强照射微藻培养物悬浮液,测定5 min内氧气的平均释放速率,即为光合放氧速率(μmol · mg-1 · h-1,以每mg Chl.a产生的O2量(μmol)计).关闭光源,测定5 min内氧气的平均消耗速率,即为暗呼吸速率(μmol · mg-1 · h-1).
2.3.5 叶绿素荧光参数测定利用脉冲调制式叶绿素荧光仪XE-PAM(Walz,德国)测定光系统Ⅱ的最大光量子产量(Fv/Fm)、相对电子传递速率(rETR)、光系统Ⅱ实际量子产量(Yield)及光化学淬灭(qP).将调为同一吸光度(OD750=0.5)的藻液放于暗室中进行暗适应1 h,取3 mL加入四面光透光比色皿,置于荧光仪中,打开测量光(PAR,光合有效辐射为8 μmol · m-2 · s-1),测量初始荧光(F0). 然后打开光化光(光合有效辐射为100 μmol · m-2 · s-1),照射5 min,打开饱和脉冲光激发测定光系统Ⅱ的Fv/Fm、Yield、ETR、qP等参数.
2.3.6 丙二醛(MDA)含量及抗氧化系统酶活性测定取培养后冷冻保存的藻泥,液氮条件充分研磨,悬浮于蛋白提取液并在冰浴中提取2 h,制备成酶提取液.分别用南京建成生物工程研究所开发的丙二醛(MDA)含量测定试剂盒、总超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性测定试剂盒及总抗氧化活性(T-AOC)测定试剂盒测定各成分的含量或活性.提取液成分为50 mmol · L-1磷酸缓冲液(含有1 mmol · L-1 EDTA、1% Triton X-100、1% PVP-300).另用Lowry法测定酶提取液中水溶性蛋白含量(Lowry et al., 1951).
2.4 数据处理分别用Excel 2010和Origin 8.5处理数据并作图,并用SPSS 17.0 Duncan法和LSD法进行显著性差异分析,显著性水平设定为α=0.05.
3 结果与分析(Results and analysis) 3.1 重金属铅、铬胁迫对斜生栅藻生物量积累的影响如图 1所示,当培养周期为8 d时,不含重金属的改良BG\-11培养基培养下的斜生栅藻,生物量呈现上升趋势;而在一定浓度范围内,重金属铅、铬的存在能显著抑制斜生栅藻生物量的增长,且随着浓度增大,抑制程度增加.如图 1a所示,各浓度Pb2+胁迫下斜生栅藻的生物量均受到极显著的抑制(p<0.01),其中胁迫浓度为32 mg · L-1时斜生栅藻在第3 d就出现了显著抑制,生物量仅为对照组的43.58%;4、16和32 mg · L-1胁迫组在第4 d的抑制作用亦十分明显,生物量分别为对照组的72.96%、47.23%和28.01%;在Pb2+胁迫下,斜生栅藻的生物量在第5或第6 d开始下降;培养终点时,各胁迫组生物量分别是对照组的40.00%、28.31%和26.73%.如图 1b所示,各浓度Cr3+胁迫下斜生栅藻生物量均受到极显著的抑制(p<0.01);3、6、9 mg · L-1 Cr3+胁 迫下,第4和第8 d时的生物量分别是对照组的62.68%、55.68%、36.15%和72.57%、64.55%、54.47%.各浓度Cr6+胁迫下,斜生栅藻生物量的响应与Cr3+胁迫比较相似,均受到显著抑制(p<0.01);0.5、1.0、1.5 mg · L-1 Cr6+胁迫下,第4和第8 d的生物量分别是对照组的84.03%、63.87%、35.71%和86.49%、76.25%、53.16%(图 1c).
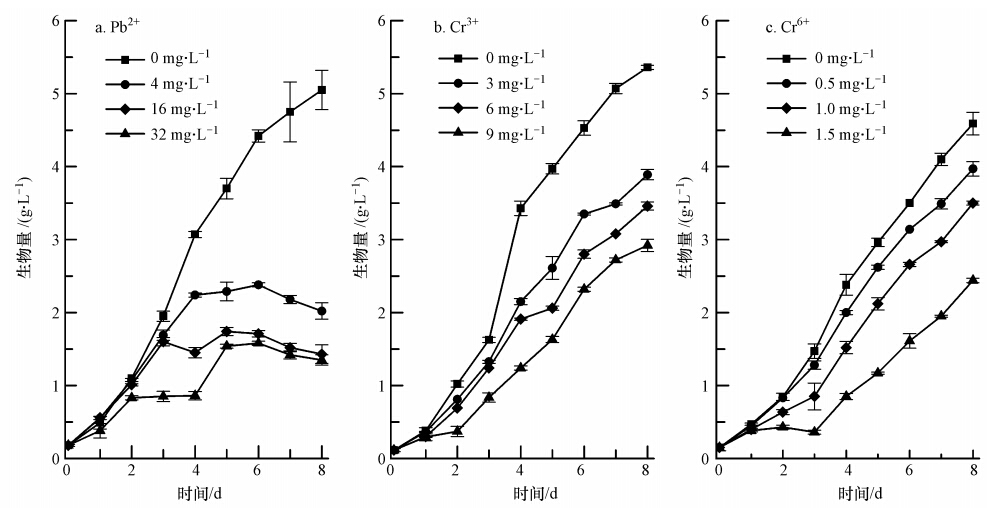 |
| 图 1 重金属胁迫下斜生栅藻的生物量(干重)积累(平均值±标准差,n=3,下同) Fig. 1 The biomass(dry weight)of JNU49 under heavy metal stress(Mean±SD,n=3,the same below) |
取第4 d的生物量计算96 h的半数抑制浓度(IC50),Pb2+的胁迫浓度分别为4、8、16、24、32、40、48 mg · L-1,Cr3+胁迫浓度分别为3、4、5、6、7、8、9 mg · L-1,Cr6+胁迫浓度分别为0.25、0.50、0.75、1.00、1.25、1.50、1.75 mg · L-1.通过拟合胁迫浓度(x)与抑制率(y)之间的关系,得到线性方程为Pb2+:y=1.495x+24.417,R2=0.9896;Cr3+:y=4.623x+20.908,R2=0.9544;Cr6+:y=47.179x-8.103,R2=0.9877.计算得到重金属Pb2+、Cr3+和Cr6+对斜生栅藻的半数抑制浓度(IC50)分别为17.17 mg · L-1(82.94 μmol · L-1)、6.30 mg · L-1(121.15 μmol · L-1)、1.23 mg · L-1(23.65 μmol · L-1).
3.3 重金属铅、铬半数抑制浓度胁迫下斜生栅藻的生物量和叶绿素a含量变化图 2为在不同金属离子(Pb2+、Cr3+、Cr6+)的半数抑制浓度胁迫培养下,斜生栅藻生物量和叶绿素a含量的变化情况.如图 2a所示,在不同金属离子的胁迫下,斜生栅藻的生长均受到明显抑制(p<0.01);在Pb2+胁迫下,斜生栅藻的生物量从第5 d开始出现明显下降;而Cr3+、Cr6+胁迫下的斜生栅藻生物量一直呈现上升趋势,与对照组一致.Pb2+、Cr3+、Cr6+胁迫下斜生栅藻的生物量在第4和第8 d分别占对照组生物量的57.72%、53.63%、38.18%和32.88%、65.78%、56.44%.
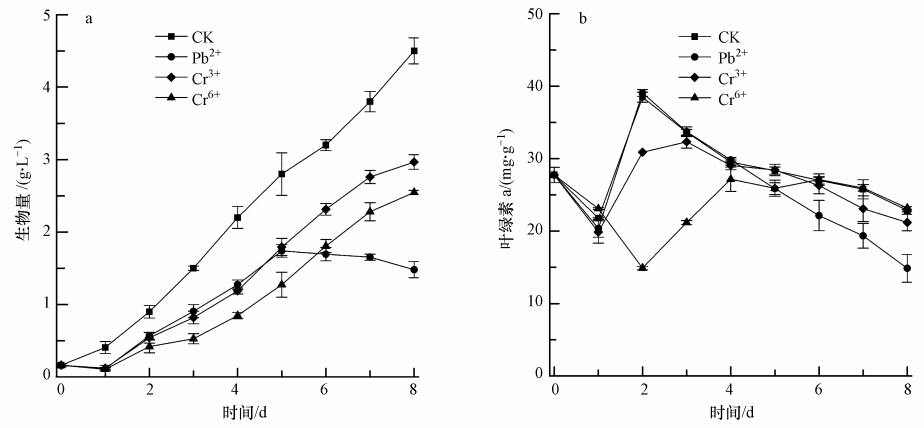 |
| 图 2 重金属半数抑制浓度胁迫下斜生栅藻的生物量和叶绿素a含量 Fig. 2 Biomass and Chl.a content of JNU49 under the stress of IC50 |
图 2b为在重金属半数抑制浓度胁迫下,斜生栅藻单位生物量的叶绿素a含量(mg · g-1,以干重计)的变化情况.第0~4 d时,Pb2+胁迫组叶绿素含量与对照组变化趋势基本一致,且与对照组无明显差别(p>0.05),而Cr3+和Cr6+胁迫组叶绿素含量显著低于对照组(p<0.01);第5~8 d时,Pb2+胁迫组叶绿素含量显著低于对照组(p<0.01),而Cr3+和Cr6+胁迫组则与对照组无显著差异(p>0.05).
3.4 不同重金属胁迫下斜生栅藻的光合及呼吸效率如图 3a所示,对照组光合效率从接种起点到第3 d呈现上升趋势,并于第3 d达到最大光合效率(67.74±2.19)μmol · mg-1 · h-1;第4~8 d时呈现下降趋势.Pb2+胁迫组光合效率在培养1 d(24 h)后达到最大,且与对照组无明显差异(p>0.05);而第2~8 d时光合效率呈现明显下降趋势,第3 d和第8 d的光合效率分别为对照组的73.34%和13.98%,极显著低于对照组(p<0.01).Cr3+、Cr6+胁迫组的斜生栅藻光合效率变化趋势与对照组基本一致,均于第3 d达到最大值,分别为(64.11±0.23)、(60.25±1.32)μmol · mg-1 · h-1.培养前3 d,Cr3+、Cr6+胁迫组的斜生栅藻光合效率极显著(p<0.01)低于对照组,第2 d时分别为对照组光合效率的82.66%和62.89%;第3~8 d,这两个胁迫组的光合效率低于对照组(p<0.01).
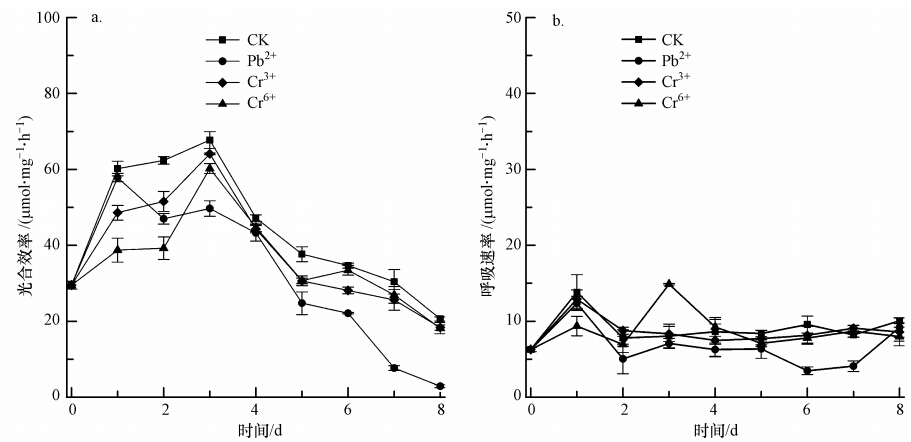 |
| 图 3 斜生栅藻光合效率和呼吸速率对不同重金属胁迫的响应(a.光合效率;b.呼吸效率) Fig. 3 Photosynthetic and Respiration rate of JNU 49 under the stress of different heavy metals(Mean±SD,n=3,a.Photosynthetic rate;b.Respiration rate) |
如图 3b所示,对照组斜生栅藻的呼吸速率变化不明显,一直处于5~15 μmol · mg-1 · h-1之间.Pb2+胁迫组的斜生栅藻的呼吸速率在第2~8 d时均受到明显影响,呼吸速率均低于对照组(p<0.01).而Cr3+、Cr6+胁迫组的斜生栅藻的呼吸速率与对照组相比,均无显著差异(p>0.05).
3.5 不同重金属胁迫下斜生栅藻的叶绿素荧光参数变化如图 4a所示,对照组PSⅡ最大光能转化效率(Fv/Fm)从培养初期到培养末期均无明显变化,一直处在0.70~0.74之间;Pb2+胁迫组的斜生栅藻从培养第1 d开始到培养结束时,Fv/Fm均极显著低于对照组(p<0.01),且呈现逐渐下降趋势;第4 d和第8 d时Fv/Fm分别为0.62±0.00和0.49±0.01,分别为对照组的86.11%和69.01%.Cr3+胁迫组的斜生栅藻Fv/Fm值受到较小的影响,第2 d时高于对照组,其余时相均低于对照组,而其Fv/Fm均在0.69~0.73之间(p<0.05).Cr6+胁迫组的斜生栅藻,于培养第0~3 d时Fv/Fm极显著低于对照组(p<0.01),第3 d为0.65±0.00,为对照组的90.2%,而第4~8 d时显著低于对照组(p<0.05).
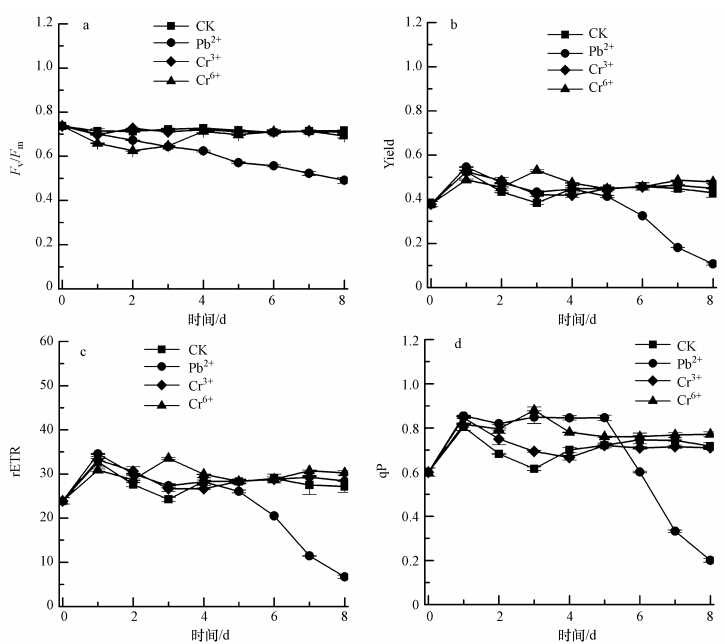 |
| 图 4 重金属胁迫下斜生栅藻叶绿素荧光参数变化图 Fig. 4 Chlorophyll fluorescence of JNU 49 under heavy metal stress(Mean±SD,n=3) |
如图 4b所示,对照组PSⅡ实际光能转化效率(Yield)在培养1 d(24 h)后达到最大值0.53±0.01,第2~8 d时一直较为稳定,处于0.38~0.45之间.Pb2+胁迫组同样是于培养1 d(24 h)后Yield 达到最大值0.55±0.01,且第1~4 d时高于对照组(p<0.01);而第5~8 d时则迅速下降,极显著低于对照组(p<0.01),第8 d时仅为0.11±0.01.Cr3+和Cr6+胁迫组与对照组相比差异不显著(p>0.05).
如图 4c所示,对照组斜生栅藻相对电子传递速率(rETR)培养起始时为23.90±0.72,培养1 d(24 h)后达到最大值32.77±1.16,而后较为稳定,维持在24~29之间.Pb2+胁迫组同样是于第2 d达到最大值34.53±0.12,第1~3 d时高于对照组,第4~8 d时低于对照组,且与对照组差异极显著(p<0.01),第8 d时为6.70±0.34.Cr3+、Cr6+胁迫组的rETR值则与对照组的变化趋势较为一致,且差异不显著(p>0.05).如图 4d所示,对照组光化学淬灭(qP)值初始为0.60±0.02,并于第1 d(24 h)时达到最大值0.81±0.02;第2~3 d时下降,第3 d时为0.61±0.01;第4~8 d稳定在0.70~0.75之间.Pb2+胁迫组于第1 d(24 h)时达到最大值0.86±0.01;第1~5 d维持在0.81~0.86之间,高于对照组(p<0.01);第6~8 d时迅速下降,低于对照组(p<0.01),第8 d时仅为0.20±0.01.Cr3+胁迫组qP值第1 d(24 h)时达到最大值0.85±0.01;第1~3 d时高于对照组,第4~8 d略低于对照组(p<0.01).Cr6+胁迫组qP值于第3 d达到最大值0.88±0.02,且整个培养周期均高于对照组(p<0.01).
3.6 不同重金属胁迫下斜生栅藻丙二醛(MDA)含量及抗氧化酶活的变化如图 5a所示,对照组斜生栅藻的MDA含量随着培养时间的延长而逐渐增加,从培养起始的(1.05±0.05)nmol · mg-1(以Protein计)到第4 d(96 h)的(1.52±0.09)nmol · mg-1.Pb2+胁迫组斜生栅藻的MDA含量也是呈现上升趋势,高于对照组,第4 d的含量为(1.99±0.00)nmol · mg-1,为对照组的130.92%(p<0.01).Cr3+胁迫组的MDA含量则呈现先上升后下降的趋势,且第0~4 d时高于对照组,并于第3 d达到最大值(2.75±0.00)nmol · mg-1,为对照组的196.43%(p<0.01).Cr6+胁迫组的MDA含量在第0~4 d也是呈上升趋势,于第4 d达到最大值(2.48±0.09)nmol · mg-1,为对照组的163.16%(p<0.01).
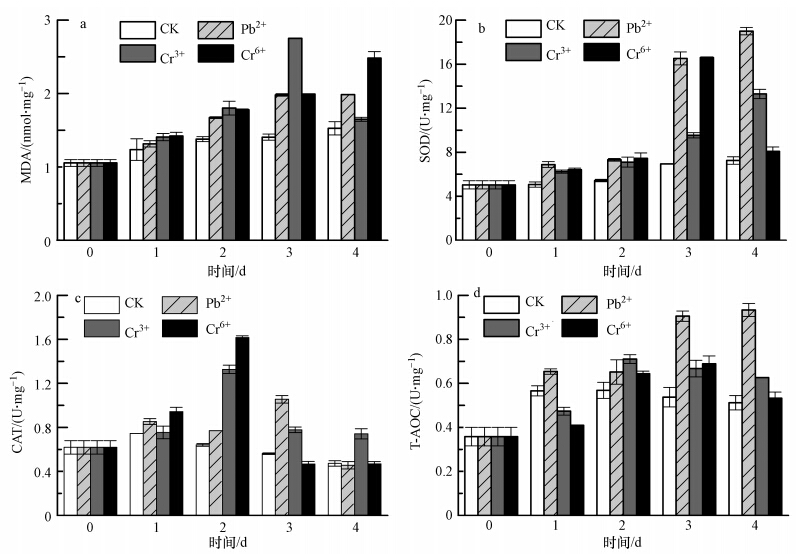 |
| 图 5 重金属胁迫下斜生栅藻丙二醛含量及抗氧化酶活变化 Fig. 5 MDA content and anti-oxidant activity of JNU 49 under heavy metal stress |
如图 5b所示,对照组斜生栅藻的SOD活性从培养初始的(5.04±0.37)U · mg-1(以Protein计)变化到第4 d(96 h)时的(7.25±0.34)U · mg-1,呈现缓慢上升趋势.Pb2+胁迫组斜生栅藻的SOD活性在第0~2 d时上升较为缓慢,第2 d为(7.31±0.12)U · mg-1,第3、4 d迅速升高,第4 d时为(19.00±0.34)U · mg-1,其活性为对照的262.66%(p<0.01).Cr3+胁迫组斜生栅藻的SOD活性也呈现较为明显的升高趋势,在培养过程中,高于对照组,但低于Pb2+胁迫组,第4 d的SOD活性为(13.30±0.42)U · mg-1,为对照组的183.44%(p<0.01).Cr6+胁迫组的SOD活性到第3 d时达到最大值(16.60±0.06)U · mg-1,为对照组的239.54%(p<0.01).
如图 5c所示,对照组斜生栅藻的CAT活性在0~4 d(0~96 h)的培养过程中变化不大.Pb2+胁迫组斜生栅藻的CAT活性在第0~3 d呈现上升趋势,并于第3 d达到最大值(1.05±0.03)U · mg-1(以Protein计),为对照组的187.50%(p<0.01),第4 d下降明显,仅为(0.46±0.04)U · mg-1,与对照差异不显著(p>0.05).Cr3+胁迫组斜生栅藻的CAT活性在培养第1~4 d均明显高于对照组,并于第2 d达到最大值(1.33±0.04)U · mg-1,为对照207.81%(p<0.01).Cr6+胁迫组斜生栅藻的CAT活性在第1、2 d明显高于对照组,并于第2 d达到最大值(1.62±0.02)U · mg-1,为对照组的253.13%(p<0.01),而第3、4 d则与对照组差异不显著(p>0.05).
如图 5d所示,对照组斜生栅藻的总抗氧化活性T-AOC值在培养起始时为(0.36±0.04)U · mg-1(以Protein计),第1~4 d时变化不大,维持在0.51~0.56 U · mg-1之间.Pb2+胁迫组斜生栅藻T-AOC值逐渐升高,并于第4 d达到(0.93±0.03)U · mg-1,为对照组的182.35%(p<0.01).Cr3+胁迫组斜生栅藻的T-AOC变化幅度不大,第2 d达到最大值(0.71±0.02)U · mg-1,为对照组的124.56%,而3、4 d则缓慢下降,第4 d时为(0.62±0.00)U · mg-1.Cr6+胁迫组斜生栅藻的T-AOC值则缓慢上升,于第3 d达到最大值(0.69±0.04)U · mg-1,为对照组的129.10%(p<0.01).
4 讨论(Discussion) 4.1 不同重金属离子对斜生栅藻生长的影响常见的重金属中,铜和锌是许多生物生长的必需元素,而镉、铬和铅则不是(欧阳慧灵等,2012).本研究中,在一定含量范围内,铅和铬对斜生栅藻的生长表现出明显的抑制作用,且在一定含量范围内,Pb2+对斜生栅藻的抑制作用在后期更为明显,后期生物量呈现下降趋势;Cr3+和Cr6+则表现为全培养周期内的抑制作用,而生物量表现为增长趋势.这种差异可能是由于铅、铬作用时与藻的结合位点不同造成的,且在Pb2+胁迫后期,观察到斜生栅藻细胞器尤其是叶绿体大量被破坏,这可能直接导致生物量的下降;而在Cr3+、Cr6+胁迫后期则几乎观察不到这种现象.
重金属离子对微藻的毒性可用重金属对微藻某个生理指标的IC50或LC50来表示,本研究中用生物量的IC50来表示重金属的毒性.一般来讲,这3种重金属离子对微藻的毒性强弱顺序为:Cr6+>Pb2+>Cr3+,且Cr6+的毒性约为Cr3+的100倍(Vignati et al., 2010).在本研究中,Pb2+、Cr3+、Cr6+对斜生栅藻生物量96 h的IC50分别为82.94、121.15、23.65 μmol · L-1,3种重金属离子对斜生栅藻的毒性大小排序为Cr6+>Pb2+>Cr3+,Cr6+的毒性仅为Cr3+的6倍左右.而在Vignati等(2010)的研究中,甚至有Cr6+毒性小于Cr3+的情况出现.这些差异可能是由于培养条件、藻种及测定指标的不同而导致的.
4.2 不同重金属离子对斜生栅藻光合性能的影响光合作用是绿色植物最基本和最重要的生命活动过程(欧阳峥嵘等,2010).而重金属则可以造成藻细胞线粒体损伤,叶绿体破坏,影响光合作用的电子传递,从而抑制藻细胞生长(Edding et al., 1996).作为光合作用的特征性产物,氧气的释放速率可以作为评价光合活性的参数之一.在梁英等(2008)的文献中报道,一定浓度的Cd2+、Cu2+、Zn2+等均会不同程度地抑制微藻的放氧速率.在本研究中,以Pb2+、Cr3+、Cr6+的半数抑制浓度(IC50)来胁迫培养斜生栅藻时,发现Pb2+对斜生栅藻放氧速率的影响从第2 d开始极显著,而Cr3+和Cr6+的影响则在前3 d表现的较明显.这表明不同的金属离子对微藻的胁迫程度及作用机制可能存在差别,而Pb2+作用时出现的叶绿体被明显破坏的现象也正与这一结果相契合.而本实验中,半数抑制浓度的重金属胁迫对斜生栅藻呼吸速率的影响并不明显,表明半数抑制浓度的Pb2+、Cr3+和Cr6+对线粒体的伤害不大.
叶绿素荧光是光合作用的良好指标和探针,通过对各种荧光参数的分析,可以得到有关光能利用途径的信息,也可以反映植物受胁迫的情况(陈书秀等,2009).Fv/Fm表示PSⅡ 的最大光化学量子产量,即PSII 的原初光能转换效率;Yield表示PSⅡ 实际光能转化效率;rETR表示PSⅡ 表观电子传递速率;qP为光化学淬灭,反映了PSII 天线色素吸收的光能用于光化学电子传递的份额,在一定程度上反映了PSⅡ 反应中心的开放程度(梁英等,2008).Pb2+胁迫下,斜生栅藻的Fv/Fm、Yield、rETR均表现出下降趋势,且明显低于对照组,表明铅使斜生栅藻PSⅡ反应中心受损,抑制了光合作用的原初反应,阻碍光合电子传递的过程;且阻止了藻细胞同化力的形成,从而影响对碳的固定和同化;此外,Pb2+也能影响斜生栅藻的电子传递速率.而Pb2+胁迫下,斜生栅藻qP值前期明显高于对照组,而从第5 d开始迅速下降到明显低于对照组的水平,表明Pb2+胁迫前期提高了PSⅡ反应中心的开放程度,电子由PSⅡ的氧化侧向PSⅡ反应中心的传递速率加快,而胁迫后期则阻碍了电子传递,用于进行光合作用的电子减少,以热耗散的光能增加.Cr3+和Cr6+对斜生栅藻Fv/Fm、Yield、rETR和qP的作用跟主要表现在前期,而后期对这些指标的影响并不明显.
4.3 不同重金属对斜生栅藻抗氧化系统的影响当植物受到不利因素胁迫时,机体会产生过量的O-2、—OH、H2O2等分子,这些活性氧分子的大量产生会引发或加剧膜脂质过氧化作用,对膜系统造成严重伤害(d′Ischia et al., 1996).而膜脂质过氧化的产物MDA可以作为反映藻细胞面临的氧化压力的指标.在本研究中,对照组的MDA含量呈现略微上升趋势,这可能是由于重新接种,单位细胞受到的光照变强导致的.而重金属胁迫下,前2 d斜生栅藻MDA含量略高于对照组,而Cr3+胁迫第3 d、Cr6+胁迫第4 d均是MDA含量极显著高于对照组.这表明Pb2+、Cr3+、Cr6+的毒性对斜生栅藻产生了不同程度的氧化压力,导致细胞膜脂质过氧化作用增强,对细胞产生了不利影响,而这种不利影响于培养的第3、4 d表现的尤为明显.
植物体内存在一套负责清除活性氧的抗氧化防御系统(Yu et al., 2004),在胁迫条件下,植物就会启动自身的防御机制,通过清除自由基,抵抗氧化损伤,以维持体内环境的相对稳定.SOD可以通过歧化反应消除O-2,是生物体防护机制的中心酶,SOD活性的增加代表O-2的增加.因此,几乎所有的胁迫都可以可诱导SOD活性显著增加(杨洪等,2012).在本研究中,Pb2+、Cr3+、Cr6+3种金属离子胁迫下的斜生栅藻,SOD活性分别在第3、4 d显著提高,明显高于对照组,表明斜生栅藻为应对氧化压力作出应激.而重金属胁迫下,CAT活性和总抗氧化能力T\|AOC与对照组相比变化不如SOD明显,仅有很小程度的提高,具体原因还需进一步探讨.
4.4 斜生栅藻相关生理生化指标作为重金属毒性评估标准的优势传统评估重金属毒性的方法是将微藻在含有不同浓度重金属离子的培养液中进行培养,通过微藻的细胞密度、微藻中叶绿素含量等的变化来反映重金属对微藻生长、繁殖的影响,或者以微藻细胞密度的LC50或IC50来表示其对重金属胁迫的敏感程度(李坤等,2003;王翔等,2006).但该法存在测量时间长、容易出现较大误差、无法准确区别活细胞和死细胞,且无法评估细胞的生命状态的缺点.
在本研究中,通过测定每天的生物量积累及96 h生物量的 IC50来评估不同浓度重金属对斜生栅藻的毒性,相对传统方法,该法可以准确反映斜生栅藻在重金属胁迫下生物量积累所受的影响,且没有传统测定方法费时.此外,斜生栅藻光合性能对Pb2+胁迫的敏感程度远高于生物量积累,且反应比生物量提前;但斜生栅藻光合性能对Cr3+和Cr6+的反应则不如生物量明显.斜生栅藻SOD活性在重金属胁迫下第3、4 d极显著高于对照,且可用于评估斜生栅藻受到的氧化压力,可以反映出斜生栅藻对重金属胁迫作出的应答.因此,以上生理生化指标的测定,相较传统评估重金属毒性的方法,具有更快速、准确、灵敏和全面的优势.
5 结论(Conclusions)1)一定浓度的Pb2+、Cr3+和Cr6+均会对斜生栅藻的生长产生抑制,Pb2+、Cr3+、Cr6+对斜生栅藻96 h的半数抑制浓度分别为82.94、121.15、23.65 μmol · L-1,毒性大小顺序为Cr6+>Pb2+>Cr3+.Pb2+对斜生栅藻生长的抑制主要表现在培养后期,而Cr3+和Cr6+则表现为全培养周期的抑制.
2)斜生栅藻在Pb2+、Cr3+和Cr6+的半数抑制浓度胁迫下,光合生理受到不同程度的影响.Pb2+对斜生栅藻放氧速率、Fv/Fm、Yield、rETR、qP的抑制作用,前期低于Cr3+和Cr6+,后期极显著高于Cr3+和Cr6+.
3)为了应对重金属胁迫所造成的氧化压力,斜生栅藻的抗氧化酶活在重金属胁迫下升高,SOD活性相较CAT升高更显著.
4)斜生栅藻的光合性能和SOD活性均可以作为评估重金属铅、铬毒性的灵敏、快速的指标.
| [1] | Azov Y.1982.Effect of pH on inorganic carbon uptake in algal cultures[J].Applied and Environmental Microbiology,43(6):1300-1306 |
| [2] | 陈书秀,梁英.2009.光照强度对雨生红球藻叶绿素荧光特性及虾青素含量的影响[J].南方水产,5(1):1-8 |
| [3] | d'Ischia M,Costantini C,Prota G.1996.Lipofuscin-like pigments by autoxidation of polyunsaturated fatty acids in the presence of amine neurotransmitters:the role of malondialdehyde[J].Biochimica et Biophysica Acta (BBA)-General Subjects,1290(3):319-326 |
| [4] | Edding M,Tala F.1996.Copper transfer and influence on a marine food chain[J].Bulletin of Environmental Contamination and Toxicology,57(4):617-624 |
| [5] | 金羽,曲娟娟,李影,等.2013.一株耐铅细菌的分离鉴定及其吸附特性研究[J].环境科学学报,33(8):2248-2255 |
| [6] | 李坤,王福强,孙慎侠,等.2003.巴夫金藻耐受Cu2+、Cd2+毒害作用的研究[J].大连大学学报,24(4):92-94 |
| [7] | 梁英,王帅,冯力霞,等.2008.重金属胁迫对纤细角毛藻生长及叶绿素荧光特性的影响[J].中国海洋大学学报:自然科学版,38(1):59-67 |
| [8] | 梁英,王帅.2009.重金属对微藻胁迫的研究现状及前景[J].海洋湖沼通报,(4):72-82 |
| [9] | Lowry O H,Rosebrough N J,Farr A L,et al.1951.Protein measurement with the Folin phenol reagent[J].The Journal of Biological Chemistry,193(1):265-275 |
| [10] | 孟春晓,高政权.2009.微藻对重金属污染的生物修复研究现状与展望[J].水产科学,28(12):795-797 |
| [11] | Omar H H.2002.Bioremoval of zinc ions by Scenedesmus obliquus and Scenedesmus quadricauda and its effect on growth and metabolism[J].International Biodeterioration & Biodegradation,50(2):95-100 |
| [12] | 欧阳慧灵,孔祥臻,秦宁,等.2012.5种重金属亚致死暴露浓度对普通小球藻生长抑制与光合毒性的比较[J].科学通报,57(10):785-793 |
| [13] | 欧阳峥嵘,温小斌,耿亚红,等.2010.光照强度、温度、pH、盐度对小球藻 (Chlorella) 光合作用的影响[J].武汉植物学研究,28(1):49-55 |
| [14] | Vignati D A L,Dominik J,Beye M L,et al.2010.Chromium (VI) is more toxic than chromium (III) to freshwater algae:A paradigm to revise?[J].Ecotoxicology and Environmental Safety,73(5):743-749 |
| [15] | 王翔,聂湘平,李凯彬.2006.三氯异氰尿酸和环丙沙星对水生生物的急性毒性[J].生态科学,25(2):155-157; 161 |
| [16] | 杨洪,黄志勇.2012.锌胁迫对小球藻抗氧化酶和类金属硫蛋白的影响[J].生态学报,32(22):7117-7123 |
| [17] | Yu J,Tang X X,Zhang P Y,et al.2004.Effects of CO2 enrichment on photosynthesis,lipid peroxidation and activities of antioxidative enzymes of Platymonas subcordiformis subjected to UV-B radiation stress[J].Acta Botanica Sinica,46(6):682-690 |
 2014, Vol. 34
2014, Vol. 34


