2. 建设综合勘察研究设计院有限公司, 北京 100007;
3. 青岛市水利勘察设计研究院, 青岛 266071
2. Construction Survey and Design Institute co., LTD., Beijing 100007;
3. Water Survey and Design Institute of Qingdao, Qingdao 266071
在地下水资源开发(蘭宗宗和田玉新,2010)、水源热泵(李卓等,2010)、中水微灌(薛英文等,2007)以及油田开采过程(李阳,2002)中,需要向地层中进行大量注水,不可避免会带入霉菌、酵母菌、放线菌等微生物(Wingender et al., 1999;Chong et al., 2008;Jarusutthirak et al., 2002).在适宜的条件下,这些微生物迅速繁殖,并分泌大量的胞外聚合物(Metzger et al., 2007;Zhang et al., 2007)(Extracellular Polymeric Substances,EPS).胞外聚合物是一类高分子粘性聚合物,通常附着在含水介质的颗粒表面,降低其有效孔隙度,从而形成生物堵塞.此外,生物堵塞现象还在膜生物反应器以及生物滤池中普遍存在.马立等(2005)在下向流生物滤池的进水端发现微生物种群丰富,菌胶团结构致密,胞外聚合物的积累加上悬浮物的截留,使得生物滤池水头损失增加较快,发生严重的生物堵塞.工程实践表明,由胞外聚合物积累导致的生物堵塞严重影响着工程的效率、维护成本以及设备的使用寿命(杜新强等,2009).
微生物分泌的胞外聚合物成分复杂,主要由多糖和蛋白质组成,其组成和含量受诸多因素影响(Sheng et al., 2010).Li和Yang(2007)研究了不同碳源对活性污泥产生EPS的影响,认为以葡萄糖为碳源时,污泥产生的EPS含量最高.Durmaz和Sanin(2001)研究了不同C∶N下活性污泥EPS组分的变化,发现随着C ∶ N升高,EPS中多糖含量增多,蛋白质含量降低.Jia等(1996)认为,在细菌对数生长期内,EPS浓度随培养时间逐渐升高;而在细菌处于生长稳定期时,EPS含量随培养时间反而下降.李久义等(2002)对曝气生物滤池中生物膜EPS进行研究,认为多糖是EPS最主要的组成部分,并且EPS含量随进水有机物浓度降低而逐渐下降.曹相生等(2004)研究了Mn2+、Mo6+和Zn2+对活性污泥中EPS组分的影响,认为低浓度(0.05 g · L-1)Mn2+导致EPS中蛋白质、多糖和核酸含量下降,而Zn2+使EPS中多糖含量改变,进而导致蛋白质/多糖比值的改变,Mo6+则对EPS各组分基本没有影响.
在环境工程领域中,有关胞外聚合物的研究多是针对其对活性污泥疏水性、絮凝性、沉降性以及对重金属离子吸附性(罗曦等,2005)的影响,而对于胞外聚合物在含水介质中的积累作用报道较少.本文以粗砂为代表性含水介质,通过砂柱试验模拟人工回灌过程,考察回灌条件对粗砂介质上胞外聚合物组成和含量的影响,该研究可为含水层生物堵塞机理和防治等提供科学依据.
2 材料与方法(Materials and methods) 2.1 试验装置与材料试验装置见图 1,砂柱由有机玻璃制成,高22 cm,内径5 cm.柱体一侧距底部进水口0、2、4、6、12、18 cm处分别设测压口.试验采用蠕动泵将回灌水以恒定流速由底部进水口泵入,流经砂柱后由出水口排出.
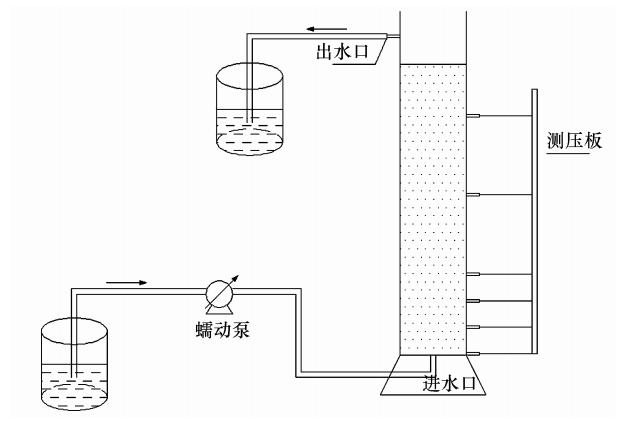 |
| 图 1 试验装置示意图 Fig. 1 Schematic diagram of experiment equipment |
供试砂样取自青岛市大沽河下游潜水含水层,该砂样为粗砂,其粒径分布曲线见图 2,砂样基本物理性质见表 1.本文采用实验室配水的方法,将蒸馏水中分别加入葡萄糖、氯化铵(NH4Cl)、磷酸氢二钾(K2HPO4)作碳、氮和磷源,并加入微生物生长所需微量元素(孔祥平,2007).
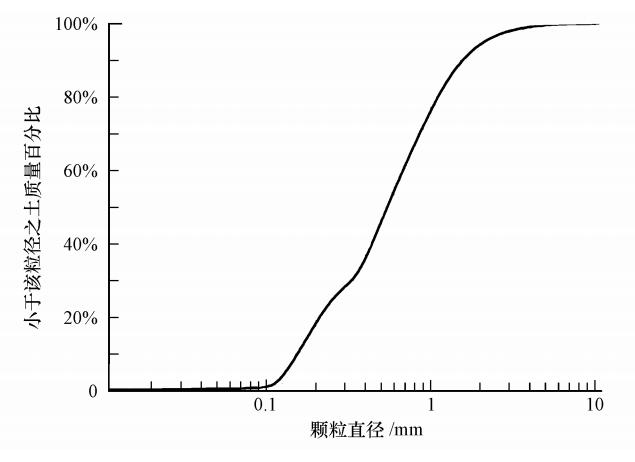 |
| 图 2 供试砂样粒径分布曲线 Fig. 2 Particle size distribution curve of s and sample |
| 表1 砂样基本物理性质 Table.1 Physical properties of s and sample |
菌种取自青岛市大沽河下游贾疃坝附近的堵塞含水层.利用异养菌平板计数法(杨海燕和朱万学,2005)测定供试微生物种群数量,分别采用牛肉膏蛋白胨培养基、厌氧富集培养基、高氏一号培养基及马丁氏培养基(周群英和王士芬,2008)培养好氧细菌、厌氧细菌、放线菌及真菌,并进行计数,每组试验做2个平行样.微生物数量、形态见表 2和图 3.
| 表2 微生物种群数量 Table.2 Microorganism quantity on porous medium |
 |
| 图 3 显微镜下附着微生物微观形态(a)和扫描电镜下附着微生物及EPS空间形态(b) Fig. 3 Gram′s stain of the attached microorganism on porous medium(a) and SEM image of the attached microorganism and EPS on porous medium(b) |
由图 3可得,介质中的细菌主要以短杆菌为主;砂粒上的附着微生物在胞外聚合物的作用下相互粘结成团,形成黏性菌胶团附着在砂粒表面.菌体分泌的胞外聚合物可以降低介质的有效孔隙度,增加流体粘度,增强菌体细胞之间的粘附性,同时增加流体-介质之间的摩擦力,从而降低含水介质的渗透性.
通过聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)技术对供试微生物的优势菌种进行鉴定,分别属于甲基杆菌属(Methylobacterium )、紫色杆菌属(Janthinobacterium)、耶尔森杆菌属(Yersinia)、葡萄球菌属(Staphylococcus)、食酸菌属(Acidovorax).查阅文献可知,供试菌种中的甲基杆菌属、紫色杆菌属、葡萄球菌属和食酸菌属均为产粘性胞外聚合物的菌群(Nakamura et al., 1976).
2.2 试验方法 2.2.1 渗透系数采用砂柱试验模拟人工回灌过程中含水层的生物堵塞,通过介质渗透系数的变化,描述不同砂柱的堵塞过程.试验开始前,用自来水对砂柱进行饱水,计算砂柱的初始渗透系数.待初始渗透系数稳定后进行人工回灌试验.其中,渗透系数由式(1)求得:

回灌试验结束后,利用公式(1)计算砂柱的渗透系数.其中,Q为出水流量,D=5 cm,Δx为砂柱上、下测压管的水头损失,Δh为两测压管距离(18 cm).以砂柱渗透系数的降低率描述砂柱的堵塞程度,公式如下:
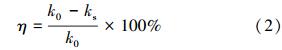
菌种采集后,用曝气机充分曝气2 h.静置30 min,将上层清液以恒定流速(1 mL · min-1)泵入饱水后的砂柱,接种6 h,关闭进、出水阀,保证含水介质上一定的菌种附着量.打开蠕动泵,以恒定流速(5 mL · min-1)泵入营养液,模拟人工回灌过程.
回灌结束后,拆除砂柱,称取定量砂样,超声波振荡仪振荡数次(每次振荡时间不超过5 min,振荡的次数一般为1~3次,视振荡效果而定),采用甲醛-氢氧化钠法提取微生物EPS(Frlund et al., 1996).为了保证多糖和蛋白质不变性,最好能在提取的当天测定.然后,采用苯酚-硫酸法(罗毅等,2005)和考马斯亮蓝法(李如亮,1998)分别测定EPS中多糖及蛋白质的含量,并将两者之和计为EPS总量,以单位质量砂样上附着含量表示(μg · g-1).每组试验做2个平行样.
3 结果与讨论(Results and discussion)以回灌水碳、氮、磷浓度、盐度和温度为主要控制条件,进行砂柱回灌试验,分析各因素对微生物EPS中多糖、蛋白质含量的影响.
3.1 碳浓度控制回灌水CODCr∶N∶P为100∶5∶1,使NaCl质量浓度为0.5%,选取葡萄糖作为微生物生长的唯一碳源.回灌试验进行216 h,计算不同砂柱渗透系数的降低率,并考察不同碳浓度下,EPS中多糖、蛋白质含量的变化(见图 4).
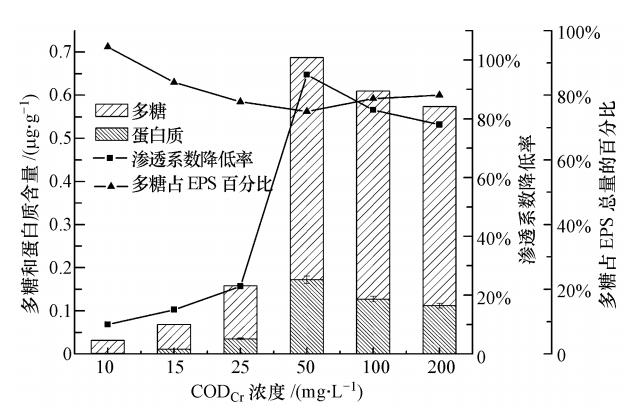 |
| 图 4 不同CODCr浓度下多糖和蛋白质组成和含量变化 Fig. 4 The polysaccharide and protein content under different concentrations of CODCr |
由图 4可以看出,连续回灌216 h后,砂柱渗透系数均明显下降.同时,渗透系数的下降率与微生物EPS含量的变化趋势一致,说明砂柱的堵塞程度与EPS含量呈正相关性.CODCr为50 mg · L-1时,EPS含量达到最大值(0.68 μg · g-1),此时砂柱渗透系数降低率为95%,堵塞程度最严重.随CODCr浓度的继续增加,EPS 略有降低,含水介质的渗透系数降低率从95%减小为78%,生物堵塞程度略有减轻.分析原因,当进水CODCr浓度很低时,微生物生长可利用的碳源远远低于正常生长所需的浓度,此时微生物将其用于维持生长,分泌的胞外聚合物含量很低,此时含水介质表面较为光滑,孔隙空间较大.随着CODCr 浓度的升高,微生物的生长不受碳源的限制,同时介质孔隙度较大,含氧量丰富,微生物生长速度加快,新陈代谢旺盛,分泌的EPS含量增多,堵塞相邻介质的连接通道.然而,随着EPS的大量积累,同时介质孔隙度降低,含氧量不足严重抑制微生物的正常生长,反而使EPS含量略有下降.
由图 4还可看出,微生物分泌的胞外聚合物中多糖明显高于蛋白质,占胞外聚合物的76%~95%,这与Flemming 等(Flemming and Wingender, 2001;Vocks et al., 2006;Susant et al., 2008;Yigit et al., 2008)的研究一致.此外,不同碳浓度下,多糖在微生物分泌的胞外聚合物总量中所占比例先降低后升高,说明碳源是影响EPS中多糖、蛋白质组成的主要因素.EPS中含有大量具有强吸附性的负电基团,例如蛋白质的酰胺(Ⅱ)、羧基以及多糖中的C—O—C、—OH等基团对进水中带正电的胶体具有络合能力.随着人工回灌的进行,EPS不断吸附进水中的胶体,减小了含水介质的有效孔隙度,从而降低其渗透性.
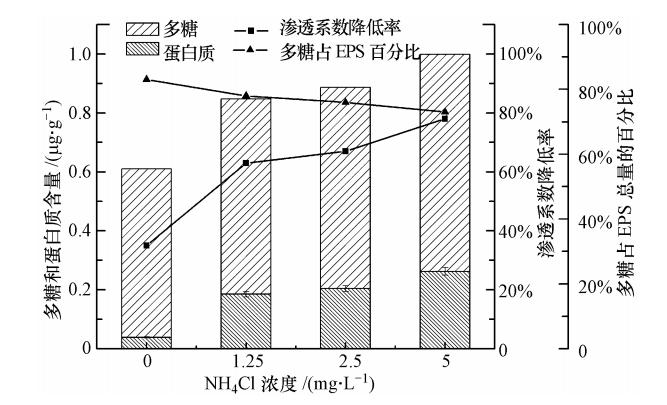
3.2 氮源本试验中,控制回灌水CODCr、K2HPO4、NaCl浓度分别为50 mg · L-1、0.5 mg · L-1(以P计)、0.5%.选取NH4Cl作为氮源.连续回灌216 h,计算砂柱渗透系数的降低率,考察不同NH4Cl浓度下,EPS中多糖和蛋白质含量的变化,试验结果见图 5.
 |
| 图 5 不同氮浓度下多糖和蛋白质组成和含量变化 Fig. 5 The polysaccharide and protein content under different concentrations of N |
由图 5可以看出,连续回灌216 h后,砂柱的渗透系数均明显下降,说明粗砂介质上发生生物堵塞现象.回灌水NH4Cl浓度很低时(0 mg · L-1),胞外聚合物的成分主要为多糖类,此时粗砂介质渗透系数下降率为35%.随进水NH4Cl浓度的升高,粘附于介质表面的EPS含量呈现缓慢上升趋势,变化不大.此时砂柱渗透系数下降率从63%升至78%,介质堵塞程度略有加剧.分析原因,当进水氮浓度很低时,微生物不能进行正常的新陈代谢,只能将碳源转化为多糖类聚合物.随回灌水氮浓度的升高(0 mg · L-1升至1.25 mg · L-1),氮源不再是限制微生物生长的因素,其生长速率加快,代谢能力增强,分泌胞外聚合物的量逐渐增多.EPS粘附于含水介质表面,堵塞介质孔隙通道,导致介质间有效孔隙减小,砂柱渗透系数急速下降(下降率为63%).随进水氮浓度继续升高(1.25 mg · L-1升至5 mg · L-1),EPS大量附着于粗砂介质表面,致使孔隙含氧量降低,抑制微生物活动,其分泌的胞外聚合物的量呈现缓慢上升趋势,但基本变化不大.砂柱堵塞程度变化缓慢,渗透系数下降率从63%升至78%.由图 4还可以看出,不同氮浓度下,多糖在微生物分泌的胞外聚合物总量中所占比例变化不大,说明氮对EPS中多糖、蛋白质组成的影响不大.
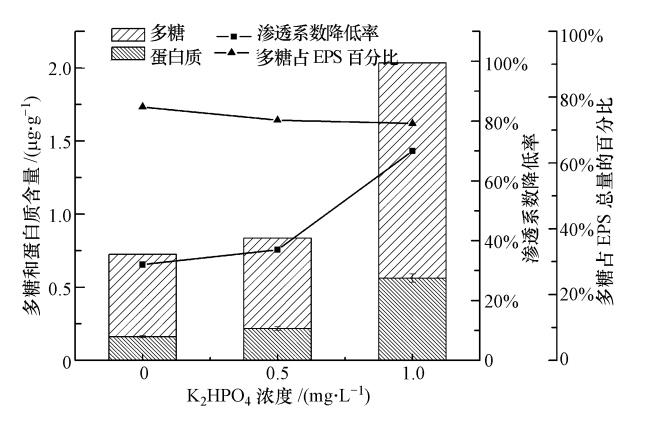
3.3 磷源控制进水CODCr、NH4Cl、NaCl浓度分别为50 mg · L-1、5 mg · L-1(以N计)和0.5%.选取K2HPO4作为磷源.进行216 h人工回灌试验,计算砂柱渗透系数的降低率,考察不同磷浓度下,含水介质EPS中多糖和蛋白质组成和含量的变化(见图 6).
 |
| 图 6 不同磷浓度下多糖和蛋白质组成和含量变化 Fig. 6 The polysaccharide and protein content under different concentrations of P |
由图 6可以看出,当进水磷为0 mg · L-1时,砂样上附着的EPS含量很低,仅为0.72 μg · g-1,回灌结束时,砂柱渗透系数降低率为32%;随磷浓度的增大(0.5 mg · L-1增大到1 mg · L-1),EPS含量呈现急速上升趋势,由0.83 μg · g-1上升至2.03 μg · g-1,砂柱渗透系数降低率从37%增大到70%.面对低磷环境时,微生物存在自身磷酸盐代谢体系(Zhao et al., 2005;Su et al., 2010;Ciston et al., 2009).当进水磷浓度很低时,微生物仍然会表现出一定的代谢能力.但此时磷源为微生物生长的限制因素,微生物生长繁殖能力较弱,仅产生少量的胞外聚合物,附着于含水介质的表面,对介质孔隙通道的堵塞效应较低,随回灌时间的延长,砂柱渗透系数下降较缓慢;随回灌水磷浓度的升高,微生物活性增强,并且含水介质间存在较大的孔隙空间,为其生长提供了必要的氧气.微生物通过自身代谢作用分泌的胞外聚合物,粘附于砂粒表面,增加了介质与流体之间的摩擦力.同时EPS吸附了大量胶体颗粒,导致其分泌量持续增多.EPS大量附着于粗砂介质表面,严重堵塞孔隙通道,致使渗透系数下降率达70%.由图 6还可以看出,在不同磷浓度下,多糖在微生物分泌的胞外聚合物总量中所占比例变化不大,说明磷并不是影响EPS中多糖、蛋白质组成的主要因素.
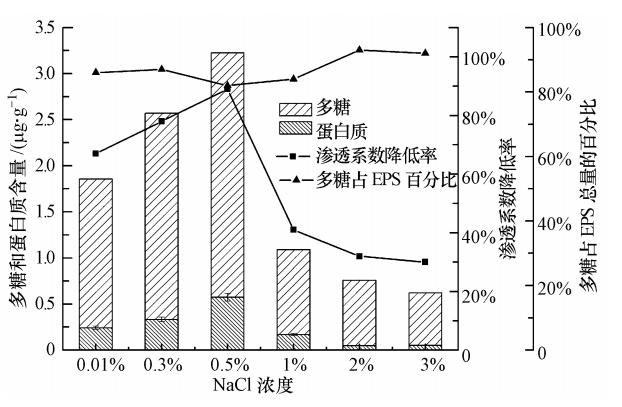
3.4 盐度使进水CODCr、NH4Cl、K2HPO4浓度分别为50 mg · L-1、5 mg · L-1(以N计)、1 mg · L-1(以P计),砂柱模拟人工回灌试验,计算砂柱渗透系数的降低率,分析盐浓度对微生物EPS中多糖和蛋白质组成和含量的影响(见图 7).
 |
| 图 7 不同盐度下多糖和蛋白质组成和含量变化 Fig. 7 The polysaccharide and protein content under different concentrations of salt |
由图 7可得,随进水NaCl浓度的升高,微生物EPS含量呈现先升高、后降低的趋势.砂柱渗透系数降低率亦呈现相同趋势.当进水NaCl浓度从0.01%升高至0.5%时,含水介质上的EPS附着量从1.85 μg · g-1增加到3.22 μg · g-1;渗透系数降低率从67%增大到89%.表明随EPS含量的增大,砂柱生物堵塞程度增强.当NaCl浓度继续增大时,EPS含量急剧下降,最低降至0.62 μg · g-1;砂柱渗透系数降低率逐渐减小.分析原因,当进水盐浓度从0.01%增至0.5%时,盐度不再是限制微生物生长的主要因素,其生长迅速,新陈代谢旺盛,分泌了大量的EPS,粘附于砂粒表面.同时,离子浓度的升高导致含水介质中粘粒双电层的距离减小,降低其排斥力,使胞外聚合物与含水介质的结合力增强,致使砂柱渗透系数显著降低,降低率从67%增大至89%.而当NaCl浓度超过1%时,微生物无法适应外部高盐环境,在生长初期,发生细胞失水,进而死亡;只有少部分菌体发生细胞自溶现象,释放胞内聚合物,其中的负电性基团与含水介质中的胶体紧密吸附在一起,形成EPS,砂柱的堵塞程度有所缓解,降低率从41%降至30%.由图 7还可以看出,在不同盐度下,胞外聚合物中多糖所占比例先降低、后升高,说明盐度是影响EPS中多糖、蛋白质组成的因素之一.
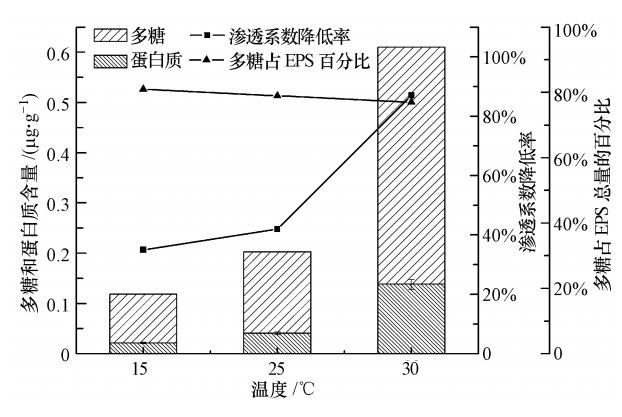
3.5 温度控制回灌水CODCr、NH4Cl、K2HPO4、NaCl浓度分别为50 mg · L-1、5 mg · L-1(以N计)、1 mg · L-1(以P计)、0.5%.人工回灌216 h,计算砂柱渗透系数降低率,考察温度对含水介质EPS中多糖、蛋白质组成及含量的影响(见图 8).
 |
| 图 8 不同温度下多糖和蛋白质组成和含量变化 Fig. 8 The polysaccharide and protein content under different temperature |
由图 8可知,随回灌水温度的升高,微生物分泌的EPS含量呈现上升趋势,同时砂柱生物堵塞程度加剧.从15 ℃升高到30 ℃时,胞外聚合物从0.11 μg · g-1增加至0.61 μg · g-1,介质的渗透系数从35%增大至87%.分析原因,当环境温度很低时,微生物生长速率缓慢,新陈代谢能力较弱.随着温度的升高,微生物生长速率增大,新陈代谢旺盛,向周围环境分泌大量的代谢产物.此外,随回灌水温度的升高,含水介质粘粒间扩散双电层增大,表面电势随着双电层厚度增大而升高,粘粒之间以及粘粒与孔隙表面间的排斥力逐渐增大,导致粘粒释放.释放的粘粒随着回灌水的迁移被吸附于胞外聚合物的表面,导致含水介质的孔隙通道发生堵塞、中断,从而其渗透性降低.由图 8还可看出,不同温度下,多糖在微生物分泌的胞外聚合物中所占比例变化不大,说明温度对EPS中多糖、蛋白质组成的影响不大.
4 结论(Conclusions)1)在研究的回灌条件下,含水介质中胞外聚合物的主要成分为多糖和蛋白质,其中多糖占总量的72%~99%.
2)砂柱生物堵塞程度与介质上附着的EPS含量呈正相关性.当回灌水碳、氮、磷浓度、盐度和温度分别为50 mg · L-1、5 mg · L-1、1 mg · L-1、0.5%和30 ℃时,最有利于微生物分泌胞外聚合物,产生量最大,砂柱渗透系数降低率最大,堵塞程度最严重.碳、磷浓度、盐度和温度是影响胞外聚合物生成的主要因素,而氮对EPS的生成量影响不大.
3)水中碳浓度和盐度对微生物胞外聚合物中多糖、蛋白质的组成影响较大,而氮、磷浓度和温度是相对次要的因素.
| [1] | 曹相生, 龙腾锐, 孟雪征, 等. 2004. Mn2+、Mo6+和Zn2+对活性污泥内胞外聚合物组分的影响[J]. 环境科学, 25(4): 70-73 |
| [2] | Chong T H, Wong F S, Fane A G. 2008. The effect of imposed flux on biofouling in reverse osmosis: Role of concentration polarisation and biofilm enhanced osmotic pressure phenomena[J]. Journal of Membrane Science, 325(2): 840-850 |
| [3] | Ciston S, Lueptow R M, Gray K A. 2009. Controlling biofilm growth using reactive ceramic ultrafiltration membranes[J]. Journal of Membrane Science, 342: 263-268 |
| [4] | Durmaz B, Sanin F D. 2001. Effect of carbon to nitrogen ratio on the composition of microbial extracellular polymers in activated sludge[J]. Water Science Technology, 44(10): 221-229 |
| [5] | 杜新强, 冶雪艳, 路莹, 等. 2009. 地下水人工回灌堵塞问题研究进展[J]. 地球科学进展, 24(9): 973-980 |
| [6] | Flemming H C, Wingender J. 2001. Relevance of microbial extracellular polymeric substances (EPS) Part I: Structural and ecological aspects[J]. Water Science and Technology, 43(6): 1-8 |
| [7] | Frlund B, Palmgren R, Keiding K, et al. 1996. Extraction of extracellular polymers from activated sludge using a cation exchange resin[J]. Water Research, 30(8): 1749-1758 |
| [8] | Jarusutthirak C, Amy G, Croué J. 2002. Fouling characteristics of wastewater effluent organic matter (EfOM) isolates on NF and UF membranes[J]. Desalination, 145(1/3): 247-255 |
| [9] | Jia X S, Furumai H, Fang H H P. 1996. Extracellular polymers of hydrogen-utilizing methanogenic and sulfate-reducing sludges[J]. Water Research, 30(6): 1439-1444 |
| [10] | 孔祥平. 2007. 一株地芽孢杆菌(Geobacillus sp.)在模拟油藏环境下的生长与运移实验研究 . 青岛: 中国海洋大学. 67-69 |
| [11] | 蘭宗宗, 田玉新. 2010. 地下水人工回灌方法及堵塞问题分析[J]. 中国科技博览, (24): 25 |
| [12] | 李久义, 左华, 栾兆坤, 等. 2002. 不同基质条件对生物膜细胞外聚合物组成和含量的影响[J]. 环境化学, 21(6): 546-551 |
| [13] | 李如亮. 1998. 生物化学实验[M]. 武汉: 武汉大学出版社. 32-35 |
| [14] | Li X Y, Yang S F. 2007. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation, sedimentation and dewaterability of activated sludge[J]. Water Research, 41(5): 1022-1030 |
| [15] | 李阳. 2002. 微生物与石油工业[J]. 油气地质与采收率, 9(4): 1-4 |
| [16] | 李卓, 卞大中, 阎淑平. 2010. 对水源热泵回灌堵塞问题的几点认识[J]. 浙江水利科技, 172(6): 70-72 |
| [17] | 罗曦, 雷中方, 张振亚, 等. 2005. 好氧/厌氧污泥胞外聚合物(EPS)的提取方法研究[J]. 环境科学学报, 25(12): 1624-1629 |
| [18] | 罗毅, 潘细贵, 刘刚, 等. 2005. 苯酚-硫酸法测定多糖含量显色方式的优选[J]. 制剂与工艺, 12(1): 45-46 |
| [19] | 马立, 白宇, 张杰, 等. 2005. 下向流生物滤池低温堵塞问题的分析与研究 [J]. 给水排水, 31(1): 37-40 |
| [20] | Metzger U, Le-Clech P, Stuetz R M, et al. 2007. Characterisation of polymeric fouling in membrane bioreactors and the effect of different filtration modes[J]. Journal of Membrane Science, 301(1/2): 180-189 |
| [21] | Nakamura J, Miyashiro S, Hirose Y. 1976. Screening, isolation, and some properties of microbial cell flocculants[J]. Agricultural and Biological Chemistry, 40(2): 377-383 |
| [22] | Sheng G P, Yu H Q, Li X Y. 2010. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: A review[J]. Biotechnology Advances, 28(6): 882-894 |
| [23] | Su X J, Zhao Q, Wang S, et al. 2010. Modification of diamond-like carbon coatings with fluorine to reduce biofouling adhesion[J]. Surface and Coatings Technology, 204(15): 2454-2458 |
| [24] | Susanto H, Arafat H, Janssen E M L, et al. 2008. Ultrafiltration of polysaccharide-protein mixtures: Elucidation of fouling mechanisms and fouling control by membrane surface modification[J]. Separation and Purification Technology, 63(3): 558-565 |
| [25] | Vocks M, Bracklow U, Drews A, et al. 2006. Comparison of polysaccharide concentration and fouling rates in different membrane activated sludge systems[J]. Desalination, 199(1/3): 381-383 |
| [26] | Wingender J, Neu T R, Flemming H C. 1999. Microbial extracellular polymeric substances[M]. Berlin: Springer. 1-19 |
| [27] | 薛英文, 杨开, 李白红, 等. 2007. 中水微灌系统生物堵塞特性探讨[J]. 中国农村水利水电, (7): 36-39 |
| [28] | 杨海燕, 朱万学. 2005. 异养菌静态法评定化学杀生剂杀菌性能[J]. 理化检验(化学分册), 41(6): 436-437 |
| [29] | Yigit N O, Harman I, Civelekoglu G, et al. 2008. Membrane fouling in a pilot-scale submerged membrane bioreactor operated under various conditions[J]. Desalination, 231(1/3): 124-132 |
| [30] | Zhang L L, Feng X X, Zhu N W, et al. 2007. Role of extracellular protein in the formation and stability of aerobic granules[J]. Enzyme and Microbial Technology, 41(5): 551-557 |
| [31] | Zhao Q, Liu Y, Wang C, et al. 2005. Effect of surface free energy on the adhesion of biofouling and crystalline fouling[J]. Chemical Engineering Science, 60(17): 4858-4865 |
| [32] | 周群英, 王士芬. 2008. 环境工程微生物学[M]. 北京: 高等教育出版社. 45-48 |
 2014, Vol. 34
2014, Vol. 34


