全氟辛烷磺酸(Perfluorooctane Sulfonate,PFOS)是一类典型的全氟化合物,其结构式如图 1所示.由于PFOS具有良好的化学稳定性和热稳定性、优异的疏水和疏油性、生物相容性及高的表面活性等特点,被广泛地应用于纺织、造纸、包装、农药、地毯、皮革、地板打磨、洗发香波和灭火泡沫等工业生产和生活消费品生产领域(金一和等,2002;Giesy et al., 2002;Yu et al., 2012).同时,由于PFOS也具有持久性、生物累积性及器官毒性、生殖与发育毒性、致癌性和免疫毒性等多种毒性(Hekster et al., 2003;MacDonald et al., 2004;Beach et al., 2006),因此,其对生态环境及生物体存在潜在的威胁.
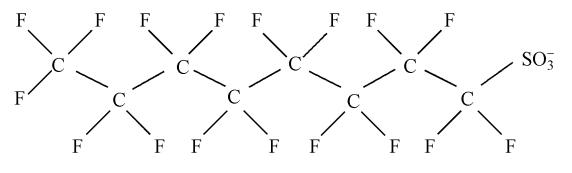 |
| 图 1 PFOS的化学结构式 Fig. 1 Chemical structural formula of PFOS |
研究表明,PFOS在全球范围内的各种环境介质,如土壤、大气、水体及许多生物体均有分布,其中,水体中PFOS污染最为严重(Olsen et al., 2005;Houde et al., 2008;Naile et al., 2010).由于PFOS在环境中非常稳定,常规的处理方法很难有效对其进行降解,超声法、零价铁还原、光催化法、吸附法等是目前用于去除水体中PFOS较为有效的方法(赵德明等,2011;Hori et al., 2006;Cao et al., 2010;Zhou et al., 2010a;Wang et al., 2012).其中,吸附法因具有能耗低、操作简单、生产成本低、吸附容量大、选择性好及处理速度快等优点,被认为是最有效的方法之一.清华大学的邓述波团队在吸附去除水中PFOS方面进行了大量的研究,他们尝试用活性炭、活性污泥、壳聚糖、有机蒙脱土、阴离子交换树脂及聚合氯化铝等(Yu et al., 2009;Zhou et al., 2010b;Zhang et al., 2011;Zhou et al., 2010a;Deng et al., 2010)对水中PFOS进行吸附,取得了较好的效果.Chen等(2011)考察了PFOS在木炭、粉煤灰、碳纳米管上的吸附行为,结果显示,PFOS在木炭、粉煤灰、碳纳米管上达到吸附平衡的时间分别为48、384和2 h.贾大伟等(2011)的研究表明,在PFOS初始浓度为4 mg · L-1、pH为3、反应时间为24 h、Fe3O4投加量为1.25 g · L-1的条件下,90%的PFOS能够被去除,且在酸性条件下更有利于PFOS的吸附去除.综上发现,上述吸附剂存在吸附量不高、吸附饱和时间长等缺陷.为此,研发对PFOS具有吸附容量大、吸附时间短且再生性能好的新型吸附材料十分必要.
介孔氮化碳(Mesoporous carbon nitride,MCN)因具有较好的稳定性及较大的比表面积(Datta et al., 2010;Deng et al., 2012;Mane et al., 2012),在许多领域都有广泛的应用.近几年,将MCN作为一种新型吸附材料,用于对水中阴离子污染物进行选择性去除,已经引起了人们的关注.Haque等(2010)利用MCN对苯酚溶液进行了吸附研究,结果表明,与活性炭和介孔碳(CMK-3)相比,MCN显示出了更高的吸附容量,并认为这主要是由于MCN具有大的比表面积和孔容及表面带有大量的—NH或—NH2碱性基团.Moradi和Baniamerian(2011)以MCM-48为模板成功制备了MCN,并研究了其吸附水中Cr(VI)的性能,结果显示,MCN具有比介孔碳和氨基功能化的介孔碳更高的吸附能力.
因此,本研究以SBA-15为模板、乙二胺和四氯化碳为前驱体,通过模板法制备MCN,并对其进行表征.同时,系统研究MCN对水中PFOS的吸附性能,包括吸附动力学及吸附等温线,溶液pH、溶液温度及共存离子等因素对吸附的影响,以及吸附剂的解吸与再生等.最后,进行MCN与CMK-3、活性炭(AC)吸附剂对水中PFOS吸附性能的比较.
2 材料与方法(Materials and methods) 2.1 实验仪器与材料仪器:HZQ-F100全温度振荡培养箱,PE20型pH计,HH-2数显恒温水浴锅,85-1磁力搅拌器,BS224S分析天平,DZF-6021真空干燥箱,LD5-10低速离心机,SX2-5-12箱式电阻炉,SK2-1-10电阻炉,100 mL水热反应釜.
材料:正硅酸乙酯、乙二胺、四氯化碳、蔗糖、浓硫酸、氢氧化钠、浓盐酸、氢氟酸、乙醇均为分析纯,购自国药集团化学试剂有限公司;全氟辛烷磺酸(PFOS,40%)为分析级,购自Aldrich公司;甲醇为色谱级,购自Fisher公司;粉末状活性炭购自南京宁试化学试剂有限公司;高纯氮气(99.999%)购自南京文达特种气体有限公司;去离子水由实验室自制.
2.2 样品的制备MCN是以SBA-15为模板、乙二胺和四氯化碳为前驱体制备而成.SBA-15的制备根据文献(Jun et al., 2000)方法进行.MCN的制备是在文献(Vinu et al., 2005)方法的基础上进行了改进,具体制备过程为:将0.5 g的SBA-15加入到2.2 g乙二胺和5.4 g四氯化碳混合液中,充分搅拌成粘稠状后转移到三口瓶中,并于363 K的恒温水浴中回流加热搅拌6 h,然后在373 K下真空干燥24 h;将得到的棕褐色的固体研碎并置于电阻炉中,在氮气保护及573 K温度下焙烧5 h;将得到的黑色粉末用质量分数为5%的氢氟酸溶液洗去模板,随后离心过滤并用去离子水、乙醇交替洗涤至中性,最后在373 K真空干燥12 h,即得到MCN.
CMK-3是以SBA-15为模板、蔗糖为碳源,按照文献(Lee et al., 2002)方法制备而成.
2.3 样品的表征X射线衍射(XRD)分析采用Bruker公司的D8 Advance型X射线衍射仪测定,铜靶,Kα射线(λ=0.15045 nm),管电压30 kV,管电流20 mA,扫描速度8° · min-1;样品形貌采用日本JEOL公司JSM-6380LV型扫描电子显微镜(SEM)观察,加速电压30 kV;样品微观结构采用日本JEOL公司JEM-200CX型透射电子显微镜(TEM)观察,加速电压200 kV;傅里叶红外光谱(FT-IR)采用美国NICOLET公司NEXUS970型傅里叶变换红外光谱仪进行分析,扫描速率为4 cm-1 · min-1,扫描范围为500~4000 cm-1;材料的C、H和N元素使用德国Heraeus公司CHN-O-Rapid型元素分析仪进行测定;X射线光电子能谱(XPS)采用美国Thermo-ESCALAB 250型X射线光电子能谱仪测定;样品的Zeta电位采用美国Brookhaven Instruments公司的zetaPALS/90plus 31482型Zeta电位仪测定,具体的制样方法参考文献(Zhou et al., 2010).
2.4 实验方法 2.4.1 吸附实验吸附动力学:称取60 mg吸附剂置于200 mL锥形瓶中,分别加入100 mL初始浓度为100、280和500 mg · L-1的PFOS溶液,在298 K下恒温振荡(180 r · min-1),每隔一定时间取样,经0.22 μm滤膜过滤后,测定PFOS的浓度.
吸附等温线:分别在温度为288、298和318 K时进行吸附等温线实验,配制初始浓度为5 ~1000 mg · L-1的PFOS溶液,将100 mL的PFOS溶液和60 mg吸附剂加入到200 mL锥形瓶中,恒温振荡(180 r · min-1)12 h,经0.22 μm滤膜过滤后,测定溶液PFOS的浓度.
溶液pH值对吸附的影响:配制一系列初始浓度为280 mg · L-1、pH在2~10范围的PFOS溶液,分别将100 mL不同pH值的PFOS溶液和60 mg吸附剂加入到200 mL锥形瓶中,298 K下恒温振荡(180 r · min-1)12 h,经0.22 μm滤膜过滤后,测定溶液PFOS的浓度.
共存离子对吸附的影响:配制一系列PFOS初始浓度为280 mg · L-1、共存离子浓度(Cl-、NO-3、SO2-4或CO2-3)在5 ~160 mg · L-1范围的溶液,分别将100 mL含不同共存离子的PFOS溶液和60 mg吸附剂加入到200 mL锥形瓶中,调节溶液pH为3.25,298 K下恒温振荡(180 r · min-1)12 h,0.22 μm滤膜过滤后,测定PFOS的浓度.为了保证实验数据的可靠性,所有实验均重复3次以上.
MCN对PFOS在t时刻的吸附量qt(mg · g-1)、平衡吸附量qe(mg · g-1)和去除率η分别按公式(1)、(2)和(3)计算.
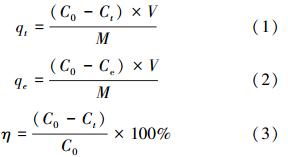
将吸附PFOS饱和的MCN吸附剂加入到盛有0.1 mol · L-1 NaOH溶液的锥形瓶中,在温度为298 K和转速为180 r · min-1的恒温振荡培养箱中解吸24 h;然后用去离子水多次洗涤至中性,烘干备用,即为再生1次的吸附剂.随后用再生1次的吸附剂对PFOS溶液进行吸附,待吸附饱和后,再重复上面的步骤得到再生2次的吸附剂,依次进行解吸/再生5次,计算出每次再生吸附剂在相同条件下对PFOS的去除率.
2.5 分析方法溶液中PFOS的浓度采用高效液相色谱-电导检测器(e2695-432,Waters,美国)进行测定.测试条件:色谱柱为XBridge-C18柱(4.6 mm×250 mm,安捷伦),流动相为甲醇/0.02 mol · L-1 NaH2PO4(V ∶ V=75∶25),流速为1 mL · min-1,进样量为50 μL,柱温为40 ℃.
3 结果与讨论(Results and discussion) 3.1 MCN的表征 3.1.1 XRD分析图 2为MCN的小角XRD谱图.从图中可以看出,MCN在0.5°~2.5°的范围内出现了1个尖锐的衍射峰和2个小的衍射峰,分别对应六方空间群P6mm介孔中的(100)、(110)和(200)晶面,是六方相介孔结构的典型特征衍射峰,说明MCN保持了模板SBA-15的有序介孔结构(Li et al., 2011),因此,其对生态环境及生物体存在潜在的威胁.
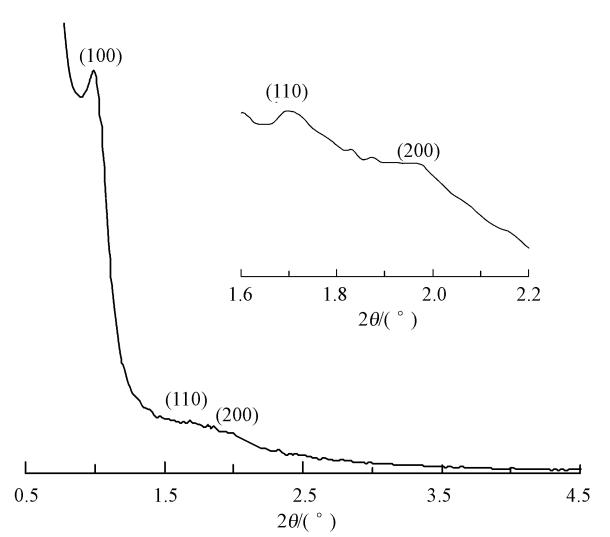 |
| 图 2 MCN的小角XRD谱图 Fig. 2 Low-angle XRD patterns of MCN |
图 3为MCN的SEM和TEM照片.从图 3a中可以看出,MCN的整体形貌主要为均一、规则的短棒状结构,长度大约为2 μm,宽度在0.5 μm左右.从图 3b中可以看出,MCN具有规则排列的介孔结构,这与小角XRD结果吻合.
 |
| 图 3 MCN的SEM(a)和TEM(b)照片 Fig. 3 SEM(a) and TEM(b)images of MCN |
图 4为MCN吸附PFOS前后的FT-IR谱图.可以看出,MCN在750.2、1310.7、 1604.5和3293.9 cm-1处存在4个吸收峰,它们分别表示CN杂环、CN环上C—N键的伸缩振动、CN环上C N键的伸缩振动、O—H的伸缩振动或N—H的伸缩振动(Srinivasu et al., 2008).吸附PFOS后,MCN的FT-IR谱图中有明显的新峰出现:在1200~1350 cm-1范围内出现的新峰为CF2或CF3振动吸收峰,500~700 cm-1、1000~1075 cm-1和1150~1250 cm-1范围内出现的新峰为有机磺酸基团(—SO3—)的振动吸收峰(Zhang et al., 2013).对比MCN吸附PFOS前后的FT-IR谱图,表明PFOS在MCN上发生了吸附.
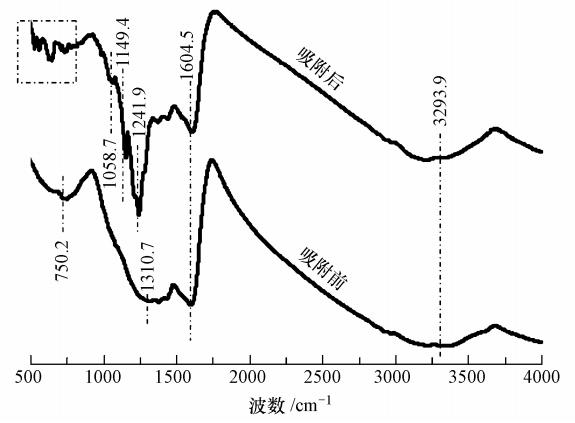 |
| 图 4 MCN及其吸附PFOS后的FT-IR谱图 Fig. 4 FT-IR spectra of MCN before and after the PFOS adsorption |
图 5a为MCN吸附PFOS前后的XPS谱图.从图中可以看出,MCN主要由碳、氮和少量的氧元素组成,氧元素的存在主要来源于前驱体乙二胺和四氯化碳,这与文献报道结果一致(Liu et al., 2010).由XPS测定MCN中碳和氮的质量分数分别为68.21%和22.86%,算出碳氮质量比为3.48,与元素分析测定结果碳氮质量比为3.52基本一致.
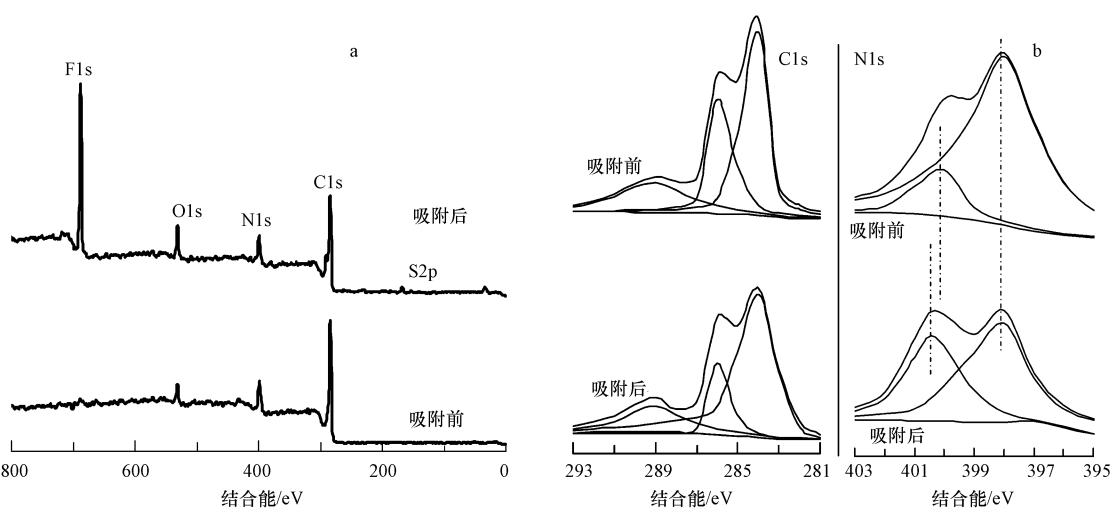 |
| 图 5 MCN吸附PFOS前后的XPS全谱图(a)、C1s和N1s谱(b) Fig. 5 XPS spectra of survey scan(a) and C1s and N1s(b)for MCN before and after the PFOS adsorption |
吸附PFOS后,MCN的XPS谱图形状基本没有发生改变,只是在688.6 eV和168.1 eV处增加了F1s和S2p峰,且C1s和N1s吸收峰的强度稍有减弱.为了进一步说明吸附前后C1s和N1s吸收峰变化情况,对其进行了高斯拟合,结果如图 5b所示.从C1s谱图可以看出,MCN吸附PFOS前后均在结合能为289.1、285.7和284.3 eV处存在3个峰,它们分别对应于CN结构中的C—C键、与N相连的sp2杂化的C和与CN杂环上N相连的sp2杂化的C.从N1s谱图可以看出,MCN在结合能为398.2 eV和400.1 eV处存在两个峰,分别对应于CN杂环中sp2杂化的N和与CN杂环相连的sp2杂化的N.吸附PFOS后,在结合能为400.1 eV处的峰移到400.7 eV,该峰为质子化的氮(Niu et al.2010).产生这一结果的原因是由于吸附时PFOS溶液的pH为3.25,其小于MCN的等电点6.4(见图 8内插图),从而使其所带的碱性官能团—NH或—NH2发生了质子化.
3.2 MCN吸附水中PFOS性能研究 3.2.1 吸附动力学不同初始浓度的PFOS溶液在MCN上的吸附量随吸附时间的变化如图 6所示.可以看出,吸附量随吸附时间的增加而增大.在前1 h吸附速率较快且吸附量迅速增加,之后吸附量随吸附时间的延长而缓慢增加,12 h后吸附达到平衡.
将上述的吸附动力学数据分别用准一级吸附动力学模型(4)和准二级吸附动力学模型(5)(Trivedi et al., 1973;Ho et al., 1999)进行拟合.
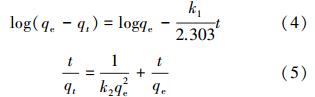
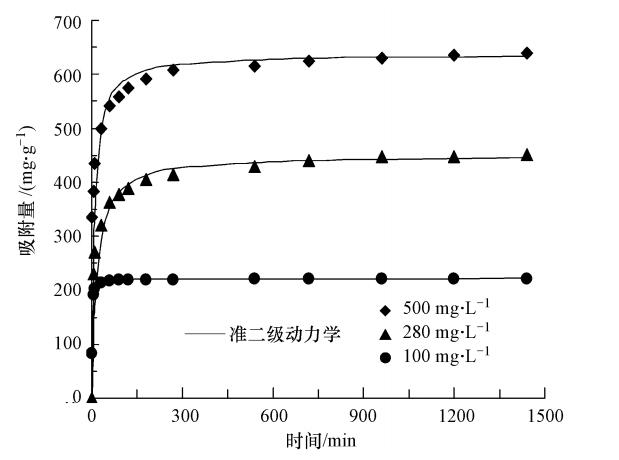 |
| 图 6 MCN对PFOS的吸附动力学曲线 Fig. 6 Adsorption kinetic curves of PFOS on MCN |
分别以log(qe-qt)对t和t/qt对t作图,拟合结果如表 1所示.由表 1可知,采用准二级动力学方程拟合具有更好的可决系数(R2>0.999),说明准二级动力学模型适用于该实验数据的拟合.此外,从表 1中的结果可以看出,根据准二级动力学方程拟合得到的平衡吸附量与实验测得的结果基本吻合.
| 表1 MCN吸附PFOS的动力学拟合参数 Table.1 Kinetic parameters for the adsorption of PFOS on MCN |
图 7为在溶液温度分别为288、298和318 K时,PFOS在MCN上的吸附等温线.可以看出,MCN对PFOS的平衡吸附量随着溶液温度的升高而增加,表明MCN吸附PFOS的过程为吸热反应.
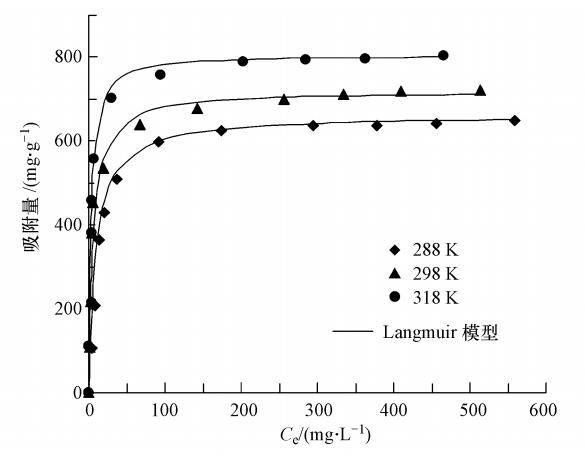 |
| 图 7 PFOS在MCN上的吸附等温线 Fig. 7 Adsorption isotherms of PFOS on MCN |
分别用Langmuir等温线模型(6)和Freundlich等温线模型(7)(Sharma et al.,1994)对吸附等温线数据进行拟合.
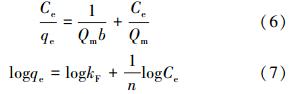
分别以Ce/qe对Ce和logqe对logCe作图,拟合结果见表 2.由表 2可知,Langmuir等温线模型适合描述MCN吸附PFOS的过程(R2>0.999).根据Langmuir等温线方程,在溶液温度分别为288、298和318 K时,MCN对PFOS的最大吸附量分别为666.67、714.29和833.33 mg · g-1.
| 表2 MCN吸附PFOS的等温线拟合参数 Table.2 Isotherm parameters for the adsorption of PFOS on MCN |
溶液pH值对PFOS在MCN上吸附去除效率的影响见图 8.从图中可以看出,MCN吸附PFOS效率受溶液pH影响较大,PFOS的去除率随着溶液pH值的升高而减小.同时,这种降低趋势具有一定的规律,即先缓慢降低,当溶液pH值达到某一值时急剧降低,最后又缓慢减少.当溶液pH由2.2升高到6.4时,去除率由98.15%缓慢降低到85.88%;溶液pH由6.4升高7.5,去除率由85.88%急剧地降到28.10%;当溶液pH为10.6时,去除率仅为5.59%.
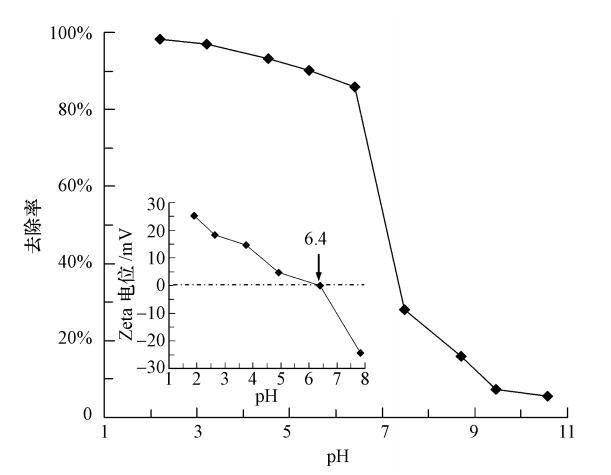 |
| 图 8 溶液pH值对MCN吸附PFOS的影响和MCN的Zeta电位(内插图) Fig. 8 Effect of solution pH on the adsorption of PFOS by MCN and zeta potential of MCN( inset) |
产生这一结果是由吸附质和吸附剂的性质共同决定的.PFOS的pKa为-3.27,表明PFOS在水溶液中主要以阴离子的形式存在;通过Zeta电位法测得MCN的等电点(pHpzc)为6.4(见图 8内插图).当溶液pH小于6.4时,由于质子化作用MCN表面带正电,通过静电作用MCN对水中PFOS具有很好地吸附效果;随着溶液pH值的增加,质子化能力不断降低,MCN表面带正电荷的量也不断减少,导致去除率缓慢降低.当溶液pH值大于6.4时,由于去质子化作用MCN表面带负电,MCN与水中PFOS存在排斥作用,同时大量的OH-的存在对活性吸附位也产生了一定的竞争,从而使去除率显著降低.这一结果同时也说明PFOS在MCN表面的吸附主要是通过静电作用.
3.2.4 共存离子对吸附的影响M溶液中Cl-、NO-3、SO2-4和CO2-3等阴离子对MCN吸附PFOS的影响如图 9所示.可以看出,PFOS的去除率随共存离子浓度的增加而不断降低,且4种阴离子对MCN吸附PFOS的影响大小遵循如下规律:CO2-3>SO2-4>NO-3>Cl-.其中,CO2-3对吸附影响最为明显,这主要是由于CO2-3在水溶液中发生了水解(见方程式(8)和(9)),增大了溶液的pH值,使MCN表面所带的正电荷减少,导致吸附作用减弱.
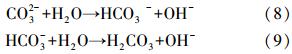
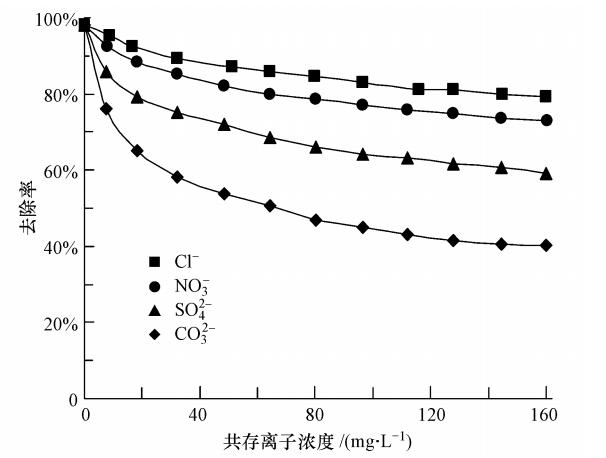 |
| 图 9 共存阴离子对MCN吸附PFOS的影响 Fig. 9 Effect of co-existing anions on the adsorption of PFOS by MCN |
选用0.1 mol · L-1 NaOH溶液为解吸液,在温度为298 K下对吸附PFOS饱和的MCN进行解吸,24 h后PFOS的解吸率为96.45%.然后将解吸后的MCN用去离子水洗涤至中性,烘干后再次利用.随后考察了5次循环解吸/再生的MCN对PFOS的吸附情况,结果如图 10所示.可以看出,PFOS的去除率随循环解吸/再生次数的增加略有降低,但经5次循环再生后的去除率仍在95%以上,说明MCN具有较好的再生性能和较高的稳定性.
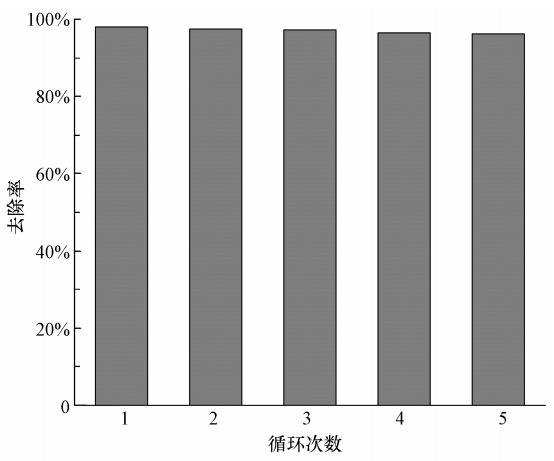 |
| 图 10 循环次数对MCN吸附PFOS的影响 Fig. 10 Effect of cycling times on the adsorption of PFOS by MCN |
图 11为MCN、CMK-3和AC 3种吸附剂对PFOS吸附性能的比较.可以看出,在相同的吸附条件下,MCN对PFOS的吸附量优于CMK-3和AC.吸附12 h后,MCN、CMK-3和AC对PFOS的平衡吸附量分别为454.60、372.15和300.45 mg · g-1,这可能是由于MCN表面特有的化学性质提高了其对PFOS的吸附,但尚需进一步的探究和证实.
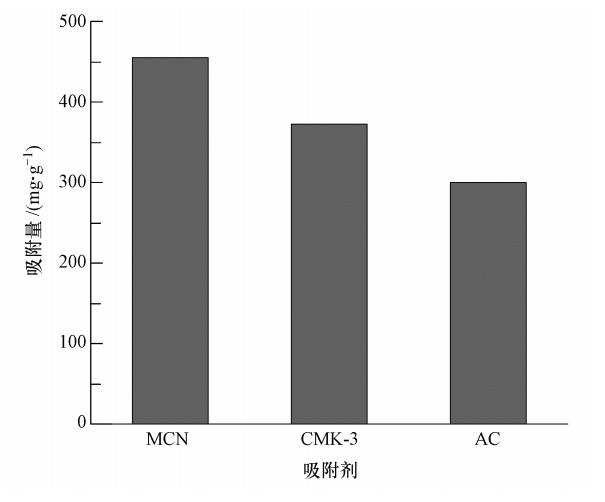 |
| 图 11 不同吸附剂对PFOS的吸附性能比较 Fig. 11 Comparison of adsorption amount of PFOS on different adsorbents |
以SBA-15为模板、乙二胺和四氯化碳为前驱体,通过模板法制备了MCN吸附剂.表征结果显示,MCN主要由碳、氮和氧元素组成且具有有序的介孔结构.动力学研究表明,MCN对PFOS的吸附在12 h后可达到吸附平衡,并符合准二级动力学模型.吸附等温线结果表明,采用Langmuir等温线模型能够较好地描述PFOS在MCN上的吸附.同时,MCN对水中PFOS的吸附效率受溶液pH值、溶液温度及共存离子等因素的影响.其中,溶液pH值的影响最为显著,当溶液pH值为2.2和10.6时,MCN对PFOS的去除率分别为98.15%和5.59%.解吸与再生研究表明,0.1 mol · L-1 NaOH溶液对吸附饱和的MCN具有良好的解吸效果,经5次循环/再生后的去除率仍在95%以上.在相同的条件下,MCN对水中PFOS的吸附效果优于CMK-3和AC.
| [1] | Beac h S A,Newsted J L,Coady K,et al.2006.Ecotoxicological evaluation of perfluorooctanesulfonate(PFOS)[J].Environ Contamin Toxicol,186:133-174 |
| [2] | Cao M H,Wang B B,Yu H S,et al.2010.Photochemical decomposition of perfluorooctanoic acid in aqueous periodate with VUV and UV light irradiation[J].J Hazard Mater,179(1/3):1143-1146 |
| [3] | Chen X,Xia X H,Wang X L,et al.2011.A comparative study on sorption of perfluorooctane sulfonate (PFOS)by chars,ash and carbon nanotubes[J].Chemosphere,83(10):1313-1319 |
| [4] | Datta K K R,Reddy B V S,Ariga K,et al.2010.Gold nanoparticles embedded in mesoporous carbon nitride stabilizer for highly efficient three-component coupling reaction[J].Angew Chem Int Ed,49(34):5961-5965 |
| [5] | Deng Q F,Liu L,Lin X Z,et al.2012.Synthesis and CO2 capture properties of mesoporous carbon nitride materials[J].Chem Eng J,203:63-70 |
| [6] | Deng S B,Yu Q,Huang J,et al.2010.Removal of perfluorooctane sulfonate from wastewater by anion exchange resins:Effects of resin properties and solution chemistry[J].Water Research,44(18):5188-5195 |
| [7] | Giesy J P,Kannan K.2002.Peer reviewed:perfluorochemical surfactants in the environment[J].Environ Sci Technol,36(7):146A-152A |
| [8] | Haque E,Jun J W,Talapaneni S N,et al.2010.Superior adsorption capacity of mesoporous carbon nitride with basic CN framework for phenol[J].J Mater Chem,20:10801-10803 |
| [9] | Hekster F M,Laane R W P M,Voogt P D.2003.Environmental and toxicity effects of perfluoroalkylated substances[J].Environ Contamin Toxicol,179:99-121 |
| [10] | Ho Y S,McKay G.1999.Pseudo-second order model for sorption processes[J].Process Biochem,34(5):451-465 |
| [11] | Hori H,Nagaoka Y,Yamamoto A,et al.2006.Efficient decomposition of environmentally persistent perfluorooctanesulfonate and related fluorochemicals using zerovalent iron in subcritical water[J].Environ Sci Technol,40(3):1049-1054 |
| [12] | Houde M,Czub G,Small J M,et al.2008.Fractionation and bioaccumulation of perfluorooctane sulfonate(PFOS)isomers in a lake ontario food web[J].Environ Sci Technol,42(24):9397-9403 |
| [13] | 贾大伟,田秉晖,张国珍,等.2011.Fe3O4纳米磁性微粒对全氟辛烷磺酸盐的吸附[J].环境工程学报,6(2):389-392 |
| [14] | 金一和,汤先伟,曹秀娟.2002.全球性全氟辛烷磺酰基化合物环境污染及其生物效应[J].自然杂志,6(24):344-348 |
| [15] | Jun S,Joo S H,Ryoo R,et al.2000.Synthesis of new,nanoporous carbon with hexagonally ordered mesostructure[J].J Am Chem Soc,122(43):10712-10713 |
| [16] | Lee J,Joo S H,Ryoo R.2002.Synthesis of mesoporous silicas of controlled pore wall thickness and their replication to ordered nanoporous carbons with various pore diameters[J].J Am Chem Soc,124(7):1156-1157 |
| [17] | Li Y J,Yan B.2011.Preparation,characterization and luminescence properties of ternary europium complexes covalently bonded to titania and mesoporous SBA-15[J].J Mater Chem,21:8129-8136 |
| [18] | Liu N N,Yin L W,Wang C X,et al.2010.Adjusting the texture and nitrogen content of ordered mesoporous nitrogen-doped carbon materials prepared using SBA-15 silica as a template[J].Carbon,48(12):3579-3591 |
| [19] | MacDonald M M,Warne A L,Stock N L,et al.2004.Toxicity of perfluorooctane sulfonic acid and perfluorooctanoic acid to Chironomus tentans[J].Environ Toxicol Chem,23(9):2116-2123 |
| [20] | Mane G P,Talapaneni S N,Anand C,et al.2012.Preparation of highly ordered nitrogen-containing mesoporous carbon from a gelatin biomolecule and its excellent sensing of acetic acid[J].Adv Funct Mater,22(17):3596-3604 |
| [21] | Moradi S E,Baniamerian M J.2011.The effect of mesoporous carbon modification by nitrogen on its enrichment efficiency of chromate ion:comparison between N-doped mesoporous carbon and amino grafted mesoporous carbon[J].CI&CEQ,17(4):505-515 |
| [22] | Naile J E,Khim J S,Wang T Y,et al.2010.Perfluorinated compounds in water,sediment,soil and biota from estuarine and coastal areas of Korea[J].Environ Pollut,158(5):1237-1244 |
| [23] | Niu L,Deng S B,Gang Yu,et al.2010.Efcient removal of Cu(Ⅱ),Pb(Ⅱ),Cr(Ⅵ)and As(Ⅴ)from aqueous solution using an aminated resin prepared by surface-initiated atom transfer radical polymerization[J].Chem Eng J,165(3):751-757 |
| [24] | Olsen G W,Huang H Y,Helzlsouer K J,et al.2005.Historical comparison of perfluorooctanesulfonate,perfluorooctanoate,and other fluorochemicals in human blood[J].Environ Health Perspect,113(5):539-545 |
| [25] | Sharma D C,Forster C F.1994.A preliminary examination into the adsorption of hexavalent chromium using low-cost adsorbents[J].Bioresource Technol,47(3):257-264 |
| [26] | Srinivasu P,Vinu A,Hishita S,et al.2008.Preparation and characterization of novel microporous carbon nitride with very high surface area via nanocasting technique[J].Microporous Mesoporous Mater,108(1/3):340-344 |
| [27] | Trivedi H C,Patel V M,Patel R D.1973.Adsorption of cellulose triacetate on calcium silicate[J].,Eur Polym J,9(6):525-531 |
| [28] | Vinu A,Ariga K,Mori T,et al.2005.Preparation and characterization of well-ordered hexagonal mesoporous carbon nitride[J].Adv Mater,17(14):1648-1652 |
| [29] | Wang F,Liu C S,Shih K.2012.Adsorption behavior of perfluorooctanesulfonate(PFOS)and perfluorooctanoate(PFOA)on boehmite[J].Chemosphere,89(8):1009-1014 |
| [30] | Yu J,Lü L,Lan P,et al.2012.Effect of effluent organic matter on the adsorption of perfluorinated compounds onto activated carbon[J].J Hazard Mater,225-226:99-106 |
| [31] | Yu Q,Zhang R Q,Deng S B,et al.2009.Sorption of perfluorooctane sulfonate and perfluorooctanoateon activated carbons and resin:Kinetic and isotherm study[J].Water Research,43(4):1150-1158 |
| [32] | 赵德明,丁成,徐新华,等.2011.超声波降解全氟辛烷磺酸和全氟辛酸的动力学[J].化工学报,62(3):829-835 |
| [33] | Zhang Q Y,Deng S B,Yu G,et al.2011.Removal of perfluorooctane sulfonate from aqueous solution by crosslinked chitosan beads:Sorption kinetics and uptake mechanism[J].Bioresour Technol,102(3):2265-2271 |
| [34] | Zhang K L,Huang J,Yu Q,et al.2013.Destruction of Perfluorooctane Sulfonate(PFOS)and Perfluorooctanoic Acid(PFOA)by Ball Milling[J].Environ Sci Technol,47(12):6471-6477 |
| [35] | Zhou Q,Deng S B,Yu Q,et al.2010a.Sorption of perfluorooctane sulfonate on organo-montmorillonites[J].Chemosphere,78(6):688-694 |
| [36] | Zhou Q,Deng S B,Zhang Q Y,et al.2010b.Sorption of perfluorooctane sulfonate and perfluorooctanoate on activated sludge[J].Chemosphere,81(4):453-458 |
 2014, Vol. 34
2014, Vol. 34


