2. 昆士兰大学, 化学工程系, 澳大利亚 4072;
3. 上海市政工程研究设计总院, 上海 200092
2. School of Chemical Engineering, The University of Queensland, Queensland 4072;
3. Shanghai Municipal Engineering Design General Institute, Shanghai 200092
氧化亚氮(N2O)被认为是21世纪对臭氧层最严重的威胁之一(Ravishankara et al., 2009),同时也是一种重要的强温室气体(Greenhouse Gas,GHG),其全球增温潜势约为CO2的200~300倍(Solomon et al., 2007).1997年通过的《京都议定书》中明确指出,要对包括N2O在内的6种温室气体(二氧化碳、甲烷、氧化亚氮、氢氟碳化合物、全氟碳化合物和六氟化硫)进行控制和削减(Tett et al., 1999).据政府间气候变化专门委员会(IPCC)报道,全球每年N2O排放量约为1.77×1010 kg(以N计,下同),导致其对全球温室效应的贡献率在2004年达到了7.9%(Denman et al., 2007).同时,全球大气中N2O浓度值已从100年前的约270 ppb(10-9)增至2005年的319 ppb,并正以每年0.25%~0.31%的速度递增(Denman et al., 2007).大气中N2O每增加1倍,将会使全球地表气温平均上升0.4 ℃,同时臭氧减少10%.后者将导致到达地面的紫外线辐射强度增加20%,从而对生态系统造成严重损害(Ravishankara et al., 2009; Denman et al., 2007).
N2O排放分为天然排放(原状土壤释放、海洋中N2O释放等)和人为排放(如农业耕作、化石燃料燃烧、污染治理等),其中人为排放约占40%(Denman et al., 2007).而污水处理是N2O排放重要的人为排放源之一.不同污水处理厂N2O释放因子(N2O排放量/N负荷)相差较大. Kampschreur等(2009a)总结前人的相关研究结果得到:在大规模城镇污水处理厂的污水脱氮过程中可能有0~14.6%的氮转化为N2O释放.这导致人们对污水厂占全球N2O总排放的估计量存在较大出入: IPCC称污水处理过程约占全球N2O总排放量的1.2%(IPCC,2007);而根据美国环保局(USEPA)的报告,污水处理厂排放了全球约3%的N2O(USEPA,2006).随着各国环保部门对污水氮排量控制的日益严格,越来越多的污水厂已经实现脱氮工序,这将导致N2O排放量可能进一步呈增大趋势.Law等(2012b)预测在2005—2020年,全世界污水厂排放的N2O将增加13%.
2 N2O的产生途径(N2O production pathways)基于目前的文献报道(Kampschreur et al., 2009a; Foley et al., 2010; Law et al., 2012b),污水处理中N2O主要产生于以下几个过程:好氧氨氧化菌(aerobic ammonia-oxidizing bacteria,AOB)的亚硝化作用、AOB的反硝化作用、异养反硝化菌(heterotrophic denitrifier,HDN)的反硝化作用以及其他途径.
2.1 AOB的亚硝化作用硝化作用一般由两类不同的菌完成:在好氧条件下,AOB先把氨氧化为亚硝酸盐,即亚硝化作用;再由亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)将亚硝酸盐氧化为硝酸盐(图 1).
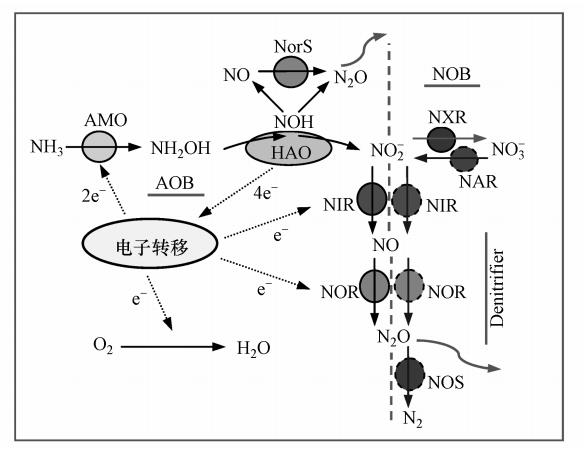 |
| 图 1 AOB,NOB和反硝化菌的氮转化途径(Law et al., 2012b) Fig. 1 Nitrogen transformation pathways of AOB,NOB and denitrifier |
在亚硝化过程,AOB的直接电子供体是NH3而不是NH+4(Suzuki et al., 1974).如图 1所示,NH3先在跨膜蛋白氨单加氧酶(ammonia monooxygenase,AMO)的作用下在胞内生成羟氨(NH2OH).NH2OH由细胞膜内转移到膜外,并在位于细胞周质的羟氨氧化还原酶(hydroxylamine oxidoreductase,HAO)作用下生成亚硝酸盐.此过程产生4个电子,其中2个转移给AMO激发氧分子与氨反应生成NH2OH,另外两个电子进入电子传递链产生能量(Andersson and Hooper, 1983).
1997年,Igarashi等(1997)研究HAO时发现,NH2OH被氧化成NO-2事实上分为两个过程:NH2OH先被氧化为不稳定的亚硝酰基团(NOH);然后NOH再被氧化为NO-2.这样,在NH2OH的氧化过程中,可能会出现NOH的积累.而不稳定的NOH会分解产生N2O.由于NOH分解产生N2O的过程并不需要酶的作用,所以该过程并非生物反应,而是化学反应.
尽管一般认为NOH化学分解产生N2O的途径在污水硝化处理中并不占主导地位,但在某些特殊条件下(如高氨氮废水硝化过程),该化学过程可能在N2O的产生中发挥着重要作用.Law等(2012a)开展了针对模拟污泥好氧消化液(氨氮最高浓度达500 mg · L-1)的短程硝化研究,他们获得了比N2O生成速率与比氨氧化速率之间的关系,随后又建立4种可能产生N2O过程的数学模型,比对发现NOH化学分解产生N2O模型拟合的曲线与实测值基本符合(在比氨氧化速率接近于0时,NOH分解模型偏离实际值).
另外,NOH被氧化为NO-2的过程中会形成NO,该过程也是N2O的潜在来源. NO会在细胞色素c554或一氧化氮还原酶(nitric oxide reductase,NOR)的同源物NorS的作用下被还原为N2O(Upadhyay et al., 2006; Stein,2011),该过程为生物反应过程.事实上,在大多数AOB体内都发现了编码NorS的基因(Stein,2011).
2.2 AOB的反硝化作用AOB不仅能产生亚硝化作用所需要的酶,而且还能诱导产生部分反硝化酶: 亚硝酸盐还原酶(nitrite reductase,NIR)和一氧化氮还原酶.在AOB中,已被检测到了编码NIR和NOR的基因,而未检测到编码氧化亚氮还原酶(nitrous oxide redcutase,NOS)的基因,这说明AOB能将亚硝化过程产生的亚硝酸盐反硝化还原至N2O,但无法继续反硝化至N2(Law et al., 2012b; Garbeva et al., 2007).
目前普遍认为AOB的反硝化作用是好氧硝化过程产生N2O的主要途径.Ostrom等(2010)利用同位素标记法验证了这一结果.在他们的实验中,NH3的氧化过程仅产生少量的N2O且大部分N2O都来源于AOB体内NO-2的还原.Kim等(2010)也发现在活性污泥曝气池中,N2O的主要排放源是AOB的反硝化,他们在AOB中检测到编码NIR的基因的表达.
在溶解氧(DO)浓度较低条件下,AOB的反硝化作用较为显著(李莎,2012; Kampschreur et al., 2008a).因为当DO受限制时,亚硝酸盐氧化受到抑制而积累,从而促进了AOB的反硝化作用,增加了N2O的释放潜能. Wunderlin等(2012)研究发现,随着硝化反应的进行,污水中氨氮降低,亚硝酸盐上升,这将导致AOB反硝化作用贡献的N2O比例逐渐上升.
2.3 异养反硝化作用异养反硝化是污水处理中最普遍的反硝化作用.异养反硝化菌在缺氧条件下利用反硝化酶系将NO3-或NO-2经NO和N2O还原成N2(图 1).
N2O是异养反硝化过程不可逾越的中间产物.在典型反硝化过程,NO和N2O的最大还原速率大于NO3-和NO-2,因此,通常情况下N2O会被快速还原成N2,而不易积累或释放(Wicht et al., 1996).但是,外界环境的波动可能会导致N2O的积累.例如,DO会抑制反硝化酶系的产生及其活性,且NOS较其他反硝化酶对DO波动更敏感,当环境由缺氧变为有氧时,NOS立即失去活性,而其他反硝化酶仍可维持数小时的活性,从而导致N2O积累(Otte et al., 1996).另一方面,NOS的诱导产生也较其他反硝化酶滞后,这也导致环境由有氧恢复到缺氧时N2O的暂时积累.
由于N2O在水中具有一定的溶解度(1.13 g · L-1,25 ℃&100 kPa),只有经过曝气吹脱才能使溶解态N2O大量释放出来,所以N2O排放绝大多数发生在曝气单元.反硝化反应不需要曝气,所以在缺氧反应池中即使暂时积累了N2O也不易释放到空气中,而且由于NOS的存在,还可能会还原混合液中部分溶解态的N2O(Desloover et al., 2012).但是,如果积累N2O的混合液流入好氧池中,N2O将很快被吹脱至大气中(Kampschreur et al., 2009a; Ahn et al., 2010),造成N2O的释放.延长缺氧反应时间可使暂时积累的N2O被尽可能地被还原,从而减少N2O释放到大气中的量(Law et al., 2012b).
另外,有些反硝化菌没有NOS,其反硝化的最终产物是N2O,这也可能导致N2O的产生与释放.目前已筛选出的仅产生N2O的反硝化菌有十几种,如Roseobacter denitrificans (Shiba et al., 1991),Pseudomonads stutzeri和Paracoccus denitrificians(Takaya et al., 2003)等.
2.4 其他途径2005年,Knneke等(2005)发现某些古菌能将氨氧化,并将其称为氨氧化古菌(ammonia-oxidizing archaea,AOA).随后Park等(2006)在低DO、长污泥龄的污水处理设施中发现了AOA.尽管还没有关于实际污水处理设施中AOA产生N2O的研究,但其产生潜势却不容忽视.事实上,Santoro等(2011)发现海洋中N2O主要源于AOA而非AOB. AOA的代谢途径尚未明晰,现在主要有3种推测:①类似于AOB,氨先在AMO作用下氧化成NH2OH,然后在CuHAO(copper hydroxylamine oxidoreductase)作用下氧化成NO-2; ②氨经NH2OH氧化为NO-2后,再被还原为NO,以提供电子给AMO; ③氨先在AMO作用下氧化成NOH,然后在NXOR(nitroxyl oxidoreductase)作用下氧化成NO-2(Stahl et al., 2012). 在AOB中,NH2OH、HNO、NO均有可能转化为N2O.在AOA中N2O的产生很可能也来自于以上几种前体物,但这还需要进一步研究证实.
某些反硝化菌在好氧条件下也能进行反硝化作用,这个过程称为好氧反硝化.好氧反硝化也要利用反硝化酶系将NO3-或NO-2经NO和N2O还原成N2(Chen and Strous, 2013),所以好氧反硝化产生N2O的途径也与缺氧反硝化类似.有研究发现,好氧反硝化菌产生的N2O低于传统的缺氧反硝化菌.例如,Miyahara等(2010)发现好氧反硝化菌Pseudomonas stutzeri TR2可以减少污水厂N2O的排放.然而也有研究发现异养硝化菌在硝化过程中产生的N2O远高于自养硝化菌(Anderson et al., 1993; Van Niel et al., 1993).
近年来生物脱氮的研究热点是厌氧氨氧化技术,它是指氨与亚硝酸盐反应生成氮气,即厌氧氨氧化反应.Kartal等(2007)发现厌氧氨氧化菌也能产生N2O,主要是源于其对NO的解毒作用(NO是厌氧氨氧化反应的中间产物).
3 实际污水厂N2O的释放(N2O emissions from WWTPs)表 1表示采用几种典型工艺的实际污水厂N2O释放情况.由表 1可以看出,不同污水厂N2O释放因子(N2O-N/TNinfluent)相差很大,这证明了N2O释放因子较大的污水厂还存在较大减排空间.N2O释放因子每增加1%,污水处理厂碳足迹将增加约30%(de Haas et al., 2004).Foley等(2010)研究指出:脱氮效果好的污水厂N2O释放因子小于脱氮效果差的污水厂,从而证明提高脱氮效果和减少N2O排放是可以同时获得的.
| 表1 几种典型工艺的污水厂N2O的释放情况 Table.1 N2O emissions from sewage treatment plants with several representative processes |
由表 1可知,当前城市污水厂采用的几种污水处理工艺的N2O释放因子大体上有如下顺序:SHARON-ANAMMOX,SHARON > CANON > 生物滤池 > A2O > AS,A/O,氧化沟,连续流间歇曝气工艺.
SHARON,SHARON-ANAMMOX和CANON工艺产生较多N2O的原因是这三种工艺都包含短程硝化反应,而且这些工艺的进水氨氮浓度远高于普通污水处理工艺.短程硝化会形成NO-2积累,其NO-2浓度较全程硝化高100倍以上(Kampschreur et al., 2008b).
一般认为NO-2浓度增加会促进AOB反硝化作用,从而增加N2O的释放(Kampschreur et al., 2008a; Colliver and Stephenson, 2000).不仅如此,高氨氮浓度也会大大促进亚硝化阶段N2O的产生.如前文所述,Law等(2012a)发现短程硝化系统中N2O产生速率与氨氧化速率呈指数关系.在上述研究中,N2O主要产生于SHARON反应器内,ANAMMOX反应器内产生的N2O相对较少,仅占整个 反应系统的20%左右(Gustavsson and Jansen, 2011; Kampschreur et al., 2008b). Kartal等(2007)利用15N稳定同位素标记法研究发现N2O并非厌氧氨氧化反应的中间产物,故厌氧氨氧化菌产生的N2O相对较少(0.26%的硝氮转化为N2O).
另外,CANON工艺由于短程硝化和厌氧氨氧化在同一个反应器内进行,短程硝化产生的NO-2通常立即被厌氧氨氧化菌还原,所以NO-2在CANON工艺中难以大量积累.Desloover等(2011)针对实际污水厂研究发现,CANON工艺中NO-2积累量约为SHARON工艺的1/50~1/10.因此,CANON工艺的N2O释放因子一般低于SHARON或SHARON-ANAMMOX两段式工艺.虽然CANON工艺释放的N2O多于普通污水处理工艺,但由于CANON工艺所需曝气强度小(通过短程硝化途径),而且碳源消耗非常少(脱氮主要采用厌氧氨氧化途径来完成),所以产生的碳足迹反而比较低(Weissenbacher et al., 2010). Joss等(2009)研究采用CANON工艺的实际污水厂发现,尽管其释放的N2O多于普通硝化/反硝化工艺,但该工艺的碳足迹还不到普通硝化/反硝化工艺的一半.
Wang等(2009)研究生物滤池处理城市生活污水时,测得其N2O释放因子(0.06%~0.84%)略高于活性污泥工艺,且其N2O释放呈现明显的季节变化:N2O释放因子在春季较低,而在夏季明显升高.同时他们发现,影响N2O释放的主要因素是空气和水体的温差(r=0.81,n=6),而非气温本身(r=0.51,n=6).他们推测这是因为气温和水温相近会阻碍空气流向滤池填料层,使得生物膜上氧气不足从而导致N2O积累.另一方面,他们认为生物膜系统产生较多N2O可能与膜表面好氧、内部厌氧的分布有关,该分布可能会导致NO-2在好氧厌氧交界处积累从而促进N2O产生.
在A2O工艺中,N2O主要是在好氧池释放,且好氧池DO浓度越低,NO-2浓度越高,则释放的N2O越多(李莎,2012; 王金鹤,2012).另外,王金鹤(2012)发现冬季低温时,采用A2O工艺的污水厂N2O释放量也会增大.A2O工艺的N2O释放因子普遍要高于A/O、AS、氧化沟以及连续流间歇曝气等工艺,这可能与A2O工艺要兼顾脱氮除磷功效引起的.为了获得一定生物除磷效果,A2O工艺中会存在一定比例聚磷菌(PAOs),它们与反硝化菌竞争进水中的碳源,用于合成聚-β-羟基丁酸酯(PHB)作为好氧或缺氧吸磷的能量来源.而碳氮比(C/N)是决定反硝化是否完全的重要因素(Chung and Chung, 2000),一般认为C/N>4才能完全反硝化(Law et al., 2012b).如果作为电子供体的碳源因为生物除磷的干扰而不足,各种反硝化酶(NAR,NIR,NOR和NOS)(图 1)将竞争电子;由于NOR和NOS对电子的亲和力要小于NAR和NIR,使得NO和N2O的还原一定程度上受到抑制,从而导致N2O的积累(Knowles,1982).另一方面,部分PAOs会利用体内储存的PHB进行反硝化,这虽然能部分补偿碳源损失,但该过程也可能促进N2O产生(Lemaire et al., 2006).有研究发现,PAOs胞内降解PHB产生电子的速率较降解外碳源低得多,这使得PHB降解成为反硝化作用的限速步骤(Mumleitner et al., 1997).由于电子供应速率较低,也会导致不同反硝化酶间竞争电子,诱发N2O产生(Law et al., 2012a).
AS工艺、A/O工艺、氧化沟工艺以及连续流间歇曝气工艺的N2O释放因子相差不大(表 1).AS工艺N2O释放主要发生在曝气池内(Czepiel et al., 1995).采用AS工艺实际污水厂的N2O释放因子变化范围(0~14.6%)较其他工艺大.这很可能是因为AS工艺并不重点考虑脱氮,因此不同污水厂脱氮程度有很大差异,而N2O释放与脱氮效果有关,故导致采用AS工艺的各污水厂N2O释放因子相差很大(Czepiel et al., 1995).
Ahn等(2010)研究发现,A/O工艺中好氧池释放的N2O比缺氧池高2~3个数量级.Benckiser等(1996)也报道了N2O释放量一定程度上取决于污水中的C/N.Aboobakar等(2013)考察了采用A/O工艺的大型污水处理厂,他们发现一天中各整点的N2O释放因子呈规律变化,并与进水氨氮浓度正相关(R2=0.82).Butler等(2009)采用A/O中试研究时发现,当系统受到各种有害抑制剂冲击时,N2O释放激增总是快于出水氨氮激增,这表明N2O释放突然增加可以作为出水水质恶化的预警,但这还需在实际污水厂进一步证实.
氧化沟工艺的N2O释放因子也较小(表 1).李莎(2012)研究了采用卡鲁赛尔氧化沟的城市污水处理厂时发现,前序曝气沉砂池的N2O释放通量远大于后续的卡鲁塞尔氧化沟单元.但是由于曝气沉砂池面积远小于氧化沟单元的面积,氧化沟单元仍是整个氧化沟工艺中N2O的主要排放源.他们同时发现氧化沟单元中N2O释放速率随DO浓度升高而降低.
一般认为N2O在DO浓度突然变化时会大幅增加(Kampschreur et al., 2008a; Yu et al., 2010),Kimochi等(1998)研究采用连续流间歇曝气工艺的实际污水厂也证实了这一点,当好氧时间所占比例从25%逐渐升高到50%时,反应池内曝气停止瞬间DO下降速率随之加快,N2O释放因子相应由0.01%上升到0.08%.
4 实际污水厂N2O的减排(Mitigation strategies for N2O missions form WWTPs)减少污水厂N2O释放的措施主要包括:①减少好氧段N2O的产生;②减少好氧段N2O的释放;③增大缺氧段N2O的还原;④通过制定政策和规范检测方法等手段激励污水厂减排N2O.
4.1 减少好氧段N2O产生在硝化过程中,低DO、高进水氨氮浓度都会促进N2O产生(Kampschreur et al., 2008b).硝化过程需要确保足够的DO以使得NH2OH和NO-2被及时氧化.实际污水厂的鼓风曝气量一般是恒定的,所以进水基质含量的波动会影响反应池内DO浓度,因此应尽量使进水均匀以免系统中DO浓度波动过大而促进N2O产生(Ahn et al., 2009).实时监控反应池内DO浓度使其处于合适范围也有利于避免N2O积累.另外,维持足够的污泥停留时间(SRT)和中性的pH条件同样有助于减少N2O的产生(Kampschreur et al., 2008b).
4.2 减少好氧段N2O释放N2O产生并不等于N2O释放.相比于N2O的产生,N2O释放机理的研究并不多.普遍认为,N2O的释放与系统内传质系数有关,而好氧池N2O的传质系数通常比缺氧池高2~3个数量级(Foley et al., 2010).为降低系统内N2O传质系数,可以采用以下几种措施:①减少过量曝气,使曝气更高效; ②减少好氧池内的扰动; ③采用无泡曝气,如膜曝气生物反应器(MABR工艺)等(Pellicer-Nàcher et al., 2010).但是,减少好氧段N2O释放的最终效果还有赖于后续缺氧段对溶解态N2O的还原.
4.3 增大缺氧段N2O还原为确保反硝化还原N2O所需碳源,可以根据实际情况不设初沉池或添加外碳源来提高碳氮比.反硝化菌消耗甲醇比消耗乙醇产生的N2O要少,所以在外加碳源时,不仅要考虑费用也要考虑N2O排放(Lu and Chandran, 2010).为避免后续缺氧区DO过高,还应防止前序好氧区过量曝气.应提供足够长的缺氧段水力停留时间,以使得N2O被最大程度地还原(Law et al., 2012b).由于铜是NOS的重要组成元素,所以提供足够的Cu2+对N2O的反硝化降解非常重要(Richardson et al., 2009).Zhu等(2013)研究发现,外加10~100 μg · L-1 Cu2+可减少54.5%~73.2% N2O.由于我国《城镇污水处理厂污染物排放标准》GB18918-2002规定总铜不超过500 μg · L-1,所以在不超过微生物抑制浓度以及排放标准水质的前提下,通过流入一部分(小流量)含铜离子的工业废水,可以起到减少N2O产生的作用.除此之外,生物富集一些特殊菌种,也可以促进N2O的还原.Miyahara等(2010)发现好氧反硝化菌Pseudomonas stutzeri TR2可以减少污水中N2O释放.
4.4 制定政策和规范检测方法除了用上述技术手段来减少排放N2O,使污水厂有减排的动力也很重要.相关机构应制定政策来激励污水厂减排N2O,比如与经济效益挂钩或设立相关法律法规等.已有人建议建立温室气体信用体系使N2O减排对污水厂产生价值(Wang et al., 2011).然而上述方法离不开一个普遍认同的评价标准,这就要求N2O检测方法更加准确和规范.这些还需要更进一步的努力,相关研究亟待开展与深入.
5 中国城镇污水厂N2O释放量估算(Estimation of N2O emissions from WWTPs in China)为了更好地控制温室气体排放应对气候变化,我国“十二五”规划纲要首次把控制温室气体排放这一目标纳入到经济社会发展规划.N2O作为一种重要的温室气体,应引起我们足够重视.然而我国实际污水处理过程中N2O释放总量尚不明晰,这为提出有效地N2O减排措施带来困难.
我国目前仅王金鹤(2012)基于山东济南三座采用A2O工艺污水处理厂的N2O释放情况估算了全国污水厂N2O释放总量(0.93~1.28×109 g · a-1).鉴于我国城市污水厂采用的脱氮工艺的多样性,如何更为精准地评估污水处理过程N2O释放总量成为一个难题.本文尝试区别各个不同污水处理工艺来估算全国污水厂N2O释放总量,旨在尽可能提供更为准确的N2O释放量估计值.
根据中华人民共和国环境保护部公布的“全国投运城镇污水处理设施清单(2012)”(中华人民共和国环境保护部,2012),2011年我国有3184座城镇污水处理厂在运行,平均每天处理城市生活污水1.062亿m3.不同污水处理工艺处理情况见表 2.《室外给水设计规范》GB50013—2006规定,我国城市综合生活用水定额为每人每天100~340 L.《室外排水设计规范》GB50014—2006规定,我国城市综合生活污水定额可按当地用水的80%~90%考虑;生活污水的总氮量可按每人每天5~11 g计算.综合上述数据,可大致估算出我国城市生活污水平均进水氮浓度:
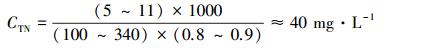
注:生活污水每人每天总氮量取平均值为8 g · L-1,城市综合生活用水定额取平均值为每人每天220 L,综合生活污水定额比例取90%(由于近几年我国污水处理设施发展很快,所以通常取较大值).
| 表2 不同污水处理工艺运行情况(中华人民共和国环境保护部,2012) Table.2 The operating situations of different wastewater treatment processes |
可用以下公式估算全国城镇污水厂每日N2O释放总量:
每日N2O释放量≈∑(平均进水氮负荷×各工艺处理水量×各工艺N2O释放因子)
由于A2O工艺、氧化沟工艺、A/O工艺以及传统活性污泥工艺处理水量所占比重之和高达75.6%,即这4种工艺具有较大的代表性,故可按下式估算每日N2O释放总量:
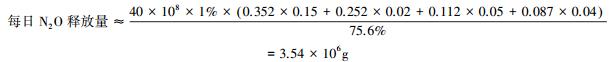
由此可估计2011年全国N2O释放总量约为1.26×109g.
应当指出的是,以上对各工艺N2O释放因子的估计值并非十分准确.一方面,调查样本大部分取自国外污水厂,且不同样本N2O释放因子相差也较大;另一方面,我国3000多座污水厂进水水质、运行情况差别很大,必然导致各污水厂N2O释放情况变化较大. 不仅如此,A2O工艺、氧化沟工艺、A/O工艺、以及传统活性污泥工艺处理水量所占比重之和为75.6%,剩下24.4%的污水处理中所N2O的释放差异在以上估算中未能考虑,这也导致所得估计值存在偏差.因此本文对全国年N2O释放总量的估计还需进一步完善.这就要求我们更多地监测国内不同地区实际污水处理厂中N2O释放情况,为国内N2O释放的定量和减排提供背景数据支撑.
6 总结(Conclusions)关于比较不同工艺实际污水厂N2O的释放情况,并分析其产生差异原因的研究还未见报道.本文初步比较和分析了实际污水厂几种典型工艺的N2O释放情况,并首次从区别不同污水处理工艺角度,估算了全国污水厂的N2O释放总量.
采用IPCC或USEPA等国外研究机构报道的N2O释放因子来估算我国不同地区、不同工艺污水厂N2O的释放量,其准确性还有待考究.如果无法获得较为准确的城市污水处理厂N2O释放的背景数据,将影响我们后续相关研究的开展和政策制定.这就要求我们必须监测足够多的实际污水厂来提供足够多的样本数据支撑.然而关于N2O释放的研究大部分仍集中在小试装置,关于实际污水厂的研究相对较少,特别是国内实际污水厂释放N2O的研究还处于起步阶段,亟待加大和深入.同时,目前鲜见关于实际污水厂和小试装置N2O释放差异的研究,而这些对理解N2O释放规律具有重要价值.污水处理数学模型的建立有助于我们理解和预测N2O产生和释放,但现有的数学模型因其采用的部分参数具有不确定性,整体还不够准确,仍需进一步完善.
| [1] | Aboobakar A, Cartmell E, Stephenson T, et al. 2013. Nitrous oxide emissions and dissolved oxygen profiling in a full-scale nitrifying activated sludge treatment plant [J]. Water Research, 47(2): 524-534 |
| [2] | Ahn J H, Kim S, Park H, et al. 2009. Spatial and temporal variability in N2O generation and emission from wastewater treatment facilities[A]// Proceedings of the Water Environment Federation, Nutrient Removal 2009 [C]. Washington D. C.: Water Environment Federation. 401-409 |
| [3] | Ahn J H, Kim S P, Park H K, et al. 2010. N2O Emissions from activated sludge processes, 2008—2009: results of a national monitoring survey in the United States [J]. Environmental Science & Technology, 44(12): 4505-4511 |
| [4] | Andersson K K, Hooper A B. 1983. O2 and H2O are each the source of one O in NO2- produced from NH3 by Nitrosomonas: 15N-NMR evidence [J]. FEBS Letters, 164(2): 236-240 |
| [5] | Anderson I C, Poth M, Homstead J, et al. 1993. A comparison of NO and N2O by the autotrophic nitrifier Nitrosomonas europaea and the heterotrophic nitrifier Alcaligenes faecalis [J]. Applied and Environmental Microbiology, 59(11): 3525-3533 |
| [6] | Benckiser G, Eilts R, Linn A, et al. 1996. N2O emissions from different cropping systems and from aerated, nitrifying and denitrifying tanks of a municipal waste water treatment plant [J]. Biology and Fertility of Soils, 23(3): 257-265 |
| [7] | Butler M D, Wang Y Y, Cartmell E, et al. 2009. Nitrous oxide emissions for early warning of biological nitrification failure in activated sludge [J]. Water Research, 43(5): 1265-1272 |
| [8] | Chen J W, Strous M. 2013. Denitrification and aerobic respiration, hybrid electron transport chains and co-evolution [J]. Biochim Biophys Acta, 1827(2): 136-144 |
| [9] | Chung Y C, Chung M S. 2000. BNP test to evaluate the influence of C/N ratio on N2O production in biological denitrification [J]. Water Science & Technology, 42(3/4): 23-27 |
| [10] | Colliver B B, Stephenson T. 2000. Production of nitrogen oxide and dinitrogen oxide by autotrophic nitrifiers [J]. Biotechnology Advances, 18(3): 219-232 |
| [11] | Czepiel P, Crill P, Harriss R. 1995. Nitrous oxide emissions from municipal wastewater treatment [J]. Environmental Science & Technology, 29(9): 2352-2356 |
| [12] | de Haas D, Hartley K. 2004. Greenhouse gas emission from BNR plants: Do we have the right focus? // Proceedings of EPA Workshop: Sewage Management: Risk Assessment and Triple Bottom Line . Cairns, Australia |
| [13] | Denman K L, Brasseur G, Chidthaisong A, et al. 2007. In Climate Change 2007: The Physical Science Basis [M]. Cambridge: Cambridge University Press. 501-588 |
| [14] | Desloover J, De Clippeleir H, Boeckx P, et al. 2011. Floc-based sequential partial nitritation and anammox at full scale with contrasting N2O emissions [J]. Water Research, 45(9): 2811-2821 |
| [15] | Desloover J, Vlaeminck S E, Clauwaert P, et al. 2012. Strategies to mitigate N2O emissions from biological nitrogen removal systems [J]. Current Opinion in Biotechnology, 23(3): 474-482 |
| [16] | Foley J, Haas D, Yuan Z. 2010. Nitrous oxide generation in full-scale biological nutrient removal wastewater treatment plants [J]. Water Research, 44(4): 831-844 |
| [17] | Garbeva P, Baggs E M, Prosser J I. 2007. Phylogeny of nitrite reductase (nirK) and nitric oxide reductase (norB) genes from Nitrosospira species isolated from soil [J]. FEMS Microbiology Letters, 266(1): 83-89 |
| [18] | Gustavsson D J, Jansen J L. 2011. Dynamics of nitrogen oxides emission from a full-scale sludge liquor treatment plant with nitritation[J]. Water Science & Technology, 63(12): 2838-2845 |
| [19] | Igarashi N, Moriyama H, Fujiwara T, et al. 1997. The 2. 8 A structure of hydroxylamine oxidoreductase from a nitrifying chemoautotrophic bacterium, Nitrosomonas europaea [J]. Nature Structural Biology, 4(4): 276-284 |
| [20] | IPCC. 2007. Climate Change 2007: Synthesis Report . Geneva, Switzerland: IPCC |
| [21] | Joss A, Salzgeber D, Eugster D, et al. 2009. Full-scale nitrogen removal from digester liquid with partial nitritation and anammox in one SBR [J]. Environmental Science & Technology, 43(14): 5301-5306 |
| [22] | Kampschreur M J, Tan N C G, Kleerebezem R, et al. 2008a. Effect of dynamic process conditions on nitrogen oxides emission from a nitrifying culture [J]. Environmental Science & Technology, 42(2): 429-435 |
| [23] | Kampschreur M J, van der Star W R L, Wielders H A, et al. 2008b. Dynamics of nitric oxide and nitrous oxide emission during full-scale reject water treatment [J]. Water Research, 42(3): 812-826 |
| [24] | Kampschreur M J, Temmink H, Kleerebezem R, et al. 2009a. Nitrous oxide emission during wastewater treatment [J]. Water Research, 43(17): 4093-4103 |
| [25] | Kampschreur M J, Poldermans R, Kleerebezem R, et al. 2009b. Emission of nitrous oxide and nitric oxide from a full-scale single-stage nitritation-anammox reactor [J]. Water Science & Technology, 60(12): 3211-3217 |
| [26] | Kartal B, Kuypers M M M, Lavik G, et al. 2007. Anammox bacteria disguised as denitrifiers: nitrate reduction to dinitrogen gas via nitrite and ammonium [J]. Environmental Microbiology, 9(3): 635-642 |
| [27] | Kim S W, Miyahara M, Fushinobu S, et al. 2010. Nitrous oxide emission from nitrifying activated sludge dependent on denitrification by ammonia-oxidizing bacteria [J]. Bioresource Technology, 101(11): 3958-3963 |
| [28] | Kimochi Y, Inamori Y, Mizuochi M, et al. 1998. Nitrogen removal and N2O emission in a full-scale domestic wastewater treatment plant with intermittent aeration [J]. Journal of Fermentation and Bioengineering, 86(2): 202-206 |
| [29] | Knowles R. 1982. Denitrification [J]. Microbiological Revieews, 46(1): 43-70 |
| [30] | Könneke M, Bernhard A E, de la Torre J R, et al. 2005. Isolation of an autotrophic ammonia-oxidizing marine archaeon [J]. Nature, 437(7058): 543-546 |
| [31] | Law Y, Ni B J, Lant P, et al. 2012a. N2O production rate of an enriched culture of ammonia oxidising bacteria culture exponentially correlated to its ammonia oxidation rate [J]. Water Research, 46(10): 3409-3419 |
| [32] | Law Y, Ye L, Pan Y, et al. 2012b. Nitrous oxide emissions from wastewater treatment processes [J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 367(1593): 1265-1277 |
| [33] | Lemaire R, Meyer R, Taske A, et al. 2006. Identifying causes for N2O accumulation in a lab-scale sequencing batch reactor performing simultaneous nitrification, denitrification and phosphorus removal [J]. Journal of Biotechnology, 122(1): 62-72 |
| [34] | 李莎. 2012. 城市污水四种典型处理工艺N2O排放特征的研究 . 北京: 北京林业大学 |
| [35] | Lu H J, Chandran K. 2010. Factors promoting emissions of nitrous oxide and nitric oxide from denitrifying sequencing batch reactors operated with methanol and ethanol as electron donors [J]. Biotechnology and Bioengineering, 106(3): 390-398 |
| [36] | Miyahara M, Kim S W, Fushinobu S, et al. 2010. Potential of aerobic denitrification by Pseudomonas stutzeri TR2 to reduce nitrous oxide emissions fromwastewater treatment plants [J]. Applied and Environmental Microbiology, 76(14): 4619-4625 |
| [37] | Murnleitner E, Kuba T, van Loosdrecht M C M, et al. 1997. An integrated metabolic model for the aerobic and denitrifying biological phosphorus removal [J]. Biotechnology and Bioengineering, 54(5): 434-450 |
| [38] | Ostrom N E, Sutka R, Ostrom P H, et al. 2010. Isotopologue data reveal bacterial denitrification as the primary source of N2O during a high flux event following cultivation of a native temperate grassland [J]. Soil Biology and Biochemistry, 42(3): 499-506 |
| [39] | Otte S, Grobben N G, Robertson L A, et al. 1996. Nitrous oxide production by Alcaligenes faecalis under transient and dynamic aerobic and anaerobic conditions [J]. Applied and Environmental Microbiology, 62(7): 2421-2426 |
| [40] | Park H D, Wells G F, Bae H, et al. 2006. Occurrence of ammonia-oxidizing Archaea in wastewater treatment plant bioreactors [J]. Applied and Environmental Microbiology, 72(8): 5643-5647 |
| [41] | Pellicer-Nàcher C, Sun S P, Lackner S, et al. 2010. Sequential aeration of membrane-aerated biofilm reactors for high-rate autotrophic nitrogen removal: experimental demonstration [J]. Environmental Science & Technology, 44(19): 7628-7634 |
| [42] | Ravishankara A R, Daniel J S, Portmann R W. 2009. Nitrous oxide: the dominant ozone-depleting substance emitted in the 21st century [J]. Science, 326(5949): 123-125 |
| [43] | Richardson D, Felgate H, Watmough N, et al. 2009. Mitigating release of the potent greenhouse gas N2O from the nitrogen cycle-could enzymic regulation hold the key [J]. Trends in Biotechnology, 27(7): 388-397 |
| [44] | Sümer E, Weiske A, Benckiser G, et al. 1995. Influence of environmental conditions on the amount of N2O released from activated sludge in a domestic waste water treatment plant [J]. Experientia, 51(4): 419-422 |
| [45] | Santoro A E, Buchwald C, Mcllvin M R, et al. 2011. Isotopic signature of N2O produced by marine ammonia-oxidizing archaea [J]. Science, 333(6047): 1282-1285 |
| [46] | Shiba T. 1991. Roseobacter litoralis gen. nov., sp. nov., and Roseobacter denitrificans sp. nov., Aerobic Pink-Pigmented Bacteria which Contain Bacteriochlorophyll a production from hypersaline Ekho Lake [J]. Systematic and Applied Microbiology, 14(2): 140-145 |
| [47] | Solomon S, Qin D, Manning M, et al. 2007. In Climate Change 2007: The Physical Science Basis [M]. Cambridge University Press. 21-92 |
| [48] | Stahl D A, de la Torre J R. 2012. Physiology and diversity of ammonia-oxidizing archaea [J]. Annual Review of Microbiology, 66(1): 83-101 |
| [49] | Stein L Y. 2011. Surveying N2O-producing pathways in bacteria [J]. Methods in Enzymology, 486: 131-152 |
| [50] | Suzuki I, Dular U, Kwok S C. 1974. Ammonia or ammonium ion as substrate for oxidation by Nitrosomonas europaea cells and extracts [J]. Journal of Bacteriology, 120(1): 556-558 |
| [51] | Takaya N, Catalan-Sakairi M A B, Sakaguchi Y, et al. 2003. Aerobic denitrifying bacteria that produce low levels of nitrous oxide [J]. Applied and Environmental Microbiology, 69(6): 3152-3157 |
| [52] | Tett S F B, Stott P A, Allen M R, et al. 1999. Causes of twentieth-century temperature change near the Earth's surface [J]. Nature, 399(6736): 569-572 |
| [53] | Upadhyay A K, Hooper A B, Hendrich M P. 2006. NO reductase activity of the tetraheme cytochrome c554 of Nitrosomonas europaea [J]. Journal of the American Chemical Society, 128(13): 4330-4337 |
| [54] | USEPA. 2006. Global Anthropogenic Non-CO2 Greenhouse Gas Emissions: 1990—2020 [M]. Washington D. C. |
| [55] | Van Niel E W J, Arts P A M, Wesselink B J, et al. 1993. Competition between heterotrophic and autotrophic nitrifiers for ammonia in chemostat cultures [J]. FEMS Microbiology Ecology, 102(2): 109-118 |
| [56] | 王金鹤. 2012. 城镇污水处理厂中温室气体的释放研究 . 济南: 山东大学环境工程系 |
| [57] | Wang J S, Hamburg S P, Pryor D E, et al. 2011. Emissions credits: opportunity to promote integrated nitrogen management in the wastewater sector [J]. Environmental Science & Technology, 45(15): 6239-6246 |
| [58] | Wang Y Y, Stephenson T, Harnett R. 2009. Nitrous oxide emissions during nitrification in a trickling filter: Effect of temperature // 2nd International Conference on Pollution Control and Resource Reuse for A Better Ttomorrow and Sustainable Ecology . Nanjing, China |
| [59] | Weissenbacher N, Takacs I, Murthy S, et al. 2010. Gaseous nitrogen and carbon emissions from a full-scale deammonification plant [J]. Water Environment Research, 82(2): 169-175 |
| [60] | Wicht H. 1996. A model for predicting nitrous oxide production during denitrification in activated sludge [J]. Water Science & Technology, 34(5/6): 99-106 |
| [61] | Wunderlin P, Mohn J, Joss A, et al. 2012. Mechanisms of N2O production in biological wastewater treatment under nitrifying and denitrifying conditions [J]. Water Res, 46(4): 1027-1037 |
| [62] | Yu R, Kampschreur M J, Lo osdrecht M C M V, et al. 2010. Mechanisms and specific directionality of autotrophic nitrous oxide and nitric oxide generation during transient anoxia [J]. Environmental Science & Technology, 44(4): 1313-1319 |
| [63] | 中华人民共和国环境保护部. 2012.全国投运城镇污水处理设施清单(2012) . 2013-04-29. http://www.zhb.gov.cn/gkml/hbb/bgg/201305/t20130508_251788.htm |
| [64] | Zhu X Y, Chen Y G, Chen H, et al. 2013. Minimizing nitrous oxide in biological nutrient removal from municipal wastewater by controlling copper ion concentrations [J]. Applied Microbiology and Biotechnology, 97(3): 1325-1334 |
 2014, Vol. 34
2014, Vol. 34


