2. 中国农业大学水利与土木工程学院, 北京 100083
2. College of Water Resources and Civil Engineering, China Agricultural University, Beijing 100083
长江三峡工程运行后,水库发生泥沙淤积(Fang et al., 2000).由于污染物与泥沙颗粒的相互作用,包括营养物质及重金属在内的物质易在水库底部聚集.研究表明,三峡工程蓄水前,TN、TP入库负荷与出库负荷相等;而蓄水后,约84.45%的TN和48.76%的TP滞留于水库中(中国水利水电科学研究院等,2012).因此,研究泥沙颗粒与污染物之间的相互作用,认识污染物在天然水体中的不同赋存形式,成为三峡工程运行过程中亟待解决的一个重要科学问题.
泥沙颗粒与污染物之间的相互作用,即污染物在固/液两相之间的分配,通常称为吸附过程(汤鸿霄,1993).表面络合模型作为一种机理模型,自20世纪70年代初期被Stumm等(1970)首先提出后,被广泛应用于吸附过程的研究.早期的模型应用多针对纯矿物,尤其是水合氧化物.如Catts等(1986)应用表面络合模型研究了Cu、Pb和Zn在δMnO2上的吸附特性;Dzombak等(1990)综合研究了水合氧化铁的吸附特性;Robertson等(1997)研究了pH值、离子强度等对不同氧化物吸附特性的影响.之后,表面络合模型被逐渐应用到天然泥沙颗粒.与纯矿物不同,天然泥沙颗粒是多种矿物的组合体,表面特性更为复杂.Wen等(1998)将泥沙颗粒视为整体,用平均表面官能团的概念研究了颗粒对Cu和Cd的吸附特性,发现表面络合模型也能较好地反应天然泥沙的吸附特性;Davis等(1998)则采用组分相加法,分别考虑组成泥沙颗粒的不同矿物成分,综合分析了Zn在颗粒表面的吸附特性;同样,Dong等(2012)研究了U(VI)在泥沙颗粒表面的吸附特性.
表面络合模型将颗粒物界面上与H+、OH-和污染物等的结合用溶液中络合平衡的方式处理(汤鸿霄等,2000),不同处在于考虑固液界面电荷的静电力影响,即基于某种双电层结构模式的假设,建立表面电荷与电位的定量关系,对表面络合常数加以静电力校正.常见的络合模型有恒定容量模式(CCM)、双层模式(DLM)和三层模式(TLM).前人多采用这些模型,对吸附过程做了较好的模拟.但这些模型均假设颗粒表面的电荷均匀分布,然后得到周围电位的分布规律(张中路等,1989),进而对表面络合常数进行静电力校正.事实上,天然河流中的泥沙颗粒,除了包含多种矿物成分外,还具有极其复杂的表面特性,如表面形貌、晶体结构等,这些都导致颗粒表面电荷的非均匀分布(黄磊等,2012a).如何确定天然泥沙颗粒表面的双电层结构,是将表面络合模型应用到天然体系的又一大挑战(Davis et al., 1990).因此,考虑颗粒表面电荷的非均匀分布,对表面络合常数采用更合理的静电力校正,是本文的研究重点.
本文基于课题组已有的复杂泥沙的研究,考虑泥沙颗粒表面电荷的非均匀分布,修正传统的表面络合模型.首先,从泥沙颗粒形貌出发,结合表面电荷分布与形貌间的统计关系,构建统计意义下的颗粒表面电荷分布情况;然后,利用带电颗粒周围电位的计算公式,计算出表面电位的异质性分布,进而修正表面络合常数,得到非均匀电荷分布下的表面络合模型.修正模型更接近天然泥沙的吸附特性,对于水体中各种污染物在泥沙颗粒表面的吸附计算具有重要意义.
2 材料与方法(Materials and methods)天然河流中的泥沙颗粒组成复杂,主要包括石英、长石及各种粘土矿物.在众多成分中,石英(SiO2)所占比例最大,是天然泥沙的主要组成成分,如长江荆江段床沙中石英占79%~80%(钱宁等,1983).因此,本文以石英砂为例,展开相关研究.
2.1 石英砂颗粒的表征取天然石英砂若干,过0.1 mm筛,储存在洁净的玻璃皿中,以供使用.试验时,将石英砂用导电胶布粘在金属样品盘上,然后放到扫描探针显微镜的样品操作台,进行表面形貌及电荷分布测量.整个过程要尽量地快,以减少外界环境对样品的污染.实验使用美国DI仪器公司生产的Dimension 3100型原子力显微镜,在清华大学物理系完成.
原子力显微镜(AFM)形貌测量采用接触模式在大气环境下进行成像观察,所有图像均在恒力模式下获得.这里对多个样品进行观测,每个样品至少进行3次不同位置的AFM观测,位置选取注重随机性,同时尽量保证每个位置具有不同特点,以提高其代表性.
静电力显微镜(EFM)电荷测量使用MESP探针,探针表面镀有一层导电金属膜.为了排除表面形貌对EFM信号产生的影响,首先利用AFM的表面成像功能,记录样品的表面形貌特征.然后,让探针回到扫描前的位置,并在竖直方向上抬高50 nm,使探针按照刚才记录的样品表面形貌特征,再进行1次开环扫描(Dianoux et al., 2003).这里对多个样品进行观测,观测位置的选择与形貌测量一样,注重随机性和代表性.
2.2 平衡吸附实验准确称取(0.4390±0.001)g磷酸二氢钾(分析纯)倒入1 L容量瓶中,加入去离子水配置成总磷浓度为100 mg · L-1的磷标准液.取所需质量的石英砂在去离子水中配成悬浊液,泥沙浓度为10 g · L-1;然后加入磷标准液配制所需浓度的总磷溶液,磷初始浓度分别为1.0、2.0、3.0、4.0、5.0、8.0和10.0 mg · L-1;背景电解液为0.1 mol · L-1 NaNO3;在振动平台上振动24 h,达到吸附平衡.将悬浊液进行离心处理,提取上清液并过0.45 μm微孔滤纸,用钼酸铵分光光度法测定滤液中的总磷浓度.与此同时,制备空白样,做吸附前的磷浓度率定.由此计算出单位质量石英砂的吸附量(mg · g-1).实验溶液pH为6~7,实验温度为室温,25 ℃左右.
3 表面络合模型的修正(Modified surface complexation model)颗粒物在水中结合配位水,成为羟基化的表面,即表面拥有大量的羟基官能团(Boehm,1971).这些表面羟基可以质子化或去质子化,也可以与溶液中的离子发生配体交换,具体过程如式(1)~(4)所示,其中,>S表示表面原子.将颗粒表面作为一种带有许多荷电表面羟基的聚合电解质,用类似溶液中络合平衡的方法处理颗粒物界面上与H+、OH-和污染物离子等的结合.
表面质子反应:
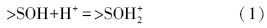
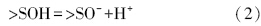
与溶液中离子的配体交换:
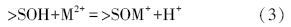
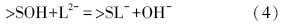
静电力校正项是表面络合模型区别于溶液中络合平衡的重要方面.欲求此校正项,则需了解在一定电荷密度σ0下表面电位Ψ0的情况.无论是恒定电容模式,还是双层模式或者三层模式,它们对颗粒表面双电层结构的假设,都是基于表面电荷均匀分布的概念,然后建立了不同的表面电荷与电位的定量关系,如表 1所示,其中,C、C1和C2为电容(F · m-2),I为溶液中的离子强度(mol · L-1),Z为正、负离子所带的电荷数,F为法拉第常数(C · mol-1),R为普适气体常数(J · K-1 · mol-1),T为绝对温度(K),下标0、β和d分别代表颗粒表面层、专属吸附离子层和扩散层.然而,天然泥沙颗粒的表面电荷并非假设的均匀分布,相反,复杂的表面结构(如晶体结构、矿物成分和表面粗糙等)都会引起表面电荷分布的异质性.Davis等(1990)指出,如何确定泥沙颗粒表面的双电层结构,是将表面络合模型应用到天然体系的一大挑战.下面我们将以石英砂为例,考虑颗粒表面电荷分布的异质性,提出非均匀电荷分布下的表面络合模型.
| 表1 不同双电层结构模式下的电荷密度与电位关系 Table 1 Relationship between surface charge distribution and surface potential |
图 1为石英砂颗粒表面的AFM形貌图像,扫描面积为2 μm×2 μm,给出了纳米尺度下颗粒的表面形貌.其中,图 1a为俯视图,图 1b为对应的三维图像.原子力显微镜的优点在于:不但图像的分辨率高,而且能够直接给出颗粒表面的高度值,为数据分析提供了方便.从图 1可以看出,石英砂颗粒具有极其复杂的表面形貌(如凸起、凹地、鞍部等),且颗粒内部可能还存在着各种尺度的孔隙.这些复杂的形貌会导致颗粒表面活性位分布的异质性,引起颗粒与水体中污染物离子作用的不均匀,从而出现表面电荷的非均匀分布.
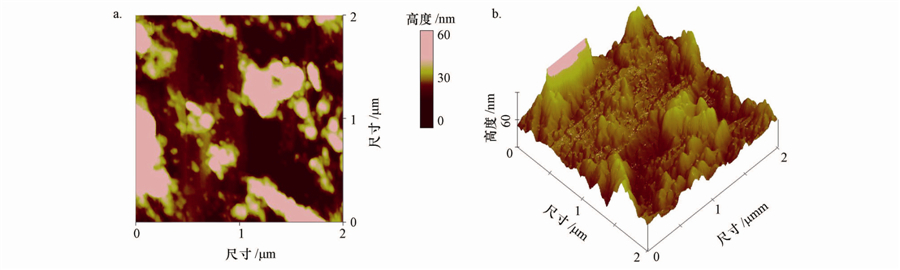 |
| 图 1 石英砂颗粒的AFM图像(a.俯视图;b.三维图像) Fig. 1 AFM images of quartz s and (a.top view; b.3D image) |
颗粒表面千变万化,形态各异,不可能用一个简单的函数式来描述.陈明洪等(2009)借用描述地球表面形态的理论来对颗粒表面形态进行研究.由于颗粒表面地形形态的不连续性,对表面形貌的描述采用分块处理的方法.假设颗粒表面上每个点P与其8-邻域点构成一个微曲面,根据微分几何的曲面论理论(梅向明等,1988),设曲面参数方程为z=z(x,y),其中,x、y为该点在图像矩阵中的坐标,则该点处的高斯曲率K和平均曲率H为:

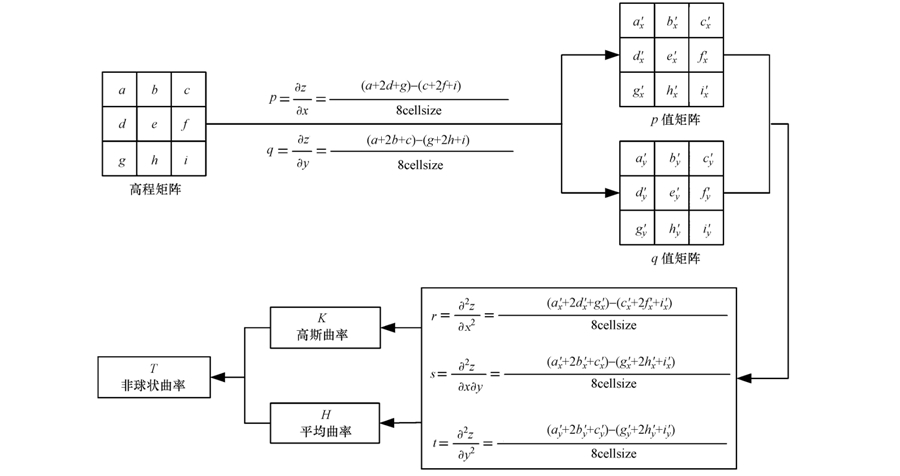 |
| 图 2 表面曲率的计算流程图(Chen et al., 2013) Fig. 2 Calculation flow chart of surface curvature(Chen et al., 2013) |
由于高斯曲率和平均曲率不方便单独用来判断地形特征,进一步引入非球状曲率T.它刻画了局部曲面形态与球体的接近程度,也是高斯曲率和平均曲率的函数.非球状曲率T的定义为:

图 3为静电力显微镜(EFM)测量得到的石英砂颗粒表面电荷分布(黄磊等,2012b).扫描面积为10 μm×10 μm,采样点数为256×256,采样点的间距约为39 nm,较为精细地在x、y方向上测量了石英砂颗粒的表面形貌与电荷分布状况.图 3a为形貌图,图中亮的区域表示该处的高程较高,暗色的区域表明该处的高程较低.图 3b为相位图,图中亮的区域相位差为正,作用力为斥力,由于该图是在导电针尖上施加+5 V电压时测得的,故该区域带正电,区域越亮电荷强度越强;反之,暗色的区域相位差为负,作用力为引力,该区域带负电,区域越暗电荷强度越强.
对比图 3a和b可以看出,石英砂颗粒表面电荷分布与表面形貌有一定的相关关系,表面形貌复杂的地方电荷密度相对较大.黄磊等(2012b)统计分析了电荷分布位置与颗粒表面微形貌的相关关系,认为电荷大多集中分布在颗粒表面的鞍部、凸起和凹地部位,而在凹槽、凸脊和平坦部位分布较少;此外,还统计了表面电荷与非球状曲率T的关系,即:

 |
| 图 3 石英砂颗粒的表面形貌(a)与相位图(b)(针尖电压为+5V) Fig. 3 Surface morphology(a) and phase image(b)of quartz s and |
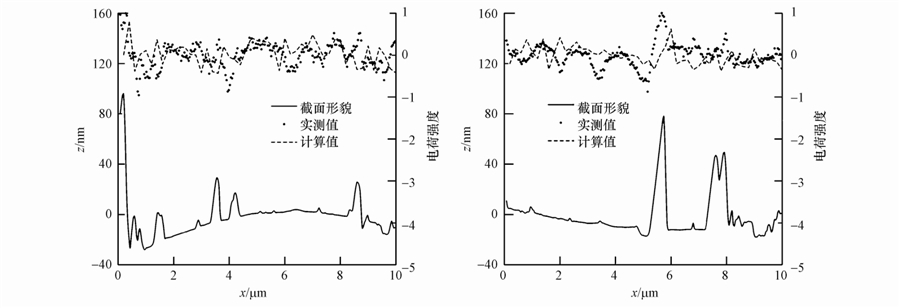 |
| 图 4 石英砂颗粒表面电荷分布实测值与计算值的比较 Fig. 4 Comparison between the measured values and calculated values of surface charge distribution |
前面给出了石英砂颗粒表面电荷分布的计算方法,对于任意一颗已知表面形貌的颗粒,利用式(7)及非球状曲率计算,可以得到其表面电荷分布.计算该电荷分布下的表面电位,则是修正传统络合模型,从而建立非均匀电荷分布下表面络合模型的关键.
非均匀带电颗粒周围电位的计算公式(Kirkwood,1934;Sader et al., 1998)如下所示:
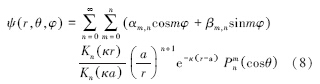
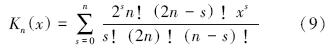
此外,系数 αm,n和βm,n 为表面电荷分布矩,对于具有N个离散点电荷的颗粒((ri,θi,φi)处电荷值为qi),计算式如下:
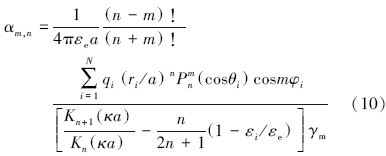

式(8)~(11)给出了非均匀带电颗粒周围电位的计算方法.令r=a,便可计算得到表面电位Ψ0(a, θ,φ)的分布情况.由此,我们建立了颗粒表面形貌-电荷分布-表面电位三者间的数学关系,对于任意一颗已知表面形貌的颗粒,可以计算出其表面电荷分布,进而得到表面电位分布.
为了结果的代表性,即表面电荷分布-表面电位关系的代表性,我们观测了大量的石英砂颗粒,分别得到其表面形貌图.“数学泥沙”,即从大量颗粒形貌中抽象出的具有统计意义形貌的泥沙,是描述泥沙颗粒复杂形貌,研究其与污染物作用的重要工具(方红卫等,2009).借助构建数学泥沙的方法,本文建立了统计意义上的数学石英砂,具体如图 5所示.这样就可以建立统计意义上的表面电荷分布-表面电位关系,用于修正表面络合模型.图 6为数学石英砂表面电荷分布和电位分布的俯视图(电荷总量约为7.3×10-13 C).
 |
| 图 5 统计意义上的数学石英砂 Fig. 5 Mathematical quartz sand |
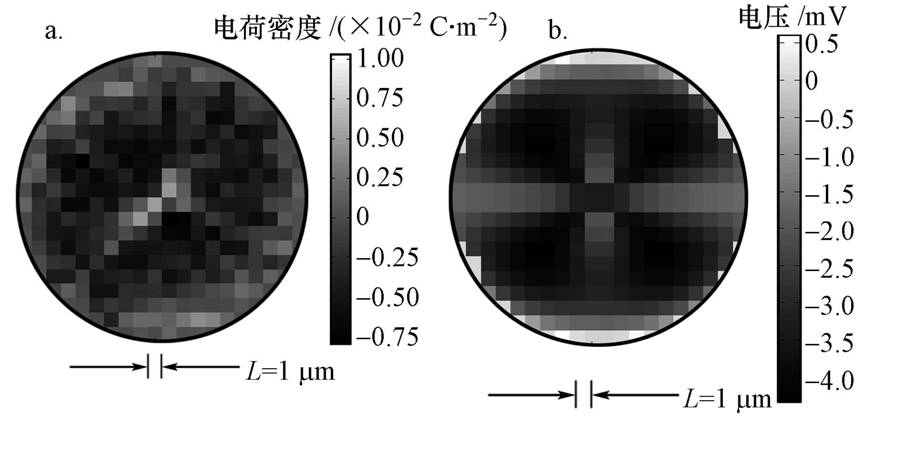 |
| 图 6 数学石英砂表面电荷分布(a)与电位分布(b)的俯视图 Fig. 6 Surface charge distribution(a) and potential(b)of mathematical quartz sand |
传统的表面络合模型,通过迭代求解质量作用方程与质量平衡方程,得到不同条件下污染物在固/液界面的分配情况.不同的模型假设不同的双电层结构,即不同的表面电荷与电位关系式,如表 1所示.考虑颗粒表面电荷的非均匀分布后,上述关系式不再适用.
3.1~3.3节建立了统计意义上的表面电荷分布-表面电位关系.在给定各组分初始猜想值的情况下(包括表面电位的猜想值Ψ*0),根据体系中不同的界面反应,可以推求出颗粒表面的电荷总量Γ,它是由表面质子反应及与溶液中离子的配体交换引起的(式(1)~(4)),表达式如下:
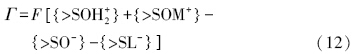
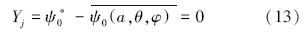
石英砂对磷的平衡吸附实验结果如图 7所示,实验pH为6~7.从图中可以看出,随着水相浓度的进一步增加,石英砂对磷的平衡吸附量逐渐增大;当水相浓度较小时,增长速度较快,平衡吸附量呈线性增长;而随着水相浓度的增加,平衡吸附量的增长速度逐渐变慢,最终趋于最大值,反映了石英砂颗粒对磷的最大吸附能力.这里,石英砂颗粒对磷的最大吸附量约为0.35~0.40 mg · g-1.图 7同时给出了CCM、DLM及修正模型对实测数据的拟合情况,表面酸度常数取值为:logKa1=-1.5,logKa2=-7.5;其他参数选择如表 2所示.相比之下,修正模型考虑了石英砂颗粒表面电荷的非均匀分布,更接近实际情况,能够更好地模拟吸附结果.
 |
| 图 7 石英砂颗粒对磷的平衡吸附 Fig. 7 Adsorption isotherm of phosphate on quartz sand |
| 表2 磷在石英砂颗粒表面吸附的参数选择 Table 2 Parameters for the adsorption of phosphate on quartz s and |
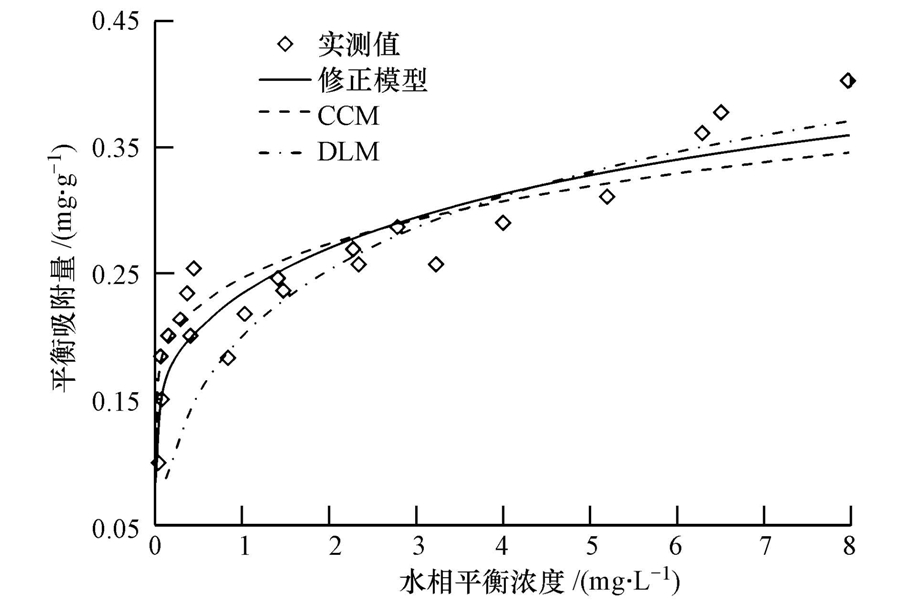
为了更好地验证模型,本文采用他人的实验结果对修正模型进行进一步验证.Bolt(1957)在不同NaCl溶液浓度下对石英砂进行表面滴定实验,得到石英砂颗粒表面电荷密度随pH值的变化情况(图 8).从图中可以看出,石英砂颗粒表面电荷密度随着pH值的增大而逐渐减小,pHpzc≈4.5;但不同NaCl浓度下,表面电荷密度变化的速度有所差异,离子浓度越高,变化越快.
 |
| 图 8 不同NaCl溶液浓度下石英砂表面电荷密度随pH值的变化(a.0.1 mol · L-1,b.0.01 mol · L-1,c.0.001 mol · L-1) Fig. 8 Surface charges from Bolt(1957)for quartz s and in NaCl solutions(a.0.1 mol · L-1,b.0.01 mol · L-1,c.0.001 mol · L-1) |
这里分别用CCM、DLM和本文修正模型对实测结果进行拟合(图 8),其中,实心点为Bolt滴定实验结果,实线为本文修正模型计算结果,虚线和点虚线分别为CCM和DLM计算结果.各模式参数选择如表 3所示.由表可知,3种模式均能较好地再现实验结果,但修正模型由于考虑了石英砂颗粒表面电荷的非均匀分布,相比之下更接近天然泥沙的吸附特性,能够更好地模拟结果.
| 表3 表面滴定实验中不同模式下的参数选择 Table 3 Parameters for the titration experiment |
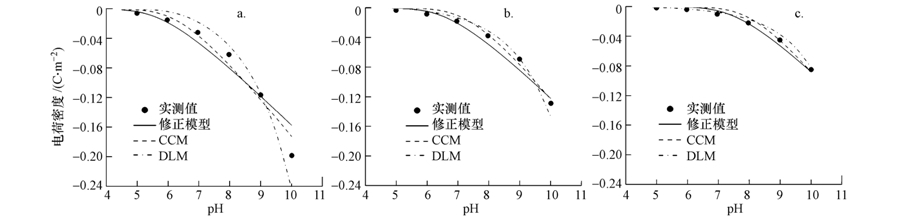
Benyahya等(1999)研究了4种微量金属(Cd、Zn、Co和Mn)在石英砂颗粒表面的吸附,pH范围为4~9,结果如图 9所示(图中吸附量表示相对于最大吸附量的百分比,以便于不同数据的比较).实验中,石英砂浓度为1 g · L-1,背景液为0.05 mol · L-1 NaNO3溶液,微量金属的初始浓度分别为:[Mn]=10 nmol · L-1,[Co]=10 nmol · L-1,[Zn]=50 nmol · L-1和[Cd]=10 nmol · L-1.从图中可以看出,微量金属在石英砂颗粒表面的吸附量随着pH值的增大而增加,当pH小于6时,吸附量很少,这时的吸附量可能主要来自阳离子交换量;当pH大于6时,吸附量随pH值的增大而快速增加.4种微量金属最大吸附量对应的pH值满足:Zn<Cd<Co<Mn.这里用修正模型对实验结果进行了拟合,模型参数如表 4所示.可见,该修正模型能够较好地模拟实测结果.
 |
| 图 9 Cd、Zn、Co和Mn在石英砂颗粒表面的吸附 Fig. 9 Adsorption of Cd,Zn,Co, and Mn on quartz sand |
| 表4 Cd、Zn、Co和Mn在石英砂颗粒表面吸附的参数选择 Table 4 Parameters for the adsorption of Cd,Zn,Co, and Mn on quartz sand |
Subramaniam等(2003)研究了不同含沙浓度下Cu在石英砂颗粒表面的吸附,具体如图 10所示.石英砂浓度分别取0.25、1和2 g · L-1,Cu的初始浓度为1.6×10-4 mol · L-1,背景液为0.001 mol · L-1 NaNO3溶液,表面位密度取值5.0 sites · nm-2.图中线条为修正模型的拟合结果,表面酸度常数取值为:logKa1=-1.5,logKa2=-7.5;Cu的表面络合常数取值为logK=1.39.
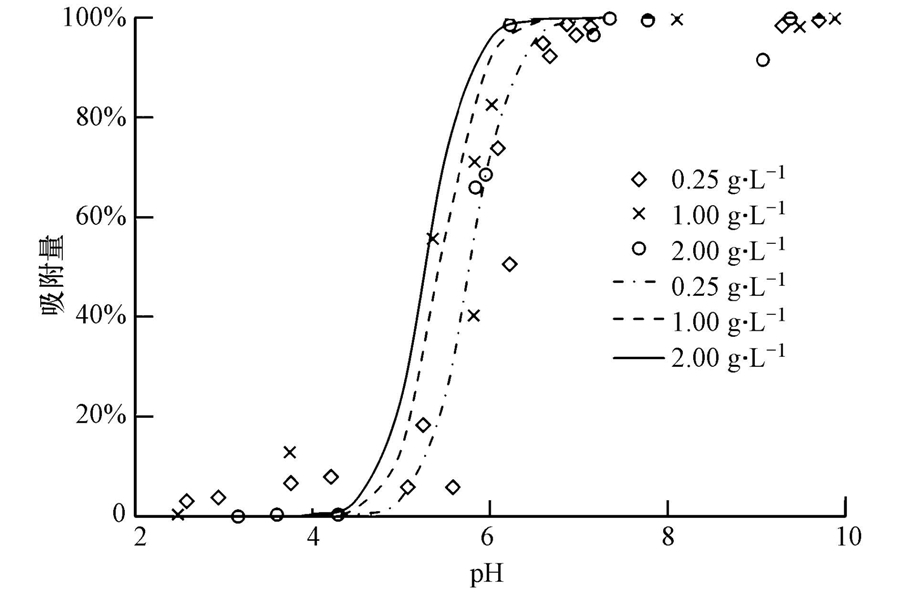 |
| 图 10 不同含沙浓度下Cu在石英砂颗粒表面的吸附 Fig. 10 Adsorption of Cu on quartz s and under different s and content |
1)石英砂颗粒具有极其复杂的表面形貌,这些复杂的形貌导致颗粒表面活性位分布的异质性,引起颗粒与水体中污染物离子作用的不均匀,从而出现表面电荷的非均匀分布.
2)表面电荷分布与表面形貌有一定的相关关系,可用来模拟颗粒表面电荷分布,进而结合非均匀带电颗粒周围电位的计算公式,建立表面电荷分布-表面电位数学关系.
3)利用统计意义上的表面电荷分布-表面电位数学关系,本文修正了传统的表面络合模型,并用表面滴定实验及吸附实验数据对模型进行验证.结果表明,修正模型考虑了泥沙颗粒表面电荷的非均匀分布,更接近天然泥沙的吸附特性.
| [1] | Benyahya L, Garnier J M. 1999. Effect of salicylic acid upon trace-metal sorption (CdII, ZnII, CoII, and MnII) onto alumina, silica, and kaolinite as a function of pH [J]. Environmental Science & Technology, 33(9): 1398-1407 |
| [2] | Boehm H P.1971.Acidic and basic properties of hydroxylated metal oxide surfaces[J].Discussions of the Faraday Society,52: 264-275 |
| [3] | Bolt G H. 1957. Determination of the charge density of silica sols[J]. The Journal of Physical Chemistry, 61(9): 1166-1169 |
| [4] | Catts J G, Langmuir D. 1986. Adsorption of Cu, Pb and Zn by δMnO2: applicability of the site binding-surface complexation model [J]. Applied Geochemistry, 1(2): 255-264 |
| [5] | 陈明洪, 方红卫, 陈志和. 2009. 泥沙颗粒表面磷吸附分布的实验研究[J].泥沙研究, (4): 51-57 |
| [6] | Chen M H, Fang H W, Huang L.2013.Surface charge distribution and its impact on interactions between sediment particles[J].Ocean Dynamics, 63(9/10): 1113-1121 |
| [7] | Davis J A, Kent D B. 1990. Surface complex modeling in aqueous geochemistry, mineral-water interface geochemistry[J]. Min Soc Am Reviews in Mineralogy, 23: 177-260 |
| [8] | Davis J A, Coston J A, Kent D B, et al. 1998. Application of the surface complexation concept to complex mineral assemblages[J]. Environmental Science & Technology, 32(19): 2820-2828 |
| [9] | Dianoux R, Martins F, Marchi F, et al. 2003. Detection of electrostatic forces with an atomic force microscope: Analytical and experimental dynamic force curves in the nonlinear regime[J]. Physical Review B, 68: 45403-45408 |
| [10] | Dong W M, Tokunaga T K, Davis J A, et al. 2012. Uranium (VI) adsorption and surface complexation modeling onto background sediments from the F-area Savannah River site [J]. Environmental Science & Technology, 46(3): 1565-1571 |
| [11] | Dzombak D A, Morel F M M. 1990. Surface complexation modeling: hydrous ferric oxide [M]. New York: Wiley |
| [12] | Fang H W, Wang G Q. 2000. Three-dimensional mathematical model of suspended-sediment transport[J].Journal of Hydraulic Engineering, 126(8): 578-592 |
| [13] | 方红卫,陈明洪,陈志和.2009.环境泥沙的表面特性与模型[M].北京:科学出版社 |
| [14] | 黄磊,方红卫,陈明洪,等. 2012a. 粘性细颗粒泥沙的表面电荷特性研究进展[J].清华大学学报:自然科学版, 52(6): 747-752 |
| [15] | 黄磊,方红卫,陈明洪. 2012b. 泥沙颗粒表面电荷分布的初步研究[J].中国科学: 技术科学, 42(4): 395-401 |
| [16] | Kirkwood J G. 1934. Theory of solutions of molecules containing widely separated charges with special application to zwitterions [J]. Journal of Chemical Research, 2: 351-361 |
| [17] | 梅向明, 黄敬之. 1988. 微分几何[M].北京: 高等教育出版社 |
| [18] | 钱宁, 万兆惠. 1983. 泥沙运动力学[M].北京:科学出版社 |
| [19] | Robertson A P, Leckie J O. 1997. Cation binding predictions of surface complexation models: Effects of pH, ionic strength, cation loading, surface complex, and model fit [J]. Journal of Colloid and Interface Science, 188(2): 444-472 |
| [20] | Sader J E,Lenhoff A M.1998.Electrical double-layer interaction between heterogeneously charged colloidal particles: A superposition formulation [J]. Journal of Colloid and Interface Science, 201(2): 233-243 |
| [21] | Stumm W,Huang C P,Jenkins S R.1970.Specific chemical interaction affecting the stability of dispersed systems[J].Croatica Chemica Acta, 42: 223-244 |
| [22] | Subramaniam K,Vithayaveroj V,Yiacoumi S,et al.2003.Copper uptake by silica and iron oxide under high surface coverage conditions: surface charge and sorption equilibrium modeling [J]. Journal of Colloid and Interface Science, 268(1): 12-22 |
| [23] | Sverjensky D A, Sahai N. 1996.Theoretical prediction of single-site surface-protonation equilibrium constants for oxides and silicates in water [J]. Geochimica et Cosmochimica Acta, 60(20): 3773-3797 |
| [24] | 汤鸿霄. 1993.环境水质学的进展——颗粒物与表面络合(上)[J].环境科学进展, 1(1): 25-41 |
| [25] | 汤鸿霄,钱易,文湘华,等.2000.水体颗粒物和难降解有机物的特性与控制技术原理: 水体颗粒物[M].北京:中国环境科学出版社 |
| [26] | Wen X H,Du Q,Tang H X.1998. Surface complexation model for the heavy metal adsorption on natural sediment [J]. Environmental Science & Technology, 32(7): 870-875 |
| [27] | 张中路,张仁佑.1989.胶体与表面化学导论[M].北京:化学工业出版社 |
| [28] | 中国水利水电科学研究院. 2012. 三峡水库水环境演化与安全问题诊断研究[R]. 北京:中国水利水电科学研究院 |
 2014, Vol. 34
2014, Vol. 34


