2. 华南理工大学环境与能源学院, 广州 510006
2. College of Environment and Energy, South China University of Technology, Guangzhou 510006
光催化技术是一种在能源和环境领域有着重要应用前景的“绿色”技术.常见的半导体光触媒材料有TiO2(Fujishima et al., 1972;Tachikawa et al., 2007)、WO3(Santato et al.,2001;Su et al., 2011)、ZnO(Chakrabarti et al., 2004;Ko et al., 2011)和CdS(Bao et al.,2007;Jang et al.,2007)等.TiO2 具有化学性质稳定、无毒、成本低、可在常温常压下进行催化反应且不产生二次污染等优点,因而被广泛研究.但TiO2作为一种宽带半导体(锐钛矿型,带隙能Eg = 3.2 eV),只有在波长小于387 nm的紫外区下才能激发其催化活性(Xie et al.,2004),在到达地面的太阳能中,这一波段的能量尚不足5%,且TiO2的比表面积比较小(50~200 m2 · g-1),所以其吸附性能较差.
1992年,Mobil 公司的科学家Kresge等(1992)首次在碱性介质中以阳离子表面活性剂作模板剂,用水热晶化法合成具有规整孔道结构和狭窄孔径分布的介孔分子筛系列材料,记作M41s,揭开了分子筛科学的新纪元.介孔分子筛催化剂具有如下特点:表面积大(约1000 m2 · g-1)、吸附容量高、热和水热稳定性良好.但由于纯硅M41s 分子筛具有中性的骨架结构、缺陷少、离子交换能力小、酸含量和酸强度低、反应活性低,因此,限制了它们在催化、吸附、分离和环保等方面的应用.当具有可交换性的金属离子,如钛(豆茂峰等,2008;Mihai et al.,2009;Zhang et al.,2012)、钒(Schulz et al.,2004;Jia et al.,2004)、铝(Cai et al., 2011)等引入骨架后,其缺陷数量增加、吸附性能、酸碱性提高,从而改善其催化性能.过渡金属离子具有可变价性,导致介孔分子筛具有氧化还原性,可作为催化氧化剂.鉴于TiO2与多孔洞材料在环境治理中的广泛应用及各自特点,将TiO2与多孔洞材料通过一定反应相结合,可以获得更高的比表面积及有效吸附位点,使水体中污染物在TiO2表面的吸附优先于表面反应进行,还能够进一步提高对污染物的降解效率.其中,Ti-MCM-41是一种最有吸引力的杂原子介孔分子筛,由于其良好的酸性和氧化还原性能,已被广泛地应用于催化领域,如选择性氧化(Iglesias et al., 2010)、光催化特性(Peng et al., 2011)、酯交换反应(Srinivas et al.,2002)等.根据文献的报道,Ti-MCM-41的合成最常用的方法是水热合成法(Qiao et al.,2004; Herrera et al., 2005;Zou et al., 2008),此方法合成周期长(一般需要1~3 d)、能耗大(120~200 ℃)、制备成本高,难以满足节能环保要求越来越高的社会需求.与传统水热合成法相比,微波的高频率和不同于热传导的加热特性,使得微波具有加热时间快、作用物质受热均匀的特点,且微波技术能明显加快均相成核和结晶的速度,已广泛应用于微波法介孔材料的合成(Celer et al., 2006,Newalkar et al.,2001; Wang et al., 2011).因此,在微波辐射条件下,可以在较短的晶化时间内获得质地均匀的Ti-MCM-41介孔材料,具有快速、节能、环保的特点.
甲基橙是纺织染料中的代表性污染物之一,由于印染废水具有水量大、色度高、成分复杂、可生化性差等特点,一直是废水处理的难点.染料分子中大量苯环的存在和现在染料的良好稳定性,使传统的生物方法在脱色和降解方面的效果并不显著(Hachem et al., 2001; Gogate et al., 2004).因此,本研究应用微波水热法合成Ti-MCM-41,并将XRD、FT-IR、BET、TEM、XPS、Zeta电位等手段用于Ti-MCM-4理化性质、结构特征、催化效率、表面特性的表征测试.同时,以甲基橙作为目标污染物来测试Ti-MCM-41的催化氧化性能,并在不同的pH条件下对甲基橙的催化降解效率进行探讨,并通过Zeta 电位为其提供理论解释.
2 材料与方法(Materials and methods) 2.1 实验材料十六烷基三甲基溴化铵(Hexadecytrimethyl-ammonium bromide,CTAB)、异丙醇钛、甲基橙(Methyl Orange,MO)、硅酸钠溶液购于Sigma-Aldrich公司,氢氧化钠(NaOH)、硫酸(H2SO4)购自成都科龙化工试剂厂,以上试剂为分析纯,去离子水由华南理工大学自制.
2.2 Ti-MCM-41的制备本研究以硅酸钠(Na2SiO3)为硅源,异丙醇钛为钛源,十六烷基三甲基溴化铵(CTAB)为模板剂,采用水热法合成介孔分子筛Ti-MCM-41,其具体过程如下.
将4.25 g CTAB溶解于30 g的去离子水中,磁力搅拌30 min,5.32 g Na2SiO3溶于15 g水中,搅拌20 min,将上述两种溶液混合,磁力搅拌,并用1 mol · L-1的硫酸溶液慢速调节溶液pH至9.5~10.0,再用注射器将异丙醇钛注入溶液中,搅拌180 min后,再用1 mol · L-1硫酸调节溶液pH至9.5~10.0.然后将所得溶液置于微波消解仪(ETHOS1,Milestone,Italy),在100 ℃、120 W的条件下反应180 min,产物经过过滤后用去离子水洗涤至中性,将此前驱体于马弗炉中550 ℃煅烧360 min,冷却后研磨得介孔分子筛,即为微波水热法合成介孔分子筛Ti-MCM-41,记为MWH-Ti-MCM-41;传统水热法合成的Ti-MCM-41则需要在100 ℃下搅拌晶化12 h,过滤后将滤饼于100 ℃烘干5 h.微波水热法合成介孔材料MCM-41,不需要将异丙醇钛加入到CTAB和Na2SiO3的混合溶液中,其余步骤与微波水热法合成Ti-MCM-41相同.
2.3 材料表征Ti-MCM-41样品的官能团采用傅里叶变换红外光谱FTIR(Nicolet 6700)测定,波数范围为4000~400 cm-1,采用KBr 固体压片.样品的晶相采用X-射线衍射仪XRD(Rigaku D/max-2500)检测,以CuKα为放射源(λ=0.15418 nm),其操作条件为:40 kV,100 mA,30 MPa,扫描速度2 ° · min-1,扫描范围1°~10°,衍射数据记录时间间隔为0.01°.样品的外在结构用TEM(JEOL,JEM-100CX-II,Japan)表征,以低温 N2吸附脱附仪(Micromeritics,ASAP2020,USA)作吸附脱附等温线,测定Ti-MCM-41的比表面积和孔径分布.Ti-MCM-41表面元素性质XPS(PHI-1600型电子能谱仪)分析采用MgKα(1253.6 eV)作为激发光源,功率为300 W,以C1s(284.98 eV)作为校正电荷.
用去离子水把MWH-Ti-MCM-41配成10 mg · L-1的溶液,超声振荡1 h,使MWH-Ti-MCM-41 均匀分散,再用盐酸或氢氧化钠调节pH值,配制序列不同pH的MWH-Ti-MCM-41溶液,再用Zeta电位分析仪(Zatasizer Nano ZS90)测量MWH-Ti-MCM-41溶液在不同pH值的Zeta电位.
2.4 甲基橙的催化降解本实验中的光催化降解,其催化反应在密闭的黑箱中进行.光源采用250 W金卤灯,金卤灯置于石英冷阱中,两层管壁间接入循环冷却水,以保证反应过程中温度的基本稳定.将此玻璃管置于500 mL烧杯中,烧杯内加入 300 mL的甲基橙(10 mg · L-1)溶液及0.3 g的合成材料MWH-Ti-MCM-41.先于暗箱中以磁石搅拌1 h,以达到吸附平衡,随后开灯进行光降解.整个反应中,每10 min采样1次,将所采的样过滤后进行吸光度测试,以紫外可见分光光度计(Shimadzu,UV-1750)分析降解效果.
3 结果与讨论(Results and discussion) 3.1 FTIR光谱分析图 1为微波水热法合成的Ti-MCM-41(MWH-Ti-MCM-41)及传统水热法合成的Ti-MCM-41(TH-Ti-MCM-41)的FTIR图谱.由图 1可知,1620 cm-1处出现的吸收峰是由水分子的变形振动引起的;476 cm-1和810 cm-1附近的吸收峰则归属于Si—O伸缩振动和Si—O四面体弯曲振动,其中,把970 cm-1的吸收峰归属于可能存在的骨架钛的 Ti—O—Si的振动吸收,可作为其振动特征峰,表明杂原子进入了分子筛的骨架结构(Uphade et al., 2001;Deyanira et al., 2008).但文献报道,纯硅介孔分子筛的无定形骨架结构的表面的大量Si—OH 在960 cm-1处也有吸收,比较合理的解释是Ti—O—Si 键的振动和Si—OH的伸缩振动共同作用的结果(Prasad et al., 2006).由FTIR分析结果可知,这两种方法合成的Ti-MCM-41的基团并没有太大的差异.
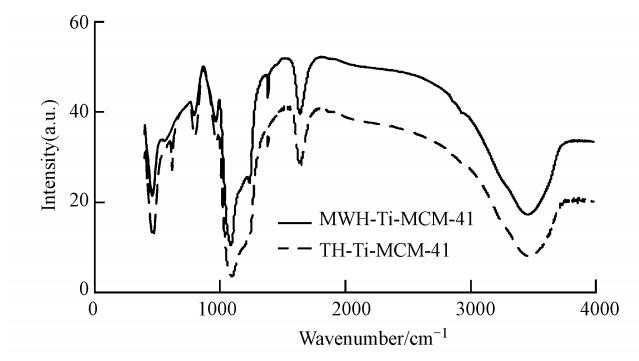 |
| 图 1 MWH-Ti-MCM-41和TH-Ti-MCM-41红外光谱图 Fig. 1 FTIR Spectra of MWH-Ti-MCM-41 and TH-Ti-MCM-41 |
MWH-Ti-MCM-41的XRD分析结果如图 2所示.由图可知,在2θ为1°~6°范围内出现了明显的(100)、(110)、(200)和(210)晶面的特征衍射峰,这正是MCM-41分子筛的六方相特征衍射峰.XRD 衍射谱在2θ = 2.2°处显示出强的(100)衍射峰,属于MCM-41 介孔分子筛的特征峰(Srinivas et al., 2002).从图 2中可知,该峰相当尖锐,说明该材料的结晶度良好.同时,2θ=3.7°、4.3°和5.6°附近有衍射峰,这些衍射峰的存在表明了该分子筛具有较好的六方结构,是长程有序的介孔材料(Blasco et al.,1995).
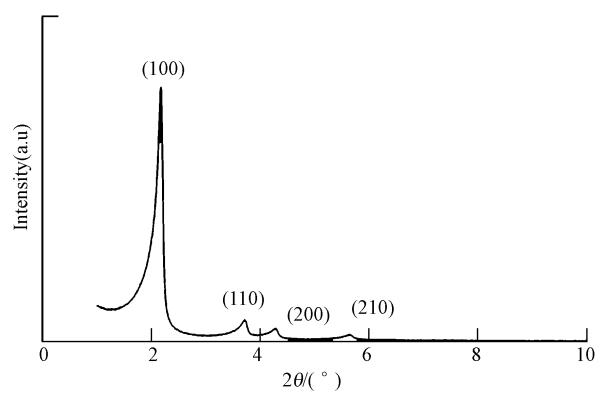 |
| 图 2 MWH-Ti-MCM-41的XRD谱图 Fig. 2 XRD patterns of MWH-Ti-MCM-41 |
图 3为微波水热法合成的MWH-Ti-MCM-41及MWH-MCM-41的TEM图.由图可知,MWH-Ti-MCM-41较好地保持了MWH-MCM-41原有的多孔洞结构,孔洞结构完好紧致,排列有序,展现出典型的六方相规整孔道结构,在孔道轴向方向呈现出致密的蜂巢状结构,在孔道径向方向则呈现出长孔状结构.MWH-Ti-MCM-41孔道尺寸均一,说明其在净化过程中的稳定结构和良好吸附能力.从图中可测得孔洞直径约为2~5 nm,处于介孔材料的孔径范围内.从图 3a中也可以看出,由于钛的掺杂,并未导致 MCM-41 分子筛孔径的变化.这与Schacht等(2004)和Kovalchuk等(2005)的研究结果一致.
 |
| 图 3 MWH-Ti-MCM-41(a)和MWH-MCM-41(b)TEM图 Fig. 3 TEM image of MWH-Ti-MCM-41(a) and MWH-MCM-41(b) |
由图 4可知,MHW-Ti-MCM-41的吸附等温曲线存在吸附滞后回环现象,说明有中孔存在(Mihai et al., 2009;Shi et al., 2011).根据IUPAC的分类,MHW-Ti-MCM-41于吸附材料中属于类型IV(Lim et al., 2002),为毛细凝结的单层吸附.N2 吸脱附实验结果显示,相较于一般介孔材料(直径2~50 nm)(Lim et al., 2002),Ti-MCM-41样品的孔径分布较窄,约为 3~5 nm.在较低的相对压力下(p/p0<0.3),N2吸附量随相对压力的升高而缓慢增加,这个是N2在分子筛孔道表面的单层到多层的吸附过程;在中压阶段(p/p0 = 0.3~0.45时),N2吸附量随相对压力的升高而急剧增加,吸附曲线出现明显的突越,这与介孔分子筛孔道的毛细管现象有关;在高压阶段(p/p0>0.6)产生的吸附表明,在毛细管内N2的吸附达到了饱和状态.图 4也显示了在接近饱和蒸汽压(p/p0 = 0.9)时,吸附等温曲线上出现了突越,此现象是由孔内的二次毛细凝聚现象引起的.由BET实验数据可知,MHW-Ti-MCM-41的平均孔径为 4.70 nm,参杂钛后,样品的孔隙度明显提高.综合比对,氮气吸脱附实验结果与TEM结果是相一致的,即材料的孔洞直径约为3~5 nm,这与未掺杂钛的MCM-41的孔径一般为2.0~6.5 nm相近,也与Morey等(1997)的研究相一致.这是因为MCM-41分子筛的孔壁比沸石分子筛的孔壁薄,杂原子不可能全部进入分子筛的骨架,这样就有部分金属离子暴露在分子筛孔壁的表面,掺杂的金属离子与表面羟基及孔壁之间相互作用,会导致 MCM-41 分子筛孔径的变化,但变化不大.
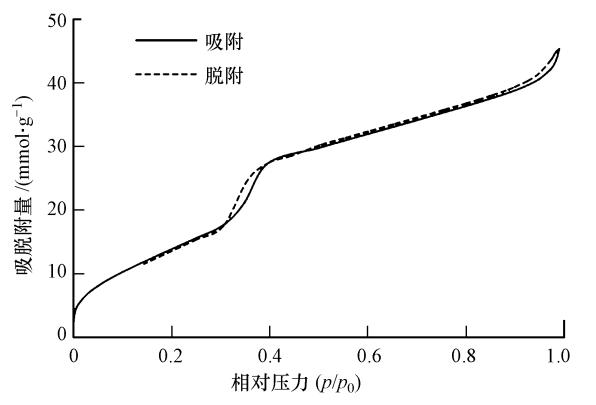 |
| 图 4 MWH-Ti-MCM-41的N2低温吸附-脱附曲线 Fig. 4 Nitrogen adsorption-desorption isotherms of MWH-Ti-MCM-41 |
Ti-MCM-41 分子筛的XPS表征结果显示,Ti 2p3/2的结合能在四面体配位 Ti(IV)中心和八面体配位的锐钛矿型 TiO2中分别为(459.9±0.1)eV和(458.5±0.1)eV,其间相差大于1 eV(Blasco et al., 1995).从图 5中可知,MWH-Ti-MCM-41 分子筛中 Ti 2p3/2的结合能为 458.8 eV,介于这两者之间,这说明分子筛中可能存在八面体配位的锐钛矿型 TiO2和四面体配位钛共存的结构.Ti 2p的出现也证实了钛元素已经成功地掺杂到MCM-41的结构中,其中,Ti的质量分数为0.10%(表 1).Joshi等(2008)对Ti-MCM-41的测定结果为Ti的原子百分数为0.34%;Wang等(2012)测定Ti掺杂的介孔洞材料中Ti的质量百分数为0.6%,其结论与本研究相似.
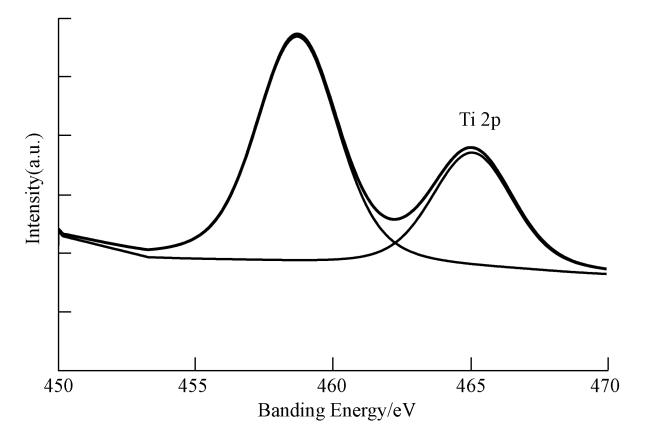 |
| 图 5 MWH-Ti-MCM-41的 Ti 2p XPS 谱图 Fig. 5 Ti 2p XPS spectra of MWH-Ti-MCM-41 |
| 表1 MWH-Ti-MCM-41的XPS分析元素含量 Table.1 Element content results of XPS analysis for MWH-Ti-MCM-41 |
为了解MWH-Ti-MCM-41对甲基橙的吸附平衡时间,本研究进行了1440 min的暗箱吸附实验(MWH-Ti-MCM-41/MO =1 g · L-1).从图 6中可知,反应60 min后,基本达到吸附平衡,其对甲基橙的吸附去除率约为40%.因此,在往后的甲基橙光催化降解实验中,皆先进行60 min暗反应,达到吸附平衡后再开灯进行光催化反应.
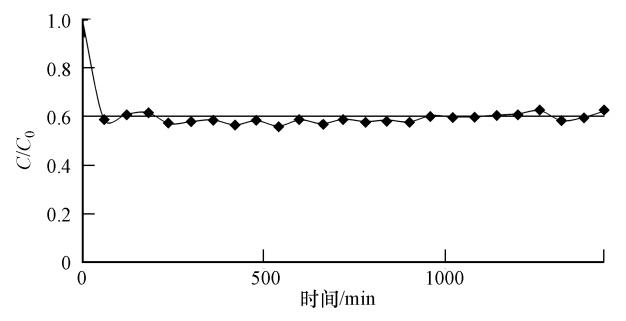 |
| 图 6 MWH-Ti-MCM-41对甲基橙的吸附 Fig. 6 Methyl Orange absorption spectra of MWH-Ti-MCM-41 |
不同pH值下甲基橙的去除率变化情况如图 7所示.在pH值为3、7和11时,暗反应的吸附去除率分别为40%、35%和30%.开灯反应90 min后,pH=3时,甲基橙的去除率从40%增加到83%;而在pH=7和11时,其去除率只提高10%. 通过比较可以得出,在pH=3时,MWH-Ti-MCM-41对甲基橙的去除率明显大于pH=7和11时.可见,pH值对甲基橙的吸附去除的影响比较大.方世杰等(2001)及李明玉等(2009)利用TiO2作为光催化剂降解甲基橙的实验也证实了在酸性条件下甲基橙的降解速率比在碱性条件下较佳.
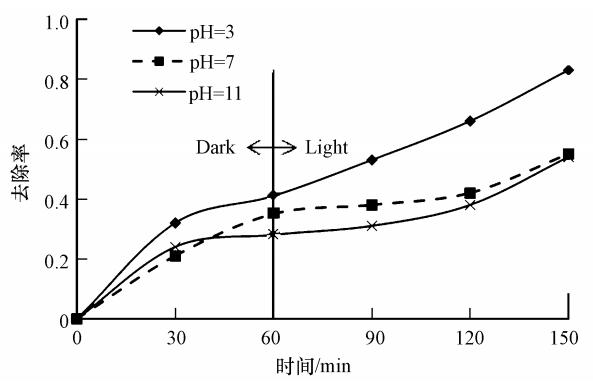 |
| 图 7 不同pH下甲基橙的降解去除情况 Fig. 7 Photocatalytic degradation spectra of MO with different pHs |
本研究测试了pH=3时,MWH-Ti-MCM-41和MWH-MCM-41对甲基橙溶液的去除效率.其中,甲基橙起始浓度为10 mg · L-1,催化剂的浓度为1 g · L-1,以250 W金卤灯作为光源.从图 8中可知,暗反应60 min后达到吸附平衡,MWH-Ti-MCM-41、MWH-MCM-41的吸附去除率分别为30%和37%.这与材料的比表面积有关,如表 2所示,MWH-MCM-41和MWH-Ti-MCM-41的比表面积分 别为1239.2和1021 m2 · g-1,当比表面积越大时,材料的吸附去除率越大,本研究结果与Surachai等(2009)的实验结果相类似.
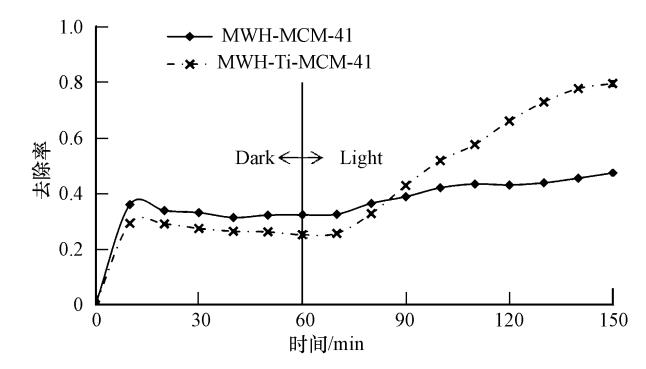 |
| 图 8 pH=3时不同材料降解甲基橙的情况 Fig. 8 Photocatalytic degradation spectra of MO with different materials |
| 表2 TiO2、MWH-Ti-MCM-41和MWH-MCM-41的结构参数 Table.2 The structure parameter of TiO2,MWH-Ti-MCM-41 and MWH-MCM-41 |
此实验表明,在同样的实验条件下,MWH-Ti-MCM-41的催化降解效率明显比不含钛的MWH-MCM-41高.这是因为随着Ti的引入,增加了缺陷数量,从而提高了反应活性(Chao et al.,2004).同时由于金属离子的可交换性,可提高表面的吸附性能,从而改善其催化性能.
由于钛属于半导体,半导体的能带结构是由填满电子的低能价带(Valence B and ,VB)和空的高能导带(Conduction B and ,CB)构成,价带和导带之间存在禁带.半导体的禁带宽度一般在 3.0 eV 以下.当能量大于或等于禁带(hν≥Eg)的光照射到半导体时,处于价带的电子就可跃迁到导带上,即产生电子-空穴对.纳米级的TiO2在紫外光的照射下,由于吸收了光能而产生电子空穴对.这些空穴对会迅速迁移至表面,并激活其表面附着的H2O与O2而产生氢氧自由基(.OH),其机理方程式如下:

此外,本研究的光催化反应为异相反应(heterogeneous reaction),即液相中染料与固体材料接触时,才会发生降解反应,因此,吸附在Ti-MCM-41上的染料分子会最先被降解.
3.6.3 Zeta电位本研究以zeta电位分析MWH-Ti-MCM-41的等电位点(Iso-electric point,IEP),解析MWH-Ti-MCM-41的最佳光催化反应pH范围.从图 9中可以看到,材料表面带电性随着pH的升高而降低,当pH=2.8时出现等电位点,之后Zeta 电位变得越来越负,所需要的降解时间也越来越长.这是因为当在低pH值时,材料表面带正电,和光催化产生的电子结合,减少了电子和空穴的结合,从而提高了其氧化效率,所以降解速率比较快.反之,当在高pH值时,材料表面带负电,增加了电子,加速了电子和空穴的结合,从而降低了其氧化效率,所以降解速率比较慢.本研究Zeta电位的结果也印证了3.6.1节不同pH下甲基橙光催化降解的结果(图 7).
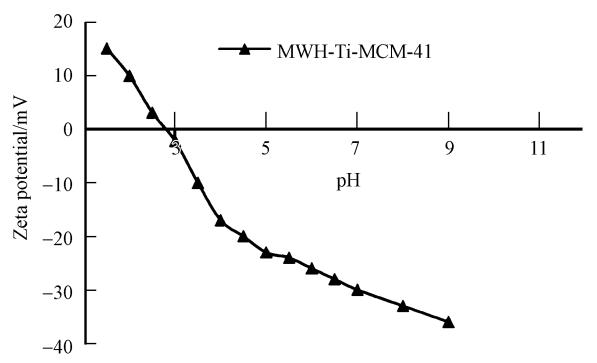 |
| 图 9 pH与Zeta电位关系图 Fig. 9 Plots of pH vs Zeta potential |
本研究以微波水热法制备了掺Ti的介孔Ti-MCM-41 光触媒,并对该材料进行表征及光催化实验.TEM表征结果证实了MWH-Ti-MCM-41具有长程有序的六方结构;FTIR、XPS等表征结果表明,大部分Ti进入分子筛的骨架结构.引入微波水热法代替传统水热法制备Ti-MCM-41 分子筛,具有操作简单,缩短操作时间而不改变其结构的优势.以甲基橙为光催化降解的目标污染物,结果表明,在酸性的条件下MWH-Ti-MCM-41具有较高的催化效率,此与Zeta 电位的结果相符.
| [1] | Artkla S, Wantala K, Srinameb B, et al. 2009. Characteristics and photocatalytic degradation of methyl orange on Ti-RH-MCM-41 and TiO2/RH-MCM-41[J]. Korean Journal of Chemical Engineering, 26(6): 1556-1562 |
| [2] | Bao N Z, Shen L M, Takata T, et al. 2007. Self-templated synthesis of nanoporous CdS nanostructures for highly efficient photocatalytic hydrogen production under visible light[J]. Chemistry of Materials, 20(1): 110-117 |
| [3] | Blasco T, Corma A, Navarro M T et al. 1995. Synthesis, characterization and catalytic activity of Ti-MCM-41 structures[J]. Journal of Catalysis, 156(1): 65-74 |
| [4] | Cai C, Wang H, Han J Y. 2011. Synthesis and characterization of ionic liquid-functionalized alumino-silicate MCM-41 hybrid mesoporous materials[J]. Applied Surface Science, 257(23): 9802-9808 |
| [5] | Celer E B, Jaroniec M. 2006. Temperature-programmed microwave-assisted synthesis of SBA-15 ordered mesoporous silica[J]. Journal of the Americal Chemical Society, 128(44): 14408-14414 |
| [6] | Chakrabarti S, Dutta B K. 2004. Photocatalytic degradation of model textile dyes in wastewater using ZnO as semiconductor catalyst[J]. Journal of Hazardous Materials, 112(3): 269-278 |
| [7] | Chao M C, Lin H P, Mou C Y, et al. 2004. Synthesis of nano-sized mesoporous silicas with metal incorporation[J]. Catalysis Today, 97(1): 81-87 |
| [8] | Deyanira A B, Guillermo N S, Leticia L R, et al. 2008. Titanium-modified MCM-41 prepared by ultrasound and by hydrothermal treatment, catalysts for acetylation reactions[J]. Journal of the Mexican Chemical Society, 52(3): 175-180 |
| [9] | 豆茂峰, 金胜明, 付英, 等. 2008. 介孔分子筛Ti-MCM-41的制备和结构[J]. 硅酸盐学报, 36(1): 65-68 |
| [10] | 方世杰, 徐明霞, 黄卫友, 等. 2001. 纳米Ti02光催化降解甲基橙[J].硅酸盐学报, 29(5): 439-442 |
| [11] | Fujishima A, Honda K. 1972. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 238(5358): 37-38 |
| [12] | Gogate P R, Pandit A B. 2004. A review of imperative technologies for wastewater treatment I: oxidation technologies at ambient conditions [J]. Advances in Environmental Research, 8(3/4): 501-551 |
| [13] | Hachem C, Bocquillon F, ZahraaO, et al. 2001. Decolourization of textile industry wastewater by the photocatalytic degradation process[J]. Dyes and Pigments, 49(2): 117-125 |
| [14] | Herrera J M, Reyes J, Roquero P, et al. 2005. New hydrotreating NiMo catalysts supported on MCM-41 modified with phosphorus [J]. Microporous and Mesoporous Materials, 83(1/3): 283-291 |
| [15] | Iglesias J, Melero J A, Snchez-Sanchez M. 2010. Highly Ti-loaded MCM-41: Effect of the metal precursor and loading on the titanium distribution and on the catalytic activity in different oxidation processes[J]. Microporous and Mesoporous Materiels, 132(1/2): 112-120 |
| [16] | Jang J S, Joshi U A, Lee J S. 2007. Solvothermal synthesis of CdS nanowires for photocatalytic hydrogen and electricity production[J]. Journal of Physical Chemistry C, 111(35): 13280-13287 |
| [17] | Jia M J, Valenzuela R X, Amoros P, et al. 2004. Direct oxidation of isobutane to methacrolein over V-MCM-41 catalysts[J]. Catalysis Today, 91-92: 43-47 |
| [18] | Joshi U A, Choi S H, Jum S J, et al. 2008. Transesterification of dimethylcarbonate and phenol over silica supported TiO2 and Ti-MCM-41 catalysts: structure insensitivity[J]. Catalysis Letters, 123(1/2): 115-122 |
| [19] | Ko S H, Lee D, Kang H W, et al. 2011. Nanoforest of hydrothermally grown hierarchical ZnO nanowires for a high efficiency dye-sensitized solar cell[J]. Nano Letters, 11(2): 666-671 |
| [20] | Kovalchuk T V, Sfihi H, Korchev A S, et al. 2005. Synthesis, structure, and acidic properties of MCM-41 functionalized with phosphate and titanium phosphate groups[J]. Journal of Physical Chemistry, B109(29): 13948-13956 |
| [21] | Kresge C T, Leonowicz M E, Roth W J, et al. 1992. Ordered mesoporous molecular sieves synthesized by a liquid-crystal template mechanism[J]. Nature, 359(6397): 710-712 |
| [22] | 李明玉, 尚薇, 王心乐, 等. 2009. 光电化学协同催化降解甲基橙的研究[J]. 中国环境科学, 29(5): 512-517 |
| [23] | Lim S, Haller G L. 2002. Preparation of highly ordered vanadium-substituted MCM-41: stability and acidic properties[J]. Journal of Physical Chemistry B, 106(33): 8437-8440 |
| [24] | Mihai G D, Meynen V, Beyers E, et al. 2009. Synthesis, structural characterization and photocatalytic activity of Ti-MCM-41 mesoporous molecular sieves[J]. Journal of Porous Materials, 16(1): 109-118 |
| [25] | Morey M, Davidson A, Eckert H, et al. 1996. Pseudotetrahedral O3/2V=O centers immobilized on the walls of a mesoporous, cubic MCM-48 support: preparation, characterization, and reactivity toward water as investigated by51V NMR and UV-vis spectroscopies[J]. Chemistry of Materials, 8(2): 486-492 |
| [26] | Newalkar B L, Olanrewaju J, Komarneni S. 2001. Direct synthesis of titanium-substituted mesoporous SBA-15 molecular sieve under microwave-hydrothermal conditions [J]. Chemistry of Materials, 13(2): 552-557 |
| [27] | Peng R, Zhao D, Dimitrijevic N M, et al. 2011. Room temperature synthesis of Ti-MCM-48 and Ti-MCM-41 mesoporous materials and their performance on photocatalytic splitting of water[J]. Journal of Physical Chemical C, 116(1): 1605-1613 |
| [28] | Prasad M R, Madhavi G, Rao A R, et al. 2006. Synthesis, characterization of high Ti-containing Ti-MCM-41 catalysts and their activity evaluation in oxidation of cyclohexene and epoxidation of higher olefins[J]. Journal of Porous Materials, 13(1): 81-94 |
| [29] | Qiao S Z, Bhatia S K, Nicholson D. 2004. Study of hexane adsorption in nanoporous MCM-41 silica[J]. Langmuir, 20(2): 389-395 |
| [30] | Santato C, Odziemkowski M, Ulmann M, et al. 2001. Crystallographically oriented mesoporous WO3 films: synthesis, characterization, and applications[J]. Journal of the America Chemical Society, 123(43): 10639-10649 |
| [31] | Schacht P, Norea-Franco L, Ancheyta J, et al. 2004. Characterization of hydrothermally treated MCM-41 and Ti-MCM-41 molecular sieves[J]. Catalysis Today, 98(1/2): 115-121 |
| [32] | Schulz P C, Morini M A, Palomeque M, et al. 2002. Vanadium (V)-doped MCM-41 synthesised by a novel one-step procedure[J]. Colloid Polymer Science, 280(4): 322-327 |
| [33] | Shi Y, Wang S P, Ma X B. 2011. Microwave preparation of Ti-containing mesoporous materials. Application as catalysts for transesterification[J]. Chemical Engineering Journal, 166(2): 744-750 |
| [34] | Su J Z, Guo L J, Bao N Z, et al. 2011. Nanostructured WO3/BiVO4 heterojunction films for efficient photoelectrochemical water splitting [J]. Nano Letters, 11(5): 1928-1933 |
| [35] | Srinivas N, Rani V R, Kulkarni S J, et al. 2002. Liquid phase oxidation of anthracene and trans-stilbene over modified mesoporous (MCM-41) molecular sieves[J]. Journal of Molecular Catalysis (A: Chemical), 179(1/2): 221-231 |
| [36] | Tachikawa T, Fujitsuka M, Majima T. 2007. Mechanistic insight into the TiO2 photocatalytic reactions: Design of new photocatalysts[J]. Journal of Physical Chemical C, 111(14): 5259-5275 |
| [37] | Uphade B S, Yamada Y, Akita T, et al. 2001. Synthesis and characterization of Ti-MCM-41 and vapor-phase epoxidation of propylene using H2 and O2 over Au/Ti-MCM-41[J]. Applied Catalysis (A: General), 215(1/2): 137-148 |
| [38] | Wang S P, Shi Y, Ma X B. 2012. Effect of sulfate modification on structure properties, surface acidity, and transesterification catalytic performance of titanium-submitted mesoporous molecular sieve[J]. Industrial & Engineering Chemistry Research, 51(16): 5737-5742 |
| [39] | Wang Y R, Guo Y J, Wang G J. 2011. Synthesis, characterization and catalytic activities of bimetallic modified MCM-41 for epoxidation of styrene[J]. Journal of Sol-Gel Science Technology, 57(2): 185-192 |
| [40] | Xie Y B, Yuan C W. 2004. Photocatalytic degradation of rhodamine B by dye-sensitized TiO2 under visible-light irradiation[J]. Applied Surface Science, 221(1/4): 23-24 |
| [41] | Zhang J, Zhao D S, Liu M S, et al. 2012. The synthesis and characterization of Ti-MCM-41 by microwave Radiation [J]. Advances in Materials Research, 557: 1411-1414 |
| [42] | Zou J J, Zhang M Y, Zhu B, et al. 2008. Isomerization of norbornadiene to quadricyclane using Ti-containing MCM-41 as photocatalysts[J]. Catalysis Letters, 124(1/2): 139-145 |
 2014, Vol. 34
2014, Vol. 34


