2. 中山大学化学与化学工程学院, 广州 510275
2. School of Chemistry and Chemical Engineering, Sun Yat-sen University, Guangzhou 510275
水环境质量在线监测系统中要用到诸多传感器,这些传感器需要在外部电源供能的条件下才能正常工作,如pH计、电导率仪等(蔡强等,2004).但许多需长期监测的偏远地区则面临着电源不易提供甚至电池更换困难、光源不足无法使用太阳能电池或者存在易燃易爆等危险场合的问题,传统的供电方式无法满足要求.微生物燃料电池(Microbial fuel cell,MFC)可在降解水中有机物的同时向外输出电能,近年来随着研究的深入,已经有多种不同体积、不同构型的MFC反应器的相关报道(骆海萍等,2008;Logan,2010;汪家权等,2011).其中,在mL以下甚至μL级的MFC具有以下优点(Wang et al., 2011;Qian et al., 2011a):①可利用多种有机物在常温状态下实现稳定的电能输出;②消除了浓度梯度造成的不利影响,有机物传递过程迅速;③比表面积更大,由mL减小到μL其比表面积可提高103倍,这有可能产生极高的体积功率密度或者面积功率密度;④启动时间较短,有的只有~6 h即可达到稳定.考虑到传感器所需的外部电源往往较小,有的仅仅在nW~μW范围内,因此,有可能采用微型MFC或者MFC芯片阵列的方式产生电能,为特定的传感器监测水质变化服务.目前构建的μL级MFC芯片中通常采用纯菌种如Shewanella sp.,阳极为贵重金属如Au(Qian et al., 2011b),这不仅制作成本较高,而且纯菌种在复杂环境条件下不易存活和保持稳定.因此,本文采用混合菌种和活性炭阳极构建了μL级的MFC芯片,探讨其产电特性,以期为未来可能的传感器外部电源研发提供参考.
2 实验方法(Methods) 2.1 MFC芯片的构建采用双室MFC芯片,具体如图 1 所示.阴阳极室的结构相同,尺寸均为10.0 mm×5.0 mm×100 μm(长×宽×厚),体积均为5.0 μL,中间用质子交换膜(Nafion 117,美国杜邦)分隔,阴阳室及PEM膜之间均设置硅胶垫圈以防止反应液泄漏,垫圈的厚度为1.0 mm,故阴阳室的实际体积均为50.0 μL(10.0 mm×5.0 mm×1.0 mm).阳极是以不锈钢网(304型,60目×60目)作基体,Nafion溶液作粘合剂,将用量约1 mg · cm-2的活性炭(自制)均匀涂在不锈钢网的两面制备而成,最终阳极的具体尺寸为5.4 mm×4.1 mm×0.3 mm(长×宽×厚),阳极体积为6.6 mm3;阴极由聚苯胺和一定量的碳纳米管(成都有机所)粘合在泡沫镍上制备而成,尺寸为4 mm×4 mm×0.1 mm(长×宽×厚),阴极体积为1.6 mm3.双室MFC芯片加入阴阳极后,阳极室的有效体积为43.0 μL,阴极室的有效体积为49.0 μL.阴阳极用钛丝连接,外部电路加以10 kΩ电阻,外电路的电流信号通过皮安表(keithly 6485,美国)采集后传输至计算机记录分析,采集频率为5 min · 次-1.在实验过程中避免强光照射MFC芯片,实验温度为室温(23~27 ℃).
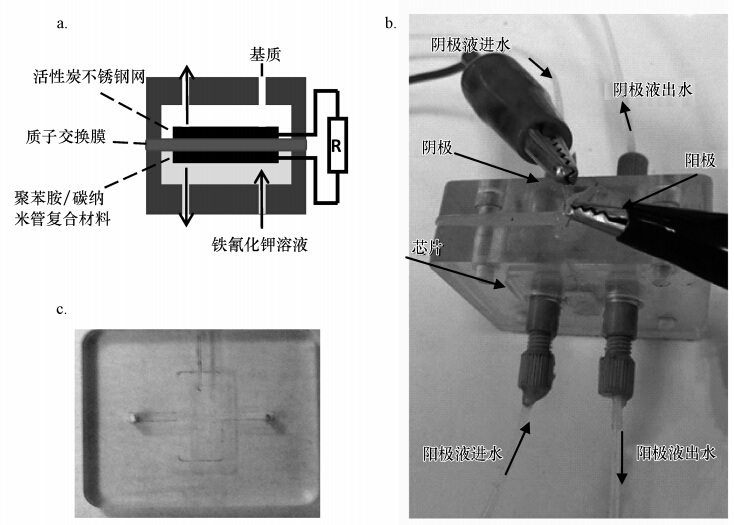 |
| 图 1 MFC芯片结构示意及实物图 (a.芯片结构示意,b.芯片的单个阴/阳极室,c.芯片) Fig. 1 Schematic structure of the MFC chip and its prototype (a. schematic structure, b. the anode-chamber in the MFC chip, c. prototype of the MFC chip) |
阳极接种菌液为本实验室长期运行稳定的微生物电解池阳极液(城市污水接种,无纯化措施),在启动阶段菌液与基质按1 ∶ 1(体积比投加),基质成分为:1 g · L-1乙酸钠、50 mmol · L-1磷酸盐缓冲溶液、维他命(12.5 mL · L-1)和微量元素(12.5 mL · L-1)(Liu et al., 2011).经过50 h后MFC芯片出现重复性良好的产电曲线,即开始正常的试验运行.在正常运行中,阳极液为1 g · L-1乙酸钠+50 mmol · L-1磷酸盐缓冲溶液,阴极液为50 mmol · L-1 K3Fe(CN)6+100 mmol · L-1磷酸盐缓冲液(Ringeisen et al., 2006).
2.3 测量与计算电流密度及功率密度均按阴极截面积(0.16 cm2,4 mm×4 mm)进行计算.
极化曲线:采用恒电位法,每个完整的周期内附加不同阻值(1、10、30、100、200、500、2000 kΩ)的外电阻,通过皮安表采集电流数据进行计算;测量在MFC芯片到达最高产电平台期(即体系稳态)时进行.MFC芯片的库仑效率(CE)按以下公式进行计算(梁鹏等,2009):
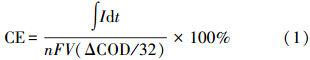
式中,∫Idt为MFC芯片一个周期内产电总库伦量(C),n为每摩尔O2氧化产生的电子量(4e- mol · mol-1),F为法拉第常数(取值为96500 C · mol-1),V为阳极室里基质的体积(L),(ΔCOD/32)即COD转换成相应O2的摩尔浓度(mol · L-1).
电化学阻抗分析(EIS):阴极作为工作电极,阳极作为参比电极和对电极(冯玉杰等,2010),扫描频率范围从100 kHz到5 mHz,振幅为10 mV,等效电路拟合软件为ZSimpWin 3.10.
冷场发射扫描电镜(JSM-6330F)扫描:对刚制备好的阴、阳极及运行2周以上的阴、阳极进行形貌分析(罗勇等,2010).阳极生物预处理步骤如下:①将样品置于2.5%戊二醛(体积为样品的30倍)浸泡溶液中3 h以上;②置于0.1 mol · L-1磷酸缓冲液浸泡4次,20 min · 次-1;③依次分别浸泡于30%酒精1次(15 min · 次-1),50%酒精1次(15 min · 次-1),70%酒精1次(12 h · 次-1),90%酒精1次(15 min · 次-1),100%酒精3次(15 min · 次-1),④置于叔丁醇液体中浸泡3次,15 min · 次-1;⑤冷冻干燥3 h以上.将准备好的样品镀金处理,SEM工作电压10 kV.
3 结果与讨论(Results and discussion) 3.1 MFC芯片的产电特性MFC芯片在启动后连续运行的7个周期的产电曲线如图 2a所示.从图中可以看出,MFC芯片可稳定地向外输出电能,此时外电阻为10 kΩ,最大输出电流达到3.5 μA,相应最大输出电压为35 mV,平均运行周期为8.0 h,但运行周期和最大电压随不同周期而略有变化,这可能与环境温度及阳极微生物活性相关.MFC芯片在无阳极微生物时的对照电流背景值为26 nA,远小于其稳定运行时的电流值,这表明外电路中的电流主要是由芯片中阳极产电微生物的作用产生的,库仑效率为26%(平均值),且随基质的更换而呈现出较好的重现性.MFC芯片的极化曲线如图 2b所示,其最大输出功率约为160 nW,最大功率密度为10.2 mW · m-2,最大电流密度为190 mA · m-2,开路电压达到0.4 V.
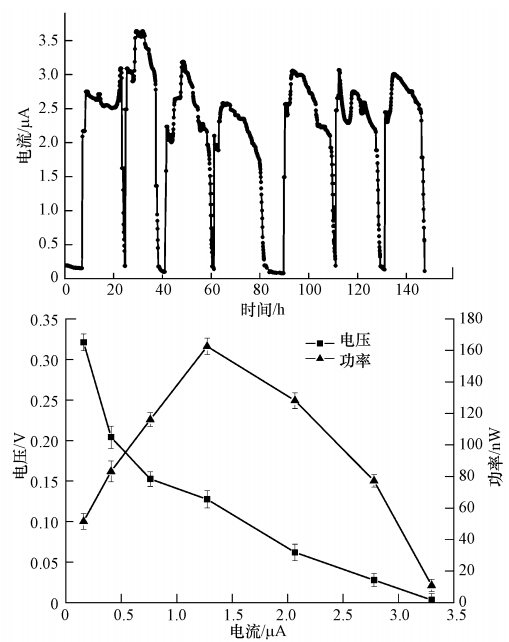 |
| 图 2 MFC芯片的产电曲线(a)和极化曲线(b) Fig. 2 Bioelectricity generation from the MFC chip(a) and the polarization curve of the MFC chip(b) |
MFC芯片的EIS分析结果如图 3a所示,由2个半圆区(凸)、中间弧区(凹)及低频区尾弧(凹)组成.拟合所得等效电路如图 3b所示,其中,CPE为阴阳极电容(Q),Ra为阳极极化电阻,Rs为欧姆电阻,Rc为阴极极化电阻(Manohar et al., 2008;He et al., 2009).通过拟合得到Ra=18050 Ω,Rs=303 Ω,Rc=17230 Ω,因此,MFC芯片的总内阻(Rin=Ra+Rc+Rs)为35583 Ω,即约35.6 kΩ(表 1).这表明芯片具有较高的内阻,本试验结果与其他文献报道相一致,如Qian等(2009)采用1.5 μL的MFC,接种Shewanella MR1纯菌株,测得的MFC内阻为13 kΩ.μL级MFC的内阻均较高,这可能与较小的电极面积,以及溶液和PEM的电阻随尺度的减小而增大等相关(Qian et al., 2011a; Wang et al., 2011).在MFC芯片总内阻中,阴阳极极化电阻占了绝大部分,这跟阴阳极材料、阴阳极间距及质子交换膜(PEM)有效截面积有关,未来可通过选用其他低电阻高导电性材料制备阴阳极,采用厚度更小、电导率更高的质子交换膜,以及优化芯片构型以降低MFC芯片的内阻,从而提高其产电性能(Manohar et al., 2008;He et al., 2009).
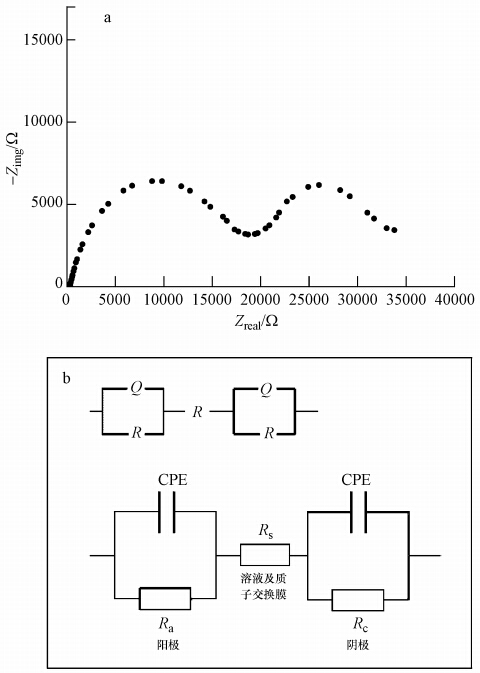 |
| 图 3 MFC芯片的电化学阻抗谱分析(a)及等效电路 (b) (Zimg:虚部(电抗),Zreal:实部(电阻)) Fig. 3 EIS analysis on the MFC chip(a) and the equivalent circuit(b) (Zimg:imaginary part,Zreal:real part) |
| 表 1 等效电路中各元件拟合值 Table 1 Fitting element in the equivalent circuit |
MFC芯片在运行前后其阳极表面形态的电镜照片如图 4所示.从图 4中可以看出,阳极在接种菌液稳定运行之后,表面已被产电微生物附着.考虑到接种菌液为运行稳定的微生物电解池阳极液(以城市污水为启动菌液),其中含有不同性能的菌种,其直接接种至MFC芯片阳极,使得MFC芯片能够稳定产电,这与纯菌种接种相比,接种过程简单且反应器无需灭菌处理,更易于在实际中应用.需要特别指出的是,SEM照片显示的阳极表面微生物量较少,这可能是由于在样品预处理过程中,多次使用到戊二醛、乙醇、叔丁醇等有机溶剂且浸泡时间长,对粘合剂Nafion溶液起到溶解作用,使得阳极表面部分活性炭脱落,导致最终SEM照片中显现较少的微生物量.
 |
| 图 4 MFC芯片阳极运行前后SEM对比 (a.运行稳定的阳极,b.刚制备的阳极) Fig. 4 Comparison on the SEM images of the electrodes after/before MFC-chip operation(a.anode after two weeks running, b.fresh anode) |
本文的50 μL MFC反应器与文献报道的μL级MFC性能对比如表 2所示.与采用纯菌株及Au作阳极的MFC芯片相比,本研究所采用混合菌种及活性炭阳极而制备的MFC芯片其产电性能处于较高水平,且可连续稳定运行至少150 h以上,这表明采用低成本材料作为产电微生物附着的阳极,MFC芯片接种混合菌液完全可行的.考虑到本文所采用的芯片为常规的有机玻璃芯片,而Chen等(2011)通过改进MFC芯片的材料和制作方式,在纯菌种Shewanella MR-1的作用下,将μL级的MFC电流密度提高了一个数量级,这意味着在持续改进本文所采用的芯片材料和制作方法的基础上,采用混合菌种有可能获得比本文结果更高的输出电能.如前所述,虽然本文中MFC芯片的产电性能仍有提升空间,但从应用角度看,其具备的诸如制备简单、对操作环境的条件要求不高、运行较为稳定等优点,未来有可能成为一种野外水质在线监测传感器供能的方式.
| 表 2 不同μL级MFC芯片的性能对比 Table 2 Comparison of micro-liter-scale MFCs in literatures |
1)通过采用混合菌群接种,以活性炭为阳极,构建了阳极体积为50 μL的MFC芯片,发现其稳定运行时的最大输出电流为3.5 μA,平均运行周期为8.0 h,最大输出功率约为160 nW,最大功率密度为10.2 mW · m-2,最大电流密度为190 mA · m-2,开路电压达到0.4 V.
| [1] | 蔡强, 何苗, 施汉昌. 2004. 电化学免疫传感器在环境污染监测中的研究进展[J]. 传感技术学报, 17(3): 526-530 |
| [2] | Chen Y P, Zhao Y, Qiu Q K, et al. 2011. An innovative miniature microbial fuel cell fabricated using photolithography [J]. Biosensors & Bioelectronics, 26(6): 2841-2846 |
| [3] | Chiao M, Lam B K, Lin L W. 2006. Micromachined microbial and photosynthetic fuel cells [J]. Journal of Micromechanics and Microengineering, 16(12): 2547-2553 |
| [4] | Crittenden S R, Sund C J, Sumner J J. 2006. Mediating electron transfer from bacteria to a gold electrode via a self-assembled monolayer [J]. Langmuir, 22(23): 9473-9476 |
| [5] | 冯玉杰, 李贺, 王鑫, 等. 2010. 电化学产电菌的分离及性能评价[J]. 环境科学, 31(11): 2804-2810 |
| [6] | He Z, Florian M. 2009. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies[J]. Energy and Environmental Science, 2(2): 215-219 |
| [7] | Hou H J, Li L, Cho Y, et al. 2009. Microfabricated microbial fuel cell arrays reveal electrochemically active microbes[J]. PLoS ONE, 8(4): e6570 |
| [8] | Hou H J, Li Lei, Figueiredo P D, et al. 2011. Air-cathode microbial fuel cell array: a device for identifying and characterizing electrochemically active microbes[J]. Biosensors & Bioelectronics, 26(5): 2680-2684 |
| [9] | 梁鹏, 黄霞, 范明志, 等. 2009. 双筒型微生物燃料电池产电及污水净化特性的研究[J]. 环境科学, 30(2): 616-620 |
| [10] | Liu G L, Yates M D, Cheng S A, et al. 2011. Examination of microbial fuel cell start-up times with domestic wastewater and additional amendments[J]. Bioresource Technology, 102(15): 7301-7306 |
| [11] | Logan B E. 2010. Scaling up microbial fuel cells and other bioelectrochemical systems[J]. Applied Microbiology and Biotechnology, 85(6): 1665-1671 |
| [12] | 罗勇, 张仁铎, 李婕, 等. 2010. 以吲哚为燃料的微生物燃料电池降解和产电特性[J]. 中国环境科学, 30(6): 770-774 |
| [13] | 骆海萍,刘广立,张仁铎,等.2008.高浓度苯酚的MFC降解及产电性能[J].环境科学学报, 28(11):2181-2185 |
| [14] | Manohar A K, Bretschger O, Nealson K H, et al. 2008. The use of electrochemical impedance spectroscopy (EIS) in the evaluation of the electrochemical properties of a microbial fuel cell [J]. Bioelectrochemistry, 72(2): 149-154 |
| [15] | Qian F, Baum M, Gu Q, et al. 2009. A 1. 5-microliter microbial fuel cell for on-chipbioelectricity generation[J]. Lab on a Chip, 9(21): 3076-3081 |
| [16] | Qian F, Morse D E. 2011a. Miniaturizing microbial fuel cells[J]. Trends in Biotechnology, 29(2): 62-69 |
| [17] | Qian F, He Z, Thelen M P, et al. 2011b. A microfluidic microbial fuel cell fabricated by soft lithography[J]. Bioresource Technology, 102(10): 5836-5840 |
| [18] | Ringeisen B R, Henderson E, Wu P K, et al. 2006. High Power Density from a Miniature Microbial Fuel Cell Using Shewanellaoneidensis DSP10[J]. Environmental Science & Technology, 40(8): 2629-2634 |
| [19] | Siu C P B, Chiao M. 2008. A microfabricated PDMS microbial fuel cell[J]. Journal of Microelectromechanical Systems, 17(6): 1329-1341 |
| [20] | Wang H Y, Bernarda A, Huang C Y, et al. 2011. Micro-sized microbial fuel cell: a mini-review[J]. Bioresource Technology, 102(1): 235-243 |
| [21] | 汪家权,夏雪兰,陈少华,等.2011.两类微生物燃料电池治理硝酸盐废水的实验研究[J].环境科学学报,31(2):254-259 |
 2014, Vol. 34
2014, Vol. 34


