2. 环境保护部南京环境科学研究所, 南京 210042
2. The Environmental Protection Department of Nanjing Institute of Environmental Science, Nanjing 210042
阿特拉津和百草枯均为广谱型除草剂,它们能通过抑制光合作用而达到杀灭杂草的目的,在全世界范围内大量使用.据Roberts等(2002)的报道百草枯在全球范围内已使用约40余年,在全球约100多个国家被批准使用.在我国据陈建军等(2010)的报道,仅2000年阿特拉津的使用量就达2835.2 t,并且每年用量以20%的速度递增.这类除草剂在使农作物获得高产的同时,也对生态环境造成了很大的影响.它们稳定性强,降解缓慢,能在土壤中大量残留(孟顺龙等,2009;苏少泉和耿贺利,2008),并能通过地表径流、淋溶等途径进入地表及地下水中,对水体造成污染,毒害水生生物(Bintein and Devillers, 1996; Eisler,1990).藻类是水体中的初级生产者,也是水体中生物链的基础环节.由于藻类对环境因子变化十分敏感(DeLorenzo et al., 1999),当藻类暴露于有害物时,毒害效应将会对整个水体生态产生影响.因此对藻类的毒害效应常被作为农药环境毒性测试的必须指标(沈宏和周培疆,2002;赵玉艳和蔡磊明,2004).
除草剂对藻类的毒害效应,通常与除草剂的浓度有关,近年来国内外有关除草剂对藻生长影响的报道很多(Sáenz et al., 1997;马建义和陈杰,2000;徐小花等,2008),但目前的研究大多关注于除草剂的暴露浓度,其他环境因子对藻类毒害效应的影响,研究较少.
阿特拉津和百草枯杀灭杂草的主要机理是通过阻断光合作用电子传递,产生氧自由基破坏细胞.不同的光照强度下阿特拉津对藻的毒害作用不同(Mayasich et al. ,1986),对大多数藻而言,较高的光照强度下有较高的毒性(Deblois et al., 2013),不同光照预适应条件下的藻暴露于阿特拉津的毒性反应也不同(Guasch and Sabater, 1998).但目前关于光强对这两种除草剂对藻类毒性的研究报道十分有限,对于百草枯也未见较详细研究报道.
为进一步评价两种除草剂的环境毒害效应,本研究以常见的蓝藻铜绿微囊藻、集胞藻和绿藻蛋白核小球藻、四尾柵藻作为材料,研究了不同光照强度下阿特拉津和百草枯对藻的毒害效应,以期为全面评价除草剂对水生态系统的毒性提供科学数据.
2 材料与方法(Materials and methods) 2.1 实验材料阿特拉津由浙江省长兴第一化工有限公司生产,纯度97%;百草枯由江苏省南京市红太阳生物化学有限责任公司生产,农药母液浓度为30.5%(农药中百草枯的纯度为305 g · L-1).
实验采用的蓝藻藻株有:铜绿微囊藻Microcystis aeruginosa PCC7806(简称“PCC7806”),M. aeruginosa XW01(简称“XW01”),集胞藻Synechocystis PCC6803(简称“PCC6803”);选用的绿藻藻株有:蛋白核小球藻Chlorella pyrenoidosa (简称“小球藻”),四尾柵藻Scenedesmus quadricauda (简称“柵藻”).PCC7806和PCC6803 源自法国巴斯德研究所,其余藻株均为本实验室分离培养.
2.2 实验方法 2.2.1 藻的培养实验所用的培养基及所有器皿均经过121 ℃高压灭菌20 min,实验在无菌条件下进行,所有藻种均用BG-11培养液培养,培养至对数生长期备用.培养温度为25 ℃,由两支40 W日光灯提供光照,通过调节培养三角瓶与灯管间的距离设置不同光照强度.每天定时摇晃3次.
2.2.2 除草剂对藻生长影响的测定农药浓度的设定:基于前期实验测得的毒害浓度范围,用BG-11培养液将阿特拉津稀释到0.01、0.05、0.1、0.5、1.0 mg · L-1,百草枯稀释为浓度0.01、0.05、0.1、1.0、10.0 mg · L-1.将5 mL处于对数生长期的藻液接入装有50 mL培养液的容量为100 mL的锥形瓶中,使OD720的值为0.10左右(初始藻细胞密度约为1.0×104 mL-1),每个浓度设置3个平行实验,以加蒸馏水为空白对照.
不同光照的设定:实验设置两种光照强度,使培养瓶处的光照强度分别调为20(低光强)和50 μmol · m-2 · s-1(高光强).将上述暴露于不同浓度除草剂下的藻分别置于这两种光照强度下培养,间隙摇晃.定时测定藻浓度(OD720).
2.2.3 半效抑制浓度EC50值的测定藻生长抑制率采用光密度法:
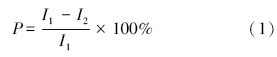
然后建立抑制率(P)和浓度的自然对数(lnC)的线性回归关系,求解抑制率为50%时的EC50值(赵玉艳和蔡磊明,2004).
2.2.4 MDA活性的测定采用硫代巴比妥酸(TBA)法(Stewart and Bewley, 1980)测定.取藻液5.0 mL,离心收集藻细胞,加入5.0 mL(5%)的三氯乙酸,在漩涡振荡仪上充分振荡反应后离心,取2.0 mL上清液,加入2.0 mL(0.6%)TBA.混合物于95 ℃沸水浴上反应10 min,迅速冷却后离心,以0.6% TBA溶液为空白,测定450、532和600 nm处的吸光值(李合生,2000).MDA含量以公式(2)计算:
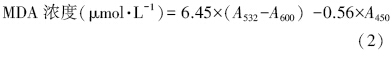
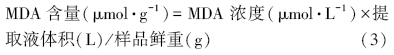
数据采用Excel作图分析,用SPSS 17.0对结果进行方差分析.数据均为3次重复测定值的平均值.
3 结果(Results) 3.1 不同光照强度下阿特拉津对各藻的生长影响由图 1可以看出,阿特拉津对蓝藻PCC7806的毒害作用具有明显的剂量-效应关系,浓度越高,抑制作用就越明显.比较不同光强下的毒害效应可见:在质量浓度为0.5 mg · L-1时,低光强20 μmol · m-2 · s-1下,未表现出明显的生长抑制,而在高光强50 μmol · m-2 · s-1下,有明显的抑制作用.当阿特拉津的质量浓度为1.0 mg · L-1时,高光强下PCC7806的生长几乎被完全抑制.
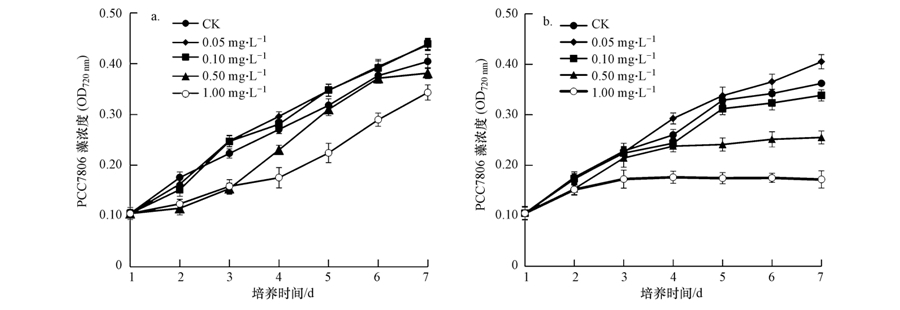 |
| 图 1 不同光照强度下阿特拉津对PCC7806生长的影响(a. 20 μmol · m-2 · s-1;b. 50 μmol · m-2 · s-1) Fig. 1 Effects of different concentrations of atrazine on the growth of Microcystis aeruginosa PCC7806 under different light intensities(a. 20 μmol · m-2 · s-1; b. 50 μmol · m-2 · s-1) |
阿特拉津对绿藻小球藻也显示出与蓝藻相似的毒害效应(图 2),在相同的浓度下,高光强表现出显著的毒害促进作用.
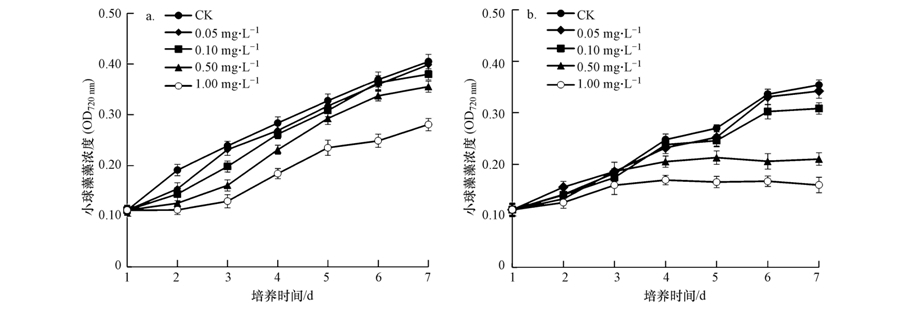 |
| 图 2 不同光照强度下阿特拉津对小球藻生长的影响(a. 20 μmol · m-2 · s-1;b. 50 μmol · m-2 · s-1) Fig. 2 Effects of different concentrations of atrazine on the growth of Chlorella pyrenoidosa under different light intensities(a. 20 μmol · m-2 · s-1; b. 50 μmol · m-2 · s-1) |
通过分别测定阿特拉津和百草枯,在不同光照强度下对5种常见蓝藻和绿藻的生长影响,根据浓度效应曲线,计算出了在不同光照强度下96h-EC50值,列于表 1中.
| 表1 不同光照强度下两种除草剂对5种藻的96 h的毒性值EC50 Table 1 96 h-EC50 of atrazine and paraquat to 5 algal strains under different light intensities |
从表 1中数据可以看出,各藻在相对高光照时的EC50 值要明显小于低光强时的EC50值,在用除草剂阿特拉津处理时,蓝藻中的PCC7806在20 μmol · m-2 · s-1 光照强度下的EC50值是50 μmol · m-2 · s-1光照强度下的1.725倍.另外,在光照强度为20 μmol · m-2 · s-1时,XW01、PCC6803、蛋白核小球藻和四尾柵藻的96 h的EC50值分别比光照强度为50 μmol · m-2 · s-1时高出1.92、2.07、1.73、1.62倍.这表明高光照强度照射下能够促进阿特拉津对各藻的毒性.
光强对百草枯毒害效应的影响与阿特拉津相似,5株藻在高光照强度时的EC50值要明显小于低光照强度时的EC50值,蓝藻PCC7806在20 μmol · m-2 · s-1光照强度下的EC50值是50 μmol · m-2 · s-1光强下的11.8倍.另外,在光照强度为20 μmol · m-2 · s-1 时,XW01、PCC6803、蛋白核小球藻和四尾柵藻96 h-EC50值分别是光照强度50 μmol · m-2 · s-1时的1.84、1.65、2.28、2.43倍.这表明高光强照射能够促进百草枯对各藻的毒性.
3.3 光强对阿特拉津破坏藻细胞生物膜的影响MDA是自由基氧化细胞膜脂的产物,其在细胞中的含量显示了氧化胁迫对细胞膜系统的破坏(Qian et al. ,2009).从图 3中可以看出,在藻细胞暴露于不同浓度阿特拉津24 h后,高光强下两种藻的MDA含量均显著高于低光强(p<0.01).说明在高光强下,同样浓度的阿特拉津可产生更多的自由基,对藻细胞的生物膜系统产生较大的伤害.
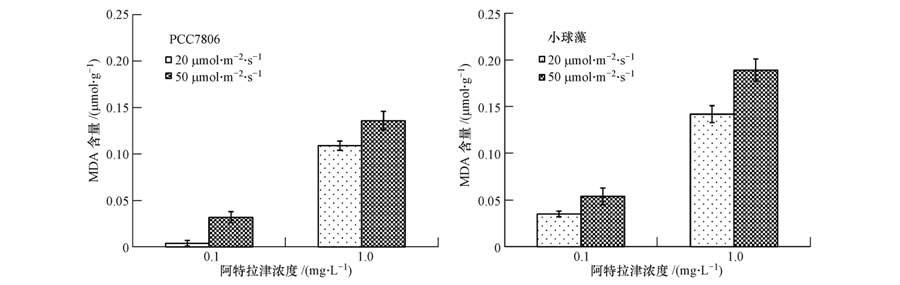 |
| 图 3 不同光强下阿特拉津对PCC7806和小球藻MDA含量的影响 Fig. 3 Effects of atrazine on MDA contents of Microcystis aeruginosa PCC7806 and Chlorella pyrenoidosa under different light intensities |
除草剂阿特拉津和百草枯均为光合作用抑制剂,阿特拉津为典型的光合系统Ⅱ抑制剂,百草枯为典型的光合系统Ⅰ抑制剂.这两种除草剂毒性的发挥均与光合作用电子传递有关,通过阻挡光合体系中电子的转移而阻止光化合成反应(Forney and Davis, 1981).同时,由于电子传递链的阻断,藻细胞吸收的光能,可转化成高能的氧自由基等有害成分,毒害细胞.在一定的光强范围内,光照强度越大,植物细胞吸收的光能越多,如光合电子传递链被阻断,溢出的能量可产生大量的自由基.因此,较高的光照强度理应促进这类除草剂毒性的作用,本文的实验结果与这一机理吻合,与对水生高等植物的毒害效应一致(Brain et al., 2012).Deblois等(2013)对10种藻类光电子传递过程的研究也显示,高光强促进了阿特拉津对藻类的毒害.但在Mayasich等(1986)的研究中,低光强下阿特拉津对绿藻Nannochloris oculata 和硅藻Phaeodactylum tricornutum的毒害性更强,其原因解释为这两种藻在适宜的光强下积累较多的抗损伤成分.这也说明除草剂对不同藻的毒害效应存在差异,同时不同的预光照和温度也会影响毒害效应.
The Organization for Economic Cooperation and Development(OECD)提出的淡水藻生长抑制试验规范(OECD,2011),已被广泛应用于污染物对藻类的毒性实验研究中去,已成为国际公认的进行除草剂对藻类风险评价的实验规范.为评价环境风险,关于阿特拉津和百草枯对藻类和高等植物毒害效应的研究已有报道,但已报道的结果主要关注了暴露的农药浓度(Ma et al., 2002;张慧等,2013),而未考虑光强.从实际运用环境来看,自然光强远高于室内通常的培养条件.因此,很多室内测定的对植物毒害的效应浓度,可能会被低估.
从目前的国内外环境可以看出,阿特拉津和百草枯的使用量在逐年升高.他们在环境中降解缓慢,在地表水中达到一定浓度后,会毒害许多水体低等动物,影响水生植物生长(Graymore et al., 2001).百草枯在水环境中降解缓慢,其半衰期约为6.6年(Bromilow,2004).已有报道显示阿特拉津能有效抑制植物和藻类的光合作用和生长(刘爱菊等,2002).从本文测定获得的拉特拉津和百草枯对藻类的毒害可以看出,在高光强50 μmol · m-2 · s-1时,96 h-EC50值最低低于0.5 mg · L-1,这一结果提示应注意这类农药的施用限量.
5 结论(Conclusions)1)光照强度能增加除草剂阿特拉津和百草枯对藻类的毒害作用,在高光照强度50 μmol · m-2 · s-1时,受试藻的EC50值都明显低于光照强度20 μmol · m-2 · s-1时的EC50值.
2)高光照强度下相同浓度的阿特拉津可使藻的MDA含量大大增加.
| [1] | Bintein S, Devillers J. 1996. Evaluating the environmental fate of atrazine in France[J]. Chemosphere, 32(12): 2441-2456 |
| [2] | Brain R A, Hoberg J, Hosmer A J, et al. 2012. Influence of light intensity on the toxicity of atrazine to the submerged freshwater aquatic macrophyte Elodea canadensis[J]. Ecotoxicology and Environmental Safety, 79: 55-61 |
| [3] | Bromilow R H. 2004. Paraquat and sustainable agriculture[J]. Pest Management Science, 60(4): 340-349 |
| [4] | 陈建军, 何月秋, 祖艳群, 等. 2010. 除草剂阿特拉津的生态风险与植物修复研究进展[J]. 农业环境科学学报, 29(S1): 289-293 |
| [5] | Deblois C P, Dufresne K, Juneau P. 2013. Response to variable light intensity in photoacclimated algae and cyanobacteria exposed to atrazine[J]. Aquatic Toxicology, 126: 77-84 |
| [6] | DeLorenzo M E, Lauth J, Penningto P L, et al. 1999. Atrazine effects on the microbial food web in tidal creek mesocosms[J]. Aquatic Toxicology, 46(3/4): 241-251 |
| [7] | Eisler R. 1990. Paraquat hazards to fish, wildlife, and invertebrates: A synoptic review[R]. 85(1. 22), Center Laurel, Maryland: U. S. Fish and Wildlife Service, Patuxent Wildlife Research. 1-38 |
| [8] | Forney D R, Davis D E. 1981. Effects of low concentrations of herbicides on submersed aquatic plants[J]. Weed Science, 29: 677-685 |
| [9] | Graymore M, Stagnitti F, Allinson G. 2001. Impacts of atrazine in aquatic ecosystems[J]. Environment International, 26(7/8): 483-495 |
| [10] | Guasch H, Sabater S. 1998. Light history influences the sensitivity to atrazine in periphytic algae[J]. Journal of Phycology, 34(2): 233-241 |
| [11] | 李合生. 2000. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社. 260-261 |
| [12] | 刘爱菊, 朱鲁生, 王军, 等. 2002. 除草剂阿特拉津的环境毒理研究进展[J]. 土壤与环境, 11(4): 405-408 |
| [13] | Ma J Y, Xu L G, Wang S F, et al. 2002. Toxicity of 40 herbicides to the green alga Chlorella vulgaris[J]. Ecotoxicology and Environmental Safety, 51(2): 128-132 |
| [14] | 马建义, 陈杰. 2000. 24种除草剂对蛋白核小球藻生长的效应[J]. 环境化学, 19(6): 518-522 |
| [15] | Mayasich J M, Karlander E P, Terlizzi Jr D E. 1986. Growth responses of Nannochloris oculata Droop and Phaeodactylum tricornutum Bohlin to the herbicide atrazine as influenced by light intensity and temperature[J]. Aquatic Toxicology, 8(3): 175-184 |
| [16] | 孟顺龙, 胡庚东, 瞿建宏, 等. 2009. 阿特拉津在水环境中的残留及其毒理效应研究进展[J]. 环境污染与防治, 31(6): 64-68 |
| [17] | Organisation for Economic Co-operation and Development, 2011. 201. OECD Guidelines for the Testing of Chemicals, Freshwater Alga and Cyanobacteria, Growth Inhibition Test[S]. Paris, France |
| [18] | Qian H F, Chen W, Li J J, et al. 2009. The effect of exogenous nitric oxide on alleviating herbicide damage in Chlorella vulgaris[J]. Aquatic Toxicology, 92(4): 250-257 |
| [19] | Roberts T R, Dyson J S, Lane M C G. 2002. Deactivation of the biological activity of paraquat in the soil environment: A review of long-term environmental fate[J]. Journal of Agricultural and Food Chemistry, 50(13): 3623-3631 |
| [20] | Sáenz M E, Alberdi J L, Di Marzio W D, et al. 1997. Paraquat toxicity to different green algae[J]. Bulletin of Environmental Contamination and Toxicology, 58(6): 922-928 |
| [21] | 沈宏, 周培疆. 2002. 环境有机污染物对藻类生长作用的研究进展[J]. 水生生物学报, 26(5): 529-535 |
| [22] | Stewart R C, Bewley J D. 1980. Lipid peroxidation associated with accelerated aging of soybean axes[J]. Plant Physiology, 65(2): 245-248 |
| [23] | 苏少泉, 耿贺利. 2008. 百草枯特性与使用[J]. 农药, 47(4): 244-247 |
| [24] | 徐小花, 肖铭, 潘慧云, 等. 2008. 阿特拉津对铜绿微囊藻和四尾栅藻生长的影响[J]. 生态与农村环境学报, 24(1): 72-76 |
| [25] | 张慧, 李静, 李建宏, 等. 2013. 除草剂百草枯对蓝藻和绿藻的毒性[J]. 环境科学学报, 33(5): 1441-1445 |
| [26] | 赵玉艳, 蔡磊明. 2004. 几种藻类毒性试验统计方法的差异[J]. 农药, 43(7): 298-299 |
 2014, Vol. 34
2014, Vol. 34


