当前土壤污染是世界公认的最为严重的环境问题之一.石油是现代工业社会的主要支柱能源之一.石油烃是石油用于人类不同活动而产生的化学物质,包括烷烃(直链烷烃、支链烷烃和环烷烃)、芳香烃类化合物、沥青质、极性物质等(Pernar et al., 2006; Cai et al., 2010).在石油的开采、炼制、贮存以及运输过程中所发生的溢油和泄露会产生落地原油,落地原油又会将石油烃带入土壤;油页岩矿渣的堆放和使用也会使大量石油烃进入土壤,对土壤造成严重污染(Phillips et al., 2009).土壤中的过量石油烃不仅影响土壤结构、土壤通透性、土壤吸湿性等土壤的理化性质,还能通过渗透作用污染到地下水(Li et al., 1997).此外,石油烃还严重影响植物的正常生长,许多研究(Ogboghodo et al., 2004)表明,土壤中石油烃可抑制种子发芽,阻碍根际呼吸作用,造成植株萎黄病等病症,并通过食物链对整个生态系统和人类健康造成重大威胁.因此,如何经济有效地修复石油烃污染土壤已经成为国内外广泛关注的热点问题(Alkorta and Garbisu, 2001; White et al., 2006).
目前,如何经济有效地修复石油烃污染土壤,是土壤修复领域的一个难题.石油烃污染土壤所用的修复技术主要有物理修复法、化学修复法和生物修复法3种.但是,传统的物理修复法和化学修复法成本较高,易导致二次污染且不适合大规模的实施应用(戴树桂,2005);微生物修复技术可能会给土壤和地下水带来生物性污染,并且一般情况下含有机污染物的盐碱土壤很难采用微生物进行有效的修复(Zhuang et al., 2010).而植物修复通过植株本身的吸收,根际微生物及其根系分泌物的降解、吸收、转化、固定或钝化作用,可将有毒的有机污染物移除或转变成为无毒或毒性较小的物质,实现污染土壤的原位修复(Pradhan et al., 1998; 周启星和宋玉芳,2004; Anderson et al., 1993; Zhou et al., 2011).与传统方法相比,植物修复方法具有成本低、自然美观、可进行大面积原位操作、无二次污染等特点(Cai et al., 2010),因此其作为一项绿色修复技术,可成为石油污染土壤修复非常具有潜力的有效可行的方法之一.
寻求能够高效降解石油烃的耐盐碱植物种类是进行石油烃污染盐碱土壤修复的前提.迄今为止,国内外已经有不少相关的研究报道.Basumatary等发现在浓度为8%的高浓度原油污染土壤中,短叶茳芏的总油脂降解率可高达61.2%(Basumatary et al., 2012);黑麦草(Hutchinson et al., 2001)、高羊茅(Schwab et al., 1998)、凤仙花(Cai et al., 2010)等也相继被发现具备高效降解土壤石油烃的能力.但是,植物生长受到气候条件、地形地貌、土壤性质等的深刻影响(周启星和宋玉芳,2004; Michael et al., 2007),所以更好地适应于污染环境的本土物种的筛选成为植物修复的首选工作.Bordoloi等研究了生长于印度阿萨姆邦的本土植物地毯草对石油烃污染土壤的修复作用,并得到了良好的修复效果(Bordoloi et al., 2012);在巴西南部一场近四百万升原油泄露的事故地带,Vanessa等发现仅有的存活树种之一——鸡冠刺桐——具备修复石油污染土壤的潜力(de Farias et al., 2009).与此同时,一系列的研究(Wu et al., 2009)表明盐蒿、棉花、田菁等也可以降低土壤含盐量.然而,用于石油烃污染土壤修复的植物大都是禾本科植物(Aprill and Sims, 1990),未见野生观赏植物的研究报道,并且盐碱双胁迫下的野生观赏植物修复石油烃的研究也未有报道.花卉植物作为高等植物的一种,与其它修复植物相比,具有种质资源丰富、耐性好、适应当地生态环境、不进入食物链、治理污染的同时美化环境等优点.因此如果能从花卉资源中筛选得到能高效降解石油烃污染土壤的耐盐碱物种,将为植物修复打开一条全新的路径(Liu et al., 2007).
大港油田土壤盐碱含量比较高,且分布不均匀,含量范围0.5%~5%,pH为8.0~9.3.深入了解盐碱条件下石油污染的特点及修复的可行性,能够为进一步的复合污染修复,恢复生态功能提供理论依据.因此,通过温室盆栽试验研究了野生观赏植物长药八宝(Hylotelephium spectabile(Boreau)H. Ohba)对大港油田石油污染盐碱土壤的修复潜力.试验所利用的长药八宝为景天科八宝属的多年生野生观赏植物.试验从长药八宝对污染的耐性、对石油烃的降解能力和土壤中石油烃降解菌的数量三方面探讨了长药八宝修复石油烃污染土壤的可行性,将为盐碱双污染胁迫下污染土壤的植物修复提供新的思路.
2 材料与方法(Materials and methods) 2.1 试验土壤大港油田东临渤海,西接冀中平原,东南与山东毗邻,北至津唐交界处,地跨津、冀、鲁3省市的25个区、市、县,总面积18716 km2.本研究所用的土壤均采自于大港油田第四采油厂.
采集的土壤自然风干后压碎,去除砾石和动植物残体,然后过4 mm筛,充分混匀,以尽可能地避免土壤中石油烃可能分布不够均匀的问题.取少量过筛土壤测定其含水率为2.78%,土壤总石油烃(Total Petroleum Hydrocarbons,TPHs)浓度为51411 mg · kg-1.土壤采集测样时,每个样品都保证在土壤的不同位置随机取样3次,以其均值作为浓度测定值,以确保取到的土壤能充分代表整个土样.
2.2 盆栽试验盆栽试验所选地点位于天津市南开大学泰达学院长江学者科研团队温室内.温室内温度维持在18~25 ℃,日光照时间持续16 h.
盆栽试验所用土壤的总石油烃浓度设为4个梯度组,分别为:CK、T1、T2、T3组,其对应的TPHs设计含量分别为0mg · kg-1、10000 mg · kg-1、20000 mg · kg-1和40000 mg · kg-1.根据测得的原污染土壤中的石油烃含量,将清洁土壤与石油污染土壤按照一定比例均匀混合,得到试验土壤的实际总石油烃含量分别为0mg · kg-1、11874mg · kg-1、20075 mg · kg-1和38986 mg · kg-1.按照每盆装土1500 g的标准,将特定浓度的污染土壤装入花盆(直径230 mm,高180 mm)中,浇水平衡2周后备用.每个处理组设3个平行,同时准备不种植植物的空白对照组.
盆栽试验所种植的植物为长药八宝.长药八宝,别名长药景天,多年生肉质草本野生植物,隶属于景天科八宝属.产于安徽、陕西、河南、山东等地,多生于低山多石山坡上,耐寒、耐旱、耐贫瘠,管理粗放并且具备很好的观赏价值.
盆栽试验采用根状茎扦插的方式培育长药八宝.选取生长发育一致的根状茎,将其插入平衡好的土壤中,每盆3株,浇水育苗.试验期间按照土壤最大需水量不定期浇水,未种植植物的对照组与试验组处理一致.植株培养4个月后到达成熟期,将其收获.
2.3 植株生物量的测定植株收获时,先采集根部附近的根际土装入自封袋,以分析修复后土壤的总石油烃浓度以及降解菌数.然后将收获后的植株的根部与地上部分开,用自来水冲洗干净后再用去离子水充分漂洗,用滤纸沥干多余的水分后测量其鲜重、株高、根长等生物量,用EPSON PERFECTION V700 PHOTO 扫描仪及WinRHIZO软件扫描并统计其根表面积.
2.4 土壤中总石油烃(TPHs)含量的测定土壤中总石油烃(TPHs)含量的测定遵循美国国家环境保护局的索提法(US EPA 3550c).称取5 g风干土样,用滤纸包好,放入索氏提取器中,加入125 mL的二氯甲烷(分析纯),54 ℃水浴萃取12 h,然后取下烧瓶(用前已烘干至恒重),54 ℃旋转蒸发至干,在通风橱内挥发至恒重,称重测量.实验所用丙酮、正己烷充分清洗仪器并采用空白实验(污染空白与试剂空白),保证结果不受外界干扰因素和交叉污染的影响;实验中采样、染毒、测定等都设3个平行,以保证样品的代表性.
土壤总石油烃含量的计算公式为:
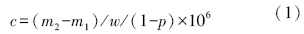
其中土壤含水率的测定步骤如下:取一干燥玻璃器皿,称重为G(g);加土样5 g于玻璃器皿中称重为G1(g);将玻璃器皿盖上盖置于真空冷冻干燥机中24小时真空冷冻干燥,放真空后,从干燥机中取出,并放在干燥器中至室温,之后称重为G2(g),必要时,如前可再置于真空冷冻干燥机中干燥,使得两次称重之差不得超过3mg,取最低一次计算.
土壤含水率p的计算公式为:
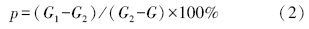
最大或然数(most probable number,MPN),可以对一个混合的微生物群落中具有特殊功能性的微生物类群(如土壤中的烷烃降解菌、芳烃降解菌、总石油烃降解菌、多氯联苯降解菌、硝化细菌等)进行数量上的测定.一般采用96孔平板进行测量(Wrenn and Venosa, 1996).本试验采用MPN的5管计数法,对土壤中的烷烃降解菌、芳烃降解菌及总石油烃降解菌进行计数.具体试验步骤如下:
(1)称取1 g土壤,加到装有9 mL无菌水的试管中,振荡20~30 min,让土壤样品均匀分散,然后按照10倍稀释法依次将所需要测量的土壤样品制成10-1~10-9的土壤稀释液.
(2)本试验采用8个稀释度,5个重复,在96孔板的每个小孔中加入180 μL 的MPN液体培养基及碳源(过0.22 μm有机滤膜).
(3)按照无菌操作要求,从10-9的土壤稀释液中吸取20 μL溶液,放入对应编号的5个小孔中,并按照同样的方法将10-8~10-2的土壤稀释液各20μL加入到相应编号的小孔中.
(4)将96孔板置室温培养.烷烃降解菌和总石油烃降解菌培养2周后,加入INT显色反应,隔天观察结果进行计数,以红色为阳性反应.芳烃降解菌培养3周后计数,以溶液变黄或浑浊为阳性反应.
培养基为Bushnell Haas Broth,具体配方为:0.2 g · L-1的硫酸镁,0.02 g · L-1的氯化钙,1.0 g · L-1的磷酸二氢钾,1.0 g · L-1的硝酸钾,1.0 g · L-1的磷酸氢二钾和0.02 g · L-1的三氯化铁;培养后加入的染料为碘硝基四唑紫(INT),浓度为3 g · L-1;烷烃降解菌的计数所使用到的碳源是正十六烷,芳烃降解菌计数所使用到的碳源是4种多环芳烃混合液(10 g · L-1的菲,1 g · L-1的蒽,1 g · L-1的芴和1 g · L-1的二苯并噻吩).
2.6 统计分析数据统计与分析采用SPSS20.0与Origin8.0进行.各实验结果均以平均数±标准偏差的形式表示.按照单因素方差分析方法中Duncan多重分析的方法,进行多组样本间的显著性分析,规定显著性水平p<0.05.
3 结果与讨论(Results and discussion) 3.1 长药八宝对石油烃和盐碱污染的耐性植株收获时,不同石油烃污染浓度下的长药八宝从外表看生长状况良好,无叶片发黄、落叶、枯萎等明显的毒害症状,说明长药八宝对石油烃和盐碱污染具备一定的耐性.由图 1a可知,当土壤总石油烃浓度为11874mg · kg-1时,长药八宝的地上部鲜重相对于无污染的对照组有显著降低(p<0.05),说明土壤石油烃和盐碱胁迫对长药八宝地上部的生长出现了明显的抑制作用.但随着石油烃浓度的增加,长药八宝的地上部鲜重减少有限,说明长药八宝对中高浓度的石油烃也显示出了一定的耐性.考虑到植物修复有机物的机制主要在于根际微生物及根系分泌物的降解作用,因此在检验长药八宝对石油烃污染是否具备耐性时,根部的生长发育情况,特别是与微生物的活动息息相关的根表面积,是比地上部鲜重更为重要的指标.根据图 1b和图 2a,不同浓度的石油烃污染下,长药八宝的根重、根表面积相对于无污染的对照组有所减少,这说明石油烃和盐碱污染对长药八宝的根系生长有一定的抑制作用,但抑制作用并不显著.值得一提的是,长药八宝在20075 mg · kg-1石油烃污染下的根重、根表面积要高于较低浓度(11874 mg · kg-1)和较高浓度(38986 mg · kg-1),并且联系图 2b,长药八宝在20075 mg · kg-1下的根长更是明显高于无污染的空白对照组.这说明中浓度石油烃污染(20074 mg · kg-1)对长药八宝的根系生长影响不大,甚至有促进作用.不同石油烃浓度处理下长药八宝的根系生长相对于对照组无明显降低,并且在一定浓度下有所增加,这对于其发挥修复作用极为有利,虽然其在盐碱与石油烃双胁迫下的耐性机理有待于进一步研究,但长药八宝显然对于石油烃污染是具备一定耐性,具有修复石油烃污染土壤的潜力.
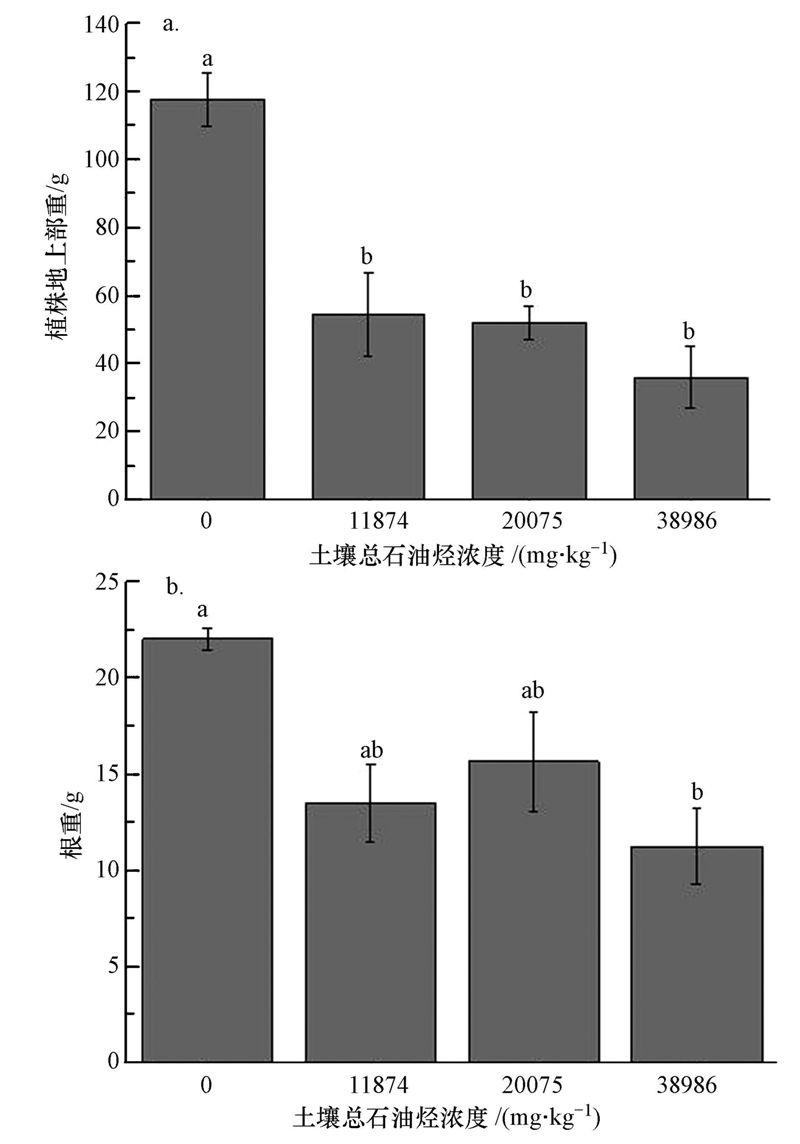 |
| 图 1 不同处理组长药八宝的地上部重(a)和根重(b)(标注不同小写字母(a和b)则具有差异显著性(p<0.05)) Fig. 1 The shoot weight(a) and root weight(b)of H. spectabile with different TPH treatments(The means followed by the different letter(a and b)were significantly different at p<0.05) |
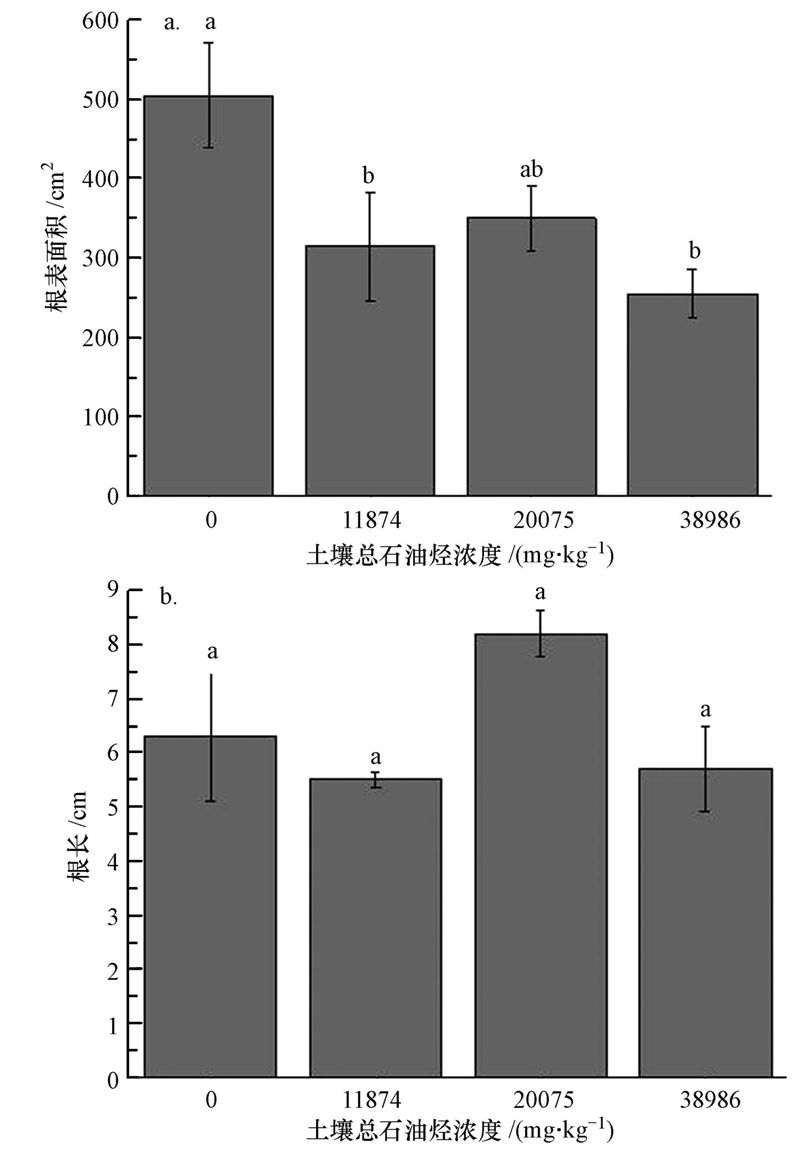 |
| 图 2 不同处理组长药八宝的根表面积(a)和根长(b)(标注不同小写字母(a和b)则具有差异显著性(p<0.05)) Fig. 2 The root surface area(a) and root length(b)of H. spectabile with different TPH treatments(The means followed by the different letter(a and b)were significantly different at p<0.05) |
图 3所示是长药八宝对土壤总石油烃的降解率.土壤总石油烃浓度分别为11874 mg · kg-1、20075 mg · kg-1、38986 mg · kg-1时,长药八宝对土壤总石油烃的降解率在22.98%~47.99%之间,明显高于对照组的17.64%~32.37%的降解率(p<0.01).这说明长药八宝对土壤中石油烃的修复效果较为显著.如前所述,在植物降解有机污染土壤的过程中,根际降解作用在其中发挥主导作用.虽然土壤中总石油烃存在一定的淋滤、光解、挥发等自然降解,但是研究表明,植物根系可以有效增加污染土壤中的微生物群落,改善土壤的物理化学性质,促进石油烃的降解(Schwitzguébel,2004).长药八宝作为野生观赏植物,抗逆性强,根系较为发达,能很好地改善土壤板结及透气性差的缺陷;此外,植物的根系分泌物和巨大的根系比表面积则为微生物群落活动提供了有利的资源和场所,加速了石油烃的降解.但是随着土壤中总石油烃浓度的增高,其降解率也明显降低.当土壤石油烃浓度为11874 mg · kg-1时,种植长药八宝组的总石油烃降解率高达47.99%,明显高于空白对照组的17.64%(p<0.01),是空白对照组的1.53倍;但当土壤总石油烃浓度为20075 mg · kg-1、时,种植植物组的降解率仅有24.49%,仅为空白对照组的1.16倍;而当土壤总石油烃浓度为38986 mg · kg-1时,种植植物组的降解率为22.98%,是空白对照组的1.45倍,明显高于空白对照组(p<0.05).这可能是因为较高浓度的石油烃对植物及其根际微生物的生物毒性较大,并且生物可利用性低,因此严重限制了根系及根系微生物群落的生长发育及降解活动.但即便如此,仍可初步推断出长药八宝对于浓度小于40000 mg · kg-1的石油烃污染土壤具备一定的修复效果,尤其是对低浓度石油烃污染土壤具备比较显著的修复效果.
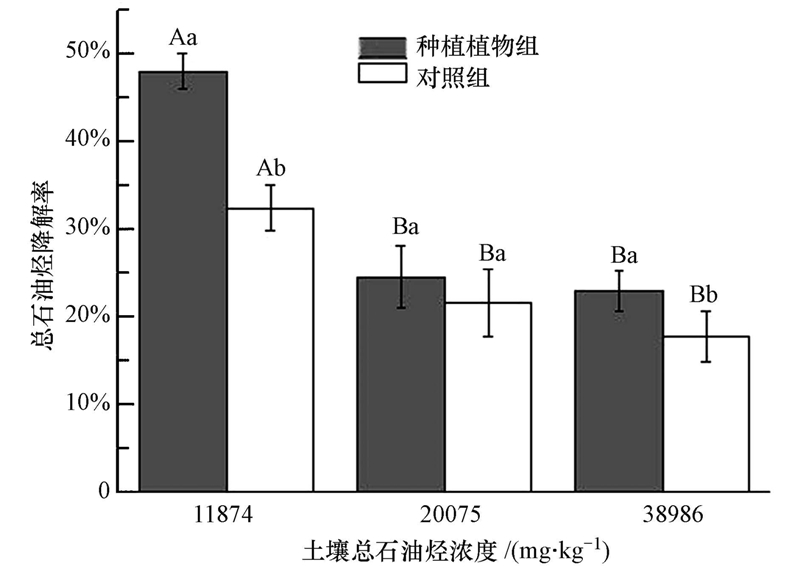 |
| 图 3 长药八宝对土壤总石油烃的降解率(不同小写字母表示同一石油烃浓度水平下有植物和无植物对照之间有显著性差异,不同大写字母表示不同浓度石油烃水平下有植物或无植物之间差异显著) Fig. 3 The TPH degradation of total petroleum hydrocarbons by H. spectabile(The means within same TPH treatments followed by the different letter(a and b)were significantly different. The means among different TPH treatments followed by the different letter(A and B)were significantly different) |
图 4a显示了不同浓度下种植植物后土壤中烷烃降解菌的数量变化.土壤中总石油烃浓度分别为11874 mg · kg-1、20075 mg · kg-1和38986 mg · kg-1时,其烷烃降解菌数呈现先增加后减小再增加的趋势.如前所述,当土壤中总石油烃浓度为11874 mg · kg-1、20075 mg · kg-1和38986 mg · kg-1时,其降解率分别是对照组降解率的1.53、1.16和1.45倍,降解强度是先增强后减弱再增强的,这同烷烃降解菌数量趋势一致.土壤总石油烃在20075 mg · kg-1时,根际土壤中烷烃降解菌的数量与11874 mg · kg-1浓度下相比明显降低,可能是因为随着石油烃浓度的增加,其毒性效应也逐渐增强,这时微生物与植物开始出现受胁迫症状,阻碍了微生物的生长、繁殖.而且研究表明(Schwarzenbach,2003),土壤的矿物质种类、粒度分布、水含量、渗透度、结构、pH、温度、金属含量、含碳有机质、孔隙率、密度、无机离子、污染历史等都影响到土壤有机物的生物毒性,20075 mg · kg-1浓度下石油烃的生物毒性可能比较强,从而限制了降解菌的生长.但是,值得关注的是,土壤总石油烃浓度在38986 mg · kg-1时,与对照相比根际土壤中烷烃降解菌的数量不仅没有降低,反而明显增加.原因可能是虽然38986 mg · kg-1浓度下石油烃的生物毒性比20075 mg · kg-1更强,但是较高浓度石油烃污染下可被降解菌利用的烷烃还是要远远高于较低浓度的石油烃污染组,充足的碳源所带来的生长刺激大大超出了这些抑制作用,因而总体表现为烷烃降解菌数量上的大幅度增加.
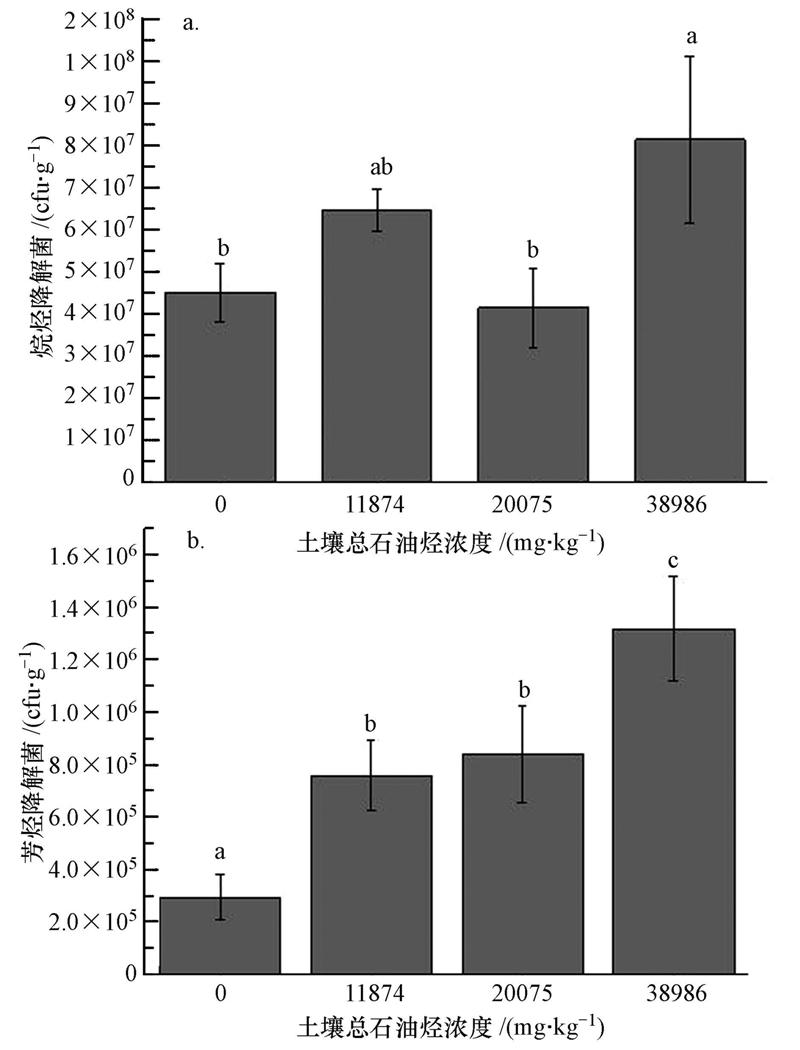 |
| 图 4 土壤中烷烃降解菌(a)和芳烃降解菌(b)的数量(标注不同小写字母(a、b和c)则具有差异显著性(p<0.05)) Fig. 4 The numbers of alkane degraders(a) and PAHs degraders(b)in rhizosphere soils(The means followed by the different letter(a,b and c)were significantly different at p<0.05) |
由图 4b可知,当土壤总石油烃浓度增加时,PAHs降解菌的数量随着土壤总石油烃浓度的升高而呈现不等量的增加.其原因在于土壤总石油烃浓度越高,PAHs含量也越高,PAHs降解菌可利用的碳源也就越充足.当土壤总石油烃浓度在20075 mg · kg-1时,其PAHs降解菌的数量与11874 mg · kg-1组相比并无明显差异,而在38986 mg · kg-1浓度的石油烃污染下,其PAHs降解菌数量出现较大幅度增加.原因可能是,20075 mg · kg-1是降解菌生长、繁殖受限的一个临界值,碳源、生物毒性、生物有效性共同作用,限制了降解菌的生长;而在38986 mg · kg-1浓度下,微生物可利用的PAHs相对充足的多,丰富的碳源弥补了其在生物毒性方面的不足,从而大大促进了PAHs降解菌的生长,加速了微生物对土壤中PAHs的降解.同时,研究发现,植物根际对土壤有机污染物(如PAHs)的生物修复起到重要作用,但土壤中土著微生物生长速度较慢,代谢活性不高,其自身降解多环芳烃的能力较弱(Narayanan et al., 1995).38986 mg · kg-1浓度下芳烃降解菌数明显增多,只是促进了根际微生物的降解作用,其相对于根际吸收、固定及分泌物的协同降解作用等来说可能仍然较弱,在芳烃的诸多降解途径中不占据主导地位.因此综合分析,芳烃降解菌数的增加只是增强了微生物的降解,石油烃的其它降解途径在此浓度下可能受到了限制,所以导致总石油烃降解率偏低.
4 结论(Conclusions)1)采用野生观赏植物,通过对大港油田石油烃污染盐碱土壤的盆栽试验发现,长药八宝对石油烃与盐碱双胁迫污染具备良好的耐性,虽然污染对长药八宝地上部的生长出现了抑制作用,但对与修复活动更为相关的根系生长发育并无显著性影响.
2)长药八宝对石油烃修复效果也比较显著,当土壤石油烃浓度为11874 mg · kg-1、20075 mg · kg-1和38986 mg · kg-1时,其降解率分别为47.99%、24.49%和22.98%,明显高于空白对照组的降解率(仅为32.37%、21.57%和17.64%)(p<0.01).
3)土壤中石油烃降解菌的数量(包括烷烃降解菌和芳烃降解菌)与对照组相比有所增加,促进了根际微生物对石油烃的降解,一定程度上推动了植物对石油烃的修复.
4)综上所述,长药八宝对一定浓度的石油烃与盐碱污染土壤具有良好的耐性,对土壤石油烃也具有较高的降解效果,具有修复4%以下的石油烃污染的盐碱土的能力.
| [1] | Alkorta I, Garbisu C. 2001. Phytoremediation of organic contaminants in soils[J]. Bioresource Technology, 79(3): 273-276 |
| [2] | Anderson T A, Guthrie E A. Walton B T. 1993. Bioremediation in the rhizosphere[J]. Environmental Science & Technology, 27(13): 2630-2636 |
| [3] | Aprill W, Sims R C. 1990. Evaluation of the use of prairie grasses for stimulating polycyclic aromatic hydrocarbons treatment in soil[J]. Chemosphere, 20(1/2): 253-265 |
| [4] | Basumatary B, Bordoloi S, Sarma H P. 2012. Crude oil-contaminated soil phytoremediation by using Cyperus brevifolius (Rottb.) Hassk[J]. Water, Air, and Soil Pollution, 223(6): 3373-3383 |
| [5] | Bordoloi S, Basumatary B, Saikia R, et al. 2012. Axonopus compressus (Sw.) P. Beauv. A native grass species for phytoremediation of hydrocarbon-contaminated soil in Assam, India[J]. Journal of Chemical Technology and Biotechnology, 87(9): 1335-1341 |
| [6] | Cai Z, Zhou Q X, Peng S W, et al. 2010. Promoted biodegradation and microbiological effects of petroleum hydrocarbons by Impatiens balsamina L. with strong endurance[J]. Journal of Hazardous Materials, 183(1/3): 731-737 |
| [7] | 戴树桂. 2005. 环境化学进展[M]. 北京: 化学工业出版社. 119-120 |
| [8] | de Farias V, Maranho L T, de Vasconcelos E C, et al. 2009. Phytodegradation potential of Erythrina crista-galli L., Fabaceae, in petroleum-contaminated soil[J]. Appl Biochem Biotechnol, 157(1): 10-22 |
| [9] | Hutchinson S L, Banks M K, Schwab A P. 2001. Phytoremediation of aged petroleum sludge: Effect of inorganic fertilizer[J]. Journal of Environmental Quality, 30(2): 395-403 |
| [10] | Li X, Feng Y, Sawatsky N. 1997. Importance of soil-water relations in assessing the endpoint of bioremediated soils: I. Plant growth[J]. Plant and Soil, 192(2): 219-226 |
| [11] | Liu J N, Zhou Q X, Sun T, et al. 2007. Feasibility of applying ornamental plants in contaminated soil remediation[J]. The Journal of Applied Ecology, 18(7): 1617-1623 |
| [12] | Michael R, Yuen S, Baker A, et al. 2007. A sustainable approach for hydraulic control of landfills using quarry scalpings and native plants[J]. Australian Journal of Multi-Disciplinary Engineering, 5(1): 39-48 |
| [13] | Muralidharan N, Davis L C, Tracy J C, et al. 1995. Experimental and modeling studies of the fate of organic contaminants in the presence of alfalfa plants[J]. Journal of Hazardous Materials, 41(2/3): 229-249 |
| [14] | Ogboghodo I A, Iruaga E K, Osemwota I O,et al. 2004. An assessment of the effects of crude oil pollution on soil properties, germination and growth of maize (Zea mays) using two crude types-forcados light and escravos light[J]. Environmental Monitoring and Assessment, 96(1/3): 143-152 |
| [15] | Pernar N, Baksic D, Antonic O, et al. 2006. Oil residuals in lowland forest soil after pollution with crude oil[J]. Water, Air, and Soil Pollution, 177(1/4): 267-284 |
| [16] | Phillips L A, Greer C W, Farrell R E, et al. 2009. Field-scale assessment of weathered hydrocarbon degradation by mixed and single plant treatments[J]. Applied Soil Ecology, 42(1): 9-17 |
| [17] | Pradhan S P, Conrad J R, Paterek J R, et al. 1998. Potential of phytoremediation for treatment of PAHs in soil at MGP sites[J]. Journal of Soil Contamination, 7(4): 467-480 |
| [18] | Peng S W, Zhou Q X, Cai Z, et al. 2009. Phytoremediation of petroleum contaminated soils by Mirabilis Jalapa L. in a field plot experiment[J]. Journal of Hazardous Materials, 168(2/3): 1490-1496 |
| [19] | Schwab A P, Al-Assi A A, Banks M K. 1998. Adsorption of naphthalene onto plant roots[J]. Journal of Environmental Quality, 27(1): 220-224 |
| [20] | Schwarzenbach R P, Gshwend P M, Imboden D M. 2003. Envirenmental Organic Chemistry (2nd ed)[M]. New York: Wiley |
| [21] | Schwitzguébel J P. 2004. Potential of phytoremediation, an emerging green technology: European trends and outlook[J]. Proceedings of the Indian National Science Academy (Part B Biological Sciences), 70(1): 131-152 |
| [22] | White Jr P M, Wolf D C, Thoma G J, et al. 2006. Phytoremediation of alkylated polycyclic aromatic hydrocarbons in a crude oil-contaminated soil[J]. Water, Air, and Soil Pollution, 169(1/4): 207-220 |
| [23] | Wrenn B A, Venosa A D. 1996. Selective enumeration of aromatic and aliphatic hydrocarbon degrading bacteria by a most-probable-number procedure[J]. Canadian Journal of Microbiology, 42(3): 252-258 |
| [24] | Wu Y Y, Liu R C, Zhao Y G, et al. 2009. Spatial and seasonal variation of salt ions under the influence of halophytes, in a coastal flat in eastern China[J]. Environmental Geology, 57(7): 1501-1508 |
| [25] | 周启星, 宋玉芳. 2004. 污染土壤修复原理与方法[M]. 北京: 科学出版社 |
| [26] | Zhou Q X, Cai Z, Zhang Z N, et al. 2011. Ecological remediation of hydrocarbon contaminated soils with weed plant[J]. Journal of Resources and Ecology, 2(2): 97-105 |
| [27] | Zhuang X L, Han Z, Bai Z H, et al. 2010. Progress in decontamination by halophilic microorganisms in saline wastewater and soil[J]. Environmental Pollution, 158(5): 1119-1126 |
 2014, Vol. 34
2014, Vol. 34


