2. 河南大学生态科学和技术研究所, 开封 475004
2. Institute of Ecological Science and Technology, Henan University, Kaifeng 475004
土壤是陆地生态系统的中心成分,在生物地球化学循环中起着重要作用.土壤履行碳固定、氮矿化、营养循环等生态系统服务,这些对可持续的粮食生产十分重要.土壤肥力是评价土壤质量的一个有效指标,而土壤酶活性在短时间内会受到施肥的影响,常被作为检测土壤质量变化的敏感指标(Dinesh et al., 2012; Zagal et al., 2009).土壤酶主要由微生物、植物根系和土壤动物分泌.酶是土壤中最活跃的有机成分之一,驱动几乎所有的生物化学反应.酶(胞内酶和胞外酶)直接参与土壤中物质的转化、养分释放和固定过程,与土壤肥力状况密切相关(Puglisi et al., 2006).
在世界上人类通过大量施用化肥来满足人口增长对食物的需求,许多研究关注长期施化肥对作物产量的影响,施化肥可提高土壤肥力和农作物产量,但从长远来看,这可能导致土壤环境质量和功能的转变.氮(N)和磷(P)是作物生长的主要限制营养元素,当前,人为对农田的N投入比自然界本身产生的高30%,比100年前高10倍(Ramirez et al., 2010).欧洲农田土壤中P的积累量在过去40年间高达800~1500 kg · hm-2(Behrendt et al., 1993).中国从1996年到2005年谷物产量增加10%,而化肥使用量增加了51%(Chen et al., 2011).土壤酶活性显著地受长期施肥的影响,N、P与土壤酶活性关系密切,研究显示,N与脲酶活性及纤维素酶活性显著正相关(Dinesh et al., 2012; Iyyemperumal et al., 2008).P能增加脱氢酶活性和降低根际土壤中磷酸酶活性(Rooney et al., 2009;Fox et al., 1992).目前可参考的文献主要是研究单一N、P对土壤酶活性影响(Shen et al., 2010; Alvaro-Fuentes et al., 2013; Wright et al., 2001; Groffman et al., 2011),而有关N和P的交互作用对土壤酶活性的影响研究很少.施肥增强纤维素酶活性会加快纤维素水解,加快土壤碳(C)循环,脲酶活性增强后会加快氨化作用,改变N循环,进而影响土壤环境质量.因此,理解施肥与土壤酶活性的关系可以增加对有效营养、酶活性、土壤环境变化之间联系的理解,这对农田土壤环境质量管理非常重要.
C和N是重要的生命物质,也是非生物组成部分的重要元素.酶与土壤中C、N元素的生物化学循环密切相关,积极参与土壤C、N的转化.人们常常通过测量酶活性来研究施肥对土壤C、N循环的变化(Iyyemperumal et al., 2008).纤维素酶水解纤维素生成葡萄糖,经微生物同化和异化作用,转变土壤中有机质和无机质量,是C循环中的一个重要酶(Iyyemperumal et al., 2008;关松荫,1983);蛋白酶矿化有机氮形成无机氮,在脲酶作用下,进行氨化作用生成NH+4,改变土壤中有效氮含量,脲酶和蛋白酶是参与N循环的关键酶(关松荫,1983;Geisseler et al., 2010);脱氢酶常被用来估量微生物活性(Beauregard et al., 2010; Benitez et al., 2006).酶活性、微生物活性、C和N养分动态可以作为农田生态系统变化的标志.
黄淮海平原是中国主要的小麦产区.因此,本文采用盆栽模拟实验研究施N、P对冬小麦开花期和成熟期土壤酶活性的影响,探究N、P及其交互作用对土壤中参与C、N循环酶活性的影响.旨在为农田土壤环境保持健康稳定提供一定的科学依据.
2 材料和方法(Materials and methods) 2.1 实验地概况试验地点位于河南省开封市河南大学试验田,地理位置为34°48′N、114°18′E.区域属暖温带气候,受季风影响显著,四季分明,年均气温14 ℃,年均日照2267.6 h,年均降雨量为634.2 mm,属于半湿润偏干旱型,土壤为黄河冲积物母质发育而成,土层深厚,土质疏松.
2.2 实验设计实验始于2010年10月,采用盆栽模拟方式(盆长75 cm、宽50 cm、高50 cm),种植作物为冬小麦(Triticum aestivum L),土壤取自撂荒地,原土壤化学性质总氮为0.30 g · kg-1,氨基氮为16.1 mg · kg-1,总磷为0.61 g · kg-1,有效磷为10.5 mg · kg-1,有机碳为3.2 g · kg-1,pH为7.41.每盆种植8株小麦,参照农田种植密度.实验设N、P两个影响因子,4个处理分别是仅施P(SP)、仅施N(SN)、施N和P(P+N)、对照(CK,无施肥),每个施肥处理设12个盆栽实验,共48个盆栽样方.P用过磷酸钙(Ca(H2PO4)2 · H20),N用尿素(CO(NH2)2).基肥的施肥时间为冬小麦播种前(10月),追肥的施肥时间为冬小麦的拔节期(次年3月),N基肥和追肥量分别为90 kg · hm-2和60 kg · hm-2,P基肥量为75 kg · hm-2,施肥量参照中国科学院封丘农业生态试验站数据.
2.3 土壤样品采集及处理在2012年冬小麦开花期(4月30号)和成熟期(6月2号),用直径2 cm土钻在实验盆中按五点法取0~20 cm土层土样,用镊子拣出根、凋落物碎屑及小石粒,混匀过2 mm土筛.分成3份,用无菌塑料袋装好,一份贮于4 ℃冰箱用于测定土壤酶活性,一份贮于-20 ℃冰箱用于测定土壤微生物生物量(仅开花期取样),一份自然风干用于测定土壤化学特性.
2.4 测定方法 2.4.1 土壤酶活性测定方法纤维素酶活性测定用3,5-二硝基水杨酸比色法,以37 ℃、72 h后,10 g土壤生成的葡萄糖质量(μg)表征,表示为μg · g-1 · h-1(以葡萄糖计);脲酶活性测定用苯酚-次氯酸钠比色法,以37℃、24 h后,1 g土壤生成的NH3-N质量(μg)表征,表示为μg · g-1 · h-1(以NH3-N计);为了消除土壤和试剂的误差,每一土样均设无基质和无土壤对照,3次重复.以上两种酶活性的具体测定方法参照文献(关松荫,1983).蛋白酶活性测定用酪蛋白酸钠分析方法,以50 ℃、2 h后,5 g土壤生成的酪氨酸质量(μg)表征,表示为μg · g-1 · h-1(以酪氨酸计)(章家恩,2006);脱氢酶活性测定则根据脱氢酶还原2,3,5-氯化三苯基四氮唑(TTC)生成的三苯基甲臜(TPF)进行表征,表示为μg · g-1 · h-1(以TPF计)(章家恩,2006).酶活性均以烘干土重为基础计算(105 ℃、24 h).
2.4.2 土壤微生物量测定方法采用磷脂脂肪酸(PLFA)生物标记法(Bossio et al., 1998),测定土壤微生物量.称量相当于8 g干重的鲜土样,用23 mL含有氯仿、甲醇、磷酸盐缓冲液(1 ∶ 2 ∶ 0.8,体积比)的混合提取液萃取脂质,N2 气体下浓缩萃取液.对磷脂进行分离,把脂肪酸恢复成甲酯,脂肪酸甲酯溶解在200 μL包含有十九烷酸甲酯(19 ∶ 0)己烷溶剂中,19 ∶ 0作为内部标准.采用安捷伦6890气相色谱仪分析磷脂脂肪酸样本,磷脂脂肪酸(PLFA)的鉴定采用细菌脂肪酸标准和MIDI峰鉴别软件.我们认定脂肪酸10Me16 ∶ 0、10Me17 ∶ 0、TBSA 10Me18 ∶ 0为放线菌标记(Bartelt-Ryser et al., 2005; Pratt et al., 2012),单一不饱和脂肪酸和环丙基脂肪酸为革兰氏阴性菌(Bartelt-Ryser et al., 2005)标记,a/i支链脂肪酸为革兰氏阳性菌标记(McKinley et al., 2005),16 ∶ 1 w5c为菌根真菌标记(McGuire et al., 2012).
2.4.3 土壤化学特性测定方法pH值分析:0.01 mol · L-1的CaCl2溶液浸提-pH计法;土壤有机碳分析:重铬酸钾氧化外加热法;土壤全氮分析:半微量凯氏定氮法;铵态氮分析:2 mol · L-1的KCl浸提连续流动分析仪测定法;土壤全磷分析:NaOH熔融-钼锑抗比色法;土壤有效磷分析:0.5 mol · L-1 NaHCO3浸提-钼锑抗比色法.
2.5 数据处理与分析酶活性参数取平均数(Means±SE,n=12),显著性差异是用SPSS 19.0软件进行单因素和多因素方差分析,用LSD法表示显著性差异;土壤酶活性与微生物量、土壤养分进行相关分析;采用Origin 8.0进行作图.
3 结果(Results) 3.1 施肥对土壤化学特性的影响与对照相比,施肥显著改变了土壤养分(表 1),施N(SN、P+N)显著地增加了总氮、铵态氮含量,显著降低了土壤pH.施P(SP、P+N)显著增加了总磷和有效磷含量,尤其是有效磷,比CK增加了2.4倍.SP处理显著地降低了土壤有机碳.氮磷交互作用显著影响铵态氮、有机碳和pH.
| 表1 施肥处理下冬小麦开花期土壤养分 Table 1 Soil nutrients in anthesis stage of winter wheat under fertilization |
由表 2可知,与对照相比,单施磷肥(SP)没有显著增加冬小麦地上和地下生物量;施N的两个处理(SN、P+N)显著地增加冬小麦地上生物量,尤其是P+N处理,比CK增加了2.7倍;SN处理没有显著增加冬小麦地下生物量,而P+N处理显著地增加了冬小麦地下生物量.
| 表2 施肥处理下冬小麦生物量 Table 2 Winter wheat biomass under fertilization |
方差分析(表 3)表明,N对冬小麦开花期土壤纤维素酶、脱氢酶和蛋白酶活性有极显著性影响,对冬小麦成熟期土壤纤维素酶、脱氢酶、脲酶活性有显著性影响;P对冬小麦开花期和成熟期土壤纤维素酶、脱氢酶活性有显著影响;N和P交互作用对冬小麦开花期土壤纤维素酶、脱氢酶、蛋白酶活性有显著影响,对冬小麦成熟期土壤蛋白酶活性有极显著影响.
| 表3 施肥对冬小麦土壤酶活性的影响方差分析 Table 3 Analysis of variance of soil enzymes under fertilization |
由图 1可知,在冬小麦开花期,纤维素酶活性在P+N处理中最高,为0.056 μg · g-1 · h-1(以葡萄糖计),显著高于CK(0.033 μg · g-1 · h-1),SP、SN处理与CK没有显著差异;脱氢酶活性在P+N处理中最大,为0.46 μg · g-1 · h-1(以TPF计),在CK处理中最小,施肥处理与CK都有显著差异;脲酶活性在SN处理中最大,为54.2 μg · g-1 · h-1(以NH3-N计),与CK有显著差异,SP、SN处理与CK没有显著差异;蛋白酶活性在SP处理中最大,为0.61 μg · g-1 · h-1(以酪氨酸计),在P+N处理中最低,为0.43 μg · g-1 · h-1,且都与CK有显著差异,SN处理与CK无显著差异.
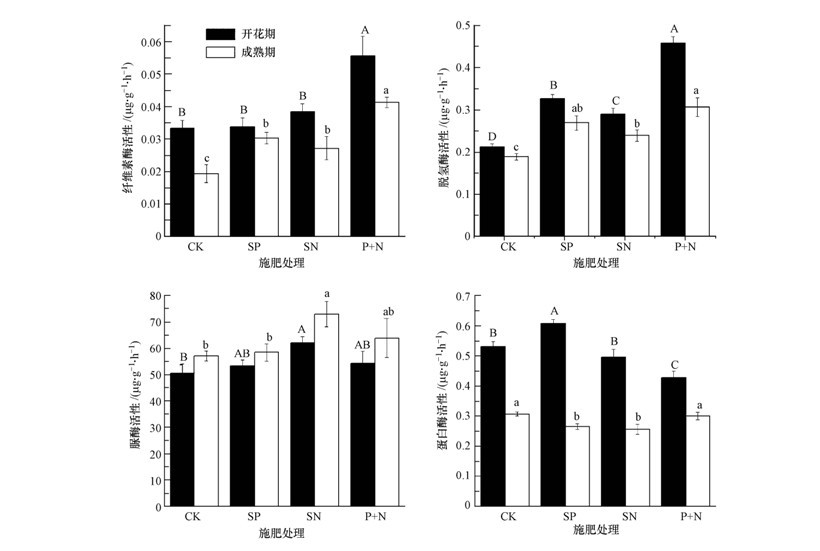 |
| 图 1 施肥对冬小麦开花期和成熟期土壤酶活性影响(数据为平均值加标准误,重复12次;相同字母表示在0.05水平上没有显著差异,下同) Fig. 1 Effects of fertilization on soil enzyme activity at anthesis and ripening stage of winter wheat(Means±SE,n=12,the same letter means there are no significant difference at 0.05 level,the same below) |
在冬小麦成熟期纤维素酶活性在P+N处理最高,为0.041 μg · g-1 · h-1(以葡萄糖计),在CK处理中最小,施肥处理与CK都有显著差异;脱氢酶活性在P+N处理中最大,为0.31 μg · g-1 · h-1(以TPF计),施肥处理与CK都有显著差异;脲酶活性在SN处理中最大,为63.9 μg · g-1 · h-1(以NH3-N计),与CK有显著差异,SP、P+N处理与CK没有显著差异;蛋白酶活性在CK中最大,为0.31 μg · g-1 · h-1(以酪氨酸计),在SN处理中最低,SP处理与CK有显著差异,P+N处理与CK无显著差异.
除脲酶外,成熟期各种酶活性在各处理中都低于开花期酶活性,而且蛋白酶活性比开花期下降幅度最大,分别下降了42.4%、56.4%、48.3%、29.9%.
3.4 施肥对土壤微生物生物量的影响由表 4可知,N、P对土壤各类群微生物量都有显著影响,N和P交互作用仅对放线菌和菌根真菌生物量有显著影响.N、P对4种脂肪酸都有显著影响,N和P交互作用对10Me16 ∶ 0、TBSA 10Me18 ∶ 0、17 ∶ 1w8c 3种脂肪酸有显著影响.
| 表4 施肥对土壤微生物生物量的影响方差分析 Table 4 Analysis of variance of soil microbial biomass under fertilization |
由图 2可知,SP、SN处理都增加了土壤总微生物、放线菌、菌根真菌生物量,但与对照无显著差异;SP处理显著增加了阳性菌生物量,而SN处理则无显著性增加;P+N处理显著增加了各类群土壤微生物生物量.
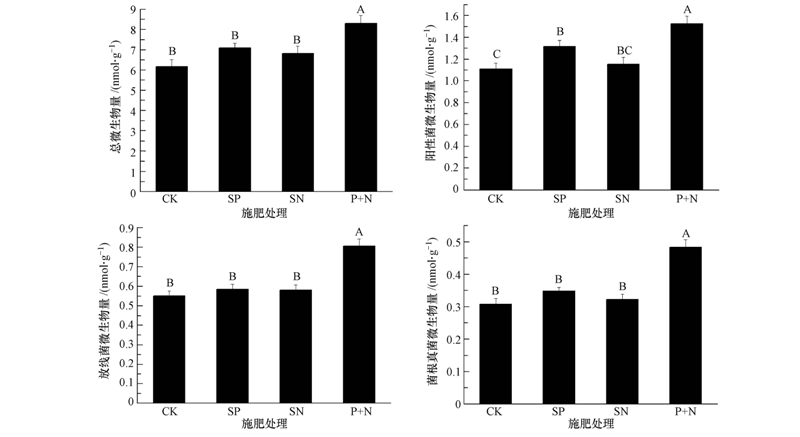 |
| 图 2 施肥对冬小麦开花期土壤微生物生物量的影响 Fig. 2 Effects of fertilization on soil microbial biomass at anthesis stage of winter wheat |
由表 5可知,纤维素酶和脱氢酶活性与总氮、铵态氮、总磷、速效磷呈显著正相关,与pH呈显著负相关;蛋白酶活性与总氮、铵态氮有显著负相关性,与pH呈显著正相关.
| 表5 土壤酶活性与土壤养分相关分析 Table 5 Correlation analysis between soil enzyme activities and soil nutrient |
除阳性菌PLFAs外,纤维素酶与其余类群微生物量和脂肪酸有显著正相关性(表 6),脱氢酶与各个类群微生物生物量和脂肪酸都有显著正相关性,蛋白酶与放线菌、菌根真菌生物量呈显著负相关,与10Me16 ∶ 0、17 ∶ 1w8c脂肪酸呈显著负相关.
| 表6 土壤酶活性与微生物量和脂肪酸相关分析 Table 6 Correlation analysis between soil enzyme activities and soil microbial biomass and phospholipid fatty acids |
N显著影响土壤纤维素酶和脱氢酶活性,因为N增加了土壤微生物生物量(铵态氮与总微生物量显著相关,r=0.335,p=0.020),增加了纤维素酶和脱氢酶活性.前人研究也证明N能增强纤维素酶活性(Carreiro et al., 2000; Sinsabaugh et al., 2005);Kautz等(2004)的研究结果显示,矿化氮对脱氢酶有弱的影响,他们认为矿化氮迅速消散于土壤有机质、植物或沥出损失,对土壤生物没有起到作用.脲酶是一种催化尿素比较专性的酶,施N增加了脲酶活性,这可能因为施N能刺激脲酶分泌(Yuan et al., 2011),前人研究也表明施N增加脲酶活性(Allison et al., 2006).成熟期脲酶活性大于开花期,这可能因为冬小麦成熟期土壤微生物细胞大部分死亡,细胞溶解,酶从细胞中释放出来(张玉兰等,2004),增加了脲酶活性.Giacometti等(2013)在玉米整个生长季研究中也显示脲酶活性在玉米成熟期最大.
P显著影响土壤纤维素酶和脱氢酶活性,因为施P增加了微生物量(速效磷与总微生物量显著相关,r=0.488,p=0.000),且施用的P中含有钙离子,钙离子是很多酶的激活剂,这也是增加酶活性的原因.P显著增加了阳性菌生物量,且与铵态氮显著相关(r=0.310,p=0.032),表明阳性菌可能对土壤有机氮矿化起着重要作用;P显著增加了蛋白酶活性,可能因为P处理缺乏N,微生物和作物分泌蛋白酶分解土壤中有机氮供作物利用.前人研究也证明P能增加蛋白酶活性(Guan et al., 2011).
N和P交互作用显著影响纤维素酶和脱氢酶活性,因为N和P交互作用显著影响放线菌和菌根真菌生物量,增强了土壤纤维素酶和脱氢酶活性;N和P交互作用显著影响放线菌脂肪酸10Me16 ∶ 0、TBSA 10Me18 ∶ 0,且与纤维素酶和脱氢酶活性显著相关,所以,含有这两种脂肪酸的放线菌对纤维素酶和脱氢酶活性有影响;尽管N和P交互作用对阴性菌无显著影响,但对阴性菌脂肪酸16 ∶ 1 w7c有显著影响,且与纤维素酶和脱氢酶显著正相关,因此,含有这种脂肪酸的阴性菌也会影响着纤维素酶和脱氢酶活性;N和P交互作用显著影响了冬小麦地下生物量,植物来源的纤维素酶和脱氢酶分泌到土壤中(地下生物量与纤维素酶和脱氢酶相关性:r=0.320,p=0.026;r=0.539,p=0.000),而且土壤中纤维素可以直接诱导纤维素酶合成,影响土壤中碳循环.N和P交互作用显著影响土壤pH,因为N和P混施冬小麦生长良好,根系吸收更多的盐基阳离子,而等量的氢离子就会释放到土壤中(Guo et al., 2010),导致pH下降.pH通过改变土壤蛋白酶用于结合和催化氨基酸功能基团的空间结构降低了蛋白酶活性,因为碱性土壤蛋白酶的理想pH在8.0左右(蔡红等,2005).而且N和P交互作用显著影响土壤铵态氮量,铵态氮是蛋白酶作用底物,与蛋白酶活性成显著负相关;脂肪酸17 ∶ 1 w8c与蛋白酶显著负相关,与铵态氮显著正相关(r=0.492,p=0.000),因此,含有该脂肪酸的阴性菌在有机氮矿化方面起重要作用.N和P交互作用对脲酶活性没有显著影响,N和P交互在适量的范围内存在明显的协同促进作用,在陆地生态系统中补充P能增加有效氮,补充N可以使生物分泌更多的胞外磷酸酶,从有机质中释放有效磷,增加P循环;N显著增加了脲酶活性,脲酶活性过高,就会使尿素快速水解,氨气浓度升高,不仅减少了尿素肥料的利用率,而且挥发的氨气成为温室气体,对环境造成污染,而N和P交互作用降低了脲酶活性,减少N损失,因此单施N对环境危害更大.
酶活性的变化会改变土壤C、N循环的生态过程,会反馈影响土壤环境质量.Guo等(2010)研究发现,高N投入是中国土壤酸化的主要原因,因为N的H+贡献量为20~33 kmol · hm-2 · a-1.本研究结果也显示施N处理土壤pH有下降趋势,因此,建议合理施N以减少土壤酸化.
5 结论(Conclusions)作物生长发育期会影响酶活性,除脲酶外,冬小麦成熟期酶活性低于开花期.N和P交互作用通过增加土壤放线菌、菌根菌生物量和作物地下生物量显著增加了土壤纤维素酶和脱氢酶活性,通过降低土壤pH和增加铵态氮量显著降低了土壤蛋白酶活性;与施N相比,N和P交互作用降低了脲酶活性,减少了N损失和环境污染.
致谢: 感谢耿玉清教授在论文修改方面提供的帮助.
| [1] | Allison S D, Nielsen C, Hughes R F. 2006. Elevated enzyme activities in soils under the invasive nitrogen-fixing tree Falcataria moluccana[J]. Soil Biology & Biochemistry, 38(7): 1537-1544 |
| [2] | Alvaro-Fuentes J, Morell F J, Madejón E, et al. 2013. Soil biochemical properties in a semiarid Mediterranean agroecosystem as affected by long-term tillage and N fertilization[J]. Soil and Tillage Research, 129: 69-74 |
| [3] | Bartelt-Ryser J, Joshi J, Schmid B, et al. 2005. Soil feedbacks of plant diversity on soil microbial communities and subsequent plant growth[J]. Perspectives in Plant Ecology, Evolution and Systematics, 7(1): 27-49 |
| [4] | Beauregard M S, Hamel C, Atul-Nayyar, et al. 2010. Long-term phosphorus fertilization impacts soil fungal and bacterial diversity but not AM fungal community in Alfalfa[J]. Microbial Ecology, 59(2): 379-389 |
| [5] | Behrendt H, Boekhold A. 1993. Phosphorus saturation in soils and groundwaters[J]. Land Degradation and Development, 4(4): 233-243 |
| [6] | Benitez E, Nogales R, Campos M, et al. 2006. Biochemical variability of olive-orchard soils under different management systems[J]. Applied Soil Ecology, 32(2): 221-231 |
| [7] | Bossio D A, Scow K M. 1998. Impacts of carbon and flooding on soil microbial communities: Phospholipid fatty acid profiles and substrate utilization patterns[J]. Microbial Ecology, 35(3/4): 265-278 |
| [8] | 蔡红,沈仁芳.2005.改良茚三酮比色法测定土壤蛋白酶活性的研究[J].土壤学报, 42(2): 306-313 |
| [9] | Carreiro M M, Sinsabaugh R L, Repert D A, et al. 2000. Microbial enzyme shifts explain litter decay responses to simulated nitrogen deposition[J]. Ecology, 81(9): 2359-2365 |
| [10] | Chen X P, Cui Z L, Vitousek P M, et al. 2011. Integrated soil-crop system management for food security[J]. Proceedings of the National Academy of Sciences of the United States of America, 108(16): 6399-6404 |
| [11] | Dinesh R, Srinivasan V, Hamza S, et al. 2012. Short-term effects of nutrient management regimes on biochemical and microbial properties in soils under rainfed ginger(Zingiber officinale Rosc.)[J]. Geoderma, 173-174: 192-198 |
| [12] | Fox T R, Comerford N B. 1992. Rhizosphere phosphatase activity and phosphatase hydrolyzable organic phosphorus in two forested spodosols[J]. Soil Biology & Biochemistry, 24(6): 579-583 |
| [13] | Geisseler D, Horwath W R, Joergensen R G, et al. 2010. Pathways of nitrogen utilization by soil microorganisms-A review[J]. Soil Biology & Biochemistry, 42(12): 2058-2067 |
| [14] | Giacometti C, Demyan M S, Cavani L, et al. 2013. Chemical and microbiological soil quality indicators and their potential to differentiate fertilization regimes in temperate agroecosystems[J]. Applied Soil Ecology, 64: 32-48 |
| [15] | Groffman P M, Fisk M C. 2011. Phosphate additions have no effect on microbial biomass and activity in a northern hardwood forest[J]. Soil Biology & Biochemistry, 43(12): 2441-2449 |
| [16] | Guan G, Tu S X, Li H L, et al. 2011. Phosphorus fertilization modes affect crop yield, nutrient uptake, and soil biological properties in the rice-wheat cropping system[J]. Soil Science Society of America Journal, 77(1): 166-172 |
| [17] | 关松荫. 1983. 土壤酶及其研究法[M]. 北京: 农业出版社. 291-297 |
| [18] | Guo J H, Liu X J, Zhang Y, et al. 2010. Significant acidification in major Chinese croplands[J]. Science, 327(5968): 1008-1010 |
| [19] | Iyyemperumal K, Shi W. 2008. Soil enzyme activities in two forage systems following application of different rates of swine lagoon effluent or ammonium nitrate[J]. Applied Soil Ecology, 38(2): 128-136 |
| [20] | Kautz T, Wirth S, Ellmer F. 2004. Microbial activity in a sandy arable soil is governed by the fertilization regime[J]. European Journal of Soil Biology, 40(2): 87-94 |
| [21] | McGuire K L, Fierer N, Bateman C, et al. 2012. Fungal community composition in neotropical rain forests: the influence of tree diversity and precipitation[J]. Microbial Ecology, 63(4): 804-812 |
| [22] | McKinley V L, Peacock A D, White D C. 2005. Microbial community PLFA and PHB responses to ecosystem restoration in tallgrass prairie soils[J]. Soil Biology & Biochemistry, 37(10): 1946-1958 |
| [23] | Pratt B, Riesen R, Johnston C G, et al. 2012. PLFA analyses of microbial communities associated with PAH-contaminated riverbank sediment[J]. Microbial Ecology, 64(3): 680-691 |
| [24] | Puglisi E, Del Re A A M, Rao M A, et al. 2006. Development and validation of numerical indexes integrating enzyme activities of soils[J]. Soil Biology & Biochemistry, 38(7): 1673-1681 |
| [25] | Ramirez K S, Lauber C L, Knight R, et al. 2010. Consistent effects of nitrogen fertilization on soil bacterial communities in contrasting systems[J]. Ecology, 91(12): 3463-3470 |
| [26] | Rooney D C, Clipson N J W. 2009. Phosphate addition and plant species alters microbial community structure in acidic upland grassland soil[J]. Microbial Ecology, 57(1): 4-13 |
| [27] | Shen W H, Lin X G, Shi W M, et al. 2010. Higher rates of nitrogen fertilization decrease soil enzyme activities, microbial functional diversity and nitrification capacity in a Chinese polytunnel greenhouse vegetable land[J]. Plant and Soil, 337(1/2): 137-150 |
| [28] | Sinsabaugh R L, Gallo M E, Lauber C, et al. 2005. Extracellular enzyme activities and soil organic matter dynamics for northern hardwood forests receiving simulated nitrogen deposition[J]. Biogeochemistry, 75(2): 201-215 |
| [29] | Wright A L, Reddy K R. 2001. Phosphorus loading effects on extracellular enzyme activity in everglades wetland soils[J]. Soil Science Society of America Journal, 65(2): 588-595 |
| [30] | Yuan L, Bao D J, Jin Y, et al. 2011. Influence of fertilizers on nitrogen mineralization and utilization in the rhizosphere of wheat[J]. Plant and Soil, 343(1/2): 187-193 |
| [31] | Zagal E, Muoz C, Quiroz M, et al. 2009. Sensitivity of early indicators for evaluating quality changes in soil organic matter[J]. Geoderma, 151(3/4): 191-198 |
| [32] | 章家恩. 2006. 生态学常用试验研究方法与技术[M]. 北京: 化学工业出版社. 162-169 |
| [33] | 张玉兰, 张丽莉, 陈利军, 等. 2004. 稻-麦轮作系统土壤水解酶及氧化还原酶活性对开放式空气CO2浓度增高的响应[J]. 应用生态学报, 15(6): 1014-1018 |
 2014, Vol. 34
2014, Vol. 34


