2. 上海海洋大学, 上海 201306
2. Shanghai Ocean University, Shanghai 201306
石油烃是由烷烃、烯烃、芳烃、杂环芳烃等多组分复杂分子结构组成的复杂混合物,开采、炼制、贮存运输和使用等人类活动过程是其进入海洋环境中主要途径(Zakaria et al., 2000; 王新红,2001),其中又以海上溢油事故危害巨大(Kingston et al., 2003).各种途径来源的石油污染物进入海洋后,显著特征是在海面形成一层厚度不等的薄膜,干扰海气界面间正常的气体、能量和水分交换,限制光合作用,破坏海洋生态系统的物质循环与能量流动的基础(Lee and Page, 1997).尽管在经过蒸发、光化学作用、微生物分解等一系列物理、化学、生物过程后,部分石油烃进入大气,但大部分石油烃最终以溶解组分或相应的降解组分存在于海洋中,并且有相当部分通过吸附、絮凝和沉淀作用进入沉积物(陈勇民,2002).进入沉积物的石油烃,尽管也会被底泥中的微生物降解,但由于海底低温、缺氧等不利条件,底质中的石油烃降解缓慢,对活动能力较差的各种底栖生物生长、发育、繁殖等生理活动造成短期或者长期毒性危害(Venturini et al., 2008).
海洋中双壳贝类作为一类世界性分布的底栖海洋动物,是海洋中重要的一类生物,也是沿海人工养殖的重要经济海产品,多属于滤食性,移动性较差,生活方式固定(徐凤山,1997).同时由于双壳贝类自身用于代谢的混合氧化系统存在缺陷,对海洋中各类污染物,特别是有机污染物具有较强的富集能力,可以作为较为理想的海洋环境污染监测生物指示种(Gunther et al., 1999; Verlecar et al., 2006; Whittle et al., 1995).测定海洋双壳贝类组织中石油烃浓度巳成为研究和监测海上溢油及其它类型海洋石油污染的一种手段,但在取样次数较少的情况下,很可能对污染的实际状况造成错误认识,因此,在利用海洋双壳贝类监测海洋石油污染时,不仅要考虑石油污染对生物毒性效应的影响,其在生物体内的富集效应也当一并受到关注(贾晓平,1989; 赵美丽,2011).目前,国内外针对石油烃对海洋双壳贝类的短期毒理学研究已有较为全面的进展(Modassir and Ansari, 2012; Fedato et al., 2010; Verlecar et al., 2012),对石油烃在双壳贝类体内的生物富集、累积效应在野外调查、室内实验也均有相关研究(Vi et al., 2009; Stegeman and Teal, 1973),但均缺乏富集过程的动力学描述,对不同形态下的石油烃的生物富集也缺少研究.而海洋双壳贝类等海洋生物对石油烃污染物的生物富集动力学参数的获得是研究石油烃污染对海洋生态系统的影响和建立多介质环境模型的前提和基础,对研究石油烃在海洋环境中的迁移、变化和归宿以及环境评价等也具有重要意义.本文以半静态双箱动力学模型(Pacheco and Santos, 2001)为基础,以燃料油(0#柴油)和原油乳化液作为实验油品,缢蛏(Sinonovacula constricta)为研究对象,通过对富集与释放过程缢蛏体内石油烃含量的动态检测以及对检测结果的非线性曲线拟合,结合对模型的拟合优度检验,量化石油烃在缢蛏体内的生物富集系数,系统地认识其动力学参数特性,比较不同种类石油在缢蛏体内的生物富集特征,探讨石油烃在缢蛏体内的富集机理,为研究、预测生物体对石油烃污染的响应,同时为溢油生态风险的预测提供基础数据.
2 材料与方法(Materials and methods) 2.1 实验材料实验所用海水从江苏省启东市自然海区抽取,盐度为20~21,pH为8.10~8.40,进行沉淀和砂滤,充分曝气(24 h以上)后备用,受试缢蛏采自启东市缢蛏养殖区,实验前首先将缢蛏流水驯养15 d(流速3.6 L · h-1),然后挑选健康个体进行实验.实验缢蛏的个体规格为:平均壳长(5.90±0.31)cm,壳宽为(1.99±0.11)cm,体重(14.60±2.62)g.实验使用40 L的聚乙烯质容器.实验用燃料油为市售0#柴油,原油由中海油东海平湖原油提供,属于轻质原油.
2.2 实验母液的制备将0#柴油、原油分别与过滤海水按1 ∶ 10(V ∶ V)配比,置于超声振荡器中连续振荡3 h,再静置3 h后将水相分离相(实验母液)注入母液贮瓶中(贾晓平和林钦,1998).使用紫外分光光度计法测定石油烃的含量(国家质量监督检验检疫总局,2008).
2.3 实验方法 2.3.1 富集、释放实验实验分为富集和释放两个阶段,分别进行18 d、15 d,在分别经过预实验确定石油烃浓度后,将母液加入到实验容器内后用过滤海水稀释成不同浓度,实验浓度梯度分别设为4组,其中1组为对照,每组设3个平行.0#柴油和原油乳化液的实验浓度梯度分别为:4 mg · L-1、0.8 mg · L-1、 0.16 mg · L-1、0 mg · L-1;5 mg · L-1、1 mg · L-1、0.2 mg · L-1、 0 mg · L-1.每个实验容器内放入40只缢蛏,24 h保持充氧,溶氧量>5.0 mg · L-1,实验期间水温为23.6~25.4 ℃,
富集阶段:实验采用半静态法进行富集实验,整个实验过程中加入海水量为14 L,每24 h换水1次,换水量为100%,每天换水时及时将行为异常或者死亡的贝类捞出.实验开始前采集缢蛏样品,以测量其石油烃本底值.贝类饵料为单独培养扁藻,每天定时定量喂食(8:00和18:00投喂1次扁藻,扁藻密度为2×104 Cell · mL-1,并重新按照设定的浓度系列配置实验溶液.分别于第1 d、4 d、8 d、16 d、19 d采集3个缢蛏样品,剥壳取软体组织,匀浆,迅速冷冻,以备分析.
释放阶段:富集阶段结束后,将每个容器中的实验溶液全部排出,在流水条件下(流速3.6 L · h-1)进行缢蛏体内富集石油烃的释放实验.每天暂停流水状态0.5 h后定时定量喂食(8:00和18:00投喂一次扁藻,扁藻密度为2×104 Cell · mL-1),分别于第20 d、21d、23d、27 d、35 d采集3个缢蛏样品,剥壳取软体组织,匀浆,迅速冷冻,以备分析.
2.4 样品分析使用荧光光度计法测定缢蛏体内石油烃的含量,取已解冻样5.0~10.0 g于60 mL皂化管中,分别加入20 mL 6 mol · L-1 NaOH溶液和20 mL无水乙醇室温避光皂化5~6 h,每隔1.0 h振摇一次,制得皂化液.将皂化液转入250 mL分液漏斗中,10 mL氟里昂(113)分两次洗涤皂化管,洗涤液并入分液漏斗中,加入25 mL氯化钠饱和溶液和80 mL水,振摇2 min,静置分层,将萃取液收集于60 mL蒸馏瓶中.再加10 mL氟利昂重复萃取1次,合并萃取液于蒸馏瓶中.然后65℃减压蒸馏近干,冷却后环己烷溶解定容至10 mL,用 960CRT 荧光分光光度计(激发波长310 nm,发射波长360 nm,狭缝10 nm测定石油烃含量(国家质量监督检验检疫总局,2008).每批样品的处理过程中,进行空白实验,在空白样品中加标测定回收率,进行质量控制样品的检测,回收率在80%~110%,验证了分析方法的可靠性.
2.5 半静态双箱动力学模型半静态双箱动力学模型(Pacheco and Santos, 2001)通常假设污染物在生物体内的生物富集可近似看作是污染物在水相和生物体之间的两相分配过程,同时考虑到了富集和释放两个过程,即生物体从环境中吸收、富集并释放污染物,富集、释放过程可用一级动力学过程进行描述.
其主要描述如下公式所示:
水相

有机相
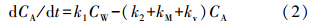
式中,k1为生物吸收速率常数;k2为生物释放速率常数;kv为挥发速率常数;kM为生物体的代谢速率常数;CW为水体污染物含量(mg · L-1);CA为生物体内污染物含量(mg · kg-1).在公式的推导过程中,忽略水体中污染物的自然挥发及生物体的代谢.
由方程(2)得出富集过程(0<t<t*),其中t*为富集阶段结束的天数(d):
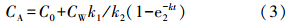
式中,C0为实验开始前生物体中的污染物含量(mg · kg-1).释放过程(t>t*):
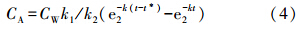
由方程(3)、(4),通过非线性拟合得到k1、k2.理论中,平衡状态下,BCF用以下公式得到:
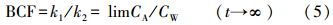
生物的半衰期指的是生物因生命活动过程的结果,体内富集的污染物释放一半所需的时间,用公式表示为:

富集达到平衡时,生物体内污染物含量CAmax用公式表示为:

即使没有达到浓度平衡,双箱动力学模型也可以用来计算理论中平衡状态下的动力学参数.
2.6 数据处理及模型的拟合优度检验使用OriginPro 8软件(OriginLab Corporation,USA)对富集和释放过程中缢蛏体内石油烃含量进行非线性曲线拟合,通过判定系数R2来评价双箱动力学模型的拟合优度,采用F检验对模型整体的显著性进行检验,并对模型的输出值和实际值进行配对t检验,显著性水平α取0.05.
3 结果与分析(Results and analysis) 3.1 缢蛏对0#柴油和原油乳化液的生物富集拟合结果通过对富集和释放过程中缢蛏体内石油烃的动态监测,并采用方程(3)和(4)对监测结果同时进行非线性拟合,得到不同暴露浓度下,缢蛏对0#柴油和原油乳化液的富集与释放曲线(图 1).在缢蛏对0#柴油和原油乳化液的富集阶段,缢蛏体内石油烃富集量呈现先增加后减小的趋势,各浓度0#柴油乳化液富集量增加幅度最高为4 mg · L-1实验组,增加了19.49 mg · d-1,各浓度原油乳化液富集量增加幅度最高为5 mg · L-1实验组,增加了14.20 mg · d-1.在缢蛏对0#柴油和原油乳化液的释放阶段,前期缢蛏体内石油烃含量急剧下降,各浓度0#柴油乳化液在释放的第1 d下降幅度最高为4 mg · L-1实验组,下降幅度为23.28%,各浓度原油乳化液在释放的第1 d下降幅度最高为5 mg · L-1实验组,下降幅度为30.27%,随着释放时间的延长,缢蛏体内石油烃浓度释放速度减慢,在释放的最后27~35 d,尽管释放时间长达7 d,但0#柴油乳化液4 mg · L-1实验组下降幅度仅为10.98%,原油乳化液5 mg · L-1实验组下降幅度仅为20.36%.
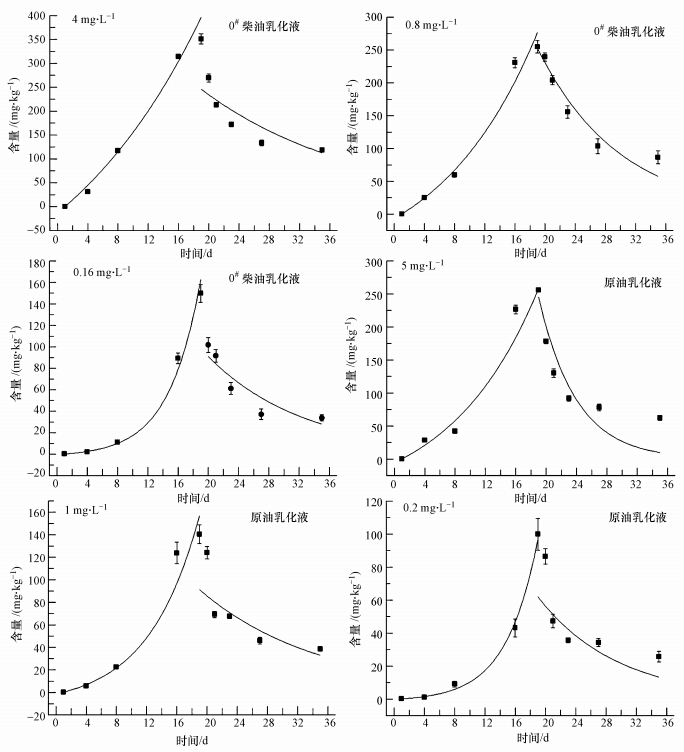 |
| 图 1 不同浓度0#柴油乳化液(4 mg · L-1、0.8 mg · L-1、0.16 mg · L-1)和原油乳化液(5 mg · L-1、1 mg · L-1、0.2 mg · L-1)条件下缢蛏体内石油烃的生物富集曲线 Fig. 1 Accumulation curves of No.0 fuel oil and Pinghu crude oil in S. constricta at different concentrations |
通过对缢蛏体内0#柴油和原油乳化液的富集与释放过程的非线性曲线拟合,得到吸收速率k1,释放速率常数k2,然后根据公式(5)、(6)、(7),得到其它动力学参数BCF、CAmax、B1/2(表 1).各富集动力学参数均具有各自独特的特性,缢蛏对0#柴油、原油乳化液的吸收速率常数k1平均值分别为10.67、7.79,均随外部水体中石油烃浓度的增大而减少;对0#柴油、原油乳化液的释放速率常数k2平均值分别为0.0795、0.0948,与外部水体中石油烃浓度无明显相关性;对0#柴油、原油乳化液的生物富集系数BCF平均值分别为122.56、89.38,均随着外部水体石油烃浓度的增大而减少;平衡状态下生物体内0#柴油、原油乳化液含量CAmax的平均值分别为129.07、110.68 mg · kg-1,均随着外部水体石油烃浓度的增大而增大,且基本成正相关关系;0#柴油在缢蛏体内的生物学半衰期B1/2长于原油乳化液,0#柴油乳化液平均为9.61 d,原油乳化液平均为7.88 d.
| 表 1 缢蛏对不同浓度0#柴油和原油乳化液的富集动力学参数 Table 1 Kinetic parameters of accumulation of No.0 fuel oil and Pinghu crude oil in S. constricta at different concentrations |
在对富集和释放过程中缢蛏体内石油烃进行非线性拟合同时,利用判定系数R2对拟合结果进行检验,各组拟合曲线判定系数R2范围为0.9122~0.9963(表 2),说明拟合程度良好,F检验表明(表 2),模型回归方程是显著的(p<0.05),另外,在模型显著性基础上,对模型的输出值和实际值进行配对t检验,在α=0.05条件下,所有的p>α(表 2),即模型输出结果和实际值差异不显著,上述检验结果表明,本实验条件下半静态双箱动力学模型应用于缢蛏对0#柴油、原油乳化液的生物富集动力学研究是可信的.
| 表 2 半静态双箱动力学模型用于缢蛏对0#柴油和原油乳化液生物富集的拟合优度检验信息 Table 2 Summary of statistical information to assess the goodness-of-fit of the two compartment models applied in the accumulation of No.0 fuel oil and Pinghu crude oil |
海洋双壳贝类多属于底栖滤食性生物,通过自身的出入水管道进行滤食(徐凤山,1997),溶解于水体中的石油烃在贝类滤食的同时从体表或者呼吸器官通过皮肤渗透、呼吸等作用被动吸收并富集于贝类体内(Toro,2004; Vi et al., 2009).主要过程包括烃类物质在环境与细胞或组织之间的主动平衡、芳香烃在细胞水相介质和细胞类脂间的疏水性分配2部分,后者则导致细胞对烃类物质的富集作用程度远超主动平衡过程,加强了生物对环境中烃类物质的吸收作用(Meador et al., 1995; Lauren and Rice, 1985).有研究表明即使石油烃在水中含量很低,双壳贝类体内污染物的富集量仍然能达到很高的程度,高于周围海水含量的1000倍以上(Thomas et al., 2007; Toro et al., 2004),且在同一海域,其富集量要高于甲壳类、鱼类(覃光球和严重玲,2006).本研究取得了与此相一致的研究结果,缢蛏体内石油烃的最高富集量达到了351.10 mg · kg-1(柴油乳化液),为缢蛏体内石油烃本底值(0.21 mg · kg-1)的1600多倍,最低富集量也达了99.99 mg · kg-1(原油乳化液),为缢蛏体内石油烃本底值(0.21 mg · kg-1)的470多倍.
同时,0#柴油和原油乳化液在缢蛏体内的富集量之间存在差异,尽管通过预实验设置的0#柴油乳化液3个浓度组均低于原油乳化液,其在缢蛏体内的富集量却均高于原油乳化液(图 1),其原因可能是不同种类石油的烃类物质组成和含量不同而引起的富集动力学参数的变动.根据分子结构组成,石油烃主要包括烷烃、烯烃、芳香烃、杂环芳香烃等,不同种类石油含有的烃类组分及其含量不同,所具有的特性也有较大差异,其中烷烃、烯烃组分溶解性差,而芳香烃组分在水体中的溶解率高(Zakaria et al., 2000; 王新红,2001),其特性不仅决定了不同种类石油的毒性差异,同时其亲脂能力的大小也决定了不同种类石油在贝类体内富集程度(Neff et al., 1976; Stegeman and Teal, 1973).其中,与饱和烷烃和芳香烃的组成及其绝对含量关系最为密切,特别是芳香烃,不仅溶解性最高,毒性也最大(Mill et al., 2012).本研究所用0#柴油和原油中芳香烃分别约占总组分的5%~25%和10%~35%(姜朝军等,2006),原油高于柴油,但由于原油同时含有胶质、沥青和石蜡等杂质(贾晓平和林钦,1998).因此,尽管在乳化过程中加入体积比一致(0#柴油、原油分别与过滤海水按体积比1 ∶ 10配比),但在乳化过程中0#柴油有更多的可溶性成分溶解于水体中,其溶解于水体中具有生物可利用性的石油烃也高于原油,造成其乳化液在缢蛏体内的富集量高于原油乳化液,这种富集的差异与BCF的变化一致,0#柴油乳化液的BCF同样也高于原油乳化液(表 1).同样,不同种类石油的烃类组分及含量差异所产生的影响也体现在缢蛏对0#柴油乳化液和原油乳化液的释放能力上,在释放阶段,0#柴油乳化液的释放比例(平均为69.91%)也低于原油乳化液(平均为74.17%),表明缢蛏对0#柴油乳化液的代谢能力低于原油乳化液,这与0#柴油和原油乳化液在缢蛏体内的生物半衰期B1/2变化一致,0#柴油乳化液的B1/2同样也高于原油乳化液(表 1).贝类对石油烃的释放主要是受排泄作用以及机体组织和水体间的分配平衡控制,不同种类石油从贝类体内的释放速率也与其烃类组成及其水溶性、分子量相关(Stegeman and Teal, 1973).同时,推测这种影响同样也存在于富集阶段,只是富集阶段时缢蛏对石油烃的富集速率远高于释放速率,从而掩盖了其对富集结果的影响.此外,石油烃在生物体内的富集、释放还受到诸如温度、盐度、pH、氧化还原电位、溶解有机碳、竞争离子、食物可获性等外部环境因素以及生物物种、性别、器官、体重增长速度、营养状态、生长周期等内部因素的影响(薛秋红,2000),需要进一步细化研究.
5 结论(Conclusions)1)缢蛏对0#柴油和原油乳化液最高富集量分别为351.10 mg · kg-1、255.84 mg · kg-1,前期富集迅速,中、后期富集速率逐渐下降,缢蛏对0#柴油和原油乳化液的释放主要集中在前期,中、后期释放速率放缓,模型拟合结果良好.
2)缢蛏对0#柴油、原油乳化液的吸收速率常数k1为3.18~17.52,BCF为39.89~180.01,均随外部水体中石油烃浓度的增大而减少,对0#柴油、原油乳化液的释放速率常数k2为0.0489~0.1251,与外部水体中石油烃浓度无明显相关性,CAmax为23.92~260.33 mg · kg-1,随外部水体中石油烃浓度的增大而增大;3. 0#柴油乳化液在缢蛏体内的富集量高于原油乳化液、释放量低于原油乳化液,与不同种类石油的烃类组分有关.
| [1] | 陈勇民. 2002. 港口水域石油污染生物降解及生物修复技术的基础研究[R]. 西安: 长安大学 |
| [2] | Fedato R P, Simonato J D, Martinez C, et al. 2010. Genetic damage in the bivalve mollusk Corbicula fluminea induced by the water-soluble fraction of gasoline[J]. Mutation Research, 700(1/2): 80-85 |
| [3] | Gunther A J, Davis J A, Hardin D D, et al. 1999. Long-term bioaccumulation monitoring with transplanted bivalves in the San Francisco Estuary[J]. Marine Pollution Bulletin, 38(3): 170-181 |
| [4] | 国家质量监督检验检疫总局. 2008. GB 17378—2007 海洋监测规范[S]. 北京: 中国标准出版社 |
| [5] | 贾晓平. 1989. 紫贻贝(Mytilus edulis)软组织中石油烃化合物释放的动力学研究[J]. 海洋环境科学, 8(3): 1-9 |
| [6] | 贾晓平, 林钦. 1998. 南海原油和燃料油对仔虾和仔鱼的急性毒性试验[J]. 热带海洋, 17(1): 93-98 |
| [7] | 姜朝军, 乔庆林, 蔡友琼, 等. 2006. 菲律宾蛤仔对石油烃的污染动力学和阈值研究[J]. 海洋渔业, 28(4): 314-320 |
| [8] | Lauren D J, Rice S. 1985. Significance of active and passive depuration in the clearance of naphthalene from the tissues of Hemigrapsus nudus (Crustacea: Decapoda)[J]. Marine Biology, 88(2): 135-142 |
| [9] | Lee R F, Page D S. 1997. Petroleum hydrocarbons and their effects in subtidal regions after major oil spills[J]. Marine Pollution Bulletin, 34(11): 928-940 |
| [10] | Meador J P, Stein J E, Reichert W L, et al. 1995. Bioaccumulation of polycyclic aromatic hydrocarbons by marine organisms//Reviews of Environmental Contamination and Toxicology[M]. Seattle: Springer |
| [11] | Mill A C, Rushton S P, Murray A W, et al. 2012. PAH contamination in shellfish: modelling to estimate exposure[J]. Ecotoxicology, 21(2): 393-408 |
| [12] | Modassir Y, Ansari A. 2012. Effect of petroleum hydrocarbon on physiological and biochemical parameters in an estuarine clam, Paphia malabarica[J]. Fishery Technology, 37(1): 40-45 |
| [13] | Neff J M, Cox B A, Dixit D, et al. 1976. Accumulation and release of petroleum-derived aromatic hydrocarbons by four species of marine animals[J]. Marine Biology, 38(3): 279-289 |
| [14] | Kingston P F, Runciman D, Mcdougall J. 2003. Oil contamination of sedimentary shores of the Galápagos Islands following the wreck of the Jessica[J]. Marine Pollution Bulletin, 47(7/8): 303-312 |
| [15] | Pacheco M A R, Santos M A. 2001. Biotransformation, endocrine, and genetic responses of Anguilla anguilla L. to petroleum distillate products and environmentally contaminated waters[J]. Ecotoxicology and Environmental Safety, 49(1): 64-75 |
| [16] | Stegeman J J, Teal J M. 1973. Accumulation, release and retention of petroleum hydrocarbons by the oyster Crassostrea virginica[J]. Marine Biology, 22(1): 37-44 |
| [17] | 覃光球, 严重玲. 2006. 滩涂底栖动物有机污染生态学研究进展[J]. 生态学报, 26(3): 914-922 |
| [18] | Thomas R E, Lindeberg M, Harris P M, et al. 2007. Induction of DNA strand breaks in the mussel (Mytilus trossulus) and clam (Protothaca staminea) following chronic field exposure to polycyclic aromatic hydrocarbons from the Exxon Valdez spill[J]. Marine Pollution Bulletin, 54(6): 726-732 |
| [19] | Toro B, Palma-Fleming H A N, Navarro J M. 2004. Organic pollutant burden of the giant mussels Choromytilus chorus from the south-central Chilean coast[J]. Chemosphere, 55(2): 267-275 |
| [20] | Venturini N, Muniz P, B I Cego M A R C, et al. 2008. Petroleum contamination impact on macrobenthic communities under the influence of an oil refinery: integrating chemical and biological multivariate data[J]. Estuarine, Coastal and Shelf Science, 78(3): 457-467 |
| [21] | Verlecar X N, Pereira N, Desai S R, et al. 2006. Marine pollution detection through biomarkers in marine bivalves[J]. Current Science, 91(9): 1153-1157 |
| [22] | Verlecar X N, Jena K B, Desai S R, et al. 2012. Biomarkers of petroleum contamination in the digestive gland of Perna viridis (L.)[J]. Turkish Journal of Biology, 36(5): 493-505 |
| [23] | Vi N As L, Franco M A, Soriano J A, et al. 2009. Accumulation trends of petroleum hydrocarbons in commercial shellfish from the Galician coast (NW Spain) affected by the Prestige oil spill[J]. Chemosphere, 75(4): 534-541 |
| [24] | 王新红. 2001. 厦门附近海区多相介质中石油烃的组成特征及其生物地球化学指示[D]. 厦门: 厦门大学 |
| [25] | Wetzel D L, van Vleet E S. 2004. Accumulation and distribution of petroleum hydrocarbons found in mussels (Mytilus galloprovincialis) in the canals of Venice, Italy[J]. Marine Pollution Bulletin, 48(9/10): 927-936 |
| [26] | Whittle K J, Mackie P R, Davis H K. 1995. Shellfish tainting-a means of monitoring petroleum-contaminated effluents[J]. Proceedings-Royal Society of Edinburgh B, 103: 127-135 |
| [27] | 徐凤山. 1997. 中国海洋双壳类软体动物[M]. 北京: 科学出版社. 1-333 |
| [28] | 薛秋红. 2000. 经济贝类对石油烃及其特性化合物的生物富集性研究[R]. 青岛: 青岛海洋大学 |
| [29] | Zakaria M P, Horinouchi A I, Tsutsumi S, et al. 2000. Oil pollution in the Straits of Malacca, Malaysia: Application of molecular markers for source identification[J]. Environmental Science & Technology, 34(7): 1189-1196 |
| [30] | 赵美丽. 2011. 栉孔扇贝对石油烃蓄积及响应的初步研究[D]. 青岛: 国家海洋局第一海洋研究所 |
 2014, Vol. 34
2014, Vol. 34


