溴酸盐是臭氧氧化含溴原水产生的副产物(Krasner et al., 1993).美国环境保护署(USEPA)将溴酸盐划分为潜在致癌物,并规定最大容许浓度(MCL)为10 μg · L-1(USEPA,1999),我国最新颁布实施的《生活饮用水卫生标准(GB 5749—2006)》将溴酸根列入常规水质检查指标,并规定限值为10 μg · L-1.
溴酸根在环境中性质稳定,不易分解,一旦形成通过常规工艺去除的难度大.目前减少溴酸根的方法主要有3类,即去除前体物溴离子、控制溴酸根的生成以及溴酸根的去除.控制溴酸根的生成主要从溴酸根的产生途径控制其生成,包括调节原水pH,投加硫酸铵,投加H2O2,减少臭氧投加量,改进臭氧接触方式等(Marhaba et al., 2003).这些方式在生产实践中成本较高,可操作性差,同时可能对臭氧氧化效果有降低作用.溴酸根去除措施有Fe(0)还原(Wang et al., 2009)、离子交换(Wisniewski et al., 2010)、膜技术(Listiarini et al., 2010)、生物降解(Davidson et al., 2011)、活性炭吸附还原(Wang et al., 2010)、新型吸附剂吸附(Zhong et al., 2013; He et al., 2012; Xu et al., 2012;Bhatnagar et al., 2012)等.其中活性炭吸附工艺以其构造简单、成本低廉、易于操作等优势受到广泛关注,但活性炭对溴酸根的吸附性能还有待提高.研究表明,活性炭的物理化学性质对其吸附溴酸根有较大影响,活性炭表面碱性官能团含量大、等电点高有利于溴酸根的吸附(Huang et al., 2008).表面活性剂可以改变活性炭表面电荷特性,利用表面活性剂改性活性炭以提高其高氯酸根吸附能力的研究国内外已有报道(Xu et al., 2011;Parette et al., 2005),如利用阳离子表面活性剂化十六烷基三甲基氯化铵(CTAC)改性后,高氯酸根饱和吸附容量提高1.1倍以上(Xu et al., 2011),但是利用表面活性剂改性活性炭吸附溴酸根的研究较少,不同文献报道的去除效果差别较大(Chen et al., 2012; Farooq et al., 2012).本文介绍了阳离子表面活性剂氯化十六烷基吡啶改性颗粒活性炭的方法及改性颗粒活性炭去除BrO-3的特性,包括初始浓度、pH、共存离子等因素的影响,并进行吸附动力学和热力学分析,初步探讨了改性颗粒活性炭去除溴酸根的机理.
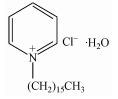
2 材料与方法(Materials and methods) 2.1 试验材料试验所用活性炭为木质颗粒活性炭(16~30目),使用前用去离子水清洗,然后在60 ℃烘24 h备用.试验所需药剂均为分析纯,由相应的钠盐配制1000 mg · L-1的BrO-3、SO2-4、CO2-3、PO3-4和NO-3标准储备液,不同浓度的溶液均由标准储备液稀释而成.改性物质氯化十六烷基吡啶一水合物(1-Hexadecylpyridinium Chloride Monohydrate,或Cetylpyridinium Chloride,CPC)为Adamas化学试剂,分析纯.表 1 为CPC的结构和性质,其中CMC(Critical micelle concentration)为表面活性剂的临界胶束浓度(Hong et al., 2009).
| 表1 阳离子表面活性剂CPC结构及性质 Table.1 Characteristics of cationic polymer CPC |
称取0.2 g GAC添加到100 mL浓度为2 mmol · L-1 的阳离子表面剂CPC溶液中,置于25℃的摇床中振荡24 h,确保达到吸附饱和状态,用去离子水清洗至中性,改性后的活性炭在100 ℃下烘箱中干燥12 h,密闭封存待用,清洗液用两相滴定法测定剩余CPC含量.未改性颗粒活性炭和CPC改性后的颗粒活性炭分别用GAC和GAC-CPC表示.
2.2.2 改性活性炭静态吸附试验取5.00 mg · L-1 BrO-3(39 μmol · L-1)溶液200 mL,准确称取改性活性炭0.2 g与溴酸根溶液一起放于250 mL磨口锥形瓶中,置于(25.0±0.1)℃,转速150 r · min-1的恒温摇床振荡24 h,取样经0.22 μm微孔滤膜过滤后分析BrO-3浓度.改变BrO-3的初始浓度、pH(滴加0.1 mol · L-1 HCl或0.1 mol · L-1NaOH溶液)、温度或增加其它共存阴离子,重复进行吸附试验,考察初始浓度、pH、共存阴离子对GAC-CPC吸附BrO-3的影响.
2.2.3 吸附动力学与吸附等温线动力学试验条件为:准确称取GAC-CPC活性炭0.2 g,放于250 mL磨口锥形瓶中,加入200 mL去离子水配制的溴酸根溶液,置于(25.0±0.1)℃,转速150 r · min-1的恒温摇床振荡,期间定时取样,膜滤后分析BrO-3浓度.吸附等温线试验在4个温度下进行,分别是15 ℃、25 ℃、35 ℃和45 ℃,根据预实验,GAC-CPC取量为0.2 g.在一系列250 mL磨口锥形瓶中,加入GAC-CPC和200 mL不同浓度的BrO-3溶液(0~80 mg · L-1,pH为5.6~5.8),与无GAC-CPC的空白样品瓶同时置于恒温摇床中以150 r · min-1频率振荡,24 h后,取样膜滤后分析.
2.3 分析方法BrO-3采用离子色谱测定.仪器采用Dionex ICS-1000(美国Dionex公司)离子色谱仪分析,采用AS 19(4 mm×250 mm)色谱柱和AG19(4 mm×50 mm)保护柱,150 μL定量进样环.淋洗液KOH浓度为20 mmol · L-1,抑制电流50 mA.阳离子表面改性剂采用以四溴酚酞乙酯钾盐为指示剂的两相滴定法测定(Tsubouchi et al., 1981).
改性活性炭的性能表征.GAC和GAC-CPC比表面积和孔体积采用全自动比表面积和孔隙度分析仪(TriStar 3000,美国麦克公司)检测,等电点采用zeta电位仪(Zetasizer Nauo Z,英国Malvern公司)测定,GAC和GAC-CPC的形貌通过场发射扫描电镜(XL30FEG,荷兰Philips公司)观察.
2.4 计算方法溴酸根的吸附量根据式(1)计算:

表 2为未改性颗粒活性炭GAC和改性颗粒活性炭GAC-CPC的特性.与GAC相比,GAC-CPC的比表面积由710 m2 · g-1降至388 m2 · g-1,总孔体积由0.35 cm3 · g-1降至0.25 cm3 · g-1.比表面积和总孔体积分别下降45%和29%,说明CPC已负载到GAC的孔道结构中,通过两相滴定法测定清洗液剩余CPC量进而计算出CPC在活性炭上的负载量为0.96 mmol · g-1.
| 表2 GAC和GAC-CPC特性 Table.2 Characteristics of GAC and GAC-CPC |
图 1为GAC和GAC-CPC的扫描电镜图,放大倍数为50000倍.由图可见,未改性的颗粒活性炭GAC含有大量小孔并构成复杂的孔结构,经CPC改性后的改性活性炭,孔道被CPC覆盖或填充,导致其比表面积和孔体积减少,这点可从表 2所列比表面积和孔径特征看出.
 |
| 图 1 GAC(a)和GAC-CPC(b)的扫描电镜图 Fig. 1 SEM micrographs of the virgin GAC(a) and GAC-CPC(b) |
图 2为不同pH下GAC和GAC-CPC的zeta电位,由图 2可知,GAC和GAC-CPC的pHpzc分别为5.48和8.64.经CPC改性后,GAC-CPC的等电点增大,在试验pH范围3~11内,GAC-CPC的zeta电位均高于GAC的相应值,这可能是因为CPC中氯解离产生带正电的基团(CP+),从而使得GAC-CPC等电点增大.
 |
| 图 2 不同pH下GAC和GAC-CPC的zeta电位 Fig. 2 Zeta potentials of the GAC and GAC-CPC at different pH values |
考察了不同BrO-3初始浓度对GAC-CPC吸附量的影响.图 3所示为BrO-3初始浓度分别为5.00 mg · L-1、10.00 mg · L-1和20.00 mg · L-1时,吸附量随时间的变化趋势.由图 3可知,BrO-3初始浓度对吸附量有较大影响,初始浓度越大,GAC-CPC对BrO-3的吸附量越大.溴酸根初始浓度分别为5.00 mg · L-1、10.00 mg · L-1和20.00 mg · L-1时,GAC-CPC对BrO-3的平衡吸附量分别为4.54 mg · g-1、8.82 mg · g-1和16.53 mg · g-1. 这是因为GAC-CPC具有大量活性吸附位,在试验浓度范围内,GAC-CPC尚未达到吸附饱和,较低浓度的BrO-3未能完全占据GAC-CPC上的活性吸附位,随着初始浓度的升高,BrO-3占据的吸附位增多,导致吸附量增大.
 |
| 图 3 初始浓度对溴酸根去除的影响 Fig. 3 Effect of initial concentration on bromate removal |
图 4为BrO-3初始浓度为5.00 mg · L-1时,pH对BrO-3去除的影响.图 4可见,在试验pH范围内,改性活性炭对BrO-3吸附过程受pH的影响远小于未改性活性炭.pH由4.06增至7.96时,GAC对BrO-3吸附量由2.53 mg · g-1降至0.56 mg · g-1,而GAC-CPC对BrO-3的吸附量均在4.12 mg · g-1以上.这是因为相比于GAC,GAC-CPC的表面pHpzc增大,由图 2知,GAC和GAC-CPC等电点分别为5.48和8.64,当pH>5.48时,GAC表面带负电,其与BrO-3离子间的静电引力作用变为静电斥力作用,导致吸附量降低,而GAC-CPC在pH<8.64时,表面带正电,GAC-CPC与BrO-3之间为静电引力作用增强了其对溴酸根的吸附.当pH由9增至11时,GAC-CPC对BrO-3的吸附量由3.88 mg · g-1降至1.85 mg · g-1.这是因为pH>8.64时,GAC-CPC表面呈电负性且负电荷随pH增大而增加,从而降低了GAC-CPC表面对BrO-3的静电作用,同时,强碱性条件下大量OH-与BrO-3形成竞争吸附,占据了GAC-CPC上的大部分活性吸附位,减少吸附量.强酸性条件下,GAC-CPC对BrO-3的吸附量有所下降可能是因为在调节pH时,引入的Cl-浓度过高对BrO-3的吸附有阻碍作用,抵消了氢离子浓度增加带来的促进作用.
 |
| 图 4 pH对溴酸根去除的影响 Fig. 4 Effect of pH on bromate removal |
天然水体中一般存在的SO2-4、CO2-3等离子与BrO-3可能在GAC-CPC上形成竞争吸附,分别考察溶液中共存阴离子对浓度为5.00 mg · L-1 的BrO-3在GAC-CPC上的吸附的影响,为消除阳离子的影响均采用钠盐.图 5为溶液里SO2-4、CO2-3、NO-3和PO3-4各自浓度与BrO-3浓度的摩尔比为1~20时,GAC-CPC对BrO-3的吸附量.由图 5可知,投加其他阴离子后,溴酸根的去除量总体呈下降趋势,当NO-3、SO2-4、PO43和CO2-3浓度分别为48.48 mg · L-1、75.12 mg · L-1、74.27 mg · L-1、46.93 mg · L-1时,GAC-CPC对BrO-3的平衡吸附量分别降至为原来的26%、44%、53%和63%,说明NO-3、SO2-4、PO43和CO2-3在GAC-CPC上与BrO-3存在明显的竞争吸附,占据了部分属于BrO-3的活性吸附位,降低了GAC-CPC对BrO-3的吸附量.4种阴离子(浓度在39~780 μmol · L-1之间,初始pH为6.0)对GAC-CPC吸附BrO-3的影响顺序为NO-3>SO2-4>PO3-4>CO2-3,这与4种阴离子的水合自由能(ΔGh,kJ · mol-1)大小顺序基本一致:即NO-3为-300 kJ · mol-1,SO2-4为-1080 kJ · mol-1,PO3-4为-2773 kJ · mol-1,CO2-3为-1315 kJ · mol-1(Chitrakar et al., 2011).水中存在的干扰离子对溴酸根吸附的影响与离子的水合程度有关,一价阴离子NO-3的水合度最低,因此,竞争吸附效果最明显.此外,二价阴离子CO2-3的竞争吸附影响大于三价阴离子PO3-4的影响,这可能与干扰离子本身的结构以及GAC-CPC表面结构和性质有关.
 |
| 图 5 共存阴离子对溴酸根去除的影响 Fig. 5 Effect of coexisting anions on bromate removal |
准一级和准二级和颗粒内扩散动力学模型分别可用公式(2)~(4)表示(Bhatnagar et al., 2009):

将图 3中数据分别带入公式(2)~(4),通过作图法计算出不同初始浓度下GAC-CPC吸附BrO-3的动力学参数,列于表 3中.分析表 3所列动力学数据并比较相关系数R2发现,准二级动力学方程拟合最好(R2>0.995),说明其在GAC-CPC对BrO-3的吸附过程中占主导地位.BrO-3初始浓度从5.00 mg · L-1升高到20.00 mg · L-1时,准二级动力学初始吸附速率h由0.2329 mg · g-1 · min-1增至0.8020 mg · g-1 · min-1,这是因为较大的初始浓度导致吸附初期溴酸根在液相和固相间的扩散速度加快,相同质量的GAC-CPC上的活性吸附位很快被BrO-3占据从而影响反应动力学.
| 表3 GAC-CPC吸附溴酸根的动力学参数 Table.3 Kinetic parameters for adsorption of bromate on GAC-CPC |
图 6为溴酸根在GAC-CPC上吸附的颗粒内扩散模型拟合,颗粒内扩散模型拟合为一条直线时说明吸附过程主要由颗粒内扩散控制,反之则存在多个反应阶段分别对应不同反应动力学模型(Bhatnagar et al., 2009).由图 6可见,GAC-CPC吸附BrO-3的过程包括两个阶段,在阶段一(0~60 min),当BrO-3初始浓度分别为5.00 mg · L-1、10.00 mg · L-1和20.00 mg · L-1时,GAC-CPC分别吸附了72%、78%和75%的BrO-3,相关系数R2>0.8971,说明初期的吸附速率主要由颗粒内扩散控制.随着吸附达到一定时间,颗粒内扩散模型不再适用于BrO-3在GAC-CPC上的吸附.这可能是由于随着BrO-3吸附量的增加,空间位阻和静电作用导致吸附在GAC-CPC表面的BrO-3孔内扩散阻力增大.
 |
| 图 6 GAC-CPC吸附溴酸根的颗粒内扩散模型拟合曲线 Fig. 6 Intraparticle diffusion plots for adsorption of bromate onto GAC-CPC |
吸附等温线是描述一定温度下吸附平衡时的吸附特性的曲线,用Langumiur和Freundlich吸附模型对15 ℃、25 ℃、35 ℃和45 ℃下的试验数据进行拟合如公式(5)~(6)所示(Bhatnagar et al., 2009):
Langmuir吸附模型:


Langmuir等温线特性可由平衡常数的无量纲系数RL(Bhatnagar et al., 2009)表示:

式(7)中,C0max为溴酸根最大初始浓度,80 mg · L-1.
两种模型的拟合结果见表 4,从表 4可看出,在288~318 K温度区间内,Langmuir模型拟合曲线的线性相关性R2值较Freundlich模型拟合曲线的R2值大,这说明GAC-CPC对BrO-3的吸附更符合Langmuir模型,即该吸附过程类似于单分子层吸附过程.在298 K下,溴酸根在GAC-CPC上的饱和吸附容量为47.17 mg · g-1,优于Chen等(2012)利用CTAC改性GAC对溴酸根的吸附效果.此外,Langmuir等温线特性可由平衡常数RL介于0~1之间说明溴酸根在GAC-CPC上的吸附容易进行(Bhatnagar et al., 2009).
| 表4 不同温度下GAC-CPC吸附溴酸根的Langmuir和Freundlich等温线参数 Table.4 Langmuir and Freundlich constants for adsorption of bromate on GAC-CPC at different temperatures |
吸附热力学从能量的角度描述溴酸根在GAC-CPC上的吸附过程,根据Van′t Hoff方程,吸附Gibbs自由能ΔG0、焓变ΔH0和熵变ΔS0可由公式(8)和(9)表示(Cho et al., 2011):


不同温度下的吸附Gibbs自由能变ΔG0、焓变ΔH0和熵变ΔS0见表 5.自由能ΔG0为负值说明GAC-CPC吸附BrO-3是自发进行的.ΔH0为负值说明反应是放热的,升温不利于BrO-3在GAC-CPC上的吸附,这点可以从表 4所示温度升高,Langmuir等温吸附模型拟合的饱和吸附容量降低的现象得到验证.ΔS0为负值说明溴酸根从水中溶解的自由态到被吸附状态是固/液界面有序度增加的过程.根据Makhorin等(Lyubchik et al., 2004)测定的离子交换反应导致的焓变值为8.4 kJ · mol-1,对比表 5所示ΔH0值,说明GAC-CPC吸附BrO-3过程可能存在离子交换力.此外,根据Von Oepen等(Yue et al., 2007)测定的吸附中可能存在的相互作用力的自由能,如范德华力4~10 kJ · mol-1,疏水作用力约5 kJ · mol-1,氢键结合力2~40 kJ · mol-1,配位体交换力约40 kJ · mol-1,偶极力2~29 kJ · mol-1,化学键力大于60 kJ · mol-1,对比试验ΔH0计算结果(表 5),GAC-CPC吸附BrO-3的过程中,除了化学键力和配位体交换力,其他作用力有可能存在.
| 表5 不同温度下溴酸根在GAC-CPC上吸附的热力学参数 Table.5 Thermodynamic parameters for adsorption of bromate on GAC-CPC at different temperatures |
1)CPC改性GAC可以有效去除水中BrO-3,但受反应条件影响.吸附量随BrO-3浓度增加而增大,pH为4.06~7.96时去除率较高,共存离子对BrO-3去除的影响顺序为:NO-3>SO2-4>PO3-4>CO2-3.
2)准二级动力学模型可很好地描述BrO-3在GAC-CPC上吸附动力学过程.Langmuir模型能很好的拟合BrO-3在GAC-CPC上吸附平衡的过程,温度为15 ℃、25 ℃、35 ℃和45 ℃时的饱和吸附容量分别为49.06 mg · g-1、47.17 mg · g-1、46.49 mg · g-1和40.87 mg · g-1.热力学分析说明BrO-3在GAC-CPC上吸附是自发且放热的,升温不利于吸附.
| [1] | Bhatnagar A, Choi Y, Yoon Y, et al. 2009. Bromate removal from water by granular ferric hydroxide (GFH)[J]. Journal of Hazardous Materials, 170(1): 134-140 |
| [2] | Bhatnagar A, Sillanp M. 2012. Sorption studies of bromate removal from water by Nano-Al2O3[J]. Separation Science and Technology, 47(1): 89-95 |
| [3] | Chen W F, Zhang Z Y, Li Q, et al. 2012. Adsorption of bromate and competition from oxyanions on cationic surfactant-modified granular activated carbon (GAC)[J]. Chemical Engineering Journal, 203: 319-325 |
| [4] | Chitrakar R, Makita Y, Sonoda A, et al. 2011. Adsorption of trace levels of bromate from aqueous solution by organo-montmorillonite[J]. Applied Clay Science, 51(3): 375-379 |
| [5] | Cho D W, Chon C M, Kim Y, et al. 2011. Adsorption of nitrate and Cr(VI) by cationic polymer-modified granular activated carbon[J]. Chemical Engineering Journal, 175: 298-305 |
| [6] | Davidson A N, Chee-Sanford J, Lai H Y M, et al. 2011. Characterization of bromate-reducing bacterial isolates and their potential for drinking water treatment[J]. Water Research, 45(18): 6051-6062 |
| [7] | Farooq W, Hong H J, Kim E J, et al. 2012. Removal of Bromate BrO3- from water using cationic surfactant-modified powdered activated carbon SM-PAC[J]. Separation Science And Technology, 47(13): 1906-1912 |
| [8] | He S L, Zhang D D, Gu L, et al. 2012. Bromate adsorption using Fe-pillared bentonite[J]. Environmental Technology, 33(20): 2337-2344 |
| [9] | Hong H J, Kim H, Lee Y J, et al. 2009. Removal of anionic contaminants by surfactant modified powdered activated carbon (SM-PAC) combined with ultrafiltration[J]. Journal of Hazardous Materials, 170(2/3): 1242-1246 |
| [10] | Huang W, Cheng Y. 2008. Effect of characteristics of activated carbon on removal of bromate[J]. Separation and Purification Technology, 59(1): 101-107 |
| [11] | Krasner S W, Glaze W H, Weinberg H S, et al. 1993. Formation and control of bromate during ozonation of waters containing bromide[J]. Journal-American Water Works Association, 85(1): 73-81 |
| [12] | Listiarini K, Tor J T, Sun D D, et al. 2010. Hybrid coagulation-nanofiltration membrane for removal of bromate and humic acid in water[J]. Journal of Membrane Science, 365(1/2): 154-159 |
| [13] | Lyubchik S I, Lyubchik A I, Galushko O L, et al. 2004. Kinetics and thermodynamics of the Cr(Ⅲ) adsorption on the activated carbon from co-mingled wastes[J]. Colloids and Surfaces(A: Physicochemical and Engineering Aspects), 242(1/3): 151-158 |
| [14] | Marhaba T, Bengrane K. 2003. Review of strategies for minimizing bromate formation resulting from drinking water ozonation[J]. Clean Technologies and Environmental Policy, 5(2): 101-112 |
| [15] | Parette R, Cannon F S, Weeks K. 2005. Removing low ppb level perchlorate, RDX, and HMX from groundwater with cetyltrimethylammonium chloride (CTAC) pre-loaded activated carbon[J]. Water Research, 39(19): 4683-4692 |
| [16] | Tsubouchi M, Mitsushio H, Yamasaki N. 1981. Determination of cationic surfactants by two-phase titration[J]. Analytical Chemistry, 53(12): 1957-1959 |
| [17] | USEPA. 1999. EPA 815-R-99-014 Alternative disinfectants and oxidants, Guidance Manual[S].Washington D C: Office of Water |
| [18] | Wang L, Zhang J, Liu J Z, et al. 2010. Removal of bromate ion using powdered activated carbon[J]. Journal of Environmental Sciences, 22(12): 1846-1853 |
| [19] | Wang Q, Snyder S, Kim J, et al. 2009. Aqueous ethanol modified nanoscale zerovalent iron inbromate reduction: synthesis, characterization, and reactivity[J]. Environmental Science and Technology, 43(9): 3292-3299 |
| [20] | Wisniewski J A, Kabsch-Korbutowicz M. 2010. Bromate removal in the ion-exchange process[J]. Desalination, 261(1/2): 197-201 |
| [21] | Xu C H, Shi J J, Zhou W Z, et al. 2012. Bromate removal from aqueous solutions by nano crystalline akaganeite (β-FeOOH)-coated quartz sand (CACQS)[J]. Chemical Engineering Journal, 187: 63-68 |
| [22] | Xu J H, Gao N Y, Deng Y, et al. 2011. Perchlorate removal by granular activated carbon coated with cetyltrimethyl ammonium chloride[J]. Desalination, 275(1/3): 87-92 |
| [23] | Yue Q Y, Li Q, Gao B Y, et al. 2007. Formation and characteristics of cationic-polymer/bentonite complexes as adsorbents for dyes[J]. Applied Clay Science, 35(3/4): 268-275 |
| [24] | Zhong Y, Yang Q, Luo K, et al. 2013. Fe(Ⅱ)-Al(Ⅲ) layered double hydroxides prepared by ultrasound-assisted co-precipitation method for the reduction of bromate[J]. Journal of Hazardous Materials, 250-251: 345-353 |
 2014, Vol. 34
2014, Vol. 34