2. 国家海洋环境监测中心, 大连 116023;
3. 大连海事大学 环境科学与工程学院, 大连 116026
2. National Marine Environmental Monitoring Center, Dalian 116023;
3. College of Environmental Science and Engineering, Dalian Maritime University, Dalian 116026
2,4-二氯苯氧乙酸(2,4-D)是一种广泛使用的氯代苯氧羧酸类除草剂,也是一种难生物降解的有机污染物,会对人体产生潜在的致癌和致突变效应(Sutherland et al., 2003).在水环境中,2,4-D的光解作用是其非生物转化的重要途径(吴星卫等,2011).微藻是水域生态系统中的主要初级生产者,其分布范围广,种类多,环境适应性强(徐宁等,2013).已有的研究发现,微藻可以参与有机污染物的光化学反应过程.例如,Zepp等(1983)研究了多环芳烃、有机磷化合物、苯胺等22种有机物在绿藻和蓝藻存在时的光转化速率,发现对硫磷和甲基对硫磷在衣藻(Chlamydomonas)水溶液中的光降解速率比在纯水中提高了390倍,而甲苯胺和苯胺的光降解速率则提高了12000倍;Hirooka等(2003)发现淡水小球藻(Chlorella fusca)和项圈藻(Anabaena variabilis)可明显促进水中2,4-二硝基苯酚的降解;Liu等(2003)也发现淡水菱形藻(Nitzschia hantzschiana)可加速环境内分泌干扰物17α-乙炔雌二醇的降解速率.
藻类细胞在生长过程中不断向周围释放许多代谢产物,研究者将藻细胞的代谢产物称为胞外分泌物(Extracellular Organic Matter,EOM),这类物质主要由蛋白质、多糖和腐殖酸等成分组成(Huang et al., 2009; Qu et al., 2012).藻类的EOM使藻细胞周围形成一种独特的微环境,藻细胞可通过微环境与外界环境相互作用(Pivokonsky et al., 2006; Henderson et al., 2008).此外,已有的研究表明,水环境中的腐殖酸及有机物降解过程中产生的部分有机小分子物质,会对有机污染物的光化学转化产生重要影响(Ou et al., 2007; 于春艳等,2010).但目前还未见微藻EOM对水环境中有机污染物光化学转化影响的研究报道.此外,天然水环境中的硝酸根离子(NO-3)和亚硝酸根离子(NO-2)均具有一定的光化学活性(Bouillon et al., 2005; Nélieu et al., 2009).在太阳光辐射下,水中NO-3、NO-2可生成· OH、NO ·和NO2 ·等活性中间体,引发芳香族有机物的氧化、硝化和亚硝化反应,也会影响有机污染物的环境归宿(Brezonik et al., 1998; 展漫军等,2004; Dimou et al., 2005).因此,本研究以2,4-D作为目标污染物,考察不同浓度微藻EOM对2,4-D光解的影响,同时研究微藻EOM与NO-3或(和)NO-2共存时对2,4-D光解作用的影响.本研究结果可为有机污染物的水环境光化学转化和环境生态风险评价提供参考资料.
2 材料与方法(Materials and methods) 2.1 材料2,4-D(纯度≥99%)购自美国ED公司,甲醇(色谱纯)购自美国Tedia公司,硝酸钠、亚硝酸钠、磷酸等试剂均为分析纯(天津科密欧化学试剂有限公司).实验用海水为大连黑石礁近岸海域表层海水(盐度 28.7,pH=8.02),经0.45 μm滤膜过滤后使用.海水小球藻(Chlorella vulgaris)和新月菱形藻(Nitzschia closterium)取自大连海洋大学藻种室,经培养达到指数生长期后待用.
2.2 实验方法2,4-D储备液(500 mg · L-1)用甲醇配制,置于冰箱中避光保存,使用期限为1个月.海水小球藻和新月菱形藻的EOM是通过3000 r · min-1离心获得,将两种微藻的EOM母液以过滤海水稀释成不同浓度的使用液,并采用总有机碳(TOC)分析仪测定的TOC值作为微藻EOM的浓度.2,4-D光解实验在自制的旋转式光化学反应装置(图 1)中进行,光源为置于冷凝石英套管中的300 W高压汞灯,光照强度为18.5 mW · cm-2.选择容积为30 mL的PYREX试管(可滤掉波长小于290 nm光)作为光化学反应器.反应溶液中2,4-D的初始浓度为2 mg · L-1,分别加入不同浓度的海水小球藻和新月菱形藻的EOM,以及不同浓度的NO-3或(和)NO-2溶液,将反应物混合后转移至PYREX试管中,经搅拌后,打开光源进行光解实验.光化学实验在室温下进行,同时设置空白对照和黑暗对照.光化学反应时间为14 h,定时取样.样品经0.22 μm的针孔滤膜(天津市津腾实验设备有限公司)过滤后,用高效液相色谱仪(美国Waters公司)测定样品中2,4-D浓度.液相色谱的流动相选择甲醇和0.2%磷酸溶液(V ∶ V=65 ∶ 35),流动相流速为1.0 mL · min-1,检测波长为230 nm.
 |
| 图 1 旋转式光化学反应装置的结构示意图 Fig. 1 The schematic diagram of rotary photochemical reactor |
本实验中,在黑暗对照条件下,溶液中2,4-D的浓度未发生变化,这说明水中2,4-D的其它转化反应在本实验条件下可以忽略.图 2为分别加入海水小球藻及新月菱形藻EOM后,溶液中2,4-D的浓度随时间的变化趋势.从实验结果可以看出,2,4-D的光解反应遵循准一级反应动力学过程,准一级反应速率常数k可根据公式 ln(C/C0)=-k · t 来计算,其中,C代表在t时刻溶液中2,4-D的浓度,C0为反应溶液中2,4-D的初始浓度.在波长大于290 nm的模拟太阳光照射下,空白对照海水中的2,4-D可发生光解反应,其光解速率常数k为0.0345 h-1.随着反应溶液中两种藻类EOM浓度的增加,2,4-D光解速率常数均出现下降.此外,当溶液中海水小球藻EOM的初始浓度从0.958 mg · L-1增加至8.621 mg · L-1时,2,4-D光解速率常数由0.0225 h-1降至0.0126 h-1(图 2a);当溶液中新月菱形藻EOM的初始浓度从1.209 mg · L-1增加至10.882 mg · L-1时,2,4-D光解速率常数由0.0224 h-1降至0.0155 h-1(图 2b).
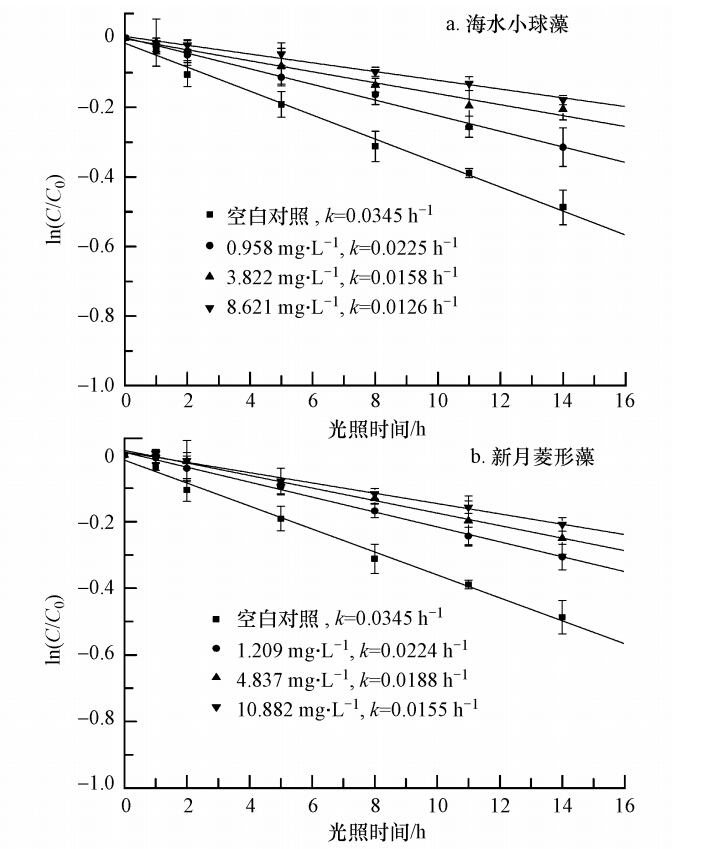 |
| 图 2 海水中不同浓度海水小球藻及新月菱形藻EOM对2,4-D光解的影响 Fig. 2 Effects of different Chlorella vulgaris and Nitzschia closterium EOM concentrations on 2,4-D photodegradation in seawater |
图 3为一定浓度的海水小球藻和新月菱形藻EOM与不同浓度的NO-2对2,4-D光解的影响.本研究设定实验体系中2,4-D的初始浓度为2 mg · L-1,在波长大于290 nm的模拟太阳光照射下,光照强度选择18.5 mW · cm-2,当溶液中海水小球藻和新月菱形藻EOM分别为0.958 mg · L-1和1.209 mg · L-1时,溶液中2,4-D光解速率常数均随着NO-2浓度的增加而增加.由图 3a可知,当溶液中NO-2浓度为2.3 mg · L-1时,2,4-D光解速率常数已达到0.0297 h-1,虽然低于空白海水对照的光解速率常数(0.0345 h-1),但已高于未加NO-2的海水小球藻EOM的光解速率常数(0.0225 h-1).当溶液中NO-2浓度由23 mg · L-1增加至230 mg · L-1时,2,4-D光解速率常数由0.0514 h-1升高至0.0728 h-1(比海水小球藻EOM光解速率常数提高近3.25倍).由图 3b可知,当溶液中NO-2浓度仅为2.3 mg · L-1时,2,4-D光解速率常数已达到0.0490 h-1,明显高于空白海水对照的光解速率常数,比新月菱形藻EOM光解速率常数提高了2.19倍.
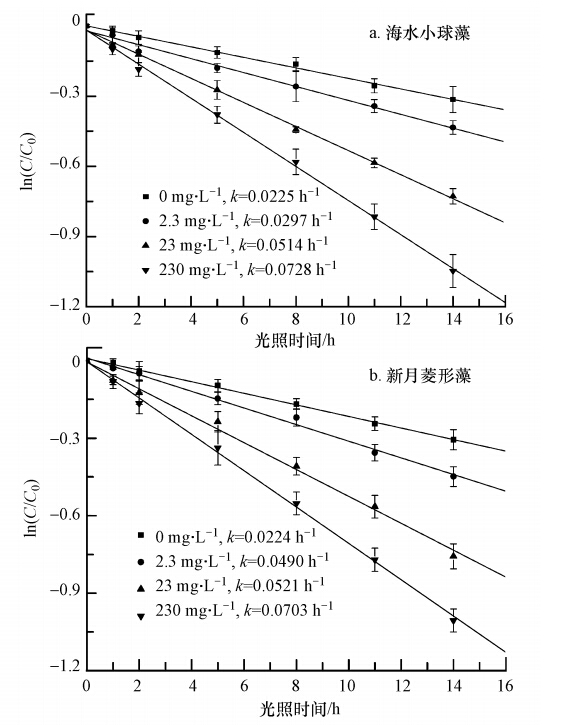 |
| 图 3 海水小球藻EOM(a)及新月菱形藻EOM(b)与不同浓度NO-2共存对2,4-D光解的影响 Fig. 3 Effects of Chlorella vulgaris EOM(a),Nitzschia closterium EOM(b) and different concentrations of NO-2 coexistent on 2,4-D photodegradation in seawater |
当溶液中海水小球藻和新月菱形藻EOM分别为0.958 mg · L-1和1.209 mg · L-1时,溶液中NO-3对2,4-D(2 mg · L-1)光解的影响如图 4所示.随着溶液中NO-3浓度增加,海水小球藻和新月菱形藻EOM溶液中2,4-D光解速率均增加.当反应溶液中NO-3浓度由3.1 mg · L-1增加至310 mg · L-1时,对于海水小球藻,其光解速率常数k由0.0225 h-1增至0.0627 h-1(图 4a);对于新月菱形藻,其光解速率常数k由0.0224 h-1增至0.0706 h-1(图 4b).
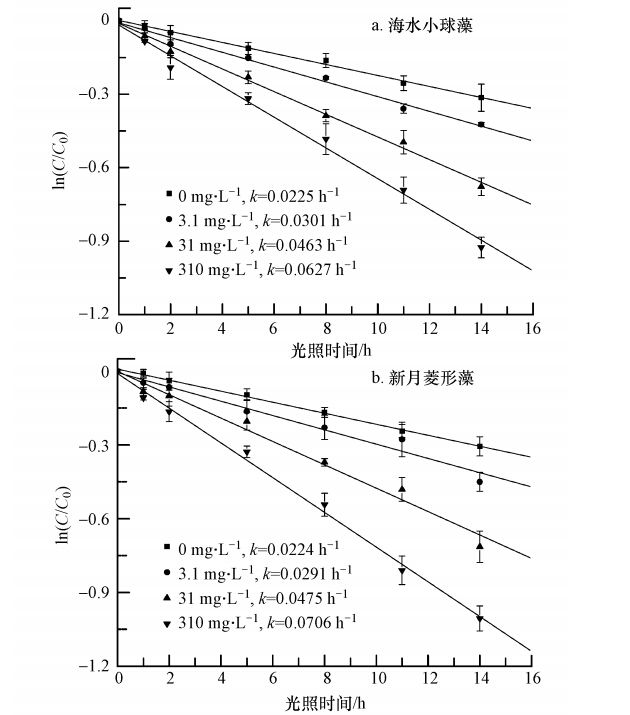 |
| 图 4 海水小球藻EOM(a)及新月菱形藻EOM(b)与不同浓度NO-3共存对2,4-D光解的影响 Fig. 4 Effects of Chlorella vulgaris EOM(a),Nitzschia closterium EOM(b) and different concentrations of NO-3 coexistent on 2,4-D photodegradation in seawater |
由于NO-2和NO-3是天然水环境中两种主要的无机阴离子,常共存于同一水体中,因此,本研究考察了微藻EOM与NO-2、NO-3共存时对2,4-D光解的影响.图 5a是海水小球藻EOM(0.958 mg · L-1)与NO-2、NO-3共存时对2,4-D(2 mg · L-1)光解的影响,可见2,4-D在海水小球藻EOM体系中的光解速率常数k由0.0225 h-1增至0.0804 h-1,光解速率常数提高近3.57倍.图 5b是新月菱形藻EOM(1.209 mg · L-1)与NO-2、NO-3共存时对2,4-D(2 mg · L-1)光解的影响,可见在新月菱形藻体系中的光解速率常数k由0.0224 h-1增至0.0923 h-1,光解速率常数提高近4.12倍.
 |
| 图 5 海水小球藻EOM(a)及新月菱形藻EOM(b)与不同浓度NO-2、NO-3共存对2,4-D光解的影响 Fig. 5 Effects of Chlorella vulgaris EOM(a),Nitzschia closterium EOM(b) and different concentrations of NO-2, and NO-3 coexistent on 2,4-D photodegradation in seawater |
2,4-D是一种常用的农田除草剂,其分子结构在260~300 nm的紫外区有吸收带,经光照射后,2,4-D本身可以吸收290~300 nm区域的光子而发生直接光解(Ou et al., 2007).本研究发现,海水中2,4-D光解速率常数随着反应溶液中海水小球藻和新月菱形藻EOM浓度的增加而下降,表明海水中2,4-D光解过程受到两种微藻EOM的抑制.此外,在相同的实验条件下,海水小球藻和新月菱形藻EOM对2,4-D光解速率常数影响略有差异,这表明两种微藻的EOM对2,4-D光解过程的抑制程度略有不同.海水小球藻EOM的抑制作用稍强于新月菱形藻,这可能与不同微藻产生的EOM种类和不同种类EOM成分的相对比例关系不同有关(Huang et al., 2009).已有的研究结果证实,微藻在生长过程中产生的EOM,其主要成分中包含腐殖酸(Qu et al., 2012).而在我们的前期研究中发现,氙灯照射下腐殖酸的存在抑制了2,4-D的光解,并且随着腐殖酸浓度的增加抑制作用越明显.这主要是由于腐殖酸具有很强的吸光能力,在一定光强的照射下,溶液中的腐殖酸可以与2,4-D竞争光子,提供给2,4-D光解的光子量相对减少,导致2,4-D光解受到一定程度抑制.因此,海水小球藻和新月菱形藻EOM中存在的腐殖酸,可能是导致2,4-D光解受到抑制的主要原因.
4.2 海水小球藻和新月菱形藻EOM与NO-2、NO-3对2,4-D光解的影响在可见光照射下,海水中的NO-2可减弱海水小球藻和新月菱形藻EOM对2,4-D光解的抑制作用.与海水小球藻EOM相比,低浓度的NO-2在新月菱形藻EOM溶液中对2,4-D光解的促进作用更加明显.已有研究结果证实,NO-2可以吸收太阳光的辐射,其光化学反应主要生成NO ·和NO2 ·等自由基,这些活性自由基可促进水中部分有机污染物光解(Dimou et al., 2005).另外,Zafiriou和True(1979)认为天然水体中NO-2光解还可以生成· OH等活性自由基.· OH是一个强氧化剂,能够与大多数有机化合物反应,因而水中NO-2的光化学反应可以提高有机污染物的光解速率.但目前也有一些研究结果表明,NO-2对水中部分有机污染物的光解过程表现出抑制作用.褚明杰等(2006)研究发现,NO-2对苯噻草胺的光降解有猝灭作用,并随着NO-2浓度的增大猝灭作用更明显;陈容等(2010)认为NO-2对三唑磷在海水中光解的抑制作用是随NO-2浓度的增大而增强;何占伟等(2011)发现随着NO-2浓度的增加,NO-2对环丙沙星光解表现出抑制作用.在本研究过程中,即使在微藻EOM的影响下,NO-2对海水中2,4-D的光解仍起到促进作用,并随着水中NO-2浓度的增大,2,4-D光解速率增加.
海水小球藻和新月菱形藻EOM溶液中加入NO-3后,对2,4-D的光解同样表现出促进作用.Zafiriou和True等(1979)研究发现,NO-3会影响天然水环境中污染物质的光降解,表现出较强的化学活性,NO-3吸收光子后产生活性氧自由基(ROS),随着水中NO-3浓度提高,对有机污染物光解的促进作用增强.展漫军等(2005)对双酚A在天然水体中的光降解行为进行研究时发现,双酚A在NO-3存在时的光解反应更迅速.季跃飞等(2012)以氙灯为模拟太阳光光源,研究了阿替洛尔在NO-3溶液中的光解情况,发现当NO-3浓度增至5 mmol · L-1时,阿替洛尔的光解速率常数由0.00226 min-1增至0.0094 min-1.本研究所获得结果与上述研究所得结论相符,在海水小球藻和新月菱形藻EOM存在的海水中,NO-3浓度的增加有利于水中2,4-D的光解.
与单独微藻EOM体系相比,或与微藻EOM与NO-2(或NO-3)共存时相比,反应溶液中微藻EOM与NO-2、NO-3三者共存时,溶液中2,4-D的光解速率常数均增大.这可能是由于NO-3和NO-2共存时,在可见光照射下,生成的活性基团数量高于NO-2或NO-3单独存在时的数量,参与2,4-D光解反应的活性基团数量增加,对2,4-D的光解起到了协同促进作用.此外,从本研究中还可以看出,在NO-2和NO-3共存的体系中,海水小球藻和新月菱形藻EOM对2,4-D光解的影响仍有差异,2,4-D在新月菱形藻EOM体系中的光解速率常数仍高于海水小球藻EOM体系,表明微藻EOM的组分对2,4-D的光解产生一定的影响.
5 结论(Conclusions)在模拟太阳光源(波长大于290 nm)照射下,2,4-D在不同浓度的藻类EOM溶液中的光解反应均符合准一级反应动力学方程.随着海水小球藻和新月菱形藻EOM浓度增加,2,4-D光解速率常数均降低,2,4-D的光解受到微藻EOM的抑制.当海水小球藻和新月菱形藻EOM与不同浓度的NO-2或NO-3共存时,2,4-D的光解速率常数均随着NO-2或NO-3浓度的增加而增大.当微藻EOM与NO-2和NO-3三者共存时,2,4-D光解速率常数进一步增大,表明NO-2与NO-3协同作用加快了2,4-D的光解.
| [1] | Bouillon R C, Miller W L. 2005. Photodegradation of Dimethyl Sulfide (DMS) in natural waters: laboratory assessment of the nitrate-photolysis-induced DMS Oxidation [J]. Environmental Science and Technology, 39(24): 9471-9477 |
| [2] | Brezonik P L, Fulkerson-Brekken J. 1998. Nitrate-induced photolysis in natural waters: Controls on concentrations of hydroxyl radical photointermediates by natural scavenging agents [J]. Environmental Science and Technology, 32(19): 3004-3010 |
| [3] | 陈容, 孟春霞, 张慧玲. 2010. 硝酸盐及亚硝酸盐对三唑磷在海水中光降解的影响 [J]. 海洋湖沼通报, (3): 121-125 |
| [4] | Dimou A D, Sakkas V A, Albanis T A. 2005. Metolachlor photodegradation study in aqueous media under natural and simulated solar irradiation [J]. Journal of Agricultural and Food Chemistry, 53(3): 694-701 |
| [5] | 何占伟, 刘国光, 刘海津, 等. 2011. 水体中不同形态氮对环丙沙星溶液光降解影响[J]. 环境科学学报, 31(11): 2410-2415 |
| [6] | Henderson R K, Baker A, Parsons S A, et al. 2008. Characterisation of algogenic organic matter extracted from cyanobacteria, green algae and diatoms [J]. Water Research, 42(13): 3435-3445 |
| [7] | Hirooka T, Akiyama Y, Tsuji N, et al. 2003. Removal of hazardous phenols by microalgae under photoautotrophic conditions [J]. Journal of Bioscience and Bioengineering, 95(2): 200-203 |
| [8] | Huang J, Graham N, Templeton M R, et al. 2009. A comparison of the role of two blue-green algae in THM and HAA formation [J]. Water Research, 43(12): 3009-3018 |
| [9] | 季跃飞, 曾超, 孟翠, 等. 2012. 阿替洛尔在硝酸根溶液中的光降解研究[J].环境科学, 33(2): 481-487 |
| [10] | Liu X L, Wu F, Deng N S. 2003. Photodegradation of 17a-ethynylestradiol in aqueous solution exposed to a high-pressure mercury lamp (250 W) [J]. Environmental Pollution, 126(3): 393-398 |
| [11] | Nélieu S, Perreau F, Bonnemoy F, et al. 2009. Sunlight nitrate-induced photodegradation of chlorotoluron: evidence of the process in aquatic mesocosms [J]. Environmental Science and Technology, 43(9): 3148-3154 |
| [12] | Ou X X, Quan X, Chen S, et al. 2007. Atrazine photodegradation in aqueous solution induced by interaction of humic acids and iron: photoformation of iron(II) and hydrogen peroxide [J]. Journal of Agricultural and Food Chemistry, 55(21): 8650-8656 |
| [13] | Pivokonsky M, Kloucek O, Pivokonska L. 2006. Evaluation of the production, composition and aluminum and iron complexation of algogenic organic matter [J]. Water Research, 40(16): 3045-3052 |
| [14] | Qu F S, Liang H, He J G, et al. 2012. Characterization of dissolved extracellular organic matter (dEOM) and bound extracellular organic matter (bEOM) of Microcystis aeruginosa and their impacts on UF membrane fouling [J]. Water Research, 46(9): 2881-2890 |
| [15] | Sutherland D J, Stearman G K, Wells M J M. 2003. Development of an analytical scheme for simazine and 2,4-D in soil and water runoff from ornamental plant nursery plots [J]. Journal of Agricultural and Food Chemistry, 51(1): 14-20 |
| [16] | 吴星卫,单正军,薛韵涵. 2011. 2,4-D的水解、光解及在土壤中的降解特性研究[J].安徽农业科学, 39(16): 9711-9713 |
| [17] | 徐宁,刘静雅,赖海燕,等.2013.海洋微藻对游离氨基酸的利用特性研究[J].环境科学学报, 33(4):1058-1065 |
| [18] | 于春艳, 赵慧敏, 陈硕, 等. 2010. 水体中腐殖酸与Fe(Ⅲ)的络合物对2,4-D光降解的作用 [J].环境科学, 31(2): 379-384 |
| [19] | Zafiriou O C, True M B. 1979. Nitrite photolysis in seawater by sunlight [J]. Marine Chemistry, 8(1): 9-32 |
| [20] | Zepp R G, Schlotzhauer P F. 1983. Influence of algae on photolysis rates of chemicals in water [J]. Environmental Science and Technology, 17(8): 462-468 |
| [21] | 展漫军, 杨曦, 孔令仁. 2004. 天然水体中亚硝酸根和硝酸根的光化学研究进展[J].环境污染治理技术与设备, 5(10): 14-19 |
| [22] | 展漫军, 杨曦, 杨洪生, 等. 2005. 天然水体腐殖质对双酚A光降解影响的研究[J].环境科学学报, 25(6): 816-820 |
| [23] | 褚明杰, 岳永德, 花日茂, 等. 2006. 几种物质对苯噻草胺在水中光降解的影响[J].应用生态学报, 17(1): 155-158 |
 2014, Vol. 34
2014, Vol. 34


