2. 清华大学深圳研究生院清洁生产重点实验室, 深圳 518055
2. Key Laboratory of Cleaner Production, Graduate School at Shenzhen, Tsinghua University, Shenzhen 518055
四溴双酚A(TBBPA)是一种重要的溴代阻燃剂,广泛应用于合成树脂、聚碳酸酯、塑料、电子产品外壳、集成电路板、纺织等产品中,以防止火灾的发生(De Wit,2002).在生产、使用、拆解和回收这些产品时,TBBPA可能会扩散到环境介质中(Sellström and Jansson, 1995).在大气、水体、沉积物和土壤等环境介质以及动物、人体内都发现了TBBPA的存在(Jakobsson et al., 2002;Sjödin et al., 2001;Watanabe et al., 1983).TBBPA具有生态毒性和生物累积性,在环境中与生物接触且累积到一定程度时,会对生物及人体健康产生危害(陈玛丽,2008;Crawford et al., 2009;Lilienthal et al., 2008).因此,研究TBBPA在环境中的迁移转化规律,降低其环境风险,是面临的重要环境问题之一.
TBBPA的分子结构如图 1所示.其具有大辛醇-水分配系数、低水溶性、亲脂性和热稳定性等特点,容易累积在河流沉积物中.微生物可以对TBBPA产生还原脱溴作用,水体、土壤、沉积物中无论是好氧还是厌氧条件下都发现了微生物降解TBBPA(Fackler,1989).在河流沉积物中TBBPA的去除主要依靠厌氧条件下的生物降解作用(Chang et al., 2012).在河流沉积物中分离培养出好氧条件下能够降解TBBPA的微生物(Chang et al., 2011).研究认为TBBPA的生物降解分为两个阶段,在厌氧阶段TBBPA被微生物还原脱溴为双酚A(BPA),在好氧阶段BPA被微生物进一步降解(Ronenand Abeliovich, 2000).TBBPA的厌氧脱溴作用跟产甲烷过程或硫酸盐降解过程有关(Voordeckers et al., 2002).以往调查研究,在瑞士26座污水处理厂有24座发现了TBBPA的存在(De Wit et al., 2007),而在西班牙17座污水处理厂中有15座检测到了TBBPA(Gorga et al., 2013).在实验室和污水厂活性污泥厌氧消化过程也发现TBBPA的降解(Gerecke et al., 2006).目前研究较少关注TBBPA在脱氮除磷工艺中的迁移转化,而此类新兴污染物的生态安全性将是未来水环境安全控制的重要对象.所以,研究关于TBBPA在生物脱氮除磷工艺的迁移转化,将为此类新兴污染物在污水处理过程中的控制提供科学依据和参考.
 |
| 图 1 TBBPA分子结构图 Fig. 1 Molecular structure of TBBPA |
本研究采用实验室序批式活性污泥反应器(sequencing batch reactor activated sludge process,SBR),研究TBBPA在工艺中的去除,尤其关注其在SBR典型周期内的变化特征,以及TBBPA在硝化反硝化过程中的去除特性和相关机理.
2 材料与方法(Materials and methods) 2.1 SBR反应器的污泥接种和驯化运行两套污水脱氮除磷SBR反应器(有效容积为8 L),接种深圳市南山污水处理厂的活性污泥,在25~28 ℃条件下以乙酸钠(NaAc)为碳源,缺氧/厌氧与好氧交替运行,驯化具有生物脱氮除磷功能的活性污泥.模拟污水的组分为:NaAc 510 mg · L-1,酵母浸膏10 mg · L-1,NH4Cl 153 mg · L-1,KH2PO4 44 mg · L-1,MgSO4·7H2O 90 mg · L-1,CaCl2·2H2O 14 mg · L-1.微量元素成份及投加量参见文献(Smolders et al., 1994).一套SBR反应器(SBRT)在以上污水组分的基础上投加0.5 mg · L-1的TBBPA,另一套SBR反应器(SBRC)不投加TBBPA作为对照.SBR反应器每天运行4个周期,每个周期分为5个阶段:进水(10 min),缺氧/厌氧阶段(110 min),曝气阶段(180 min),沉淀(40 min)和排水/闲置(20 min).缺氧/厌氧和曝气阶段采用机械搅拌器进行搅拌以使活性污泥处于充分混合状态.曝气阶段采用隔膜曝气泵进行曝气,曝气量约为1.5 L · min-1,为活性污泥提供充足的溶解氧(DO).每个周期通过蠕动泵排出4 L处理完的污水,并泵入4 L模拟污水.每天在曝气阶段结束前排泥,污泥龄控制在15 d左右.
2.2 批处理试验批处理试验采用SBR反应器中驯化的活性污泥,研究TBBPA在硝化和反硝化过程中的去除特征.批处理试验装置采用容积为500 mL的玻璃瓶,置于恒温水浴槽中使得试验温度稳定在25 ℃左右.在曝气结束前从连续运行的SBR反应器取出400 mL活性污泥,静置后弃去一半体积的上清液,分别装入玻璃瓶中.然后加入200 mL的模拟污水(不加乙酸钠).
硝化试验在以上处理的混合液中加入2 mL溶于0.1 mol NaOH溶液中的TBBPA贮备液(1000 mg · L-1),然后开始曝气.曝气量约为1.5 L · min-1,气流足够使得活性污泥处于充分混合状态.每隔10 min采样以检测相关水质指标,同时检测混合液的pH和DO值.反应结束后,若pH值发生变化的,用1 mol NaOH或1 mol HCl将pH调到初始值,然后取样分析TBBPA.硝化试验重复两次.
反硝化试验在200 mL模拟污水中加入NO-3-N使得初始浓度为30 mg · L-1,2 mL溶于0.1 mol NaOH溶液中的TBBPA贮备液(1000 mg · L-1),与经前处理的活性污泥混合.批处理反应瓶盖上瓶盖(瓶盖上连着硅胶管以备取样),用磁力搅拌器在缺氧条件下进行搅拌.每隔10 min用注射器从硅胶管采样,样品离心后进行相关检测分析.反应结束后,若pH值发生变化的,用1 mol NaOH或1 mol HCl将pH调到初始值,然后取样分析TBBPA.反硝化试验重复两次.
2.3 分析方法NO-2-N和NO-3-N用ICS-1500离子色谱仪(Dionex,USA)测定.悬浮活性污泥(MLSS)和挥发性悬浮活性污泥(MLVSS)浓度采用标准方法测定(APHA et al., 1995).NH+4-N使用纳氏试剂法,PO3-4-P使用钼酸铵分光光度法测定.
乙酸钠使用高效液相色谱仪(HPLC)进行检测(岛津 LC-20A).色谱条件如下:色谱柱为Aminex HPLC Acid Analysis Colum(型号HPX-87H),柱温35 ℃,流动相为1‰的硫酸,流速0.6 mL · min-1;检测波长为210 nm.
TBBPA使用HPLC进行检测.色谱柱是CNW Athena C18-WP,5 μm,100 A,直径为4.6 mm,长度为250 mm;柱温40 ℃;流动相1000 mL溶液包括800 mL甲醇、180 mL超纯水和20 mL冰乙酸(流动相均为色谱纯),流速0.6 mL · min-1;检测波长为254 nm.
3 结果与讨论(Results and discussion) 3.1 活性污泥长期驯化与TBBPA的去除驯化污泥30 d后,两套SBR反应器运行达到稳定.运行3个污泥龄(45 d)后,对照组SBR反应器(SBRC)中活性污泥浓度MLSS为(2167±259)mg · L-1,MLVSS为(1723±188)mg · L-1,投加TBBPA驯化的SBR反应器(SBRT)活性污泥浓度MLSS为(2239±282)mg · L-1,MLVSS为(1791±224)mg · L-1.说明TBBPA对SBR反应器污泥MLVSS的浓度没有影响,也即对活性污泥产量没有太大影响;这与Brenner等(2006)的结论一致.
两套SBR反应器稳定运行状态下,出水乙酸钠和亚硝酸盐浓度低于检测方法的检出限,出水PO3-4-P,NH+4-N浓度均小于0.5 mg · L-1,反应器具有良好的脱氮除磷功能;SBRC反应器出水NO-3-N浓度为(12.9±2.2)mg · L-1,SBRT反应器出水NO-3-N浓度为(15.3±2.0)mg · L-1.表明TBBPA对SBR反应器硝化和除磷效率没有太大影响,但对出水硝态氮浓度略有影响.
对稳定运行过程中SBR反应器进出水TBBPA的浓度进行检测;同时,对排出的剩余污泥根据Arbeli等(2006)的方法采用强碱进行处理(每1.6 mL污泥投加1 mol的NaOH溶液0.4 mL摇匀静置1 h),以释放活性污泥吸附的TBBPA.对多于15 d的检测数据进行统计分析,进水TBBPA浓度为(0.41±0.09)mg · L-1,出水浓度为(0.21±0.05)mg · L-1,污泥强碱处理后浓度为(0.26±0.05)mg · L-1,计算得到污泥吸附去除的TBBPA量为0.05 mg · L-1.经计算,TBBPA去除率为48.4%;其中生物去除率为44.4%,吸附去除率为4.0%.Brenner等(2006)研究了几种传统的活性污泥工艺对TBBPA的去除,在所有的反应器中都没有检测出TBBPA的生物降解,可能是由于他们初始投加的TBBPA浓度(230 mg · L-1)远远超过了微生物的降解能力.而Arbeli等(2006)、Ronen and Abeliovich(2000)和Voordeckers等(2002)等对受污染河流沉积物的微生物进行富集培养后,在厌氧条件下,100 mg · L-1以上浓度的TBBPA能够被有效去除.
3.2 典型周期中脱氮除磷与TBBPA变化如图 2周期试验结果所示,SBRC反应器开始运行后,5 min内NO-3-N和NO-2-N在缺氧条件下迅速被反硝化.在厌氧阶段开始20 min内,PO3-4-P大量释放,SBRC反应器PO3-4-P浓度由9 mg · L-1 升高到71 mg · L-1,SBRT反应器PO3-4-P浓度由13 mg · L-1升高到69 mg · L-1.120 min开始曝气,在好氧条件下聚磷菌吸收PO3-4-P,好氧阶段前90 min吸收速率SBRC为0.81 mg · L-1 · min-1,SBRT为1.08 mg · L-1 · min-1 .NH+4-N被硝化细菌硝化为NO-2-N和NO-3-N,而NO-2-N又被硝化为NO-3-N.好氧阶段前90 min,SBRC反应器NH+4-N去除速率为0.22 mg · L-1 · min-1,NH+4-N浓度由20 mg · L-1下降到低于0.1 mg · L-1;SBRT反应器NH+4-N去除速率为0.31 mg · L-1 · min-1,NH+4-N浓度也由20 mg · L-1下降到低于0.1 mg · L-1.两套反应器对NH+4-N、PO3-4-P的去除率均达90%以上.说明SBR反应器都具有良好的脱氮除磷功能,TBBPA对SBR反应器的硝化细菌、反硝化细菌、聚磷菌的活性没有较大影响.
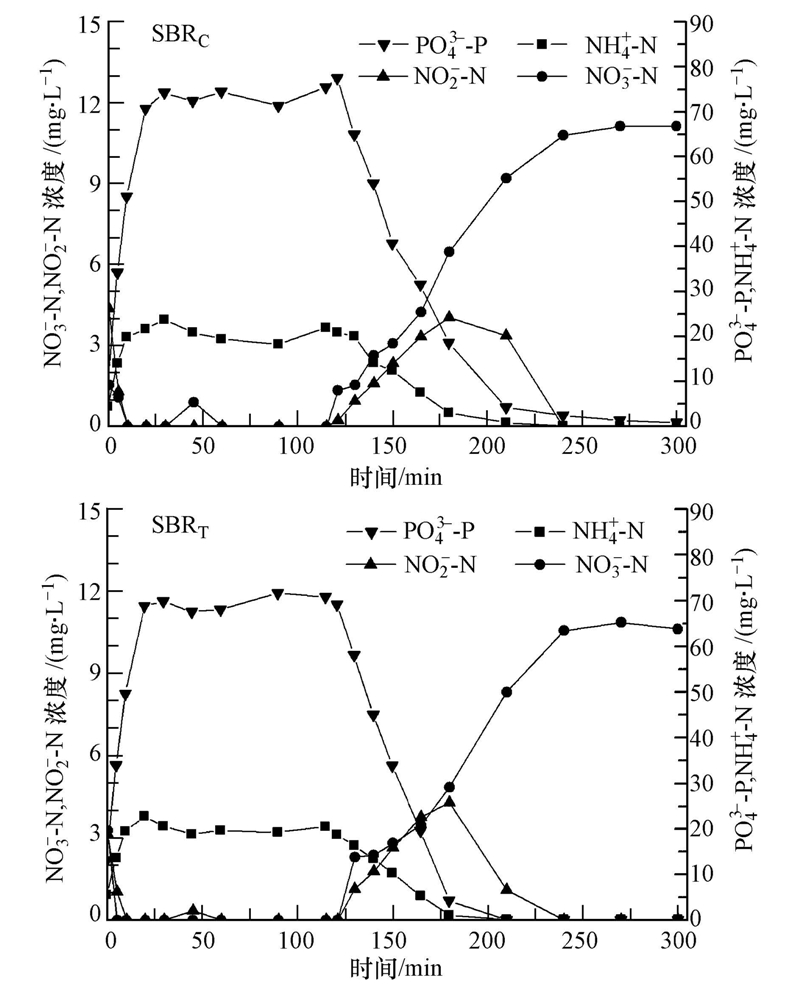 |
| 图 2 SBR反应器典型周期中N与P浓度变化 Fig. 2 Dynamics of N and P in a typical SBR cycle |
在对SBRT反应周期内TBBPA的浓度和pH进行相关性分析时,TBBPA的浓度跟pH有一定线性相关性,相关系数r为0.94.由图 3所示,厌氧阶段,由于强化生物除磷摄取有机物等反应,pH有所降低;TBBPA的浓度随着pH的降低而下降,厌氧结束时TBBPA浓度达到最低0.05 mg · L-1.曝气开始后,由于曝气导致二氧化碳等吹脱,pH升高,TBBPA浓度随着pH的升高而升高.TBBPA随着pH变化的原因为TBBPA的溶解度受pH影响较大,当pH小于7.5时,TBBPA溶解度很低而主要被活性污泥吸附,而pH增加到8时,TBBPA的溶解度急剧上升,表现为溶液中TBBPA浓度的增加(Arnon et al., 2006).
 |
| 图 3 TBBPA和pH在SBRT 典型周期内的变化 Fig. 3 Dynamics of TBBPA and pH in a typical SBRT cycle |
使用投加TBBPA驯化(SBRT)的活性污泥和未投加TBBPA驯化(SBRC)的活性污泥进行硝化试验.如图 4a所示,由于硝化细菌对氨氮的硝化作用,NH+4-N浓度不断减小,NO-3-N浓度不断增加,同时有少量的NO-2-N生成.与周期试验结果一致,TBBPA对硝化细菌的活性没有影响.图 4b为TBBPA在硝化过程的去除.硝化过程TBBPA的浓度一直下降,然而在周期试验中好氧过程TBBPA的浓度在好氧阶段一直上升.原因可能是在周期试验中除了生物降解外,pH对TBBPA的溶解度有较大的影响,TBBPA的浓度随着pH的升高而上升,而硝化试验中TBBPA的浓度随着pH的降低而下降.硝化过程中,对TBBPA的去除主要是NH+4-N作为电子供体,硝化细菌对TBBPA的生物降解作用,以及活性污泥对TBBPA的吸附作用.硝化过程结束,将pH调至初始值,TBBPA的浓度上升.原因可能是被活性污泥不稳定吸附的TBBPA在较高pH条件下被释放到溶液中.SBRC活性污泥对TBBPA的去除率为34.4%,其中生物去除占33.3%,吸附去除占1.1%.SBRT活性污泥对TBBPA的去除率为33.9%,其中生物去除占19.2%,吸附去除占14.7%.由此可见,TBBPA在硝化过程能够被去除,Potvin等(2012)研究了TBBPA在好氧膜生物反应器中的去除,发现硝化作用是生物降解TBBPA的一个关键过程.TBBPA的还原脱溴产物BPA也能够被硝化细菌去除(Roh et al., 2009; Sun et al., 2012).可能原因是硝化菌能够利用氨氮等作为电子供体,以TBBPA作为电子受体进行生化代谢;抑或硝化菌某些生化代谢过程促进了TBBPA的共代谢,此领域有待进一步深入研究.
 |
| 图 4 批处理试验硝化过程中N(a)和TBBPA浓度(b)以及pH(b)变化图 Fig. 4 Dynamics of N(a) and TBBPA(b), and pH(b)during the batch nitrification experiment |
如图 5a反硝化批处理试验结果所示,由于反硝化作用,NO-3-N被反硝化,部分生成NO-2-N.SBRC反应器中活性污泥NO-3-N反硝化速率为0.45 mg · L-1 · min-1,NO-2-N的生成速率为0.54 mg · L-1 · min-1;SBRT反应器中活性污泥NO-3-N反硝化速率为0.30 mg · L-1 · min-1,NO-2-N 生成速率为0.34 mg · L-1 · min-1.由图 5b所示,反硝化过程中TBBPA的浓度不断下降,反应结束后将pH调至初始值,TBBPA的浓度有所升高,原因可能是被活性污泥不稳定吸附的TBBPA在较高的pH条件下被释放到溶液中.SBRC反应前混合液pH为8.4,反应后为8.0,调节pH后为8.5;SBRT反应前混合液pH为8.3,反应后为7.7,调节pH后为8.3.SBRC活性污泥对TBBPA去除率为22.1%,其中生物去除占3.2%,吸附去除占18.9%.SBRT活性污泥对TBBPA的去除率为28.2%,其中生物去除占7.5%,吸附去除占20.7%.SBRC初始TBBPA浓度偏低,可能是由于活性污泥对TBBPA的吸附作用造成的.反硝化过程生物作用比硝化过程小,原因可能是TBBPA被还原脱溴是作为电子受体,而NO-3-N作为它的竞争电子受体,会抑制微生物对TBBPA的降解(Arbeli et al., 2006).批处理试验显示吸附去除TBBPA比例远高于反应器周期中数值,可能原因是在长期运行过程中,TBBPA在反应器内得到较好的生物降解去除,而在批处理试验由于反应时间较短生物过程受到限制造成.
 |
| 图 5 批处理试验反硝化过程中N(a)和TBBPA浓度(b)变化图 Fig. 5 Dynamics of N(a) and TBBPA(b)during the batch denitrification experiment |
1)TBBPA在SBR脱氮除磷反应器的去除率为48.4%,其中生物去除率为44.4%,吸附去除率为4.0%.
2)TBBPA在SBR典型反应周期中浓度受pH影响较大.
3)TBBPA在硝化过程的去除主要是生物作用,SBRC去除率为34.4%,其中生物去除的量占33.3%,吸附去除占1.1%;SBRT去除率为33.9%,其中生物去除占19.2%,吸附去除占14.7%.
4)TBBPA在反硝化过程的去除主要是吸附作用,SBRC活性污泥对TBBPA去除率为22.1%,其中生物去除占3.2%,吸附去除占18.9%.SBRT活性污泥对TBBPA的去除率为28.2%,其中生物去除占7.5%,吸附去除占20.7%.
| [1] | Arbeli Z, Ronen Z, Díaz-Báez M C. 2006. Reductive dehalogenation of tetrabromobisphenol-A by sediment from a contaminated ephemeral streambed and an enrichment culture[J]. Chemosphere, 64(9): 1472-1478 |
| [2] | Arnon S, Ronen Z, Yakirevich A, et al. 2006. Evaluation of soil flushing potential for clean-up of desert soil contaminated by industrial wastewater[J]. Chemosphere, 62(1): 17-25 |
| [3] | APHA, AWWA, WEF. 1995. Standard methods for the examination of water and wastewater[M]. Washington DC: American Public Health Association |
| [4] | Brenner A, Mukmenev I, Abeliovich A, et al. 2006. Biodegradability of tetrabromobisphenol A and tribromophenol by activated sludge[J]. Ecotoxicology, 15(4): 399-402 |
| [5] | Chang B V, Yuan S Y, Ren Y L. 2011. Aerobic degradation of tetrabromobisphenol-A by microbes in river sediment[J]. Chemosphere, 87(5): 535-541 |
| [6] | Chang B V, Yuan S Y, Ren Y L. 2012. Anaerobic degradation of tetrabromobisphenol-A in river sediment[J]. Ecological Engineering, 49: 73-76 |
| [7] | 陈玛丽. 2008. 四溴双酚A对鱼类的毒性效应[R]. 上海: 华东师范大学 |
| [8] | Crawford E S, Guarasci D T, Larson S A. 2009. A survey of thyroid gland scintigraphy [J]. Journal of Nuclear Medicine Technology, 37(3): 173-178 |
| [9] | De Wit C A. 2002. An overview of brominated flame retardants in the environment[J]. Chemosphere, 46(5): 583-624 |
| [10] | De Wit C A, Nylund K, Eriksson U, et al. 2007. Brominated flame retardants in sludge from 50 swedish sewage treatment plants: evidence of anaerobic degradation of HBCD and TBBPA //Proceedings of the 4th International Workshop on Brominated Flame Retardants[R]. Amsterdam, The Netherlands |
| [11] | EatonA D, Clesceri L S, Greenberg A E, et al. 1995. Standard methods for the examination of water and wastewater[M]. Washington DC:American Public Health Association |
| [12] | Fackler P H. 1989. Determination of the biodegradability of tetrabromobisphenol A in soil under aerobic conditions[R]. Report No. 88-11-2848. Wareham, MA: Springborn Life Sciences, Inc |
| [13] | Gerecke A C, Giger W, Hartmann P C, et al. 2006. Anaerobic degradation of brominated flame retardants in sewage sludge[J]. Chemosphere, 64(2): 311-317 |
| [14] | Gorga M, Martínez E, Ginebreda A, et al. 2013. Determination of PBDEs, HBB, PBEB, DBDPE, HBCD, TBBPA and related compounds in sewage sludge from Catalonia (Spain) [J]. Science of the Total Environment, 444: 51-59 |
| [15] | Jakobsson K, Thuresson K, Rylander L, et al. 2002. Exposure to polybrominated diphenyl ethers and tetrabromobisphenol A among computer technicians[J]. Chemosphere, 46(5): 709-716 |
| [16] | Lilienthal H, Verwer C M, Van Der Ven L T M, et al. 2008. Exposure to tetrabromobisphenol A (TBBPA) in Wistar rats: neurobehavioral effects in offspring from a one-generation reproduction study[J]. Toxicology, 246(1): 45-54 |
| [17] | Potvin C M, Long Z B, Zhou H D. 2012. Removal of tetrabromobisphenol A by conventional activated sludge, submerged membrane and membrane aerated biofilm reactors[J]. Chemosphere, 89(10): 1183-1188 |
| [18] | Roh H, Subramanya N, Zhao F M, et al. 2009. Biodegradation potential of wastewater micropollutants by ammonia-oxidizing bacteria[J]. Chemosphere, 77(8): 1084-1089 |
| [19] | Ronen Z, Abeliovich A. 2000. Anaerobic-aerobic process for microbial degradation of tetrabromobisphenol A[J]. Applied and Environmental Microbiology, 66(6): 2372-2377 |
| [20] | Sellström U, Jansson B. 1995. Analysis of tetrabromobisphenol A in a product and environmental samples[J]. Chemosphere, 31(4): 3085-3092 |
| [21] | Sjödin A, Carlsson H, Thuresson K, et al. 2001. Flame retardants in indoor air at an electronics recycling plant and at other work environments[J]. Environmental Science and Technology, 35(3): 448-454 |
| [22] | Smolders G J F, Van der Meij J, Van Loosdrecht M, et al. 1994. Model of the anaerobic metabolism of the biological phosphorus removal process: stoichiometry and pH influence [J]. Biotechnology and Bioengineering, 43(6): 461-470 |
| [23] | Sun Q, Li Y, Chou P H, et al. 2012. Transformation of bisphenol A and alkylphenols by ammonia-oxidizing batcreia through nitration [J]. Environmental Science and Technology, 46(8): 4442-4448 |
| [24] | Voordeckers J W, Fennell D E, Jones K, et al. 2002. Anaerobic biotransformation of tetrabromobisphenol A, Tetrachlorobisphenol A, and Bisphenol A in estuarine sediments[J]. Environmental Science and Technology, 36(4): 696-701 |
| [25] | Watanabe I, Kashimoto T, Tatsukawa R. 1983. The flame retardant tetrabromobisphenol-A and its metabolite found in river and marine sediments in Japan[J]. Chemosphere, 12(11/12): 1533-1839 |
 2014, Vol. 34
2014, Vol. 34


