目前,生物脱氮技术已被广泛应用在污水处理系统中.其中的硝化作用包括氨氧化细菌(AOB)将氨氮(NH+4-N)转化为亚硝酸盐氮(NO-2-N)及亚硝酸盐氧化细菌(NOB)再将NO-2-N转化成硝酸盐氮(NO-3-N)的过程.由于硝化细菌较低的增长速率及对pH、溶解氧浓度、温度、有毒化学品等具有极高的敏感性,因此,硝化作用一直被视为脱氮过程中的限速步骤(Peng et al., 2000; Hu et al., 2002; Groeneweg et al., 1994).
重金属铜(Cu)是一种重要工业原材料,被广泛用于制革、电镀、金属加工等行业,其中,金属加工、电镀工厂所排放的废水中Cu2+含量最高,浓度可达几十至几百mg · L-1(雷兆武等,2009).同时,含铜工业废水还经常会进入市政污水系统,从而影响污水厂的生物硝化处理效果.研究发现,纯培养的硝化细菌对Cu2+比较敏感,Cu2+的半抑制浓度(IC50)为13.3 mg · L-1(Kim et al., 2006).活性污泥体系中,硝化菌群对Cu2+的耐受性有所提高,50 mg · L-1的Cu2+可以抑制50%的NH+4-N降解速率(Madoni et al., 1999).与其他重金属(如Zn、Cd、Ni)相比,硝化性能受Cu抑制后需要更长的恢复时间(Nelson et al., 1981; Hu et al., 2003).由于不同试验中pH、污泥类型、污泥浓度及有机物质等因素的差别,因此,不同研究得到的Cu2+对活性污泥的抑制效果往往有差异,但几乎所有的报道都认同高浓度的Cu2+对硝化反应的抑制作用.目前,已有的研究多从动力学角度考察Cu2+冲击负荷对硝化效果的抑制,然而短期的冲击实验不足以反映受持续毒性的抑制情况(Hu et al., 2004),而针对Cu2+持续负荷及负荷结束后硝化性能变化的研究还相对较少.
因此,本文主要采用间歇式活性污泥反应器(SBR),研究Cu2+持续负荷期间及结束后AOB和NOB硝化菌群活性的变化,通过检测硝化效率、微生物活性、Cu分布特点等信息,探讨Cu2+对生物硝化过程抑制的作用原理.
2 材料与方法(Materials and methods) 2.1 模拟生活污水和接种污泥试验采用人工模拟生活污水,模拟污水COD为500 mg · L-1,NH+4-N 75 mg · L-1,pH=7.5±0.5,具体组分为(mg · L-1):无水葡萄糖480,NH4Cl 75,KH2PO4 30,NaHCO3 350,MgSO4 · 7H2O 20,FeSO4 · 7H2O 2.5,ZnSO4 · 7H2O 0.25,CaCl2 · 2H2O 10,CoCl2 · 6H2O 0.00005,MoO3 0.0015.根据试验需要向模拟生活污水中投加适量硫酸铜储备液(Cu2+浓度25 g · L-1),配置不同浓度的含Cu生活污水.在pH为7.5左右的含铜进水中,Cu2+可以和OH-(水解产物)、CO2-3(来自于350 mg · L-1 NaHCO3的HCO-3和CO2-3)、氨(来自于75 mg · L-1 NH4Cl的NH3)等形成溶解态Cu(OH)-n+2n、Cu(CO3)-2n+2n、 Cu(NH3)2+n等络合物(后文统称为Cu2+),以及 Cu(OH)2和CuCO3等难溶物质(Snoeyink et al., 1980).
接种污泥取自天津某污水处理厂A2O曝气池,并用模拟生活污水在SBR中驯养至出水NH+4-N稳定小于0.5 mg · L-1后开始试验.
2.2 试验装置反应器有效容积5 L,内径为100 mm,总高850 mm(图 1).SBR运行参数:自控装置控制运行周期,处理水量为2.5 L · 周期-1,每周期6 h,包括进水5 min,曝气240 min,静沉75 min,排水10 min,静置30 min;温度(25.0±0.5)℃.进水水箱中设有循环泵,确保进水成份均匀.曝气时控制反应器内DO≥2 mg · L-1.实验过程中平均1天排1次泥,保证MLSS为5000 mg · L-1左右,污泥龄约为6 d.
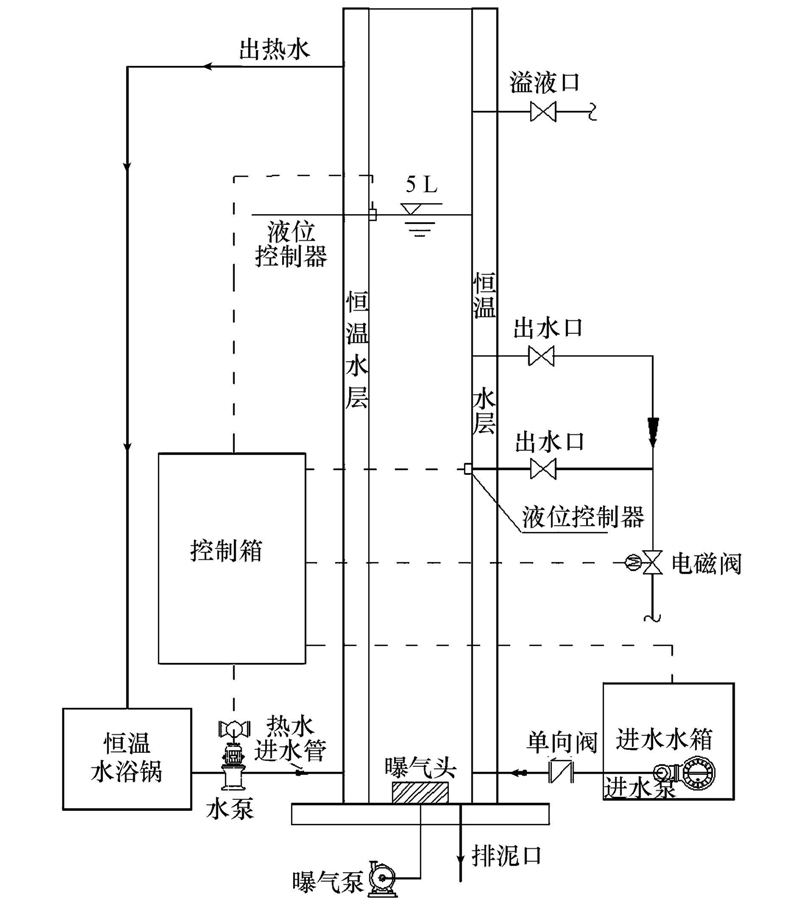 |
| 图 1 SBR反应器装置图 Fig. 1 Schematic diagram of the sequencing batch reactor(SBR) |
试验采用5个相同的SBR反应器进行持续负荷试验.其中1个反应器为对照体系,进水始终为不含Cu2+的模拟污水.另外4个反应器在第1~20周期内的进水为不含Cu2+的模拟污水,该阶段为初始阶段;第21周期后,4个反应器的进水变为含Cu2+浓度分别为10、20、30和50 mg · L-1的模拟污水,该阶段为抑制阶段;当各反应器的出水NH+4-N保持稳定后,停止向进水中加Cu2+,系统进入恢复阶段.
2.4 生物活性的表征AOB、NOB及异养菌的活性主要用氨氧化比耗氧速率(SOURNH4)、亚硝酸盐氮氧化比耗氧速率(SOURNO2)和碳氧化比耗氧速率(SOURorg.C)来表征.活性污泥各项SOUR的测定参见文献(王建龙等,1999).微生物活性的抑制率I用下式计算:
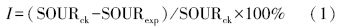
恢复期,投加Cu2+的4个反应器出水中NH+4-N和NO-3-N浓度变化率分别用kNH4和kNO3表示,其中,kNH4、kNO3可以用来评价AOB和NOB菌群的恢复速率.
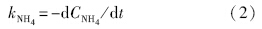

反应器体系内的总铜、溶解态铜、活性污泥内部的铜、活性污泥表面吸附的铜可以反映铜在体系内的分布,结合硝化作用的抑制可分析出铜对硝化细菌的影响.测定活性污泥内部的铜主要运用洗脱液(1 mmol · L-1 EDTA,pH=7.0,0.1 mol · L-1 NaCl)洗脱泥样后测定的方法.洗脱液使活性污泥表面吸附的铜解吸附,洗脱后残留在泥样内的铜被认为是进入细胞内部的铜(Vasconcelos et al., 2001; Hu et al., 2003).将用洗脱液洗脱后的泥样、过滤后的水样、泥水混合样加酸进行微波消解(姚国,2008)后,用火焰原子吸收仪测定铜的浓度,分别得到活性污泥内部的铜、溶解态铜、总铜含量.总铜减去溶解态铜和活性污泥内部的铜后可得到活性污泥表面吸附的铜.
2.6 常规测试项目COD:COD消解仪+分光光度法;NH+4-N:纳氏试剂分光光度法;硝酸盐氮:酚二磺酸光度法;亚硝酸盐氮:N-(1-萘基)-乙二胺光度法;MLSS:重量法;DO和pH:在线测定仪.
3 结果与讨论(Results and discussion) 3.1 Cu2+的持续负荷对系统处理性能的影响各反应器在初始阶段硝化效果良好,出水NH+4-N均低于0.5 mg · L-1,NH+4-N去除率均大于99%(图 2a).第20周期,进水变为含Cu2+污水后,Cu2+对NH+4-N去除的抑制作用随着Cu2+浓度和运行周期变化显著.在10、20、30和50 mg · L-1 Cu2+的抑制下,NH+4-N去除率分别在第84、72、28和24周期开始迅速下降,在第100、96、58和42周期分别降至31.3%、29.3%、27.1%和22.5%.各反应器初始阶段,出水NO-2-N浓度低于1 mg · L-1(图 2b);进水改为含Cu2+污水后,各反应器都首先出现了NO-2-N积累现象,随后NO-2-N以不同速率降低.出水NO-3-N在10和20 mg · L-1 Cu2+体系中的降低出现较晚且缓慢(图 2c),而30和50 mg · L-1 Cu2+体系中NO-3-N在抑制周期内很快由(37.0±2.0)mg · L-1降至(1.0±0.5)mg · L-1.在10、20 mg · L-1 Cu2+体系的抑制初期,出水NH+4-N浓度保持稳定,而出水NO-2-N浓度先增加后降低,表明体系中NOB受到抑制后逐渐被完全或者部分驯化,从而逐渐适应含Cu2+的环境.在30、50 mg · L-1 Cu2+体系中,出水NH+4-N浓度提高,表明高浓度的Cu2+对AOB和NOB都产生了严重抑制.
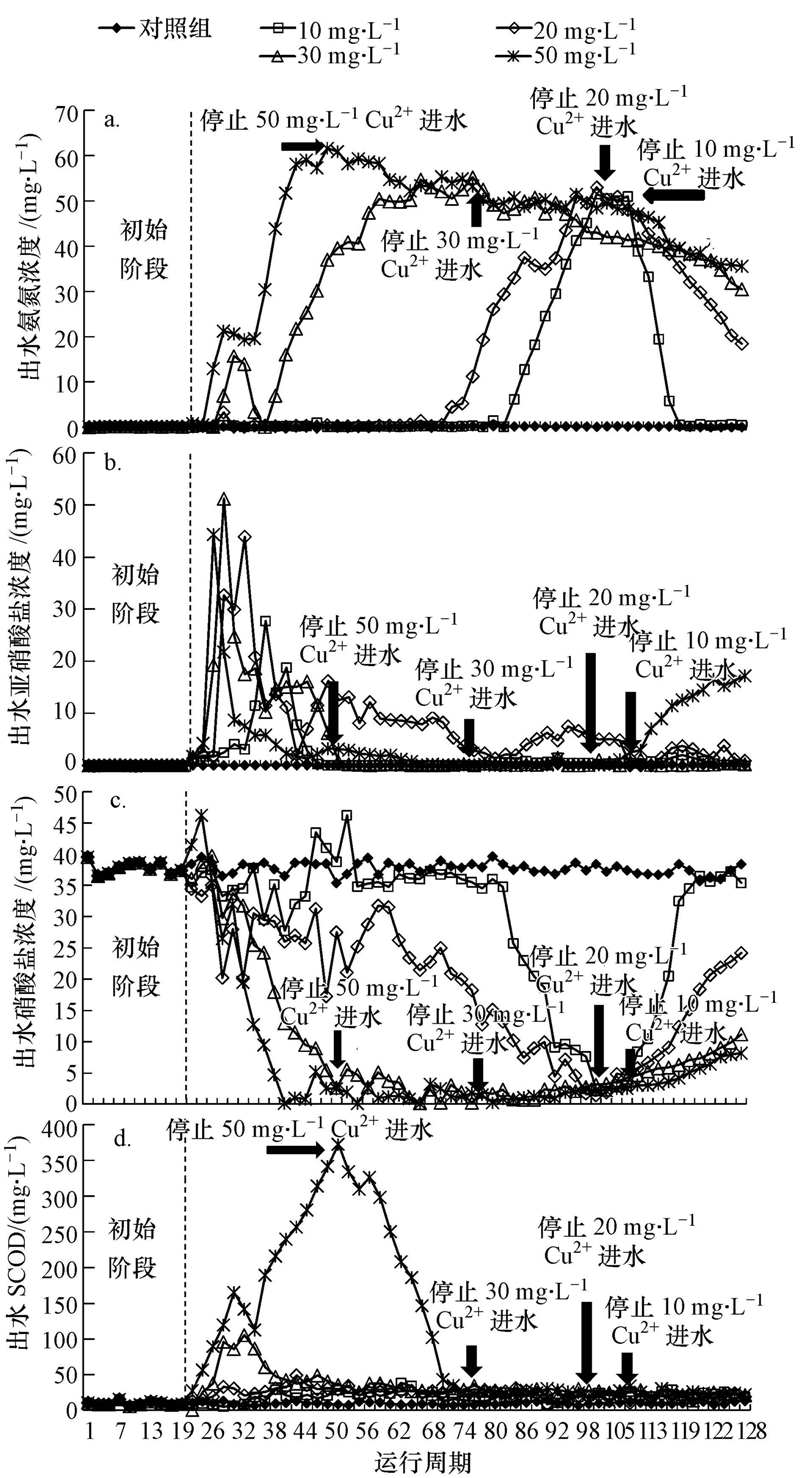 |
| 图 2 SBR系统受含Cu2+废水抑制及系统恢复阶段的运行效果 Fig. 2 Performance of the SBR systems dosed with Cu2+ in inhibition and recovery periods |
SCOD的去除同样受到Cu2+影响,当进水Cu2+为10、20 mg · L-1时Cu2+对SCOD的去除影响较小,出水SCOD从(10±5)mg · L-1上升至(20±5)mg · L-1(图 2d),表明异养菌活性受低浓度Cu2+的毒性影响较小;而当废水中Cu2+浓度为30 mg · L-1时,出水SCOD经12个周期后增至(100±5)mg · L-1,但随后微生物逐渐适应Cu2+负荷,经过10个周期运行后,出水SCOD降至(30±5)mg · L-1,表明该浓度下异养菌能逐渐被驯化;50 mg · L-1 Cu2+体系中,出水SCOD随运行时间呈上升趋势,最高达到370 mg · L-1.根据理论计算,异养菌降解500 mg · L-1的COD(480 mg · L-1葡萄糖,C6H12O6)需消耗31 mg · L-1左右的NH+4-N,这与10、20和30 mg · L-1 Cu2+体系抑制稳定时NH+4-N的去除量((28±3)mg · L-1)较接近.因此,在抑制试验运行末期,10、20和30 mg · L-1 Cu2+体系中NH+4-N的去除主要是异养菌代谢的结果,硝化作用被完全抑制.但在50 mg · L-1 Cu2+体系中,在抑制试验运行末期,NH+4-N去除量仅为15 mg · L-1左右,小于异养菌正常代谢消耗的NH+4-N,说明高浓度Cu2+对异养菌也产生了抑制,这与50 mg · L-1 Cu2+体系中SCOD的去除率降低相一致.
3.2 Cu2+的持续负荷后生物硝化效率的恢复10、20、30和50 mg · L-1 Cu2+的进水反应体系分别在第107、100、75和51周期抑制达到稳定,进水中然后停止投加Cu2+,进入恢复阶段.硝化效率在10 mg · L-1 Cu2+体系中恢复较快,恢复13个周期(第120周期)后,NH+4-N去除率恢复到初始阶段的水平(图 2a);20、30、50 mg · L-1 Cu2+体系在分别恢复了19、44、69个周期后,NH+4-N去除率达到初始阶段的48.8%、34.8%、46.2%.恢复期内,10、20、30 mg · L-1 Cu2+体系中NO-2-N无明显积累,体系中生成的NO-2-N能被氧化成NO-3-N.50 mg · L-1 Cu2+体系中,恢复初期NH+4-N去除率的提高并没有伴随NO-2-N或者NO-3-N明显生成,说明此时NH+4-N的消耗可能不是硝化菌的作用.此时50 mg · L-1 Cu2+体系中SCOD的去除效率恢复到初始阶段的水平,根据3.1节中关于异养菌消耗NH+4-N的讨论,此时50 mg · L-1 Cu2+体系中NH+4-N的消耗主要是恢复活性的异养菌代谢的结果.恢复末期,50 mg · L-1 Cu2+体系中出水NH+4-N继续降低,NO-3-N生成,并出现NO-2-N积累现象,这主要是因为随着运行周期的延长,AOB、NOB均有一定程度的恢复,而且AOB恢复速度比NOB快.根据公式(2)、(3),恢复期各反应体系的出水中NH+4-N消耗速率和NO-3-N的生成速率分别为kNH4=0.24~5.20 mg · L-1 · 周期-1,kNO3=0.04~2.59 mg · L-1 · 周期-1.kNH4和kNO3均随投加Cu2+浓度的增加而降低,表明在抑制期投加Cu2+的浓度越高的体系中AOB和NOB恢复速率越慢(图 3).当Cu2+投加浓度相同时,kNH4大于kNO3,但此时并没有NO-2-N积累,这可能是由于异养菌活性也在恢复,其消耗的NH+4-N量也在增加.
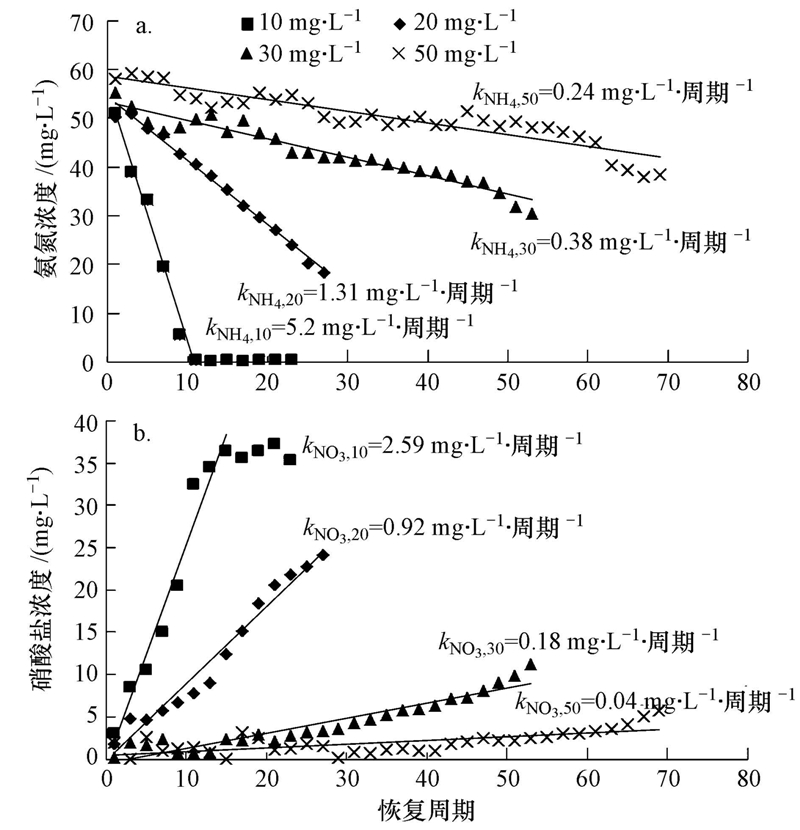 |
| 图 3 SBRs反应器恢复期的氨氮消耗速率(a)和硝酸盐氮生成速率(b) Fig. 3 Consumption rate of NH+4-N(a) and formation rate of NH+4-N(b)in the Cu2+-dosed SBRs during the recovery period |
氨氧化SOURNH4和亚硝酸盐氮氧化SOURNO2分别表征了AOB和NOB的活性变化.如图 4a所示,未投加Cu2+时,SOURNH4和SOURNO2分别为0.147和0.098 mg · g-1 · min-1(以MLSS计).抑制试验稳定期时,10、20、30和50 mg · L-1 Cu2+体系的SOURNH4抑制率分别达到89.1%、91.8%、95.2%和95.9%,SOURNO2的抑制率分别达到16.4%、46.3%、72.5%和94.9%.说明Cu2+对硝化细菌的抑制作用明显,并且对AOB的抑制作用大于NOB,即使低浓度的Cu2+也能使AOB基本失活.恢复试验末期,10、20、30和50 mg · L-1 Cu2+体系中SOURNH4分别恢复了60.4%、12.6%、5.8%和3.9%,SOURNO2分别恢复了9.0%、8.1%、4.8%和3.2%,说明AOB和NOB随恢复时间的增加能逐渐恢复部分活性,Cu2+浓度越低,恢复越快.
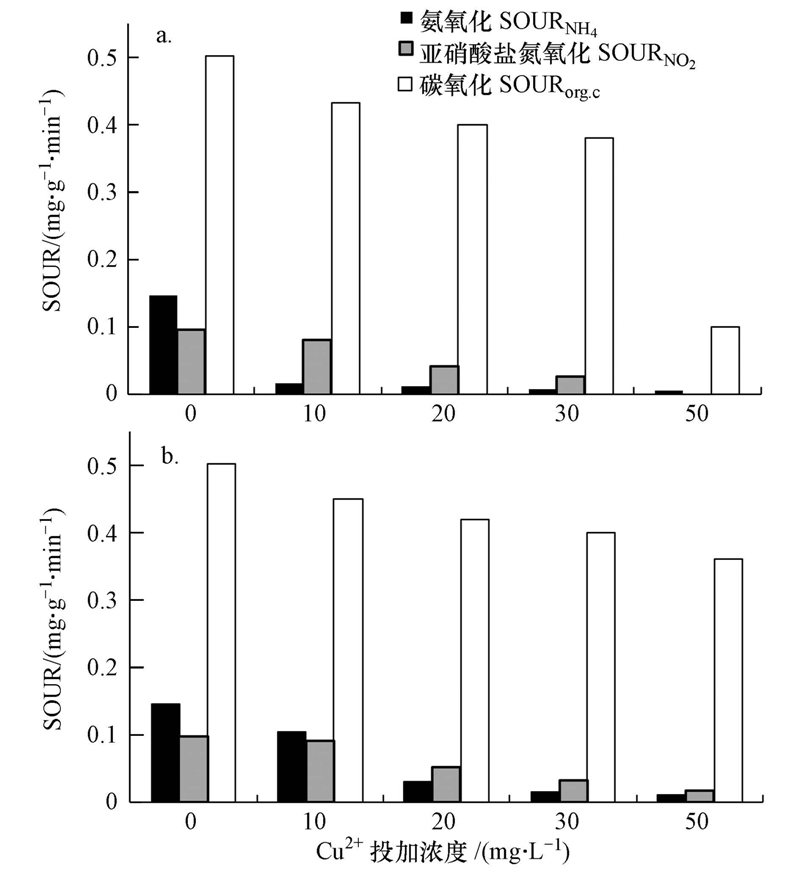 |
| 图 4 Cu2+投加浓度对SOUR的影响(a.抑制稳定期SOUR;b.恢复末期SOUR) Fig. 4 The effects of Cu2+ on SOUR(a. SOUR in the stable inhibition period;b. SOUR in the end of the recovery period) |
表征异养微生物活性的SOURorg.C受10、20、30 mg · L-1的Cu2+持续负荷影响较小,而受50 mg · L-1的Cu2+负荷影响较大.对照组的SOURorg.C为0.503 mg · g-1 · min-1(以MLSS计).抑制稳定期时,10、20、30和50 mg · L-1体系中SOURorg.C抑制率分别为13.8%、21.5%、24.5%和80.0%,这和SCOD的降解抑制率较为相符;恢复试验末期,各反应器SOURorg.C恢复至初始阶段的80%±10%.由此可见,当Cu2+浓度≤30 mg · L-1时,Cu2+对异养菌的活性抑制程度较小且易恢复;当Cu2+浓度为50 mg · L-1时,Cu2+对异养菌的活性抑制程度较大,仅能部分恢复.
3.4 反应体系内Cu的分布和积累在反应体系内铜的分布主要有3种形式:溶解态铜、活性污泥内部的铜和活性污泥吸附的铜;三者之和为体系内总铜.铜在SBR内显著积累,表明活性污泥对铜的吸附能力很强(Ong et al., 2010;Hu et al., 2003).在10、20、30和50 mg · L-1 Cu2+体系中活性污泥内部的铜分别占总铜的35.9%、36.7%、36.1%和35.4%,活性污泥吸附的铜分别占总铜的62.4%、59.6%、60.0%和56.8%(图 5).由此可见,在不同浓度体系中铜在三相中的分布比例基本相近,其中,活性污泥吸附的铜大于进入活性污泥内部的铜.将NH+4-N去除率与活性污泥吸附和内部的铜分别进行相关分析,未发现明显的相关关系(图 6a和b,p>0.05).在持续的铜负荷下,当活性污泥内部和其表面吸附的铜分别积累到(5.0±0.5)和(9.0±0.5)mg · g-1(以MLSS计)时,各浓度体系的NH+4-N降解去除率急剧下降.Hu等(2003)的研究表明,铜对硝化细菌抑制与细胞吸附和细胞内部的铜浓度无明显线性关系,此结果和本文相一致.各浓度体系中NH+4-N去除率与溶解态铜浓度呈负相关性(p<0.05),NH+4-N去除率随体系内溶解态铜浓度的增加不断降低(图 6c).Ochoa-Herrera等(2011)研究铜对硝化细菌的冲击试验时表明,相比总铜浓度而言,溶解态铜能更好地反映硝化的抑制情况.
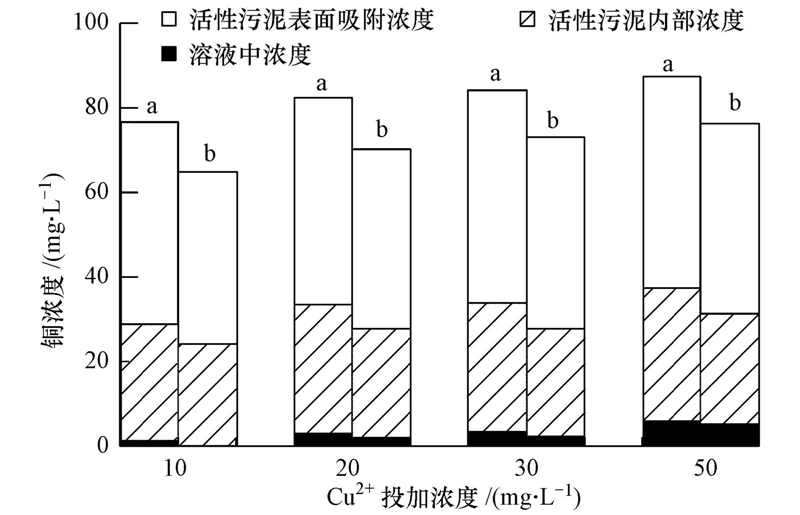 |
| 图 5 四个SBRs中铜的分布情况(a.抑制稳定期;b.恢复25周期后) Fig. 5 Distribution and accumulation of Cu in the four SBRs(a. inhibition stable period;b. recovery for 25 cycles) |
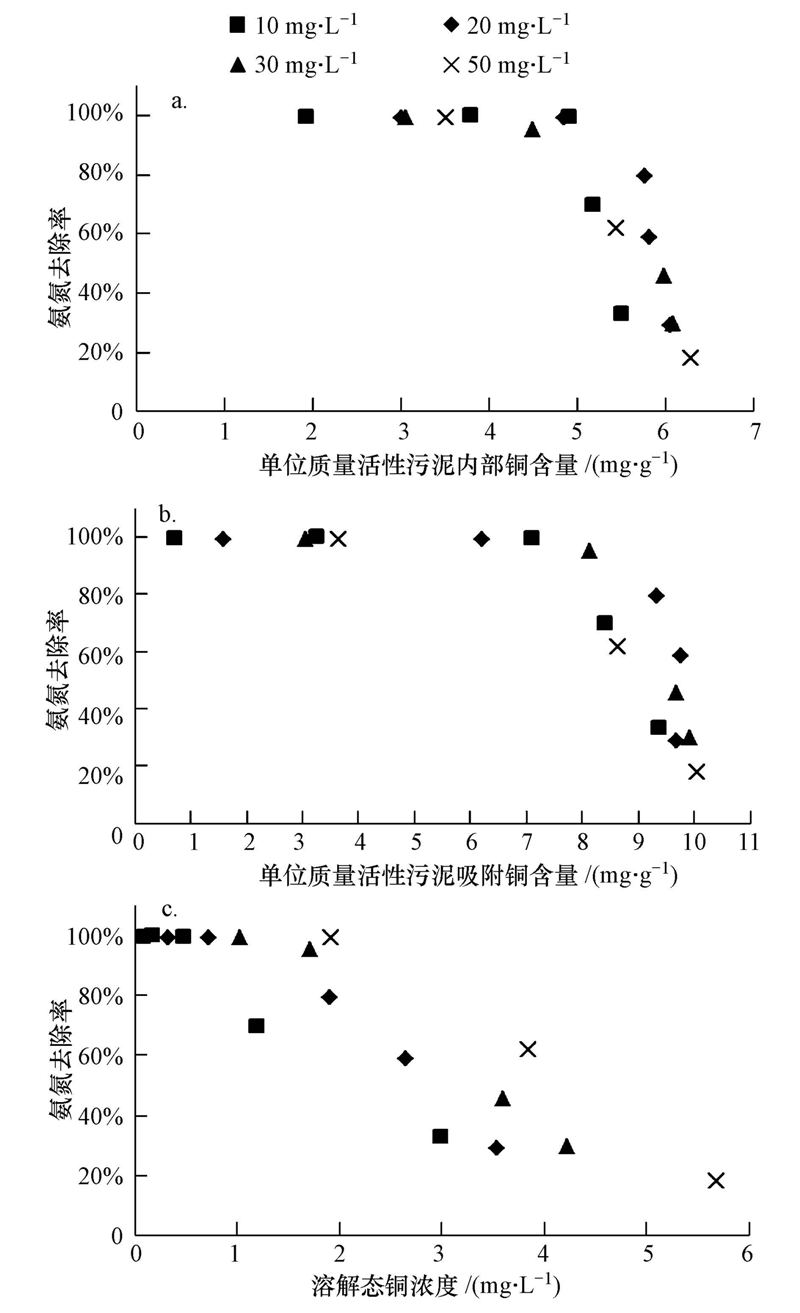 |
| 图 6 不同形态的铜和氨氮去除率的相关性(a.活性污泥内部的铜;b.活性污泥吸附的铜;c.溶解态的铜) Fig. 6 Relationship between the Cu concentration in different phases and the NH+4-N removal rate(a. Cu in activated sludge; b.Cu adsorbed on activated sludge; c. soluble Cu) |
各体系分别恢复25个周期后,反应体系内的总铜减少并不明显,相较于各自抑制稳定期,10、20、30和50 mg · L-1 Cu2+体系中活性污泥内的铜分别减少14.4%、15.1%、16.4%和16.2%,活性污泥吸附的铜分别减少14.8%、13.0%、10.1%和10.3%,溶解态铜分别减少了47.6%、37.8%、27.9%和26.6%(此时溶解态的铜浓度分别为0.58、1.83、2.32、5.02 mg · L-1).结果表明,活性污泥内部及其表面吸附的铜不易解析出来,且残余浓度降低比例相近,但溶解态铜在不同浓度体系中降低的量差异较大,降低的比例越大,NH+4-N去除率恢复速率越快,且恢复程度越大.所以,恢复过程同样体现了硝化的抑制率与溶解态铜浓度的相关性较好.
当含铜废水最初进入反应体系后,大量的铜被活性污泥固定,体系内溶解态铜浓度很快降低.这可能由于活性污泥的吸附作用促进了反应器中Cu(OH)2、CuCO3的生成和沉淀,从而产生的铜聚合物沉积在菌体表面,被活性污泥捕获(Volesky et al., 1995).随着Cu的不断投加,无法被固定的铜参与到氧化还原体系中生成羟基自由基,从而破坏了细胞膜功能(Ochoa-Herrera et al., 2011).低浓度Cu2+体系中(10、20 mg · L-1),铜投加浓度小,较晚达到吸附饱和,且溶解态铜浓度也较低,参与氧化还原的铜相对较少,对AOB细胞膜未产生不可逆的影响,所以恢复期硝化能力较易恢复.高浓度Cu2+体系中(50 mg · L-1),铜投加量较大,很快达到饱和量,溶解态铜浓度较高从而严重破坏了AOB细胞膜,导致氨氧化性能急剧下降,恢复过程也较为缓慢.与AOB抑制情况不同,从抑制稳定期的亚硝酸盐氧化性能和NOB的耗氧速率的变化可看出,NOB菌群能逐渐被驯化从而适应低浓度铜的环境.Mertoglu等(2008)也提出在重金属的影响下,AOB比NOB更易受到抑制.
4 结论(Conclusions)1)SBR活性污泥系统中硝化效率较易受到Cu2+的持续负荷影响,对NH+4-N去除的抑制作用随着Cu2+浓度的增大和运行周期的延长变得显著.在抑制期,进水中持续的10、20、30和50 mg · L-1的Cu2+负荷使NH+4-N去除率分别在抑制87、80、55、31个周期之后降低至31.3%、29.3%、27.1%、22.5%.在恢复阶段,AOB和NOB的恢复速率随着抑制期投加Cu2+浓度的增加而降低.10~20 mg · L-1 Cu2+体系中,NOB可以被全部或者部分驯化,10~30 mg · L-1 Cu2+的体系内,异养菌可以全部被驯化.
2)Cu2+对硝化细菌的活性抑制作用明显.在抑制期,Cu2+浓度为10~50 mg · L-1时,AOB活性抑制率为89.1%~95.5%,NOB抑制率为16.4%~94.9%,异养菌抑制率为13.8%~80.0%.各体系中Cu2+对菌群的抑制率为:AOB>NOB>异养菌.
3)抑制期,各系统内铜主要分布在细胞内部和表面,且恢复过程中不易解析.当活性污泥内部和其表面吸附的铜分别积累到(5.0±0.5)和(9.0±0.5)mg · g-1(以MLSS计)时,各浓度体系的NH+4-N降解去除率急剧下降.硝化抑制率与溶解态的铜浓度呈负相关.
| [1] | Dangcong P, Bernet N, Delgenes J, et al. 2000. Effects of oxygen supply methods on the performance of a sequencing batch reactor for high ammonium nitrification[J]. Water Environment Research, 72: 195-200 |
| [2] | Groeneweg J, Sellner B, Tappe W. 1994. Ammonia oxidation in nitrosomonas at NH3 concentrations near Km: effects of pH and temperature[J]. Water Research, 28: 2561-2566 |
| [3] | Hu Z, Chandran K, Grasso D, et al. 2002. Effect of nickel and cadmium speciation on nitrification inhibition[J]. Environment Science and Technology, 36: 3074-3078 |
| [4] | Hu Z, Chandran K, Grasso D, et al. 2003. Impact of metal sorption and internalization on nitrification inhibition[J]. Environmental Science and Technology, 37: 728-734 |
| [5] | Hu Z, Chandran K, Grasso D, et al. 2004. Comparison of nitrification inhibition by metals in batch and continuous flow reactors[J]. Water Research, 38: 3949-3959 |
| [6] | Kim K T, Kim I S, Hwang S H, et al. 2006. Estimating the combined effects of copper and phenol to nitrifying bacteria in wastewater treatment plants[J]. Water Research, 40: 561-568 |
| [7] | 雷兆武, 孙颖. 2009. 含铜废水处理现状[J].中国环境管理干部学院学报, 19(1): 61-63 |
| [8] | Madoni P, Davoli D, Guglielmi L. 1999. Response of SOUR and AUR to heavy metal contamination in activated sludge[J]. Water Research, 33: 2459-2464 |
| [9] | Mertoglu B, Semerci N, Guler N, et al. 2008. Monitoring of population shifts in an enriched nitrifying system under gradually increased cadmium loading [J]. Journal of Hazardous Materials, 160: 495-501 |
| [10] | Nelson P O, Chung A K, Hudson M C. 1981. Factors affecting the fate of heavy metals in the activated sludge process[J]. Journal Water Pollution Control Federation, 53: 1323-1333 |
| [11] | Ochoa-Herrera V, León G, Banihani Q, et al. 2011. Toxicity of copper(Ⅱ) ions to microorganisms in biological wastewater treatment systems[J]. Science of the Total Environment, 412: 380-385 |
| [12] | Ong S A, Lim P E, Seng C E. 2010. Effects of adsorbents and copper(Ⅱ) on activated sludge microorganisms and sequencing batch reactor treatment process[J]. Journal of Hazard Materials, 103: 263-277 |
| [13] | Snoeyink V L, Jenkins D. 1980. Water Chemistry[M]. New York: John Wiley & Sons. 201-226 |
| [14] | Vasconcelos T M, Leal F M. 2001. Adsorption and uptake of Cu by Emiliania huxleyi in natural seawater[J]. Environmental Science and Technology, 35: 508-515 |
| [15] | Volesky B, Holan Z R. 1995. Biosorption of heavy metals[J]. Biotechnology Progress, 11: 235-250 |
| [16] | 王建龙, 吴立波, 齐星, 等. 1999. 用氧吸收速率(OUR)表征活性污泥硝化活性的研究[J].环境科学学报, 19(3): 225-229 |
| [17] | 姚国. 2008. 微波消解-原子吸收/原子荧光光度法测定活性污泥中的Cd、Pb、Ni、Cu、Zn、Cr、K、As、Hg[J].干旱环境监测, 22(2): 65-69 |
 2014, Vol. 34
2014, Vol. 34


