海州香薷(Elsholtzia splendens)是我国科学工作者发现的对铜具有较高耐性和较强富集能力的本土植物(Yang et al., 1998; 柯文山等,2007).该植物能够旺盛地生长于铜矿区,常被当作铜矿的指示植物(Jiang et al., 2002; Tang et al., 1999).近年来,不少学者对海州香薷的铜耐性机制开展了一系列研究.例如,杨明杰(2001)运用差速离心法研究了Cu在海州香薷细胞内的分布特征,结果表明,细胞壁是Cu分布的主要位点之一,运用电子显微镜进一步观察发现,大量的Cu2+沉积于细胞壁内侧.彭红云等运用EDS能谱分析表明,100 μmol · L-1 Cu处理海州香薷时,在细胞壁表面及细胞壁内有大量的高密度电子体沉积,尤其是海州香薷根细胞壁内的Cu/C和Cu/O比值最高(Peng et al., 2005).Ni等(2005)运用透射电镜和能谱联用技术(TEM-EDX)研究了海州香薷中的Cu的分布定位,结果表明,Cu2+主要积累在细胞中的细胞壁和液泡部位.以上研究均表明细胞壁、尤其是根细胞壁是Cu2+的主要累积场所.
细胞壁对重金属的吸附固定主要靠细胞壁中各组分提供的各种带负电的配位基团来完成的,如羟基、羧基、醛基、氨基及磷酸基等(Haynes,1980)可以和重金属阳离子发生各种物理和化学反应而将其固定于细胞壁中,从而减少金属离子通过跨膜运输进入原生质体,在一定程度上降低了金属胁迫对植物正常生理活动的干扰(张旭红等,2008).细胞壁上的果胶是阳离子的主要结合位点,果胶中的同聚半乳糖醛酸(RGI)与二价的金属离子具有较强的结合能力(Krzesłowska,2011).除果胶以外,Cu2+还可以和细胞壁的结构物质纤维素、半纤维素及木质素结合被吸附固定在细胞壁上(Nishizono et al., 1987).也有研究发现,Cu2+还可以和细胞壁的磷酸根基团结合,以磷酸盐团聚体形式存在(Sela et al., 1988).细胞壁的部分蛋白也参与了重金属的固定,研究表明,部分蛋白可以和金属结合形成金属蛋白复合物(Bringezu et al., 1999).由此可见,无论是细胞壁的哪一部分物质与Cu2+结合,都可把Cu2+固定在其内部区域中,从而减轻Cu2+对细胞内其他部分的伤害.
海州香薷对铜的高度耐性在于其细胞壁可以积累大量的Cu2+,研究表明,70%以上的铜结合在海州香薷根细胞壁上(Peng et al., 2005).而关于海州香薷根细胞壁各组分,如果胶、纤维素、半纤维素在其对Cu2+的吸附固定过程中所起到的作用,以及其各细胞壁组分中的哪些官能团在铜吸附固定过程中起到关键性作用等一系列问题尚未解决.因此,本文以海州香薷根细胞壁及其组分为研究材料,以吸附动力学为研究手段,采用傅立叶红外光谱(FTIR)技术,进一步研究海州香薷根细胞壁对Cu的吸附行为特征,即Cu在细胞壁上的结合位点和分子形态,以阐明海州香薷根细胞壁的解毒机制.
2 材料和方法(Materials and methods) 2.1 植物材料培养供试用海州香薷种子采自浙江省富阳市环山乡铜冶炼厂附近的植物修复基地(119°55′29.7″E,29°56′22.6″N)上生长的同一棵海州香薷植株上.海州香薷种子用蒸馏水洗净,播于发芽盘中用去离子水湿润的纱布上,发芽后,移入人工气候室,用0.2×Rorison营养液预培养长至2~4叶期,选取长势一致的幼苗移栽.移栽后的幼苗用0.5×Rorison营养液培养,每3 d更换一次培养液,保持通气,昼夜温度25/20℃昼夜时间16/8 h,光强为230~240 μmol · m-2 · s-1.培养液组成如下(μmol · L-1):Ca(NO3)2 1000,MgSO4 500,K2HPO4 500,H3BO3 23,MnSO4 4.5,Na2MoO4 0.5,CuSO4 0.8,Fe(Ⅲ)-EDTA 27和ZnSO4 0.5,pH=5.8.
将培养28 d的海州香薷幼苗分根系和地上部分收获,根系用冷的5 mmol · L-1 Ca(NO3)2溶液解析30 min,以脱去根表面吸附的铜,再用去离子水洗净(Harrison et al., 1979).将植物用液氮固定,保存 于-75 ℃备用.共培养幼苗15盆,每盆种10株植物,每个处理设置3个重复,每个重复包括30株幼苗.
2.2 海州香薷细胞壁的提取细胞壁的提取采用粉碎细胞、抽提细胞内物质的方法(Zhong et al., 1993). 新鲜根系吸取水分后,在研钵中加入液氮研磨至粉末状,转移到离心管中,加入75%的冰乙醇浸没混匀,冰浴20 min后以5000 g离心10 min;去上清后加入冰丙酮提取,冰浴20 min后离心20 min,去上清后加入甲醇 ∶ 氯仿(1 ∶ 1,体积比)提取,冰浴20 min后离心20 min,去除上清;最后加入甲醇提取,冰浴20 min后离心20 min,去上清液后冷冻干燥,干燥后得到的固体即为细胞壁.提取完成后,干燥的细胞壁放入4 ℃的冰箱密封保存.(试剂用量均为10 mL · g-1,以根鲜重计)
2.3 细胞壁的化学改性 2.3.1 果胶甲基化程度的调节参照El-Nawawi等(1995)的方法调节细胞壁果胶的甲基化程度.称取一定量细胞壁样品,装入2 mL 的柱子中,用水浸泡过夜,抽干水分.加入2 mL 1.0 mol · L-1的 NH3 · H2O(含异丙醇60%)处理2 h 后(温度25 ℃),抽干,依次用60%的异丙醇、1.0 mol · L-1 HCl(含异丙醇60%)和0.01 mol · L-1 KNO3(pH=5.75)冲洗数次后,抽干溶液,用去离子水洗涤3次,沉淀冷冻干燥后4 ℃保存备用.
2.3.2 细胞壁半纤维素酶改性结合Schmohl等(2000)及Zheng等(2004)的处理方法,取2 g海州香薷根细胞壁粉末置于离心管中,加入20 mL乙酸-乙酸钠缓冲液(0.2 mol · L-1,pH=5.5)和2 g半纤维素酶,50 ℃水解2 h,沉淀经离心分离后用去离子水洗涤3次,冷冻干燥后4 ℃保存备用.
2.3.3 细胞壁纤维素酶解取2 g海州香薷根细胞壁粉末置于离心管中,加入20 mL乙酸-乙酸钠缓冲液(0.2 mol · L-1,pH=4.8)和2 g半纤维素酶,50℃水解24 h,沉淀经离心分离后用去离子水洗涤3次,冷冻干燥后4 ℃保存备用.
2.3.4 细胞壁蛋白酶解取2 g海州香薷根细胞壁粉末置于离心管中,加入20 mL磷酸缓冲液(pH=8.0)和胰蛋白酶0.06 g,在37 ℃振荡水解3 h后离心去上清液,用磷酸缓冲液清洗1次.沉淀中再加入20 mL磷酸缓冲液(pH=8.0)和碱性蛋白酶0.1 g,50 ℃振荡水解6 h,沉淀用pH=8.0的磷酸缓冲液、蒸馏水各清洗2次,冷冻干燥后4 ℃保存备用.
2.4 海州香薷细胞壁铜吸附的动力学实验吸附溶液为50 μmol · L-1 CuSO4溶液,0.01 mol · L-1 KNO3溶液作为支持电解液(pH=5.75).将0.05 g改性或未改性的细胞壁置于底部有滤纸的滤头中,滤头上下均有接口用以连接吸附溶液或收集流出液.吸附溶液用蠕动泵以5 mL · 10 min-1的流速泵入小管中,经细胞壁后用自动收集器收集,每10 min收集1管,直到流出液中Cu2+浓度与吸附溶液中Cu2+浓度相同,本研究中约在500 min时达到吸附平衡.用AAS(Atomic absorption spectrometry)测定每管中Cu2+含量.动力学实验重复3次,取平均值做曲线,为防止图中曲线不清晰,误差线未在图中标出,但误差均在10%之内.
吸附平衡后,细胞壁先经0.01 mol · L-1 KNO3(pH=5.75)溶液以5 mL · 10 min-1的流速清洗1 h.然后将解吸溶液(0.1 mol · L-1 KNO3,pH=5.75)以同样流速泵入装有细胞壁的滤头中,同样采用自动收集器收集流出液,每10 min收集一管,直到流出液中没有Cu2+为止,本研究中约在500 min时达到解吸平衡.用AAS测定每管中Cu2+含量.
2.5 傅立叶变换红外光谱(FTIR)测定以红外光谱表征粗细胞壁及经化学改性后细胞壁的化学官能团特征.傅里叶变换红外光谱仪(FTIR,Shimadzu FTIR 8900)记录了样品在4000~400 cm-1范围内的红外光谱信号,光谱分辨率为4 cm-1.分别称取5 mg冻干后的样品,与150 mg KBr充分混匀,压片,放入样品室,在相同条件下测定红外光谱图.该样品与KBr的混合比例(1 ∶ 30)与Drake推荐的1 ∶ 100相比可以得到分辨率更高的红外光谱.
3 结果与分析(Result and analysis) 3.1 铜吸附动力学及吸附位点研究在吸附初始阶段,细胞壁对Cu2+的吸附速率均较快,随后速率减缓.由图 1可知,50 μmol · L-1 CuSO4处理300 min后,提取的根细胞壁的铜吸附量已接近于饱和水平,吸附量可以达到最大吸附量的90%左右,随后逐渐达到吸附平衡.在处理500 min后细胞壁对铜的吸附量均达到饱和,饱和吸附量为5.85 mg · g-1.对细胞壁进行化学改性后,检测细胞壁对铜的吸附能力可以看出,果胶和纤维素是细胞壁固定Cu2+的主要位点,分别吸附了19.85%和25.48%的铜(图 1).果胶在受到Cu2+胁迫下,主要发生甲基化反应,由此提供更多Cu2+结合位点.经NH3 · H2O处理的果胶,变成了低酯的酰胺化果胶,果胶上的阳离子吸附位点减少,因此,对铜的吸附能力减弱.其次是半纤维素,吸附固定了9.46%的铜.细胞壁蛋白结合Cu2+的方式并非简单的物理吸附或者化学键固定,而主要通过活性的重金属结合转运蛋白及分子伴侣,在ATP酶等动力的供应下,主动把Cu2+结合然后转运到胞质中固定起来.而离体的细胞壁并无能量供应,加之蛋白失活,所以对Cu2+的固定转运能力丧失.细胞壁蛋白存在于细胞壁中,往往通过化学键与纤维素、果胶、半纤维素等化学基团结合,使其嵌入在细胞壁结构中,这样往往屏蔽了一部分Cu2+的活性结合位点.虽然细胞壁蛋白也可以提供一些巯基等官能团对铜进行吸附固定,但这部分巯基并不能补偿被屏蔽的大量的活性基团.故去除细胞壁蛋白后,更多的化学结合位点暴露使得去蛋白的细胞壁对Cu2+的吸附结合能力更强.
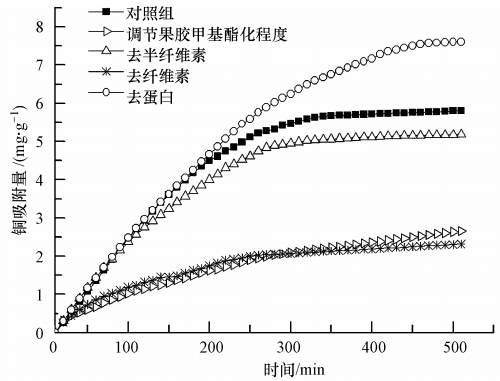 |
| 图 1 TiO2化学改性后海州香薷根细胞壁对Cu2+的吸附 Fig. 1 The amount of Cu2+ adsorbed by the cell wall of E. splendens with chemical modification |
对改性前后空白对照处理组的海州香薷根细胞壁的红外光谱图(4000~500 cm-1,图 2)进行解析,得到细胞壁在化学改性前后官能团变化的信息(表 1).
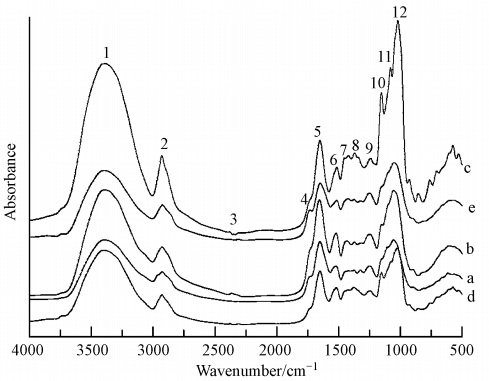 |
| 图 2 化学改性前后海州香薷根细胞壁红外光谱表征(a:未经改性的根细胞壁;b:果胶甲基酯化程度降低的根细胞壁;c:去半纤维素后的根细胞壁;d:去纤维素后的细胞壁;e:去蛋白后的细胞壁) Fig. 2 The FTIR spectra of the root cell wall of E. splendens with and without chemical modification(a: crude root cell wall; b: root cell wall with pectin esterification; c: root cell wall without hemicellulose; d: root cell wall without cellulose; e: root cell wall without protein) |
| 表 1 化学改性前后海州香薷根细胞壁红外光谱特征峰的半定量分析 Table 1 Semi-quantitative analysis of FTIR spectra on root cell wall of E. splendens with and without chemical modification |
果胶甲基酯化程度降低的根细胞壁中(图 2b),酯基—C O的伸缩振动峰(No.4)向低频方向偏移,由此说明通过NH3 · H2O降低了果胶甲基酯化程度的细胞壁改性成功.而1417cm-1处(No.7)的羧酸盐C O不对称伸缩振动吸收峰增强,表明经改 性后羧基被酯化.1249 cm-1处(No.9)的硫酸酯 的—C—O—S峰振动增强,说明细胞壁内的硫酸酯化程度增加.
去纤维素、半纤维素的根细胞壁中(图 2c,d),1053 cm-1(No.12)处的纤维素多糖链C—C键的伸缩振动峰与没有去半纤维素及纤维素的细胞壁相比,这一吸收振动峰出现在较低频的位置上,说明经过酶解后去除了细胞壁中大量的半纤维素和纤维素,改性成功.去半纤维素细胞壁中,果胶C—C键的伸缩振动峰(No.11)向低频移动(孙元琳等,2009),由此可以推断,去纤维素后与半纤维素结合的少量果胶也随之被去除,部分半纤维素与果胶紧密结合.
在去蛋白的根细胞壁中,1327 cm-1处(No.8)醇羟基的C—O弱吸收峰减弱,说明随着细胞壁结构蛋白的去除,与蛋白结合的醇羟基含量降低.果胶C—C键的伸缩振动峰(No.11)向低频移动,由此可以推断少量蛋白与果胶紧密结合.
3.3 吸附前后红外光谱分析根据FTIR谱图进行半定量分析,对每个谱图以2922 cm-1处—CH3中C—H特征吸收峰的吸光度(A2922)为基准,用其它特征峰(如3392、1732、1652和1516 cm-1等处)的吸光度A与A2922的比值,来半定量分析海州香薷根细胞壁吸附Cu2+前后特征峰的变化(图 3).另外,当官能团参与金属结合时,其吸收峰向低频移动,因此,可以通过吸收峰的位移来判断参与Cu结合的官能团.通常,FTIR谱图可以表征那些能够离子化的基团(如羧基、羟基、氨基等)在重金属吸附过程中的作用.
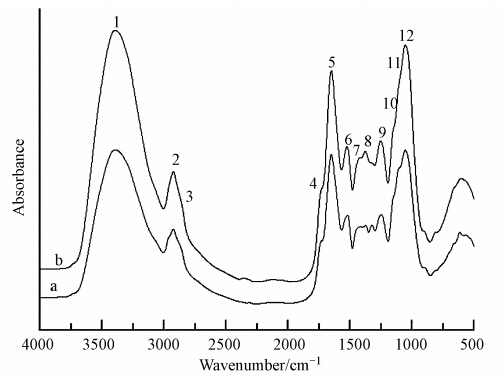 |
| 图 3 海州香薷根细胞壁吸附Cu2+前(a)后(b)的红外光谱图 Fig. 3 The FTIR spectra of the root cell wall of E. splendens before(a) and after(b)Cu2+ adsorption |
吸附前后的细胞壁红外半定量分析结果如表 2所示,且在1327 cm-1处相应的—OH弱吸收峰的吸光度也降低,说明—OH参与了Cu2+的结合,也说明细胞壁与Cu2+结合过程中化学吸附起了一定作用.吸附后纤维素弯曲振动多糖链C—C键明显增强,说明纤维素在吸附过程中发挥重要作用,纤维素中的特征峰(No.8)和果胶质中的特征峰(No.11),表明纤维素和果胶质也可能都参与了Cu2+的结合.在1249 cm-1处(No.9)对应的是硫酸酯的—C—O—S伸缩振动峰、吸附Cu2+后细胞壁硫酸酯化程度增加,由此说明硫酸酯参与了Cu2+的结合.
| 表 2 海州香薷根细胞壁吸附Cu2+前后红外光谱特征峰的半定量分析 Table 2 Semi-quantitative analysis of FTIR spectra of root cell wall of E. splendens before and after Cu2+ adsorption |
图 4和表 3是果胶甲基酯化程度降低的海州香薷根细胞壁吸附Cu2+前后的红外光谱图及相应官能团变化情况.可以看出,结合Cu2+后的—OH峰向低频方向移动38 cm-1,SH向低频方向移动6 cm-1,酰胺I带中的C—N峰也向低频方向移动2 cm-1,且多糖物质的C—C或C—O峰也向低频方向移动6 cm-1,表明果胶甲基酯化程度降低后蛋白中的—SH、—NH2和—OH及果胶中的—OH仍然是Cu的主要结合位点.
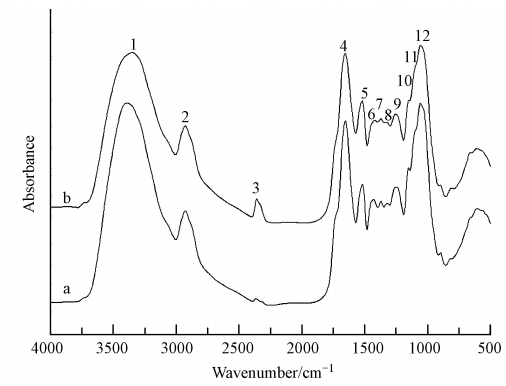 |
| 图 4 果胶甲基酯化程度降低的海州香薷根细胞壁吸附Cu2+前(a)后(b)的红外光谱图 Fig. 4 The FTIR spectra of the pectin methylated root cell wall of E. splendens before(a) and after(b)Cu2+ adsorption |
| 表 3 果胶甲基酯化程度降低的海州香薷根细胞壁吸附Cu2+前后红外光谱特征峰的半定量分析 Table 3 Semi-quantitative analysis of FTIR spectra on the pectin methylated root cell wall of E. splendens before and after Cu2+ adsorption |
图 5和表 4是去半纤维素后的海州香薷根细胞壁吸附Cu2+前后的红外光谱图及相应官能团变化情况.可以看到,结合Cu2+后的OH峰向低频方向移动2 cm-1,结合Cu2+后的酯羧基峰向低频方向移动4 cm-1,酰胺II带中的N—N峰也向低频方向移动2 cm-1,且纤维素C—O键向低频方向移动19 cm-1.
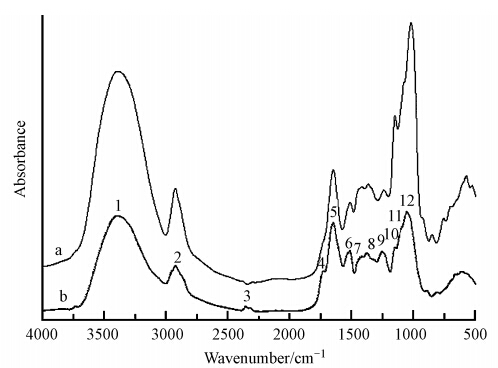 |
| 图 5 去半纤维素的海州香薷根细胞壁吸附Cu2+前(a)后(b)的红外光谱图 Fig. 5 The FTIR spectra of the root cell wall without hemicellulose of E. splendens before(a) and after(b)Cu2+ adsorption |
| 表 4 去半纤维素的海州香薷根细胞壁吸附Cu2+前后红外光谱特征峰的半定量分析 Table 4 Semi-quantitative analysis of FTIR spectra on the root cell wall without hemicellulose of E. splendens before and after Cu2+ adsorption |
表明去掉半纤维素后,蛋白质中的NH2、COOH及果胶中的—OH,纤维素中的COOH,在对铜的吸附结合中发挥重要作用.
图 6和表 5是去纤维素后的海州香薷根细胞壁吸附Cu2+前后的红外光谱图及相应官能团变化情况.可以看出,结合Cu2+后的酯羧基峰向低频方向移动4 cm-1,酰胺II带中的N—N峰也向低频方向移动2 cm-1,羧酸盐C O向低频方向移动2 cm-1,且多糖物质的C—C或C—O峰也向低频方向移动10 cm-1.表明去掉纤维素后,蛋白质中的—NH2,半纤维素中的COOH及果胶中的—OH是Cu的主要结合位点.
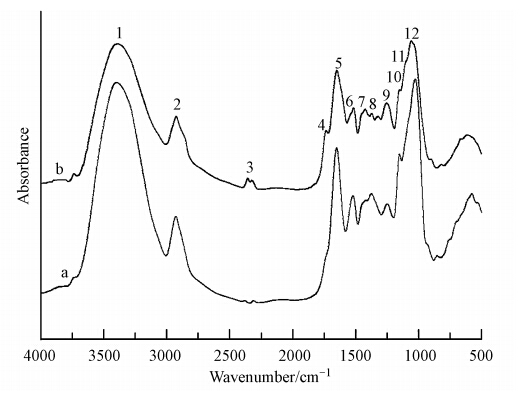 |
| 图 6 去纤维素的海州香薷根细胞壁吸附Cu2+前(a)后(b)的红外光谱图 Fig. 6 The FTIR spectra on the root cell wall without cellulose of E. splendens before(a) and after(b)Cu2+ adsorption |
| 表 5 去纤维素的海州香薷根细胞壁吸附Cu2+前后红外光谱特征峰的半定量分析 Table 5 Semi-quantitative analysis of FTIR spectra on the root cell wall without cellulose of E. splendens before(a) and after(b)Cu2+ adsorption |
去蛋白后的海州香薷根细胞壁吸附Cu2+前后的 红外光谱图及相应官能团变化情况见图 7和表 6.
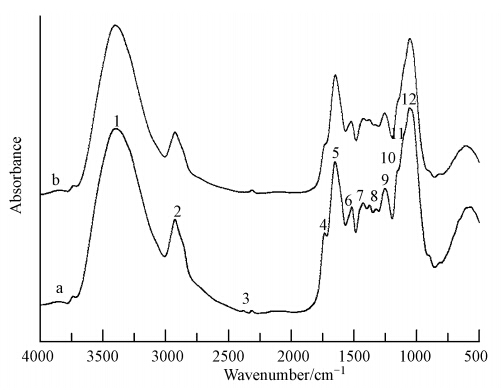 |
| 图 7 去蛋白的海州香薷根细胞壁吸附Cu2+前(a)后(b)的红外光谱图 Fig. 7 The FTIR spectra of the root cell wall without protein of E. splendens before(a) and after(b)Cu2+ adsorption |
| 表 6 去蛋白的海州香薷根细胞壁吸附Cu2+前后红外光谱特征峰的半定量分析 Table 6 Semi-quantitative analysis of FTIR spectra on the root cell wall without protein of E. splendens before(a) and after(b)Cu2+ adsorption |
结合Cu2+后的OH峰向低频方向移动2 cm-1,酰胺II带中的N—N峰也向低频方向移动1 cm-1,果胶多糖物质的C—C或C—O峰也向低频方向移动2 cm-1,表明去掉蛋白后,果胶中的—OH是的Cu2+的主要吸附结合位点.
4 讨论(Discussion)植物细胞壁含有多糖、蛋白质等物质,可以参与一系列反应,如离子交换、络合、沉析及结晶,从而改变金属元素在植物体内的蓄积行为(Krzesłowska,2011).海州香薷根系中70%左右的铜积累于根细胞壁(Lou et al., 2004),细胞壁多糖组分含有的主要基团为—OH+、—COO-、—NH2等使细胞壁具有较高的阳离子交换量.根细胞壁对铜的吸附能力主要取决于细胞壁的阳离子交换能力(CEC值)的大小,同时也受到pH、Cu2+和Ca2+浓度等许多因素的影响
细胞壁中的铜主要结合在占初生壁35%左右的带负电荷的果胶中,Cu2+可置换结合在果胶上的Ca2+(Davis et al., 2003; Dronnet et al., 1996).金属与细胞壁果胶多糖矩阵的结合,抑制了细胞壁的伸长(Eticha et al., 2005),从而影响了细胞壁的物理结构.另外,铜的毒害下还会导致细胞壁的加厚(Krzesłowska et al., 2009),部分原因是多糖积累增加的结果(Liu et al., 2004),而多糖积累的增加有利于细胞壁为重金属提供更多的吸附结合位点.已有的研究(林成永等,2005)表明,小麦敏感基因型根尖细胞壁果胶、半纤维素和纤维素含量较高,且在铝胁迫下提高幅度较大,导致根尖铝积累量及细胞壁的厚度和刚性增加,进而降低了细胞壁伸展性和根细胞的伸长速率.细胞壁组分中,果胶是吸附重金属的主要组分.从本质上说,细胞壁对铜的吸附和结合取决于细胞壁中果胶的阳离子吸附位点即游离羧基的多少,它不仅与果胶含量有关,而且还取决于果胶的甲基酯化程度(DM)(李刚等,2007),甲基酯化程度较低的果胶常含有较多的游离羧基.本实验表明,NH3 · H2O处理后果胶的细胞壁吸附Cu2+的能力与对照组相比降低了19.85%.这是因为经过NH3 · H2O处理后的果胶变成了低酯的酰胺化果胶,果胶上的阳离子吸附位点却减少了.因此,细胞壁对铜的吸附量的降低不仅与细胞壁果胶含量有关,而且与细胞壁果胶甲基酯化程度也有密切的关系.唐剑锋等(2005)研究认为,小麦根尖是铝毒蓄积的主要位点,细胞壁果胶含量和果胶甲基酯化程度可能是导致不同小麦基因型根尖细胞壁对铝吸附量和积累量差异及其对铝毒胁迫反应差异的重要原因.
吸附动力学实验表明,细胞壁的吸附位点除果胶之外,纤维素也是铜吸附的主要部位.经纤维素酶去除纤维素后,改性的细胞壁对铜的吸附量与对照相比降低了25.48%.FTIR谱图可以发现,去纤维素的细胞壁,其羧基振动峰向低频方向移动,并且对铜的吸附量降低.由此说明铜主要结合在纤维素的羧基官能团上.杨明杰(2001)研究发现,根细胞壁结合态铜有60%的铜和纤维素或者果胶结合.武贝等(2009)通过细胞壁改性实验表明,Cu2+主要结合于细胞壁纤维素、半纤维素和木质素的羧基官能团上.由此可知,纤维素在根细胞壁吸附过程中发挥重要的作用.通过去纤维素对铜吸附前后的红外光谱对比分析,可见酰胺键及果胶C—C键均发生偏移,由此说明纤维素的细胞壁、果胶、蛋白质为Cu2+吸附固定的主要位点.此外,细胞壁中的半纤维素、木质素等也能提供羧基等官能团吸附固定Cu2+.去半纤维素后的细胞壁与对照相比,果胶C—C键的振动峰偏移量较大.并且通过吸附Cu2+前后的去半纤维素的根细胞壁的红外光谱图比较分析得出,羧基、果胶C—C键及羟基、酯基的振动峰向低频方向偏移,这很好地说明了去掉半纤维素后,果胶的羟基成为结合铜的主要部位,由此也可以推测果胶以羟基和半纤维素的羧基相结合.
FTIR谱图中,由细胞壁吸附前后氨基和巯基的偏移量可判断细胞壁蛋白也参与了铜的吸附固定.但细胞壁蛋白对铜的物理性吸附固定并非重金属转运的主要方式.在活体中细胞壁蛋白通过其金属结合进行蛋白转运(如COPT等铜结合蛋白、铜分子伴侣CCS等)(Pilon et al., 2006),并在ATP酶的能量供应条件下,主动转运重金属到细胞质特定的区域内固定起来.细胞壁蛋白与细胞壁通过氢键、静电、疏水作用、范德华力和电价键等作用紧密结合在一起(Jamet et al., 2006).细胞壁蛋白通常和细胞壁多糖通过协同作用共同吸附固定重金属在细胞壁区域,防止其向内转运.某些细胞壁蛋白,如木聚糖转糖苷酶、扩张蛋白、合成和水解酶等能够通过打断细胞壁多糖之间的共价或非共价键来控制细胞的生长(Lee et al., 2004; 韩业君等,2007).本实验发现,经蛋白酶处理后去蛋白的细胞壁对Cu2+吸附后,果胶多糖链中的C—C键作用显著,羟基振动峰向低频方向移动,去蛋白的细胞壁主要是果胶通过羟基固定吸附Cu2+. 另外,通过对经蛋白酶处理的去蛋白的细胞壁与原细胞壁的FTIR谱图比较分析可知,巯基、酯基、硫酸盐及果胶C—C键的振动峰均发生偏移,由此推测出大部分细胞壁蛋白以巯基、酯基等化学键与果胶多糖链相结合.
5 结论(Conclusions)海州香薷细胞壁、特别是根细胞壁对Cu2+具有较高的吸附固定能力.吸附动力学表明,海州香薷根细胞壁对Cu2+具有较高的亲和力,吸附300 min后,根细胞壁的铜吸附量已接近于饱和水平,吸附量可以达到最大吸附量的90%左右;吸附500 min后达到吸附饱和,饱和吸附量为5.85 mg · g-1.果胶的羟基、半纤维素、纤维素的羧基、蛋白质的氨基是Cu2+吸附的位点.果胶和纤维素是Cu2+吸附固定的主要部位,分别吸附了19.85%和25.48%的铜.此外,蛋白质与果胶,以及果胶与半纤维素之间存在协同作用共同吸附固定铜.
| [1] | Bringezu K, Lichtenberger O, Leopold I, et al. 1999. Heavy metal tolerance of Silene vulgaris[J]. Plant Physiol, 154(4):536-546 |
| [2] | Davis TA, Volesky B, Mucci A. 2003. A review of the biochemistry of heavy metal biosorption by brown algae[J].Water Research, 37(18):4311-4330 |
| [3] | Dronnet V, Renard C, Axelos M, et al. 1996. Heavy metals binding by pectins: selectivity, quantification and characterisation[J]. Progress in Biotechnology, 14:535-540 |
| [4] | El-Nawawi S, Heikal Y. 1995. Production of a low ester pectin by de-esterification of high ester citrus pectin[J].Carbohyrate Polymers, 27(3):191-195 |
| [5] | Eticha D, Stass A, Horst W J. 2005. Cell-wall pectin and its degree of methylation in the maize root-apex: significance for genotypic differences in aluminium resistance[J].Plant, Cell & Environment, 28(11):1410-1420 |
| [6] | Harrison S, Lepp N, Phipps D. 1979. Uptake of Copper by excised roots Ⅱ. Copper desorption from the free space[J].Zeitschrift für Pflanzenphysiologie, 94(1):27-34 |
| [7] | Haynes R. 1980. Ion exchange properties of roots and ionic interactions within the root apoplasm: their role in ion accumulation by plants[J].The Botanical Review, 46(1):75-99 |
| [8] | 韩业君, 陈洪章. 2007. 植物细胞壁蛋白与木质纤维素酶解[J].化学进展, 19(7):1153-1158 |
| [9] | 柯文山, 熊治廷, 金则新, 等. 2007. 海州香薷 (Elsholtzia haichouensis Sun) 不同生态型 Cu 吸收和酸性磷酸酶活性差异[J].生态学报, 27(8):3172-3181 |
| [10] | Jamet E, Canut H, Boudart G, et al. 2006. Cell wall proteins: a new insight through proteomics[J].Trends in Plant Science, 11(1):33-39 |
| [11] | Jiang L, Shi W, Yang X, et al. 2002. Cu-hyperaccumulators in mining area[J].The Journal of Applied Ecology, 13(7):906-908 |
| [12] | Krzesłowska M. 2011. The cell wall in plant cell response to trace metals: polysaccharide remodeling and its role in defense strategy[J].Acta Physiologiae Plantarum, 33(1):35-51 |
| [13] | Krzesłowska M, Lenartowska M, Mellerowicz EJ, et al.2009. Pectinous cell wall thickenings formation—a response of moss protonemata cells to lead[J].Environmental and Experimental Botany, 65(1):119-131 |
| [14] | Lee S J, Saravanan R S, Damasceno C, et al. 2004. Digging deeper into the plant cell wall proteome[J].Plant Physiol Bioch, 42(12):979-988 |
| [15] | Liu H, Liao B, Lu S. 2004. Toxicity of surfactant, acid rain and Cd2+ combined pollution to the nucleus of Vicia faba root tip cells[J].The Journal of Applied Ecology, 15(3):493 |
| [16] | Lou L, Shen Z, Li X. 2004. The copper tolerance mechanisms of Elsholtzia haichowensi, a plant from copper-enriched soils[J].Environmental and Experimental Botany, 51(2):111-120 |
| [17] | 李刚, 唐剑锋, 林咸永, 等. 2007.小麦根尖细胞壁对铝的吸附/解吸特性及其与耐铝性的关系[J].植物营养与肥料学报, 13(2):192-199 |
| [18] | 林成永, 唐剑锋, 李刚, 等. 2005. 铝胁迫下小麦根细胞壁多糖组分含量的变化与其耐铝性的关系[J].浙江大学学报: 农业与生命科学版, 31(6):724-730 |
| [19] | Ni C Y, Chen Y X, Lin Q, et al. 2005. Subcellular localization of copper in tolerant and non-tolerant plant[J]. Journal of Environmental Sciences, 17(3):452-456 |
| [20] | Nishizono H, Ichikawa H, Suziki S, et al. 1987. The role of the root cell wall in the heavy metal tolerance of Athyrium yokoscense[J].Plant and Soil, 101(1):15-20 |
| [21] | Peng H, Yang X, Tian S. 2005. Accumulation and ultrastructural distribution of copper inElsholtzia splendens[J]. Journal of Zhejiang University Science B, 6(5):311-318 |
| [22] | Pilon M, Abdel-Ghany S E, Cohu C M, et al. 2006. Copper cofactor delivery in plant cells[J].Current Opinion in Plant Biology, 9(3):256-263 |
| [23] | Schmohl N, Horst W J. 2000. Cell wall pectin content modulates aluminium sensitivity ofZea mays (L.) cells grown in suspension culture[J].Plant Cell and Environment, 23(7):735-742 |
| [24] | Sela M, Tel-Or E, Fritz E, et al.1988. Localization and toxic effects of cadmium, copper, and uranium in Azolla[J].Plant Physiology, 88(1):30-36 |
| [25] | 孙元琳, 崔武卫, 顾小红, 等. 2009. 傅里叶变换红外光谱法测定当归果胶多糖的酯化度[J].光谱学与光谱分析, 29(3):682-685 |
| [26] | Tang S, Wilke B M, Huang C. 1999. The uptake of copper by plants dominantly growing on copper mining spoils along the Yangtze River, the People's Republic of China[J].Plant and Soil, 209(2):225-232 |
| [27] | 唐剑锋, 林成永, 章永松, 等. 2005. 小麦根系对铝毒的反应及其与根细胞壁组分和细胞壁对铝的吸附-解吸性能的关系[J].生态学报, 25(8):1890-1897 |
| [28] | Yang X, Shi W, Fu C, et al. 1998. Copper hyperaccumulators of Chinese native plants: characteristics and possible use for phytoremediation. Sustainable agriculture for food[J].Energy and Industry, 11:484-489 |
| [29] | 杨明杰. 2001. 海州香薷 (Elsholtzia splendens Nakai) 对铜的超积累机理研究[D].杭州:浙江大学. 52-65 |
| [30] | Zheng S J, Lin X Y, Yang J L, et al. 2004. The kinetics of aluminum adsorption and desorption by root cell walls of an aluminum resistant wheat (Triticum aestivum L.) cultivar[J].Plant and Soil, 261(1/2):85-90 |
| [31] | Zhong H, Lauchli A.1993. Changes of cell wall composition and polymer size in primary roots of cotton seedlings under high salinity[J].Experiment Botany, 44(4):773-778 |
| [32] | 张旭红, 高艳玲, 林爱军, 等. 2008. 植物根系细胞壁在提高植物抵抗金属离子毒性中的作用[J].生态毒理学报, 3(1):9-14 |
| [33] | 武贝. 2009. 海州香薷 Cu 耐性与积累机制研究[D].杭州:浙江大学 |
 2014, Vol. 34
2014, Vol. 34


