2. 浙江工业大学化学工程学院, 杭州 310014;
3. 浙江省生物燃料利用技术研究重点实验室, 杭州 310014;
4. 浙江省宁波诺丁汉大学工程学院, 宁波 315100
2. College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014;
3. Zhejiang Province Key Laboratory of Biofuel, Hangzhou 310014;
4. Division of Engineering, University of Nottingham Ningbo China, Ningbo 315100
生物炭是指生物质在无氧或缺氧的条件下发生热转化,得到的一种碳含量极其丰富的固体产物.由于原材料、技术工艺及热解条件等差异,生物炭在结构、pH、挥发分含量、灰分含量、持水性、表观密度、孔容、比表面积等理化性质上表现出非常广泛的多样性,进而使其拥有不同的环境效应和应用(Saran et al., 2009).但整体而言,生物炭因为其含碳量高、孔隙发达、稳定性高等优点,被认为是改良土壤、净化水质和减缓碳排放的优质原料(李力等,2011),同时也被认为是活性炭的前驱体(Suhas et al., 2007).现今,农作物残余物、有机废物等已成为第二代生物炭原料的主要来源(Kwapinsk et al., 2010).裂解法是生物炭制备的常用方法,水热炭化作为裂解的一种,在20世纪初就开始逐渐引起人们的关注.与高温干法裂解相比,其特点在于:可处理含水量高的废弃生物质,反应条件温和,处理设备简单,操作方便,应用规模可调节性强(Titirici et al., 2010).研究表明,不同原料的结构及化学组成上的差异,对制备出来的水热炭的物理、化学性质有较大的影响,其中,反应时间、反应温度、生物质与去离子水质量比是影响水热炭得率及性能的主要因子(Hu et al., 2010).如Ramke等(2009)以来源于工业、农业和生活中的各种有机废物为原料,制得的水热炭可直接作为固体燃料;Marta等(2011)以桉树木屑和大麦秸秆为原料,制得的水热炭在CO2吸附领域表现出较优的性能;Rillig等(2010)以甜菜根为原料,制得的水热炭可用作土壤改良剂;王定美等(2013)研究了污泥水热炭在碳固定方面的应用.以上研究表明,水热法制备生物炭已成为废弃生物质资源化利用的重要方向之一,同时寻找更为合适的生物炭原料来源也成为本领域的研究热点.
大型海藻、海草等水生植物具有不占用农业用地、生长周期短、产量高、不需要农业投入品(农药、化肥、淡水等)、易粉碎和干燥、预处理成本低等优点(Stefan et al., 2013),被FAO(Food and Agriculture Organization of the United Nation)视为最适合作生物质资源的藻类(FAO,2009).自2009年以来,基于大型海藻和海草富含木质纤维素的特点,国内外学者开展了以其为原料制备活性炭的研究,目前见诸于文献报道的包括以Undaria Pinnatifida(裙带菜)(Cho et al., 2013)、Sargassum Longifolium(S.L.)(长托马尾藻)和Hypnea Valentiae(H.V.)(鹿角沙菜)(Aravindhan et al., 2009)及Posidonia Oceanic (L.)(波喜荡海草)(Ncibi et al., 2009; Mehmet et al., 2011)为原料制备的活性炭.但目前国内除曾淦宁等(2013)和胡章等(2012)分别利用铜藻(Sargassum Horneri)和细基江蓠(Gracilaria Tenuistipitata)制备活性炭的报道外,将大型海藻作为原料制备生物炭的研究尚未见报道.基于此,本文选取浙江一种优势大型海藻-铜藻为原料,采用水热炭化法制备铜藻基水热炭,并在此基础上进行工艺优化、性能测定,以期为国内大型海藻基生物炭的系统研究和工业利用提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验原料实验采用的铜藻(Sargassum Horneri)取自温州海域,用去离子水将铜藻表面杂质洗净,于105 ℃下在烘箱中干燥至恒重,粉碎,过100目标准筛,筛得的粉末干燥保存备用.铜藻及其他几种大型海藻的元素分析和工业分析结果(表 1)表明,与其他几种大型海藻相比,铜藻具有较高的C含量和较低的灰分含量,因此,铜藻是较理想的活性炭制备原料.
| 表1 几种大型海藻的元素分析及工业分析 Table.1 Ultimate and proximate analysis of some macroalgaes |
按一定质量比(m铜藻/m去离子水=2.5/47.5~10.0/40.0)称取总质量为50.0 g的铜藻粉末与去离子水,将铜藻粉末直接加入水热反应釜(100 mL,安全温度≤220 ℃),将1.96 g Fe(NH4)2(SO4)2 · 6H2O溶于去离子水配成溶液后加入水热反应釜;将水热反应釜密封,置于烘箱中,在设定温度下反应一段时间后,取出反应釜,自然冷却至室温;将水热反应釜内的产品过滤分离,在100 ℃下干燥至恒重,得到固体铜藻基水热炭(以下正文中简称“水热炭”).
2.2.2 铜藻基干法裂解炭在自行设计的反应器中(图 1),加入10 g铜藻粉末原料,在流量为10 L · min-1的氮气保护下,从室温升至500 ℃,反应1 h,得到铜藻基干法裂解炭(以下正文中简称“干法炭”).
 |
| 图 1 生物炭干法裂解实验装置示意图 Fig. 1 Schematic diagram of experimental apparatus of dry pyrolyzed biochar |
实验样品中C、H、N、S元素含量用元素分析仪(德国,Vario Macro Cube型)测定,O含量采用差减法计算(O=100%-C-H-N-S-Ash).生物炭pH值的测定,通过在40 mL去离子水中加入2 g生物炭,搅拌30 min后静置10 min,测其悬浮液的pH值得到.样品的水分、挥发分含量采用热重分析仪(德国,TG209F3型)测定,将样品置于马弗炉中高温灼烧至恒重,称量计算得到灰分含量;固定碳含量用差减法计算得到.生物炭比表面积和孔结构采用自动吸附仪(美国,ASAP2020型)测定并通过液氮(77 K)BET吸附等温线计算.红外光谱在傅立叶变换红外光谱仪(美国,Nicolet 6700型)上测定,分辨率为4 cm-1,扫描次数为24次,光谱范围为4000~400 cm-1.生物炭的接触角采用光学接触角测量仪(德国,OCA-35型)进行测定.
2.4 碳回收率的计算生物炭碳回收率的计算公式如下:

选取反应时间、反应温度、铜藻与去离子水质量比3个因素作为正交实验的考察对象,每个因素取4个水平.以碳回收率和得率为考察指标,采用L16(45)正交表对水热炭制备工艺进行优化.前期试验发现,较低的反应温度(<180 ℃)和较短反应时间(<2 h)下得到的产物呈粘稠状,初步判断是反应不完全所致.综合考虑Fe(NH4)2(SO4)2 · 6H2O对生物质的热催化特性(Titirici et al., 2007),以及水热反应釜的安全操作温度(≤220 ℃),本实验将反应温度定为180~210 ℃,反应时间为2~16 h,固体粉末的质量比例定为5%~20%.具体工艺条件见表 2,实验结果见表 3,分析结果见表 4.
| 表2 铜藻基水热炭制备的正交因素和水平 Table.2 Factors and levels of orthogonal tests of Sargassum Horneri-based hydrochars |
| 表3 铜藻基水热炭正交实验结果 Table.3 Orthogonal test results of Sargassum Horneri-based hydrochars |
由表 4可知,对于指标碳回收率,最优工艺条件为A1 B1 C4;对于指标得率,最优工艺条件为A1 B1 C4.制备铜藻基水热炭的实验中,不同的指标对应的最佳工艺条件相同.因此,较优工艺条件为A1B1C4,即反应时间2 h、反应温度180 ℃、铜藻与去离子水质量比10.0/40.0,此条件下制得水热炭的碳回收率和得率分别为65.0%和51.4%.
| 表4 铜藻基水热炭正交实验结果分析 Table.4 Orthogonal test data processing of Sargassum Horneri-based hydrochars |
极差R的大小反映了因素的水平变化对指标的变化幅度,因素的极差越大,该因素对指标的影响越大.由表 4可知,对于指标碳回收率,因素主次顺序为A>C>B;对于指标得率,因素主次顺序为A>C>B.碳回收率受初始铜藻粉末与水质量比的影响最大,得率受反应时间影响最大.反应时间越短,反应温度越低,铜藻粉末与去离子水质量比越大,碳回收率和生物炭得率均越大.从生物炭的固碳效益考虑,要求生物炭有较高的碳回收率和得率,因此,相对较低的反应温度、较短的反应时间和较大的初始原料投入量是铜藻基水热炭的较优工艺条件.
3.2 铜藻基水热炭元素分析正交实验得到的元素组成及原子比表明,铜藻基水热炭的C含量为44.2%~51.8%,O含量为20.9%~32.5%,O/C为0.30~0.55,高于玉米青贮饲料基水热炭(0.09~0.39)、桉树基水热炭(0.27)和大麦秸秆基水热炭(0.20)的O/C(Jan et al., 2011; Marta et al., 2011).由于生物炭的O/C值越高,阳离子交换量(CEC)越大(Lee et al.,2010),因此可以认为,铜藻基水热炭的亲水性和阳离子交换能力相对较强.另一方面,生物炭的C/N值能反映其在限制土壤氮素的微生物转化和反硝化方面作用的强弱,C/N值越大,作用能力越强(Johanes et al., 2006).铜藻基水热炭的N含量为2.8%~4.0%,C/N为13.22~20.48,与杨木(69.5~85.9)、橄榄(57.7~78.0)和小麦秸秆(57.1~111.2)相比(Katja et al., 2013),比值较小,表明铜藻基水热炭在N元素固定方面较优,但在限制土壤氮素的微生物转化和反硝化方面较弱.
3.3 铜藻基水热炭表面特征分析最优工艺条件下制得的铜藻基水热炭的比表面积较低(26.64 m2 · g-1),这与国内外有关其他生物质水热炭的比表面积的报道相近,如Zhang等(2012)以浒苔(Enteromorpha Prolifera)为原料制得的水热炭比表面积为1.4 m2 · g-1;Mumme等(2011)制得的青贮玉米基水热炭最大比表面积为12 m2 · g-1;Liu等(2010)制得的松树基水热炭的比表面积为21 m2 · g-1.根据国际纯理论与应用化学联合会(IUPAC)分类,最优工艺条件下铜藻基水热炭的吸附等温线是Ⅲ型吸附等温线(图 2),孔径(13.96 nm)及孔容(0.0930 cm3 · g-1,其中,微孔孔容0.0007 cm3 · g-1)的测定结果同样证实了这一点.此类等温线表现出大孔吸附剂的吸附特征,吸附剂和吸附质的相互作用弱于吸附质间的相互作用.吸附存在H3型滞后环,表明水热炭表面具有片状颗粒堆积形成的狭缝形孔结构,吸附气体量随组分分压增加而上升,在较高相对压力区域没有任何吸附限制.铜藻基生物炭可通过进一步活化获得较佳品质的活性炭,这点已通过实验获得了初步证实.同时,铜藻基水热炭较高的O/C值和较低的C/N值说明铜藻基水热炭可能含有较高的含氧官能团和含氮官能团,也为进一步开发铜藻基生物炭的应用提供了依据.
 |
| 图 2 最优工艺条件铜藻基水热炭在77 K下的N2吸脱附等温线 Fig. 2 Absorption and desorption isotherm of N2 at 77 K of Sargassum Horneri-based hydrochar prepared at the optimal conditions |
根据3.1节试验结果,选取最优工艺条件下制得的水热炭及干法炭的化学组成如表 5所示.与水热炭相比,干法炭的灰分较高,表明水热法可将大量的无机物溶解于水溶液中,更利于制备低灰分的固体生物燃料.铜藻基水热炭和干法炭的C含量相近,而H、O和N含量,水热炭比干法炭高,表明水热炭表面有更多氮氧官能团存在.水热炭的得率(51.4%)较干法炭(33.5%)高,C含量两者相近,根据公式(1)计算可知,水热炭的碳回收率(65.0%)高于干法炭(48.7%).干法炭的pH值比水热炭的高,这与其他学者报道的一般裂解炭呈碱性,水热炭呈酸性相一致(Libra et al., 2011).水热炭和干法炭在接触角方面的差异(图 3)表明,水热炭较干法炭有更强的亲水性.基于水热炭的以上特点,可考虑将其应用于盐碱地的土壤改良.
| 表5 铜藻基水热炭和干法炭的pH值及元素和工业分析 Table.5 Ultimate and proximate analysis of Sargassum Horneri-based biochar prepared by hydrothermal carbonization and dry pyrolysis |
 |
| 图 3 铜藻基水热炭和干法炭的液滴形貌 Fig. 3 Droplets of Sargassum Horneri-based biochar prepared by hydrothermal carbonization and dry pyrolysis |
铜藻基水热炭和干法炭的FT-IR光谱图如图 4所示,两者在峰的形状和强度方面均不一样,表明水热法和干法裂解的热分解是不一样的过程.水热炭的吸收谱带表明水热炭较干法炭而言,表面含有大量极性官能团.其中,水热炭在3339 cm-1处的谱峰归属于羟基或羧基的O—H伸缩振动,2922cm-1处是脂肪族的C—H伸缩振动,1600和1429 cm-1处的谱峰是芳香环或C C的伸缩振动峰,其中,1600 cm-1处也可能是N—H的伸缩振动峰,1000~1300 cm-1处的谱带属于C—O的伸缩振动.由此推断,铜藻基水热炭的酸性与表面含有的酚羟基有关.干法炭的谱图较平坦,高温干法裂解将极性官能团(含氧官能团等)分解,这与Mohan等(2007)报道的含氧官能团在高温炭化过程中大量分解一致.红外结果表明,水热炭表面存在较为明显的含氧、含氮官能团,因而验证了上面所得出的水热炭较干法炭有更强亲水性的推论.基于以上原因,铜藻基水热炭将比干法炭具有更好的吸水和保水效果,可作为性能优良的土壤改良剂;另一方面,水热炭表面的含氧基团.使其具备更好的重金属吸附效应(Uchimiya et al., 2011),可作为性能优良的水处理吸附剂.
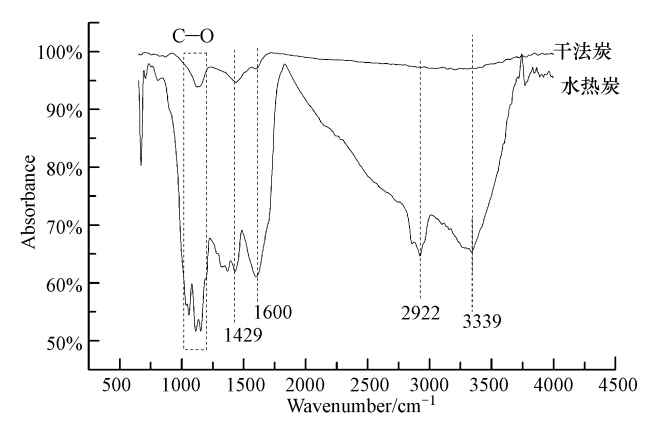 |
| 图 4 铜藻基生物炭的傅里叶红外谱图 Fig. 4 FT-IR spectra of Sargassum Horneri-based biochars prepared by hydrothermal carbonization and dry pyrolysis |
1)以铜藻为原料,制备铜藻基水热炭的最佳工艺条件为:反应时间2 h,反应温度180 ℃,铜藻与去离子水质量比1/4.在此条件下,水热炭的碳回收率为65.0%,得率为51.4%.
2)通过元素分析,铜藻基水热炭有较高的O/C和较低的C/N,表明铜藻基水热炭大量保留了铜藻中的氧、氮元素.
3)红外光谱、接触角、元素分析和工业分析比较表明,水热炭较干法裂解铜藻基生物炭表面存在更为丰富的含氧、含氮官能团,亲水性更强,水热炭的灰分含量更低,碳回收率和得率更高,因此,铜藻基水热炭在资源化利用方面具有更广阔的应用前景.
| [1] | Aravindhan R, Raghava Rao J, Unni Nair B.2009. Preparation and characterization of activated carbon from marine macro-algal biomass[J]. Journal of Hazardous Materials, 162(2/3): 688-694 |
| [2] | Bird M I, Wurster C M, de Silva P H P, et al. 2011. Algal biochar-production and properties[J]. Bioresource Technology, 102(2): 1886-1891 |
| [3] | FAO. 2009. Algae-based Biofuels:A Review of Challenges and Opportunities for Developing Countries[R]. Rome, Italy: Food and Agriculture Organization of the United Nations (FAO) |
| [4] | Hu B, Wang K, Wu L H, et al. 2010. Engineering carbon materials from the hydrothermal carbonization process of biomass[J]. Advanced Materials, 22(7): 813-828 |
| [5] | 胡章, 陈锦燕, 周昭勇, 等. 2012. 大型海藻细基江蓠制备活性炭的研究[J].化学与生物工程, 29(10): 31-33 |
| [6] | Cho H J, Kitae B, Jeon J K, et al.2013. Removal characteristics of copper by marine macro-algae-derived chars[J]. Chemical Engineering Journal, 217: 205-211 |
| [7] | Jan M, Lion E, Judith P, et al. 2011. Hydrothermal carbonization of anaerobically digested maize silage[J]. Bioresource Technology, 102(19): 9255-9260 |
| [8] | Johanes L, John G, Marco R. 2006. Biochar sequestration in terrestrial ecosystems-A review[J]. Mitigation and Adaptation Strategies for Global Change, 11(2): 403-427 |
| [9] | Katja W, Christophé N, Cornelia R, et al. 2013. Chemical modification of biomass residues during hydrothermal carbonization-What makes the difference, temperature or feedstock[J]. Organic Geochemistry, 54: 91-100 |
| [10] | Kwapinsk W, Byrne C M P, Kryachko E, et al. 2010. Biochar from biomass and waste[J]. Waste and Biomass Valorization, 1(2): 177-189 |
| [11] | Lee J W, Kidder M, Evans B R, et al. 2010. Characterization of biochars produced from cornstovers for soil amendment[J]. Environ Sci Technol, 44(20): 7970-7974 |
| [12] | Libra J A, Ro K S, Kammann C, et al. 2011. Hydrothermal carbonization of biomass residuals: a comparative review of the chemistry, processes and applications of wet and dry pyrolysis[J].Biofuels, 2 (1): 89-124 |
| [13] | 李力, 刘娅, 陆宇超, 等. 2011. 生物炭的环境效应及应用的研究进展[J]. 环境化学, 30(8): 1411-1421 |
| [14] | Liu Z G, Quek A, Hoekman S K, et al. 2013. Production of solid biochar fuel from waste biomass by hydrothermal carbonization[J]. Fuel, 103: 943-949 |
| [15] | Liu Z G, Zhang F S, Wu J Z. 2010. Characterization and application of chars produced from pinewood pyrolysis and hydrothermal treatment[J]. Fuel, 89(2): 510-514 |
| [16] | Marta S, Juan A M A, Antonio B F. 2011. Hydrothermal carbonization of biomass as a route for the sequestration of CO2: Chemical and structural properties of the carbonized products[J]. Biomass and Bioenergy, 35 (7): 3152-3159 |
| [17] | Mehmet U D, Levent C, Sergios K, et al. 2011. Methylene blue adsorption on activated carbon prepared from Posidonia oceanic (L.) dead leaves: Kinetics and equilibrium studies[J]. Chemical Engineering Journal, 168(1): 77-85 |
| [18] | Mohan D, Pittman J C U, Bricka M, et al. 2007. Sorption of arsenic, cadmium, and lead by chars produced from fast pyrolysis of wood and bark during bio-oil production[J]. Journal of Colloid and Interface Science, 310(1): 57-73 |
| [19] | Ncibi M C, Ross V J, Mahjoub B, et al. 2009. Preparation and characterisation of raw chars and physically activated carbons derived from marine Posidonia oceanica (L.) fibres[J]. Journal of Hazardous Materials, 165(3): 240-249 |
| [20] | Ramke H G, Blöhse D, Lehmann H J, et al. 2009. Hydrothermal carbonization of organic waste[A]. Twelfth International Waste Management and Landfill Symposium[C]. Sardinia, Italy |
| [21] | Rillig M C, Wagnera M, Salema M. 2010. Material derived from hydrothermal carbonization: Effects on plant growth and arbuscular mycorrhiza[J]. Applied Soil Ecology, 45(3): 238-242 |
| [22] | Saran S, Ellsa L C, Evelyn K, et al. 2009. Biochar, climate change and soil: a review to guide future research[R]. CSIRO Land and Water Science Report 05/09. UK: CSIRO Land and Water Opportunity Development Fund. 5-6 |
| [23] | Stefan K. 2013. Mass-cultivation of carbohydrate rich macroalgae, a possible solution for sustainable biofuel production[J]. Mitig Adapt Strateg Glob Change, 18(1): 27-46 |
| [24] | Suhas, Carrott P J M, Ribeiro C M M L. 2007. Lignin-from natural adsorbent to activated carbon: A review[J]. Bioresource Technology, 98(12): 2301-2312 |
| [25] | Titirici M M, Thomas A, Yu S H, et al. 2007. A direct synthesis of mesoporous carbons with bicontinuous pore morphology from crude plant material by hydrothermal carbonization[J]. Chem Mater, 19(17): 4205-4212 |
| [26] | Titirici M M, Antonietti M. 2010. Chemistry and materials options of sustainable carbon materials made by hydrothermal carbonization[J]. Chem Soc Rev, 39: 103-116 |
| [27] | Uchimiya M, Wartelle L H, Klasson K T, et al.2011. Influence of pyrolysis temperature on biochar property and function as a heavy metal sorbent in soil[J]. Journal of Agricultural and Food Chemistry, 59(6): 2501-2510 |
| [28] | 王定美, 王跃强, 袁浩然, 等. 2013. 水热炭化制备污泥生物炭的碳固定[J]. 化工学报, 64(7): 2625-2632 |
| [29] | 王爽. 2010. 海藻生物质热解与燃烧的试验与机理研究[D].上海: 上海交通大学. 32 |
| [30] | 曾淦宁, 周鸿艳, 艾宁, 等. 2013. 高比表面积铜藻基活性炭的制备及工艺优化[J].环境科学学报, 33(8): 2209-2217 |
| [31] | Zhang Z Q, Wang K, Atkinsonc J D, et al. 2012. Sustainable and hierarchical porous Enteromorpha prolifera based carbon for CO2 capture[J]. Journal of Hazardous Materials, 229/230: 183-191 |
 2014, Vol. 34
2014, Vol. 34


