合成染料广泛应用于印染、制皮、化妆品、印刷、医药和食品加工等行业,然而,这些染料大多数都具有生物毒性和致畸致癌性,而且在自然环境中极难生物降解,对光、生物酶和其他环境条件的抵抗力极强(VanderZee et al., 2005;Forgacs et al., 2004).
孔雀石绿(Malachite Green,MG)作为一种三苯甲烷类染料,广泛应用于水产养殖业、食品加工业、医药行业等各个领域中.随其广泛使用,该染料对哺乳动物细胞、水生生物和其他有机生命体的致癌致畸效应也凸现出来,引起了科学界的广泛关注(Fessard et al., 1999;Srivastava et al., 2004;Zhang et al., 2009).因此,在许多国家和地区,该染料已被立法严禁使用,且被美国食品和药物管理局(US Food and Drug Administration)列为致癌性测试的优先化学物质之一.然而,由于孔雀石绿的生产成本较低、稳定性强且使用效果较好,难以找到合适的替代物,导致很多地区仍在广泛使用该染料,严重破坏了使用地区的生态平衡(Srivastava et al., 2004;Jung et al., 2013).尽管许多科学工作者已致力于解决由孔雀石绿造成的环境污染问题,例如应用吸附、化学沉淀、光降解、渗透和膜过滤等理化处理技术处理污染水源(Rahman et al., 2005;Papinutti et al., 2006;Hameed et al., 2009;Han et al., 2010);然而,由于这些处理方法不仅处理费用高、效率不高,而且在治污的同时容易产生二次污染和难以处置的底泥,因此,极大地限制了其广泛推广使用.生物处理技术作为一种环境友好型且高效低耗的处理手段受到越来越广泛的关注(Chen et al., 2009;Jing et al., 2009).其中,细菌由于生长速度快,容易获得大量生物量,且易产生大量降解相关酶,对染料的降解效率也较高等优势而受到环境工作者的青睐.
本研究的目的在于:①广泛筛选浙南地区的MG高效脱色菌株;②初步鉴定MG高效脱色菌株为DH-9;③采用单因素实验研究菌株DH-9对MG的脱色特性,并采用响应面设计优化脱色条件.
2 材料与方法(Materials and methods) 2.1 实验材料 2.1.1 菌种来源供试土样取自浙江温州双屿皮革城和温州大罗山果园,菌株DH-9来源于常年被皮革废水污染的污泥中.
2.1.2 试剂孔雀石绿属于三苯甲烷类染料,购自国药集团化学试剂有限公司;革兰氏染色液;TE缓冲液;Tris饱和酚(pH 8.0);氯仿;10×PCR缓冲液、DNA 连接酶、dNTPs和Taq DNA 聚合酶(TaKaRa 公司);DNA 纯化试剂盒(上海生工生物工程有限公司)等.其它生化试剂均为国产分析纯.
2.1.3 培养基无机盐培养基(MSM)组成(g · L-1):Na2HPO4,15.13;KH2PO4,3.0;NaCl,0.5;NH4Cl,1.0;MgSO4 · 7H2O,0.491;CaCl2 · 2H2O,0.026;pH 7.0.LB培养基组成(g · L-1):蛋白胨,10;酵母膏,5;NaCl,10;pH 7.0~7.2.纯化培养基组成(g · L-1):在MSM培养基中添加终浓度为200 mg · L-1的MG染料.
2.2 实验仪器超净工作台;电热恒温鼓风干燥箱;高压蒸汽灭菌锅;全温恒温摇床;电子天平;pH计;高速冷冻离心机;Evolution 260紫外可见光分光光度计;Bio-rad PCR仪、自动凝胶图像分析仪及水平电泳仪等.
2.3 实验方法 2.3.1 MG高效脱色菌株的富集、分离和纯化方法将1.0 g土样接入已灭菌的含100 mL MSM培养基的三角瓶中,同时在MSM培养基中添加已过滤除菌的MG母液作为唯一碳源,使其终浓度为20 mg · L-1.将三角瓶置于30 ℃、180 r · min-1摇床中振荡培养1周后,吸取1 mL培养液转接至新鲜培养基(含40 mg · L-1的染料)中,连续驯化、富集.转接多次后,培养物可耐受的染料终浓度为200 mg · L-1.用接种环蘸取少许富集培养液,在纯化培养基平板上直接划线分离.在平板上选择不同形态特征的单菌落,重新转接至含200 mg · L-1 MG的纯化培养基平板上,转接多次直至获得单一形态的MG脱色菌纯培养物.
2.3.2 菌株16S rRNA基因的PCR扩增与序列分析(1)提取基因组DNA:采用酚-氯仿法抽提基因组DNA,具体步骤参考《分子克隆实验指南》.
(2)16S rRNA基因PCR反应:用于菌株DH-9 16S rRNA基因PCR反应的引物为一对通用引物,正向引物BSF8/20:5′-AGAGT TTGAT CCTGG CTCAG-3′;反向引物BSR1541/20:5′-AAGGA GGTGA TCCAG CCGCA-3,PCR产物的纯化和测序由上海生工生物工程有限责任公司完成.所得序列用BLAST程序与GenBank数据库(http://www.ncbi.nlm.nih.gov/blast)中的菌株进行比对,选取一些具有代表性的菌株用于系统发生树的构建.采用软件CLUSTAL X 1.8.3进行DNA序列同源性比较.比对结果用MEGA 4.1软件中的Neighbor-Joining的距离模进行UPGA分析后生成系统发育树.
2.3.3 菌株DH-9对MG的脱色特性研究(1)培养基起始pH值对MG脱色的影响:用1.0 mol · L-1的HCl或NaOH将2.0 g · L-1酵母粉溶液的初始pH值分别调整到2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0.灭菌后添加过滤除菌的MG,使MG终浓度为100 mg · L-1,接种等量菌株DH-9过夜培养物(2%,V:V),并于30 ℃、180 r · min-1条件下振荡培养.
(2)培养温度对MG脱色的影响:分别设定培养温度为15、20、25、30、35和40 ℃.在2.0 g · L-1的酵母粉溶液(pH 7.0)中添加过滤除菌的终浓度为100 mg · L-1的MG,接种等量菌株DH-9过夜培养物(2%,V∶V),并于180 r · min-1条件下振荡培养.
(3)接种量对MG脱色的影响:在2.0 g · L-1的酵母粉溶液(pH 7.0)中添加过滤除菌的终浓度为100 mg · L-1的MG,分别接种1%、3%、5%、7%、9%、11%、13%和15%(V:V)的菌株DH-9过夜培养物,并于30 ℃、180 r · min-1条件下振荡培养.
(4)碳氮源对染料脱色的影响实验:将所选碳源(葡萄糖、麦芽糖、乳糖、D-半乳糖、D-果糖、D-木糖和蔗糖)分别添加至MSM培养基中,使其终浓度为2.0 g · L-1.将所选氮源(NH4Cl、NaNO3、牛肉膏、蛋白胨、酵母粉、甘氨酸和L-谷氨酸)分别添加至无NH4Cl的MSM培养基中,使其终浓度为2.0 g · L-1.灭菌后添加过滤除菌的终浓度为100 mg · L-1的MG,接种等量菌株DH-9过夜培养物(2%,V∶V),并于30 ℃、180 r · min-1条件下振荡培养(Parshetti et al., 2006; Kalme et al., 2009).
(5)金属离子对MG脱色的影响:分别向2.0 g · L-1的酵母粉溶液(pH 7.0)中添加终浓度为1.0和2.0 mmol · L-1的CuCl2、FeCl3、CaCl2、ZnCl2、MgCl2和MnCl2,灭菌后添加过滤除菌的终浓度为100 mg · L-1的MG,接种等量菌株DH-9过夜培养物(2%,V:V),并于30 ℃、180 r · min-1条件下振荡培养(Parshetti et al., 2006; Kalme et al., 2009).
所有实验均重复3次以上,并同时设置对照实验.
2.3.4 响应面设计优化菌株DH-9对MG的脱色条件在单因素实验的基础上,采用中心组合试验设计(Central Composite Design,CCD)对MG脱色条件进行优化,培养8 h后测定其脱色率.用标准多项式回归方法,对CCD设计实验数据进行拟合,得到一个二次多项式:
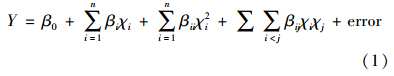
| 表1 CCD设计及其实验结果和预测结果 Table.1 Central composite design and the corresponding experimental responses |
CCD实验设计数据采用Minitab 14.0软件进行统计分析.
3 结果与分析(Results and analysis) 3.1 MG高效脱色菌株的筛选与鉴定经多次富集、纯化培养后,获得了多株对MG有一定脱色能力的菌株,其中菌株DH-9对MG的脱色效果最好,同时,全波长扫描结果显示脱色后有新的吸收峰产生(数据未给出),加之脱色后菌体沉淀呈现无色,推测该菌株对MG的脱色可能是由生物降解引起的(Ayed et al., 2009).因此,随后着重对菌株DH-9进行了鉴定.
革兰氏染色结果显示菌株DH-9是革兰氏阴性菌,短杆状.菌落呈现圆形,乳白色,半透明,表面光滑湿润.
以菌株DH-9基因组为模板,用引物BSF8/20和BSR1541/20进行PCR扩增,检测PCR产物、回收、纯化后测序,获得1475 nt的DH-9菌株的16S rRNA基因片段,在GenBank中的登录序号为KC736654.该序列经与GenBank中的数据比对后发现,其相似度与Enterobacter aerogenes strain ATCC 13048的相似度达到98%以上,并且在系统进化树中也与该菌株聚类在一起(图未给出),表明菌株DH-9属于肠杆菌属(Enterobacter sp.).
3.2 菌株DH-9对MG的脱色特性 3.2.1 pH值和温度对MG脱色的影响培养基初始pH值对MG脱色影响的结果如图 1a所示.培养12 h时,pH值在4.0~9.0之间的MG培养基脱色率在90%以上.培养24 h以后,pH值在3.0~9.0之间的MG培养基脱色率均在90%以上,说明该菌株对MG脱色的pH适应性较强,实际应用潜力较大.
 |
| 图 1 pH(a)和温度(b)对MG脱色的影响 Fig. 1 The effect of pH(a) and temperature(b)on MG decolorization |
温度对MG脱色的影响结果如图 1b所示.由图可知,培养12 h时,温度为30~40 ℃间的MG脱色率在90%以上.随着脱色时间的延长,当培养时间超过24 h后,所测温度范围内(15~40 ℃)的MG脱色率均超过90%,表明该菌株对MG脱色的最适温度范围为30~40 ℃,温度适应性较好.
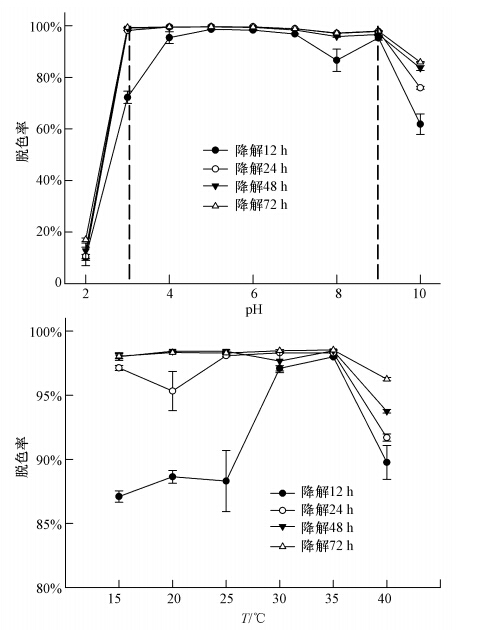
碳氮源对MG脱色的影响如图 2a、图 2b所示.实验结果表明,培养48 h以内时,多数所测试碳源对MG脱色有抑制效应或无显著影响;而当培养时间超过72 h后,多数所测试碳源对MG脱色有促进作用,其中以乳糖、半乳糖和果糖促进效果最为显著,总体而言,所测试碳源中以半乳糖对MG脱色的促进效果最好.与碳源相比,多数所测试氮源对MG脱色的促进效果优于碳源,实验中所测试的氮源均能显著促进MG脱色.有机氮源(牛肉膏、蛋白胨、酵母粉、甘氨酸和谷氨酸)比无机氮源(NH4Cl和NaNO3)的促进效果要好,其中尤以酵母粉、谷氨酸和甘氨酸的促进效果最好.
 |
| 图 2 碳(a)、氮(b)源和金属离子(c)对MG脱色的影响 (1.1.0 mmol · L-1氯化铜; 2.2.0 mmol · L-1氯化铜; 3.1.0 mmol · L-1氯化铁; 4.2.0 mmo · L-1氯化铁; 5.1.0 mmol · L-1氯化钙; 6.2.0 mmol · L-1氯化钙; 7.1.0 mmol · L-1氯化锌; 8.2.0 mmol · L-1氯化锌; 9.1.0 mmol · L-1氯化镁; 10.2.0 mmol · L-1氯化镁; 11.1.0 mmol · L-1氯化锰; 12.1.0 mmol · L-1氯化锰) Fig. 2 The effect of carbon(a),nitrogen(b)resources and metal ions(c)on MG decolorization(1.1.0 mmol · L-1 CuCl2; 2.2.0 mmol · L-1 CuCl2; 3.1.0 mmol · L-1 FeCl3; 4.2.0 mmol · L-1 FeCl3; 5.1.0 mmol · L-1 CaCl2; 6.2.0 mmol · L-1 CaCl2; 7.1.0 mmol · L-1 ZnCl2; 8.2.0 mmol · L-1 ZnCl2; 9.1.0 mmol · L-1 MgCl2; 10.2.0 mmol · L-1 MgCl2; 11.1.0 mmol · L-1 MnCl2; 12.1.0 mmol · L-1MnCl2) |
金属离子对MG脱色的影响如图 2c所示.由图可知,大多数所测试金属离子对MG脱色没有显著效应,仅Cu2+和Fe3+对MG脱色有显著抑制效应,钙离子对脱色有微弱促进效应.
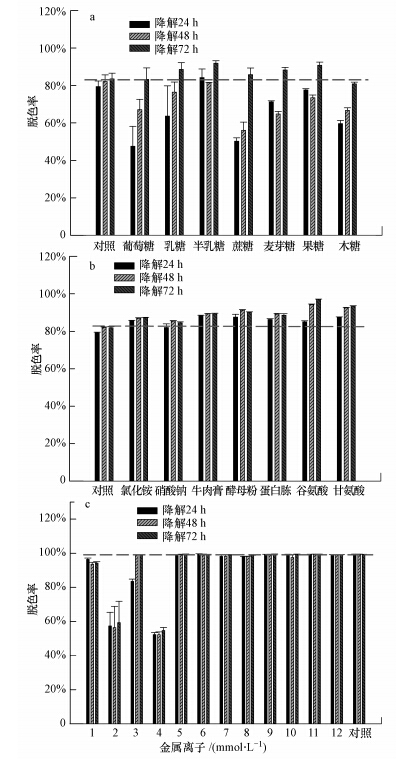
3.2.3 接种量对MG脱色的影响接种量对MG脱色的影响结果如图 3所示.当接种量从1%上升至3%时,MG脱色率上升趋势显著;而当接种量继续增大时,MG脱色率变化趋势则趋于平稳,均维持在90%以上.
 |
| 图 3 接种量对MG脱色的影响 Fig. 3 The effect of inoculums on MG decolorization |
采用CCD设计优化MG的脱色条件和研究主效应因子间的交互作用,实验结果和模型预测结果如表 1所示.实验所得培养8 h后的孔雀石绿的脱色率分布在78.0%~99.2%之间,说明主效应因子对MG脱色影响显著.MG脱色率的实验值和预测值基本保持一致,说明所获得模型精确性较高.所获得模型的回归系数和统计学分析(ANOVA)结果如表 2和表 3所示.结果显示,模型的决定系数R2和校正决定系数(adjusted R2)分别为99.7%和99.2%,这就说明该模型精确性较高,可以用于MG脱色率的预测.因此,适于预测MG脱色率的二次模型公式可表示如下:

| 表2 CCD设计所选二次模型的回归系数 Table.2 Regression coefficients for the selected quadratic model of CCD |
| 表3 CCD实验获得的二次模型的统计学分析(ANOVA) Table.3 Analysis of variance for the selected quadratic model of CCD |
用Minitab 14.0软件分析获得的因素间交互作用的2D图如图 4~6所示.图 4显示了pH和半乳糖、酵母粉、氯化钙浓度之间的交互作用及其对脱色的联合影响,结果表明pH和这3种因素之间的交互作用显著.如图所示,随着pH值逐渐升高,脱色率随半乳糖和酵母粉浓度的升高而逐渐降低,但其随氯化钙浓度的升高则呈现出先升高再降低的趋势.
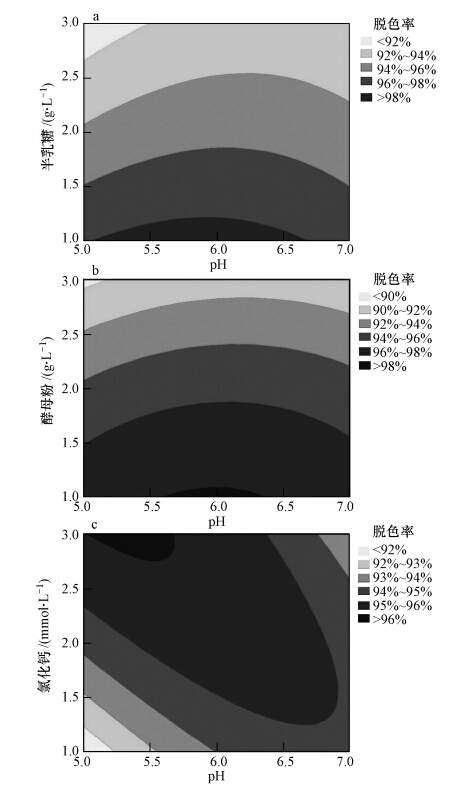 |
| 图 4 pH和半乳糖(a)、酵母粉(b)、氯化钙(c)浓度对MG脱色的影响 Fig. 4 The effect of pH and concentration of galactose(a),yeast extract(b), and CaCl2(c)on MG decolorization |
图 5显示了温度和半乳糖、酵母粉、氯化钙浓度之间的交互作用及其对脱色的联合影响,结果表明温度和这3种因素之间的交互作用显著.由图可知,随着温度逐渐升高,脱色率随半乳糖和酵母粉浓度的升高而逐渐降低,但其随氯化钙浓度的升高则呈现出先降低再升高的趋势.
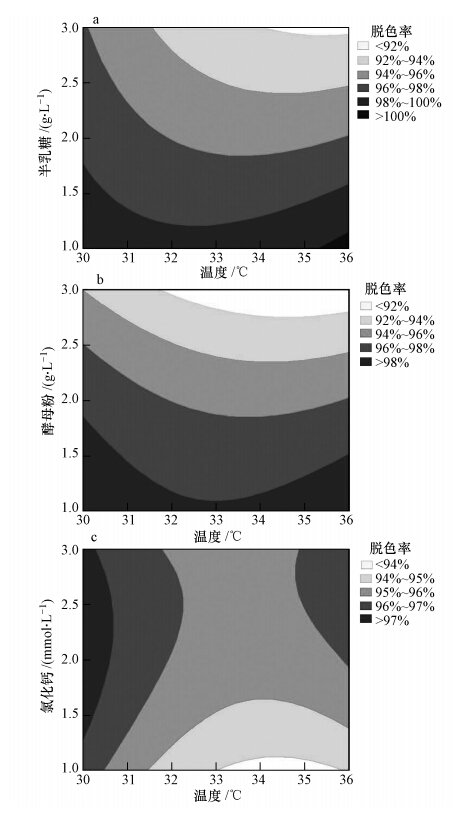 |
| 图 5 温度和半乳糖(a)、酵母粉(b)、氯化钙(c)浓度对MG脱色的影响 Fig. 5 The effect of temperature and concentration of galactose(a),yeast extract(b), and CaCl2(c)on MG decolorization |
图 6显示了半乳糖浓度和酵母粉、氯化钙浓度之间以及酵母粉浓度和氯化钙浓度之间的显著的交互作用及其对脱色的联合影响.图 6a和6b表明随着半乳糖浓度的逐渐升高,脱色率随酵母粉和氯化钙浓度的升高而呈现降低趋势.由图 6c可知,随着酵母粉浓度的逐渐升高,脱色率随氯化钙浓度的升高也呈现降低趋势.
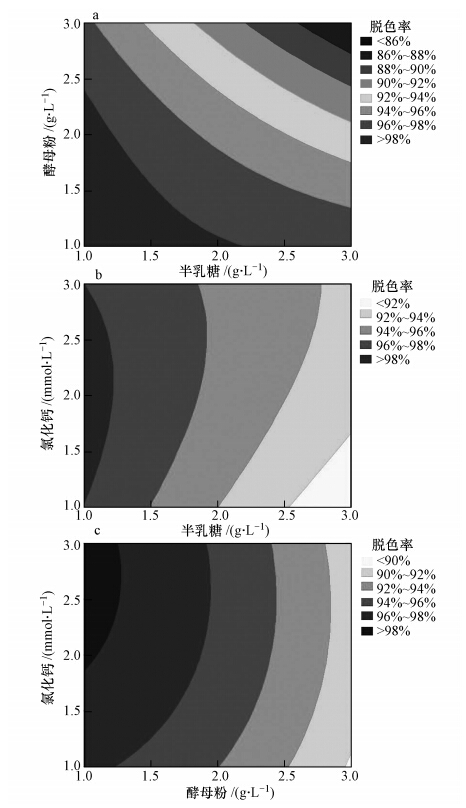 |
| 图 6 半乳糖和酵母粉(a)、氯化钙(b)及酵母粉和氯化钙(c)浓度对MG脱色的影响 Fig. 6 The effect of concentration of galactose and yeast extract(a), and CaCl2(b),as well as concentration of yeast extract and CaCl2(c)on MG decolorization |
为了确定CCD实验所获得二次模型的精确性,我们进行了验证实验.由软件分析获得的最优操作参数如下:pH值为6.0,半乳糖、酵母粉和氯化钙浓度分别为1.0 g · L-1、1.0 g · L-1和3.0 mmol · L-1,培养温度为34.5 ℃.在此条件下进行的验证实验结果表明孔雀石绿的最高脱色率为99.4%,在置信范围(100%±1%)区间内,因此,该模型对响应值的拟合效应较好.
4 讨论(Discussion)孔雀石绿在自然环境中难以自然降解,且该染料具有致癌致畸性,已引起广大环境工作者的广泛关注.以往的研究显示,很多微生物被从环境中分离出来,测试其对孔雀石绿的脱色行为,如Parshetti et al.(2006)研究了静止兼氧条件下,Kocuria rosea MTCC 1532菌株对MG的脱色,研究结果发现当MG初始浓度为50 mg · L-1、接种量为10%(V:V)时,其培养5 h后的脱色率可达到100%,而当MG的初始浓度提高到70 mg · L-1和100 mg · L-1时,其脱色率分别仅为13%和6%;Daneshvar et al.(2007)应用微藻Chlorella sp.进行了类似的实验,实验结果显示,该微藻仅在MG浓度为10 mg · L-1以下、接种量为9×106 cells · mL-1时,培养2.5 h后的脱色效果较好(脱色率可达80.7%);Ayed et al.(2009)也分离出了一株MG脱色菌,经其研究发现,在摇动状态下、接种量为14×107 cells · mL-1,该菌对50 mg · L-1的MG的4 h脱色率可达75%.已分离的菌株对孔雀石绿的脱色行为各异,但总体而言,脱色效率仍差强人意.与以往这些报道相比较,菌株DH-9在好氧条件下,当接种量为3%(V:V,菌体干重约0.23 g · L-1)时,对100 mg · L-1 的MG 8 h脱色率可达99.4%,脱色效果较好.
实际染料废水处理过程中,环境因素很难控制,进而导致处理效率不高.以往的研究结果表明,温度和pH等环境因子对多数菌株的染料脱色能力影响显著(Khan et al., 2013).例如,Jung et al.(2013)的研究表明Pseudomonas sp. MGO仅在pH 5~7的范围内对MG有较高的脱色率,而当pH<5和pH>7时,MG脱色率则不足20%;同样,Shedbalkar et al.(2011)和Kalyani et al.(2012)的报道中也指出pH和温度等环境因子会显著影响脱色菌株对MG的脱色能力.相比而言,本研究中菌株DH-9在pH3.0~9.0之间及温度范围为15~40 ℃时,培养24 h后,MG 的脱色率均可达到90%以上,说明该菌株对pH和温度的适应性较强,进而表明该菌株的实际应用潜能较为广阔.
5 结论(Conclusions)1)通过自然界中的优势菌种强化处理泄漏至水环境中的有毒害染料是国际上的研究热点之一.本研究从浙江温州分离筛选到1株孔雀石绿高效脱色菌株Enterabacter sp. DH-9,其pH(3.0~9.0)和温度(15~40 ℃)适应性都较强,培养24 h后的脱色率可达90%以上;且多数金属离子对其脱色都没有显著的影响,说明其实际应用潜力较大.
2)通过响应面设计获得了该菌株脱色孔雀石绿的最优操作条件为:pH 6.0、1.0 g · L-1的半乳糖、1.0 g · L-1的酵母粉、3.0 mmol · L-1的氯化钙以及培养温度为34.5 ℃,并构建了适于预测孔雀石绿脱色率的二次模型公式.进一步的研究将以该菌株脱色孔雀石绿的机理和其实际应用为中心,开展更加深入的探索.
| [1] | Ayed L, Chaieb K, Cheref A, et al.2009.Biodegradation of triphenylmethane dye Malachite Green by Sphingomonas paucimobilis[J].World Journal of Microbiology and Biotechnology, 25: 705-711 |
| [2] | Chen C Y, Huang Y T, Ho I H, et al.2009.Biological decolorization of dye solution containing malachite green by Pandoraea pulmonicola YC32 using a batch and continuous system[J].Journal of Hazardous Materials, 172: 1439-1445 |
| [3] | Daneshvar N, Khataee A R, Rasoulifard M H, et al.2007.Biodegradation of dye solution containing Malachite Green: Optimization of effective parameters using Taguchi method[J].Journal of Hazardous Materials, 143: 214-219 |
| [4] | Fessard V T, Godard T, Huet S, et al.1999.Mutagenicity of malachite green and leucomalachite green in vitro tests[J].Journal of Applied Toxicology, 19: 421-430 |
| [5] | Forgacs E, Cserháti T, Oros G.2004.Removal of synthetic dyes from wastewaters: a review[J].Environment International, 30: 953-971 |
| [6] | Hameed B H, Lee T W.2009.Degradation of malachite green in aqueous solution by Fenton process[J].Journal of Hazardous Materials, 164: 468-472 |
| [7] | Han R, Wang Y, Sun Q, et al.2010.Malachite green adsorption onto natural zeolite and reuse by microwave irradiation[J].Journal of Hazardous Materials, 175: 1056-1061 |
| [8] | Jing W, Gil J B, Kyoung-Sook K I M, et al.2009.Isolation and characterization of Pseudomonas otitidis WL-13 and its capacity to decolorize triphenylmethane dyes[J].Journal of Environmental Science, 21: 960-964 |
| [9] | Jung J, Seo H, Lee S H, et al.2013.The effect of toxic malachite green on the bacterial community in Antarctic soil and the physiology of malachite green-degrading Pseudomonas sp.MGO[J].Applied Microbiology and Biotechnology, 97:4511-4521 |
| [10] | Kalyani D C, Telke A A, Surwase S N, et al.2012.Effectual decolorization and detoxification of triphenylmethane dye malachite green (MG) by Pseudomonas aeruginosa NCIM 2074 and its enzyme system[J].Clean Technologies and Environmental Policy, 14:989-1001 |
| [11] | Kalme S, Jadhav S, Jadhav M, et al. 2009.Textile dye degrading laccase from Pseudomonas desmolyticum NCIM 2112[J].Enzyme and Microbial Technology, 44: 65-71 |
| [12] | Khan R, Bhawana P, Fulekar M H.2013.Microbial decolorization and degradation of synthetic dyes: a review[J].Reviews in Environmental Science and Biotechnology, 12:75-97 |
| [13] | Papinutti L, Mouso N, Forchiassin F.2006.Removal and degradation of the fungicide dye malachite green from aqueous solution using the system wheat bran-Fomes sclerodermeus [J].Enzyme and Microbial Technology, 39: 848-853 |
| [14] | Parshetti G, Kalme S, Saratale G, et al.2006.Biodegradation of Malachite Green by Kocuria rosea MTCC 1532[J].Acta Chimica Slovenica, 53: 492-498 |
| [15] | Rahman I A, Saad B, Shaidan S, et al.2005.Adsorption characteristics of malachite green on activated carbon derived from rice husks produced by chemical-thermal process[J].Bioresource Technology, 96: 1578-1583 |
| [16] | Sambrook J, Russel D W.2003.分子克隆(第3版)[M].北京:科学出版杜.611-618 |
| [17] | Srivastava S, Sinha R, Roy D.2004.Toxicological effects of malachite green[J].Aquatic Toxicology, 66: 319-329 |
| [18] | Shedbalkar U, Jadhav J P.2011.Detoxification of malachite green and textile industrial effluent by Penicillium ochrochloron[J].Biotechnology and Bioprocess Engineering, 16:196-204 |
| [19] | VanderZee F P, Villaverde S.2005.Combined anaerobic-aerobic treatment of azo dyes A short review of bioreactor studies[J].Water Research, 39: 1425-1440 |
| [20] | Zhang Y Z, Zhou B, Zhang X P, et al.2009.Interaction of malachite green with bovine serum albumin: Determination of the binding mechanism and binding site by spectroscopic methods[J].Journal of Hazardous Materials, 163: 1345-1352 |
 2014, Vol. 34
2014, Vol. 34


