有色溶解有机物(Chromophoric Dissolved Organic Matter,CDOM),又称为黄色物质,是存在于各类水体中的一类含有腐殖酸、富里酸、氨基酸和芳烃聚合物等物质的溶解性有机物(Rochelle-Newall et al., 2002).CDOM也是海洋中溶解有机物的一个重要组分,属于海洋有机碳库的一部分,在紫外和可见光区具有光吸收性质.海洋CDOM化学组分非常复杂,主要来源于陆地和海洋自生生物活动(Kirk,1994).在近海海域的主要来源为陆地来源;在远离河流影响的开阔大洋,海区自生生物活动为主要来源,浓度相对较低(Nelson et al., 1998;沈红等,2006).因此,开展CDOM分布和光谱特征研究能够更好地确定其来源及组成,这对揭示海洋碳循环变化规律和海洋生态系统特征有重要的意义.研究发现,CDOM会影响全球碳库,并对气候产生影响,在海洋乃至全球的碳循环中均起着至关重要的作用(Amon et al., 1994;Hansell et al., 2002;Tranvik et al., 2009).
国内外有关海洋CDOM的研究主要集中在CDOM光学性质、含量、分布、来源、去除、迁移转化,以及与浮游植物、细菌、光降解作用间的关系等方面(Hayase et al., 1995;Coble et al., 1998;Stedmon et al., 2005;Granskog et al., 2007;Guo et al., 2007;2011;Jiang et al., 2008).有关CDOM的光化学过程研究中发现,光降解可将CDOM降解成低分子量有机物和无机C、N,对以此为生源要素的生物地球化学循环过程有重要的影响,同时对海洋碳循环也具有重要的作用(Tranvik et al., 2009).海洋CDOM除受光反应因素影响外,Nelson等(1998)和Rochelle-Newall等(2002)均指出细菌等微生物对海洋CDOM也有影响,细菌可将浮游植物产生的有机质转化成CDOM.同时,Stedmon等(2005)和Lonborg等(2009)研究发现,细菌等微生物参与产生类蛋白质CDOM.此外,其他学者(Hayase et al., 1995;Coble et al., 1998;Chen et al., 2002;Burdige et al., 2004)研究指出,颗粒有机物的再矿化可产生CDOM,尤其是大洋深海海域颗粒有机物再矿化程度高,并且与海域水柱中的表观氧耗量垂直通量有关(Yamashita et al., 2007).
三维荧光光谱(EEMs)是近年来用于研究CDOM 的一种新型光谱指纹分析技术(Coble,1996),可方便快捷地揭示其中所含的类腐殖质和类蛋白质荧光团的组成信息(王志刚等,2006;闫丽红等,2013).利用EEMs技术可分析海洋CDOM 中这些荧光团的谱峰组成及荧光强度变化,这对估计海洋中有机物质的活动变化有很大帮助,并对预测一些物质(如营养盐和污染物)对海洋生态系统的影响也有很大的参考价值.目前,人们常用荧光指数FI、腐殖化指HIX和生物源指数BIX 3个荧光指数表示CDOM的不同来源.荧光指数FI是一种判别水体CDOM来源简便而灵敏的指标,可区分CDOM的陆地来源和微生物来源(McKnight et al., 2001;Jaffe et al., 2004).例如,McKnight等(2001)利用FI值区别河流、湖泊、地下水等水体CDOM的不同来源;FI值也可以用于区别海洋中CDOM的来源,例如,黄清辉等(2011)利用FI值判别舟山海域CDOM的来源.同时,荧光指数在判别河口近海和海洋CDOM来源时具有良好的指示性.腐殖化指数HIX可用于估计溶解有机质的腐殖化程度(Zsolnay et al., 1999;Huguet et al., 2009),生物源指数BIX可用于衡量新近的水生生物生产(自生源)的贡献(Huguet et al., 2009;2010).
在对大洋海域CDOM的研究中,鲜有对我国南海海域的研究(王福利等,2010).因此,本文以我国南海远海海域为研究对象,采用EEMs分析了2011年秋季南海3个站位CDOM的荧光组分,探讨了远海CDOM荧光组分特征与南海近海CDOM组分上的差异,并分析了远海海域CDOM组成、来源及其垂直分布特征规律.以期为南海碳及其他生源要素的生物地球化学循环研究提供参考.
2 材料与方法(Materials and methods) 2.1 样品采集与预处理在中国南海海域设置3个站位(S1、S2、S3,图 1),于2011年秋季分别在每个站位采集水深 0、25、50、75、100、150、200、300、500、800、1000、1500 m处等不同水层的水样.样品采集后立即用孔径为0.2 μm的聚碳酸酯滤膜过滤(10%HCl浸泡15 min后用Milli-Q水洗净),然后装入60 mL洁净棕色瓶中,密封、冷冻保存待测.
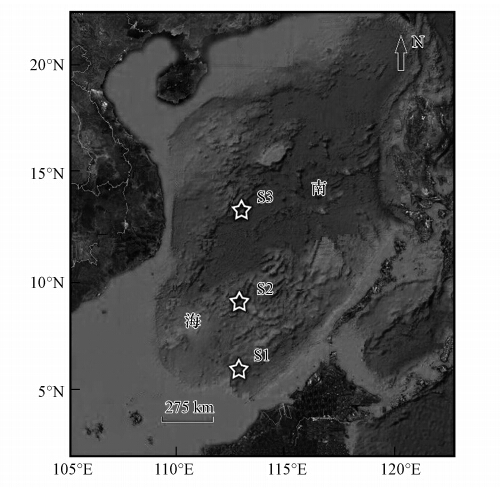 |
| 图 1 采样站位图 Fig. 1 Map of sampling station |
样品均在1个月内测完,冷冻样品取出后避光放置,自然解冻至室温,样品三维荧光光谱采用PerkinElmer公司的LS-45荧光光度计进行测定.仪器基本参数设置如下:光源为150 W氙弧灯,PMT电压为700 V,激发和发射单色仪的狭缝宽度均设为10 nm,扫描速度为1000 nm · min-1,扫描光谱进行仪器自动校正.激发波长(λEx)范围为200~600 nm,步长5 nm;发射波长(λEm)范围为210~750 nm,步长2 nm.以Milli-Q水作空白,样品所测数据都同时扣除空白值.同时记录λEx=350 nm、λEm=450 nm处的荧光强度,并用QSU单位来表示水样CDOM的相对含量.1 QSU为1 μg · L-1硫酸奎宁(溶于0.05 mol · L-1硫酸溶液)在相同条件下(λEx/λEm =350 nm/450 nm)测得的荧光强度(Chen et al., 2004).荧光指数FI是指激发光波长λEx=370 nm时,荧光发射光谱在450 nm与500 nm处的荧光强度比值(McKnight et al., 2001;Jaffe et al., 2004);腐殖化指数HIX为在激发波长λEx=254 nm时,发射波长在435~480 nm与300~345 nm波段内的荧光强度积分值(或平均值)的比率(Zsolnay et al., 1999;Huguet et al., 2009);生物源指数是指激发波长λEx=310 nm时,发射波长在380 nm与430 nm处荧光强度的比值(Huguet et al., 2009).
3 结果与讨论(Results and discussion) 3.1 南海CDOM的EEMs 特征对本次所有样品CDOM的EEMs分析测定表明,各站点均表现出相似的EEMs谱图,本文仅给出S1站位0 m处的谱图(图 2).根据前人的研究结果(Coble,1996),对CDOM的类型和来源进行区别和标记,在样品中都发现有2个荧光谱峰:分别为海源Vis类腐殖质M(λEx/λEm =290~310 nm/370~420 nm)和类蛋白质T(λEx/λEm=225~230 nm/340~350 nm).所有样品均未观测到其他类腐殖质A、C峰和类蛋白质B峰.
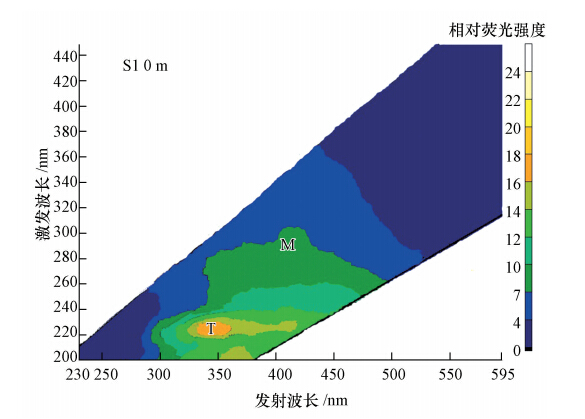 |
| 图 2 南海CDOM的EEMs 谱图 Fig. 2 CDOM EEMs in the South China Sea |
在南海海域观测到M峰(λEx/λEm=300 nm/405 nm)和T峰(λEx/λEm=225 nm/345 nm),一般认为M峰代表海洋自生来源的腐殖质;T峰是由具有芳香结构的色氨酸类物质所产生的荧光峰,与海洋生物活动有关(Del Castillo et al., 1999;Chen et al., 2004).通常认为 A峰是少芳香性的陆源UV类腐殖质所产生的荧光峰;C峰是较多芳香性的陆源Vis类腐殖质所产生的荧光峰(程远月等,2010).韩宇超等(2009)在九龙江河口观测到A、C、M和T1、T2等5类荧光峰,其CDOM受陆地径流输入影响,A峰与C峰荧光强度较突出,其CDOM来源以陆地来源为主.南海CDOM的EEMs荧光光谱不同于近海河口的光谱,其CDOM来源也不相同,河口多来源于陆地,而南海CDOM只来源于水域自生产生.王福利等(2010)在北部湾观测到类腐殖质荧光峰A(λEx/λEm=230 nm/380 nm)、C(λEx/λEm=350 nm/450 nm)、和M(λEx/λEm=290 nm/374 nm),以及类蛋白质峰T(λEx/λEm=275 nm/340 nm)、R(λEx/λEm=225 nm/340 nm).其中,M峰较突出,具有典型的海洋CDOM特征,但同时受陆源输入和北部湾环流影响,CDOM特征略呈陆地来源的A和C峰,这不同于本次在南海海域观测到的现象.Coble(1998)在阿拉伯海域也发现A、C、M等峰,其中,M峰荧光强度位置在λEx/λEm=290~310 nm/370~410 nm处,这是由于受幼发拉底河和底格里斯河径流影响,因此,在阿拉伯海域的CDOM三维荧光图谱中能观测到A峰和C峰,但其主要荧光强度是由M峰提供,海域的CDOM来源主要是由阿拉伯海域自生生物活动产生.
本次南海所观测的海域不同于其他海域和近海河口,受陆地径流影响小,其CDOM的三维荧光图谱均未观测到A峰和C峰,整个CDOM荧光峰团只观测到海源类腐殖质M峰和类色氨酸T峰,说明南海海域CDOM来源为海洋自生来源,未受陆地有机物的输入影响.
3.2 南海CDOM荧光垂直变化规律南海海域CDOM荧光强度(F(350/450),单位QSU)分布规律如图 3所示.3个站点0 m处CDOM荧光强度都最低,其垂直尺度上的分布规律一致,荧光强度规律表现为F(300 m)>F(200 m)>F(100 m)>F(500 m)>F(1500 m)>F(800 m)>F(50 m)>F(25 m)>F(0 m),CDOM荧光强度随深度增加而增大,在300 m左右达到最大峰值,然后随深度增加而下降,在500~600 m达到最小峰值,之后保持相对稳定.类蛋白质T峰和类腐殖质M峰的荧光强度随深度变化如图 4所示,其中,M峰荧光强度较小,T峰荧光强度较大,T峰是CDOM荧光物质的主要贡献者.M峰和T峰的荧光强度在垂直分布上具有大致相同的变化趋势,且与CDOM荧光强度的垂直分布规律相似.M峰/T峰荧光强度比值在透光层最大,在0.6~1.1之间;300~500 m处最小,在0.4左右;而深层荧光强度比值保持较稳定,在0.6左右,这与M峰和T峰的荧光强度垂直分布规律有相似性.
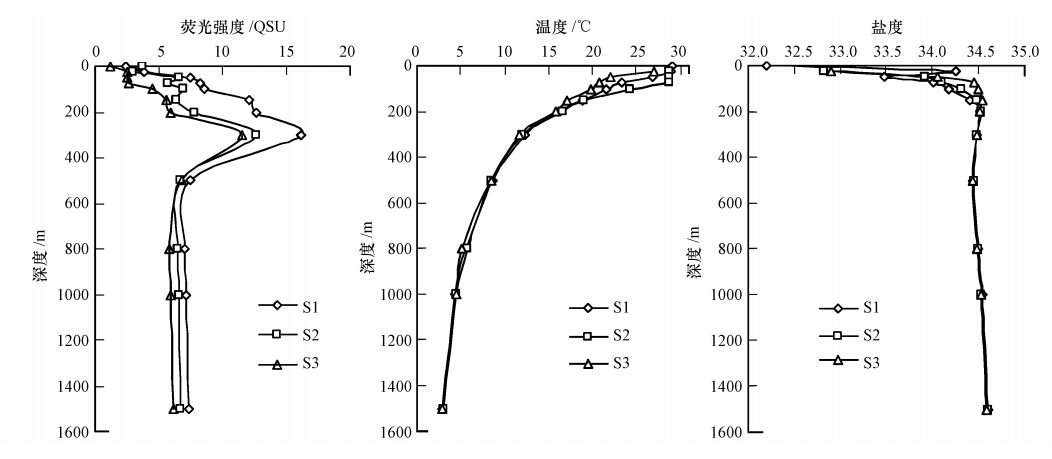 |
| 图 3 南海荧光强度(F(350/450))、温度和盐度垂直分布 Fig. 3 Vertical distribution of fluorescence intensity(λEx/λEm=350 nm/450 nm),temperature and salinity in the South China Sea |
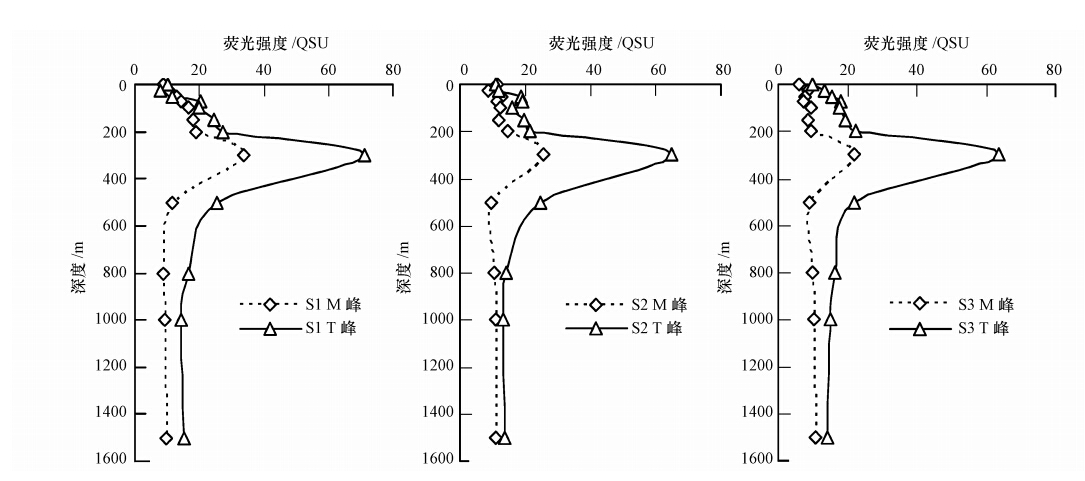 |
| 图 4 M峰与T峰的荧光强度垂直分布规律 Fig. 4 Vertical distribution of fluorescence intensity of fluorescence peaks M and fluorescence peaks T |
在南海海域,由于表层光照强烈,有机质光降解强,因此,南海海域CDOM表层荧光强度低.受强光照影响,同时靠近水面的浮游植物也少,在0 m处的荧光强度最低;而后随着深度的增加,光照强度逐渐减小,以及浮游植物的增加,同时经浮游植物产生的CDOM也逐渐增加,透光层CDOM荧光强度分布呈现为F(300 m)>F(200 m)>F(100 m)>F(50 m)>F(25 m)>F(0 m)的特征(图 3).这反映了在南海海域CDOM 光化学反应对表层CDOM影响较大,引起透光层CDOM的荧光强度降低,形成此特征的垂直分布.不少研究者发现太阳光辐射会引起CDOM的光化学降解,降低CDOM的荧光强度,形成光漂白效应(Vodacek et al., 1995;Sakkas et al., 2002;Vecchio et al., 2002).王福利等(2010)对南海北部湾等水体的研究也发现太阳光辐射的光降解作用使CDOM含量降低;Hayase等(1995)在太平洋赤道海域的透光层也发现了相似的分布特征,其分布规律与南海有一定的相似性,表层皆偏低,在300 m处荧光强度显著升高,而后逐渐下降并趋于稳定,但深层荧光强度比透光层大,这与南海的分布规律有差异,可能是水团性质、水体受影响程度有差异.光照对南海透光层海水CDOM具有较大影响,会降解CDOM,直接影响CDOM的荧光强度,进而影响透光层CDOM的垂直分布.
3个站点在300 m处CDOM荧光强度均出现极大值,同时类蛋白质T峰和类腐殖质M峰荧光强度显著增大.类蛋白质T峰的来源有:细菌等微生物将浮游植物产生的有机物转化分解成类色氨酸,浮游植物生长时细胞分泌产生,以及微生物自生细胞衰老、死亡时产生等几方面的来源.类蛋白质T峰受细菌活动的影响较大.南海水团存在温跃层(图 3),因此,表层光降解后的低CDOM浓度水团不与下层高浓度水团垂直混合,同时表层产生的CDOM下沉积累至此.研究发现,南海深水海盆区表层叶绿素a浓度较低,叶绿素a浓度高值集中在次表层剖面(高姗等,2010).温跃层和南海水层的叶绿素a分布、CDOM下沉累积(Yamashita et al., 2007),以及光降解强度弱、细菌等微生物活动强等原因,形成300 m处CDOM浓度达峰值的独特现象.Hayase等(1995)在太平洋海域也发现类似的现象,该水层的CDOM更具有活泼性,且拥有强烈的类蛋白质荧光,说明此水层的微生物比较活跃,生物活动对该水层的CDOM具有显著影响. Coble(1996)和Vignudelli等(2004)研究指出,细菌等微生物的生物活动作用对海洋CDOM的垂直分布有较大影响.Coble等(1998)在波斯湾海域也发现CDOM在200~300 m处形成极大值,他认为这是由于细菌活动引起.微生物等生物活动对南海CDOM的垂直分布也存在较大影响.CDOM、M峰和T峰荧光强度在300 m达到峰值,然后随深度增加而减小,并于500 m达到最小值,之后保持相对稳定,此深度范围的水层主要为中层水团(刘增宏等,2001;田天等,2005).细菌减少、浮游生物急剧锐减等因素促使CDOM浓度在300 m深度以后减小;500 m深度以后CDOM荧光强度随深度变化保持相对稳定,仅有微略升高的小变化,这与颗粒有机物垂直通量和矿化有密切关系(Chen et al., 2002),使得CDOM荧光强度能保持稳定而略有增加.Hayase等(1995)和Yamashita等(2007)指出CDOM与表观耗氧量具有显著的相关性,CDOM的产生过程伴随着氧气的消耗,在深层海水形成有机物的氧化和再矿化作用,与南海的这一变化规律相符合.说明颗粒有机物再矿化作用影响着深层海水CDOM的垂直分布.
南海CDOM主要为海洋自生来源,透光层CDOM受强烈的光降解影响,导致表层CDOM荧光强度低;同时受海洋微生物活动的影响,导致300 m处CDOM荧光强度显著;500~1500 m处及深层受海洋微生物活动及颗粒有机物的再矿化作用影响.南海CDOM在垂直尺度上的分布规律受光化学反应、海洋微生物活动及颗粒有机物再矿化的共同影响.
3.3 荧光指数CDOM的来源可以通过3个荧光指数来表征,即荧光指数FI、腐殖化指数HIX和生物源指数BIX.南海海域CDOM荧光指数FI垂直分布情况如图 5所示,可见,FI随深度增加而增大,同样在300 m处达到最大值,而后随深度增加而下降,并趋于稳定,保持在1.8左右.3个站点的荧光指数整体上变化不大,分布规律相似,均在1.4~2.0之间变化.荧光指数FI值可区分CDOM的陆地来源和微生物来源,McKnight 等(2001)指出陆地来源和微生物来源两个端源的FI值分别约为1.4和1.9,并且pH值对其影响不大.Battin(1998)也指出荧光指数FI=1.4时溶解性有机物主要是陆源产生,而当FI=1.9时主要来源于水体生物.同时,McKnight 等(2001)指出FI值与富里酸芳香性之间具有非线性的负相关关系,与外源富里酸(FI=1.3~1.4)相比,本土富里酸(FI=1.7~1.9)具有较低的芳香性.程远月等(2008)研究发现,近岸海域间隙水的FI值接近1.9,从而说明CDOM的腐殖质来源于微生物,而河口FI值为1.5,指示为陆源输入,或是陆源与微生物的共同作用.黄清辉等(2011)利用FI值判别了舟山海域CDOM来源,指出在高盐度和较低盐区海域FI值在1.7以上,其来源是海洋来源为主;盐度为24~31的海域FI值在1.5左右,其CDOM来源主要为陆地来源.荧光指数FI值在判别河口近海和海洋CDOM来源时具有良好的指示性.本研究海域的荧光指数FI值均在1.4~2.0间,除0 m处为FI值为1.4左右外,其余均在1.8左右,0 m处FI值为1.4是由于表层光降解强烈,因此,FI值偏小,其主要来源还是海洋自生来源.其余水层FI值在1.8左右,这说明其CDOM主要来自微生物活动,且具有较低的芳香性,进一步说明了南海CDOM来源为海洋自生来源.
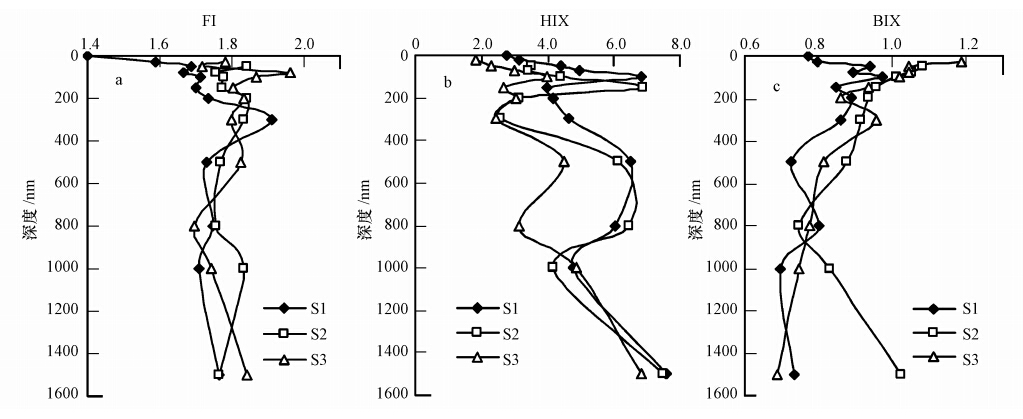 |
| 图 5 南海CDOM荧光指数(a.FI;b.HIX;c.BIX) Fig. 5 The fluorescence index of CDOM in the South China Sea(a.FI;b.HIX;c.BIX) |
腐殖化指数HIX是反映有机物中腐殖质含量或腐殖化程度的指示剂.Huguet等(2009)指出,当HIX小于4时,CDOM主要由生物活动产生,腐殖化程度较弱;当HIX高到10~16时,CDOM具有显著的腐殖质特征,主要为陆源输入.而Zhang等(2010)又指出当1.5<HIX<3时,CDOM呈微弱腐殖质特征及有重要的近期自生源.腐殖化指数HIX在3个站点的分布趋势相似,皆在1.9~8.0之间,其中,透光层的HIX多数小于4,水体CDOM腐殖化程度较弱,说明此水层生物细菌活动较强;整体上,HIX值皆偏小,说明南海CDOM腐殖化程度较低.生物源指数BIX是用来反映CDOM中自生贡献比例的指标.Huguet等(2009)指出BIX在0.6~0.7之间时,具有较少的自生组分;BIX在0.7~0.8之间时具有中度新近自生源特征;在0.8~1.0之间时,具有较强自生源特征;大于1.0时为生物或者细菌活动产生.南海海域BIX指数多数在0.7~1.1间,透光层BIX较大,说明生物细菌活动较多;同时BIX值表现出南海CDOM自生源特征显著,进一步印证了南海CDOM来源为自生来源.FI、HIX和BIX 3个荧光指数对CDOM来源表征上都具有良好的指示性,都一致显现出CDOM为自生来源.
4 结论(Conclusion)1)南海海域CDOM的三维荧光峰只观测到类腐殖质M荧光峰和类蛋白质T荧光峰,不同于河口和近岸海域等其他水体.荧光指数FI基本在1.7~1.9之间变化,腐殖化指数HIX偏小,生物源指数BIX多在0.7~1.1间,表明CDOM为自生生物活动来源,也说明南海CDOM为海洋自生来源,未受到陆地径流输入影响.
2)类蛋白质T峰为南海CDOM荧光的主要贡献者,表明CDOM的EEMs的主要贡献来源为海洋生物活动,尤其是细菌等微生物的活动.
3)南海CDOM浓度垂直分布特征呈现为随深度增加而增加,在次表层300 m处达峰值,而后逐渐降低,于500 m深度后保持相对稳定.不同深度处CDOM含量表现为:300 m>200 m>100 m >500 m>1500 m>800 m >50 m>25 m>0 m,且类腐殖质M峰和类蛋白质T峰在300 m处最为明显.南海CDOM的垂直分布规律反映了其受光化学反应、微生物活动及颗粒有机物再矿化的共同影响.
| [1] | Amon R M W, Benner R.1994.Rapid cycling of high-molecular-weight dissolved organic matter in the ocean[J].Nature, 369(6481):549-552 |
| [2] | Battin T J.1998.Dissolved organic matter and its optical properties in a blackwater tributary of the upper Orinoco river, Venezue[J].Organic Geochemistry, 28(9/10):561-569 |
| [3] | Burdige D J, Kline S W, Chen W H.2004.Fluorescent dissolved organic matter in marine sediment pore waters[J].Marine Chemistry, 89(1/4):289-311 |
| [4] | Chen R F, Zhang Y, Vlahos P, et al.2002.The fluorescence of dissolved organic matter in the Mid-Atlantic Bight[J].Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 49(20):4439-4459 |
| [5] | Chen R F, Bissett P, Coble P G, et al.2004.Chromophoric dissolved organic matter (CDOM) source characterization in the Louisiana Bight[J].Marine Chemistry, 89(1/4):257-272 |
| [6] | 程远月, 郭卫东, 胡明辉.2008.近岸沉积物再悬浮期间所释放溶解有机物的荧光特征[J].地球化学, 37(1):51-58 |
| [7] | 程远月, 郭卫东, 龙爱民, 等.2010.利用三维荧光光谱和吸收光谱研究雨水中 CDOM 的光学特性[J].光谱学与光谱分析, 30(9):2413-2416 |
| [8] | Coble P G.1996.Characterization of marine and terrestrial DOM in seawater using excitation – emission matrix spectroscopy[J].Marine Chemistry, 51(4):325-346 |
| [9] | Coble P G, Del Castillo C E, Bemard A.1998.Distribution and optical properties of CDOM in the Arabian Sea during the 1995 Southwest Monsoon[J].Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 45(10/11):2195-2223 |
| [10] | Del Castillo C E, Coble P G, Morell J M, et al.1999.Analysis of the optical properties of the Orinoco River plume by absorption and fluorescence spectroscopy[J].Marine Chemistry, 66(1/2):35-51 |
| [11] | 高姗, 王辉, 刘桂梅, 等.2010.南海叶绿素a浓度垂直分布的统计估算[J].海洋学报, 32(4):168-176 |
| [12] | Granskog M A, Macdonald R W, Mundy C J, et al.2007.Distribution, characteristics and potential impacts of chromophoric dissolved organic matter (CDOM) in Hudson Strait and Hudson Bay, Canada[J].Continental Shelf Research, 27(15):2032-2050 |
| [13] | Guo W D, Stedmon C A, Han Y C, et al.2007.The conservative and non-conservative behavior of chromophoric dissolved organic matter in Chinese estuarine waters[J].Marine Chemistry, 107(3):359-366 |
| [14] | Guo W D, Yang L Y, Hong H S, et al.2011.Assessing the dynamics of chromophoric dissolved organic matter in a subtropical estuary using parallel factor analysis[J].Marine Chemistry, 124(1/4):125-133 |
| [15] | 韩宇超, 郭卫东.2009.九龙江河口有色溶解有机物的三维荧光光谱特征[J].环境科学学报, 29(3):641-647 |
| [16] | Hansell D A, Carlson C A.2002.Biogeochemistry of Marine Dissolved Organic Matter[M].San Diego:Academic Press.685-715 |
| [17] | Hayase K, Shinozuka N.1995.Vertical distribution of fluorescent organic matter along with AOU and nutrients in the equatorial Central Pacific[J].Marine Chemistry, 48(3/4):283-290 |
| [18] | 黄清辉, 吴加学, 蒋愉林, 等.2011.舟山海域陆源溶解有机质变化及其对近岸羽状流的响应[J].海洋学报, 33(1):66-73 |
| [19] | Huguet A, Vacher L, Relexans S, et al.2009.Properties of fluorescent dissolved organic matter in the Gironde Estuary[J].Organic Geochemistry, 40(6):706-719 |
| [20] | Huguet A, Vacher L, Saubusse S, et al.2010.New insights into the size distribution of fluorescent dissolved organic matter in estuarine waters[J].Organic Geochemistry, 41(6):595-610 |
| [21] | Jaffe R, Boyer J N, Lu X, et al.2004.Source characterization of dissolved organic matter in a subtropical mangrove-dominated estuary by fluorescence analysis[J].Marine Chemistry, 84(3/4):195-210 |
| [22] | Kirk J T O.1994.Light and Photosynthesis in Aquatic Ecosystems[M].Cambridge:Cambridge University Press.57-72 |
| [23] | Jiang F H, Lee F S C, Wang X R, et al.2008.The application of excitation/emission matrix spectroscopy combined with multivariate analysis for the characterization and source identification of dissolved organic matter in seawater of Bohai Sea, China[J].Marine Chemistry, 110(1/2):109-119 |
| [24] | 刘增宏, 李磊, 许建平, 等.2001.1998年夏季南海水团分析[J].东海海洋, 19(3):1-10 |
| [25] | Lonborg C, Alvarez-Salgado X A, Davidson K, et al.2009.Production of bioavailable and refractory dissolved organic matter by coastal heterotrophic microbial populations[J].Estuarine, Coastal and Shelf Science, 82(4):682-688 |
| [26] | McKnight D M, Boyer E W, Westerhoff P K, et al.2001.Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J].Limnolgy and Oceanography, 46(1):38-48 |
| [27] | Nelson N B, Siegel D A, Michaels A F.1998.Seasonal dynamics of colored dissolved material in the Sargasso Sea[J].Deep Sea Research Part I: Oceanographic Research Papers, 45(6):931-957 |
| [28] | Rochelle-Newall E J, Fisher T R.2002.Chromophoric dissolved organic matter and dissolved organic carbon in Chesapeake Bay[J].Marine Chemistry, 77(1):23-41 |
| [29] | Sakkas V A, Lambropoulou D A, Albanis T A.2002.Photochemical degradation study of irgarol 1051 in natural waters: influence of humic and fulvic substances on the reaction[J].Journal of Photochemistry and Photobiology A: Chemistry, 147(2):135-141 |
| [30] | 沈红, 赵东至, 付云娜, 等.2006.黄色物质光学特性及遥感研究进展[J].遥感学报, 10(6):949-954 |
| [31] | Stedmon C A, Markager S.2005.Tracing the production and degradation of autochthonous fractions of dissolved organic matter by fluorescence analysis[J].Limnolgy and Oceanography, 50(5):1415-1426 |
| [32] | 田天, 魏浩.2005.南海北部及巴士海峡附近的水团分析[J].中国海洋大学学报, 35(1):9-12 |
| [33] | Tranvik L J, Downing J A, Cotner J B, et al.2009.Lakes and reservoirs as regulators of carbon cycling and climate[J].Limnology and Oceanography, 54(2):2298-2314 |
| [34] | Vecchio R D, Blough N V.2002.Photobleaching of chromophoric dissolved organic matter on natural waters: kinetics and modeling[J].Marine Chemistry, 78(4):231-253 |
| [35] | Vignudelli S, Santinelli C, Murru E, et al.2004.Distributions of dissolved organic carbon (DOC) and chromophoric dissolved organic matter (CDOM) in coastal waters of the northern Tyrrhenian Sea (Italy)[J].Estuarine, Coastal and Shelf Science, 60(1):133-149 |
| [36] | Vodacek A, Hoge F E, Swift R N, et al.1995.The use of in situ and airborne fluorescence measurements to determine UV absorption coefficients and DOC concentrations in surface waters[J].Limnolgy and Oceanography, 40(2):411-415 |
| [37] | 王福利, 郭卫东.2010.秋季南海珠江口和北部湾溶解有机物的光降解[J].环境科学学报, 30(3):606 -613 |
| [38] | 王志刚, 刘文清, 李宏斌, 等.2006.三维荧光光谱法分析巢湖CDOM的空间分布及其来源[J].环境科学学报, 26(2):275-279 |
| [39] | Yamashita K, Tsukasaki A, Nishida Z, et al.2007.Vertical and horizontal distribution of fluorescent dissolved organic matter in the Southern Ocean[J].Marine Chemistry, 106(3/4):498-509 |
| [40] | 闫丽红, 陈学君, 苏荣国, 等.2013.2010 年秋季长江口口外海域 CDOM 的三维荧光光谱-平行因子分析[J].环境科学, 34(1):51-60 |
| [41] | Zhang Y L, Zhang E L, Yin Y, et al.2010.Characteristics and sources of chromophoric dissolved organic matter in lakes of the Yungui Plateau, China, differing in trophic state and altitude[J].Limnolgy and Oceanography, 55(6):2645-2659 |
| [42] | Zsolnay A, Baigar E, Jimenez M, et al.1999.Differentiating with fluorescence spectroscopy the sources of dissolved organic matter in soils subjected to drying[J].Chemosphere, 38(1):45-50 |
 2014, Vol. 34
2014, Vol. 34


