2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049
近年来,由于农业施肥、未处理废水的排放及氮沉降等一系列原因,导致湿地氮污染加剧(Holligan et al., 1993).湿地中各种形态的氮可以发生多种转化,如同化吸收、氨化、硝化、反硝化、厌氧氨氧化、硝酸盐异解为氨(DNRA)等过程(Kiernan et al., 2003; Hurd et al., 2005; Kern et al., 2011;An et al., 2001; Weisner et al., 2010).这些过程中,反硝化和厌氧氨氧化过程往往是湿地氮净损失的原因(Hill,1979; 1981;1983).尽管在一些湿地中,厌氧氨氧化可能对氮的净损失具有一定的贡献(Zhu et al., 2013),但更多的研究表明,无论是在自然湿地,还是在人工湿地系统中,氮的净化机制中反硝化往往是最主要的过程.
与湿地沉积物相比,上覆水体往往处于氧化环境,因此,湿地反硝化主要在沉积物中发生(孙志高等,2010).而湿地沉积物反硝化的控制因素涉及物理、化学和生物等多方面,其中,pH、硝酸盐底物浓度及其来源、可利用碳源、土壤水含量及温度等(Cornwell et al., 1999; Arheimer et al., 2002; Kanyiginya et al., 2010)是最为关键的控制因子.
鄱阳湖是我国重要的湿地保护区,位于长江中游,承纳赣、抚、信、修、饶五河来水,通过调蓄后经北部湖口流入长江.由于水位变化显著,造成鄱阳湖区别于其他湖泊的重要特征在于湿地类型复杂多样.其中,既有季节性淹没的洲滩湿地和冲积洲湿地,也有河流湿地,还有长期淹没的低高程湖沼湿地.复杂的湿地类型影响了反硝化过程的诸多控制因子,如周期性的水文变化对沉积物有机质累积、矿化及沉积物氧化还原电位等存在重要影响,进而对反硝化造成影响.而水位的巨大变幅更影响了鄱阳湖不同湿地区域与流域河道的连通性,从而造成反硝化底物供给的差异.
本研究选取的洲滩沉积物、不同水力联系下的湖沼沉积物是鄱阳湖较为常见的沉积物类型,分别代表了水力联系较强的洲滩湿地、水力联系较强的连通湖区湖沼湿地及水力联系较弱的内湾湖沼湿地.通过对上述不同类型湿地沉积物柱样采集、流动培养及同位素添加模拟,对不同水力联系及沉积物特性下的沉积物反硝化进行研究,以期进一步了解水动力变化下鄱阳湖多类型湿地沉积物的反硝化空间差异及其影响规律.
2 材料与方法(Materials and methods) 2.1 样品采集本文设置研究点位共7个,其中,1#、2#是枯水季节不连通的内湾湖沼沉积物,3#、4#是与大湖面连通的湖沼沉积物,5#~7#是洲滩沉积物(图 1).反硝化研究采用原柱样沉积物流动培养法.沉积物柱状样于2012年7月用有机玻璃柱状采样器(直径75 mm)采集,每个点位采集3根(泥柱深度15~20 cm).为保证采集的沉积物有较好的同质性,所有的柱样均在较小区域内一次性采集,用橡胶塞塞紧保存,同时用10 L聚乙烯桶采集采样点的上覆水,运回实验室后用于流动培养.同时采集表层沉积物,用于沉积物理化性质分析.采集好的样品于6 h内运回实验室分析和培养,在运输过程中尽量避免沉积物界面的扰动.
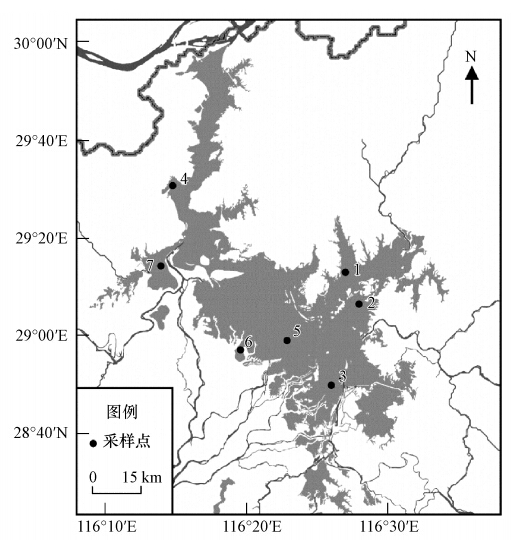 |
| 图 1 研究点位置示意图 Fig. 1 Sample sites in Poyang Lake |
采集的柱样在实验室内垂直放置,打开上端橡皮塞,用注射器沿着管壁尽量无扰动地注满上覆水,置于现场水温(20 ℃)条件下恒温水浴过夜,以去除运输过程中短暂密封造成的水体溶解氧下降等因素.为避免沉积物和水体中藻类光合作用对反硝化的影响,柱样在培养过程中用铝箔包裹.对上述柱样进行无顶空流动培养.培养系统包括具密封圈的活塞、进出水管及提供恒定进水流速的蠕动泵.进水管距水-沉积物界面约1 cm,进水管低于出水管,通过蠕动泵将进水以恒定的流速(1 mL · min-1)泵入柱样中,使流动培养的进出水循环形成垂直及水平方向的混合水流,使上覆水充分混合,并通过持续流动保持上覆水中离子浓度稳定.稳定培养24 h后用注射器小心采集进水样品,在无气泡产生的情况下装满并充分溢流至细长的溶解性气体采集管中,出水水样直接溢流收集,加200 μL 50%ZnCl2保存.用膜接口质谱仪(MIMS)测定水样中可溶性气体(28N2、29N2、30N2)的含量.另收集25 mL 进、出水样品,经0.45 μm 醋酸纤维滤膜过滤后,-4 ℃保存待用.
2.3 反硝化速率的计算方法沉积物中反硝化所需的NO-3-N可能上覆水或来自沉积物中的硝化作用,分别形成非耦合反硝化和耦合反硝化,这两种反硝化途径可以通过同位素配对技术(Nielsen et al., 1995)进行测定.向上覆水中添加15NO-3-N 并使其浓度在100 μmol · L-1左右,稳定培养一段时间后使15NO-3-N与天然丰度的14NO-3-N在表层沉积物和上覆水体中混合均匀.由这些硝酸盐产生的反硝化产物——N2的相对分子质量有28、29、30(图 2).N2释放速率(r29、r30)的计算公式如下(Kana et al., 1998):
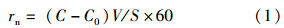
 |
| 图 2 同位素添加下氮素转化示意图(Steingruber et al., 2001) Fig. 2 Schematic representation of the transformation rates during 15NO3-tracer experiment(Steingruber et al., 2001) |
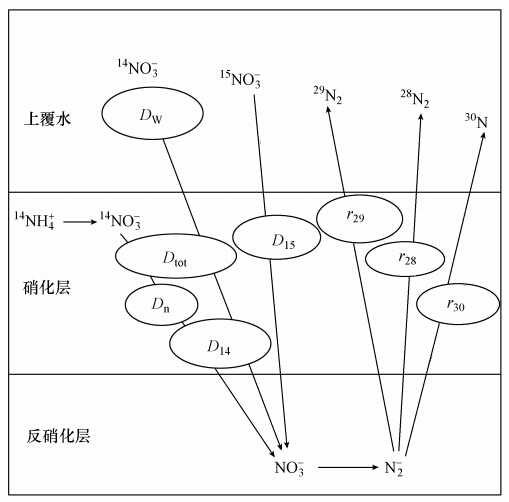
式中, rn为氮气(29N2、30N2)释放速率(μmol · m-2 · h-1); C、C0为取样时出水及进水中氮气含量(μmol · L-1);V为蠕动泵流速(mL · min-1);S为柱样中水-沉积物界面面积(m2); 60为时间换算因子.
通过生成的29N2、30N2,计算利用15NO-3-N而发生的反硝化速率D15(Rysgaard et al., 1993),利用未标记的14NO-3-N产生的反硝化速率D14,通过以上结果计算Dn、Dw,具体公式如下:
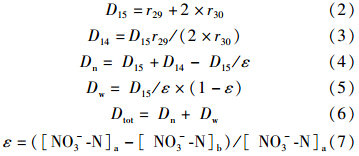
式中, D15、D14 分别为利用15NO-3-N、14NO-3-N而发生的反硝化速率(μmol · m-2 · h-1),Dn为耦合反硝化速率(μmol · m-2 · h-1),Dw为非耦合反硝化速率(μmol · m-2 · h-1),Dtot表示原位状态下的总反硝化速率(μmol · m-2 · h-1),ε代表培养试验中15NO-3-N的丰度(无量纲),下标a和b表示添加同位素之后和之前.
2.4 沉积物呼吸速率的计算通过MIMS 测定流动培养过程中进出水样的O2 含量,以此来确定反硝化过程中沉积物的呼吸速率(SOD)(Kana et al.,1994):
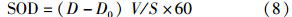
式中, D、D0为取样时出水及进水中氧气含量(μmol · L-1); V为蠕动泵流速(mL · min-1); S为柱样中水-沉积物界面面积(m2); 60为时间换算因子.
2.5 土壤微生物量碳的测定微生物量碳的测定参考Witt等(2000)和陈果等(2006)所用的方法.按5 g干土的量称取一定量新鲜土样于离心管,土样分为氯仿熏蒸组和未熏蒸组.按60 μL · g-1干土的比例加氯仿至熏蒸组,振荡使氯仿与土样充分混匀,黑暗条件下静置24 h后加入20 mL(0.5 mol · L-1)K2SO4溶液,振荡30 min,低速(5000 r · min-1)离心10 min后抽取浸提液并过滤.未熏蒸组直接加K2SO4溶液提取.将含氯仿的浸提液倒入消煮管中,称重后放入水浴锅,待水沸腾后开始计时,消煮45~60 min,以去除氯仿对TOC测定的影响,待冷却后用去离子水补充损失水分,用TOC仪测定浸提液含碳量.提取系数Kc=0.45(陈果等,2006),熏蒸组与未熏蒸组中碳含量的差异即土壤微生物量碳值.
2.6 样品的测定与分析表层沉积物总氮(TN)通过碱性过硫酸钾消解后在210 nm处用紫外分光光度法测定;水样氨氮(NH+4-N)通过纳氏试剂比色法测定;硝态氮(NO-3-N)通过紫外分光光度法测定;表层沉积物含水率(质量分数)在105 ℃条件下烘24 h至恒重后测定;有机质含量以烧失量LOI表示(Heiri et al., 2001),通过烘干的沉积物在马弗炉中550 ℃灼烧6 h后测定;容重的测定采用金属环刀法.
3 结果与分析(Results and analysis) 3.1 上覆水及沉积物的理化特性采样点位上覆水及沉积物的理化性质如表 1所示,洲滩沉积物上覆水中的NO-3-N浓度在42.86 ~51.43 μmol · L-1之间,其平均值(47.14 μmol · L-1)大于湖沼沉积物上覆水的NO-3-N(39.29 μmol · L-1),但湖沼沉积物上覆水NO-3-N的浓度范围更广(23.57~55.71 μmol · L-1),而且内湾区的NO-3-N浓度显著低于连通区(p<0.01).洲滩与湖沼沉积物上覆水NH+4-N平均浓度的差异不显著,但具有显著水力联系差异的内湾区湖沼沉积物NH+4-N显著低于连通区湖沼沉积物,且达到水平(p=0.05).
| 表 1 上覆水及沉积物的理化性质 Table 1 The physicochemical parameters of the overlying water and the sediment |
表层沉积物总氮(TN)均值在洲滩沉积物及湖沼沉积物之间的差异不显著.而湖沼沉积物含水率和烧失量的平均值均高于洲滩沉积物,其中,湖沼沉积物分别为60.97%和8.50%,而洲滩沉积物分别为47.15%和7.32%,其中,含水率的差异达到显著水平(p=0.05),烧失量差异不显著.洲滩沉积物和湖沼沉积物的容重差异则具有相反的结果,洲滩沉积物的容重均值(1.33 g · cm-3)高于湖沼沉积物(1.07 g · cm-3),但未达到显著水平(p>0.05).
MBC在3种类型沉积物中差异较大,即使同为湖沼沉积物,其水力连通性的差异也对MBC有较大影响.连通区湖沼沉积物的MBC含量最高,平均值为(218.72±71.73)mg · kg-1,内湾区湖沼沉积物含量最低,为(118.58±66.70)mg · kg-1,洲滩沉积物的MBC含量为(199.15±144.91)mg · kg-1.以MBC/LOI计算结果可以看出,MBC在这3种沉积物有机质中所占比例均较小,分别为0.27%、0.14%、0.26%.
3.2 沉积物反硝化速率和沉积物呼吸速率3种类型沉积物的反硝化速率如图 3所示.由图可知,湖沼沉积物的平均反硝化速率为(28.72±17.77)μmol · m-2 · h-1,但空间异质性大,其中,内湾湖沼沉积物反硝化速率(均值13.45 μmol · m-2 · h-1)显著低于连通区湖沼沉积物(均值43.98 μmol · m-2 · h-1)(p<0.01).较弱水力联系致使内湾区的非耦合反硝化和耦合反硝化均较弱,特别是位于周溪的半封闭湖区(1#点),几乎没有耦合的反硝化过程发生.连通性点位的非耦合反硝化速率和耦合反硝化速率均值分别为30.35 μmol · m-2 · h-1和13.63 μmol · m-2 · h-1.
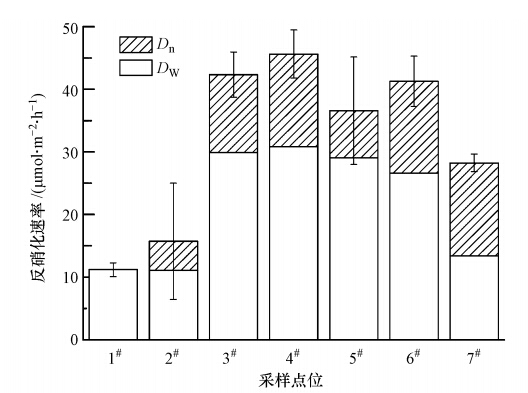 |
| 图 3 三种类型沉积物的反硝化率(误差线为标准误差,n=3) Fig. 3 The denitrification rates of three different types of sediments |
洲滩沉积物的平均反硝化速率为(35.36±6.12)μmol · m-2 · h-1,其中,6#点位的反硝化速率最高(41.29 μmol · m-2 · h-1),7#点位反硝化速率最低(28.22 μmol · m-2 · h-1),但洲滩沉积物3个点位之间反硝化速率差异不显著.洲滩沉积物的非耦合反硝化速率和耦合反硝化速率均值分别为23.02 μmol · m-2 · h-1和12.34 μmol · m-2 · h-1.
湖沼沉积物的呼吸速率(SOD)在2.55~899.6 μmol · m-2 · h-1之间(均值为351.23 μmol · m-2 · h-1,SD=387.74 μmol · m-2 · h-1),而其中水力联系较强的湖沼沉积物的SOD(均值为608.61 μmol · m-2 · h-1)显著高于内湾区的湖沼沉积物(均值为93.85 μmol · m-2 · h-1).洲滩沉积物的SOD值差异相对较小,其范围是520.91 ~756.48 μmol · m-2 · h-1,均值为647.84 μmol · m-2 · h-1,标准偏差为118.84 μmol · m-2 · h-1.
4 讨论(Discussion) 4.1 沉积物的反硝化作用总反硝化速率(Dtot)在有较强水力联系的湖沼沉积物中最高,达到(43.98±2.33)μmol · m-2 · h-1; 在洲滩沉积物中次之,为(35.36±6.12)μmol · m-2 · h-1; 而在与大湖区连通性较弱的内湾湖沼沉积物中最低,为(13.45±3.21)μmol · m-2 · h-1.Nils Risgaard-Petersen等(1998)对从Sùbygaard Sù Lake 采集的沉积物加入浓度为200 μmol · L-1的15N 同位素进行反硝化研究,得出沉积物的反硝化速率为(149.16±4.17)μmol · m-2 · h-1,显著高于本研究中各类型沉积物的反硝化速率.本研究中有较强水力联系的洲滩沉积物及湖沼沉积物的反硝化速率与徐徽等(2009)在太湖北部梅梁湾内湾测定的结果类似(均值为36.37 μmol · m-2 · h-1),而鄱阳湖中水力联系较弱的内湾湖沼沉积物的反硝化率则与梅梁湾外开敞湖区的反硝化速率相类似(均值为16.34 μmol · m-2 · h-1).
4.2 上覆水硝酸盐对反硝化速率的影响反硝化菌在呼吸作用中用硝酸盐代替氧原子作为电子受体,进而将硝酸盐还原为N2O或N2,因此,硝酸盐是反硝化的必要底物.分析湖沼沉积物和洲滩沉积物反硝化速率与上覆水硝酸盐含量的关系,可以发现,不同类型沉积物的反硝化速率与上覆水硝酸盐之间存在显著正相关(图 4,r=0.97,p<0.01),这说明上覆水硝酸盐是洲滩沉积物和湖沼沉积物的反硝化的限制性因子(Nielsen et al., 1995; Kana et al., 1998 ;Zhong et al., 2010).
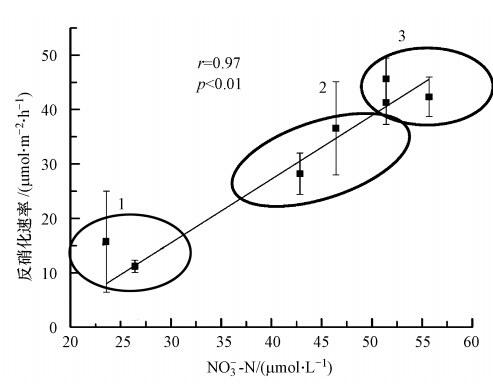 |
| 图 4 沉积物反硝化率与上覆水硝酸盐的关系(误差线为标准误差,n=3) Fig. 4 The relationship between the denitrification rate and NO-3-N in overlying water |
进一步研究发现,反硝化速率在不同水力联系及沉积物特性的湖区中呈现较强的空间异质性.这主要是由不同湖区上覆水硝酸盐含量不同所致.内湾区的上覆水硝酸盐含量较低(均值为0.35 mg · L-1),这是因为内湾区的生物在初级生产过程中吸收了大量上覆水硝酸盐,而与外界较弱的水力联系使得硝酸盐不能得到及时补充.另一方面,湖沼沉积物较高含量的有机质为反硝化活动提供了充足的碳源,反硝化活动加剧了内湾区硝酸盐的消耗.而连通湖区沉积物由于有较强的水力联系,上述原因造成的硝酸盐消耗可以得到及时补充,较高含量的硝酸盐进而提高了反硝化速率.
对比水力连通性均较强的湖沼沉积物和洲滩沉积物可以发现,湖沼沉积物的反硝化速率(均值43.98 μmol · m-2 · h-1)略高于洲滩沉积物(35.36 μmol · m-2 · h-1),但差异不显著.连通性湖沼沉积物中的MBC及上覆水硝酸盐均高于洲滩沉积物,促使反硝化速率也较高.另一方面,湖沼沉积物的含水率和孔隙率均显著高于洲滩沉积物,较高的孔隙率有利于上覆水体硝酸盐向反硝化层的迁移,进而提高了非耦合反硝化,因此,总反硝化速率也较大.
4.3 沉积物性质对反硝化的影响在上覆水到沉积物的垂向剖面中,沉积物在呼吸过程中逐渐消耗水土界面及硝化层中的氧气,并在一定的沉积深度中形成足够的厌氧环境并形成反硝化层.因此,沉积物的呼吸速率(SOD)往往与反硝化层深度及反硝化速率具有密切的联系,其中,SOD与反硝化速率往往存在着显著的正相关关系(Cornwell et al., 1999;张波等,2012).本研究中鄱阳湖湿地沉积物的反硝化速率与呼吸速率呈显著正相关(图 5,r=0.76,p<0.05)同样证实了这一规律,即无论是洲滩沉积物,还是不同类型湖沼沉积物,其SOD值越高,对水体氧气的消耗越强烈,沉积物的反硝化也越强烈.
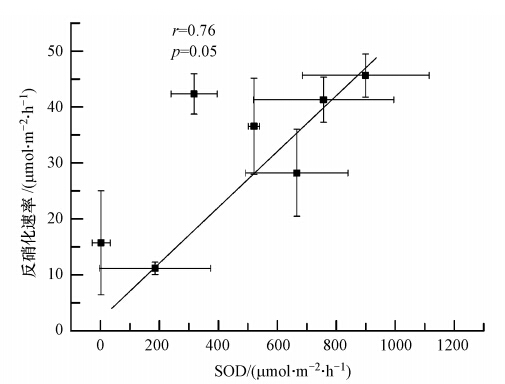 |
| 图 5 沉积物反硝化速率与SOD的关系(误差线为标准误差,n=3) Fig. 5 The relationship between denitrification rate and the SOD |
影响沉积物呼吸速率的主要因子包括沉积物的有机质含量、底栖生物和底栖微生物的数量和活性,而沉积物有机质,特别是易降解有机质,往往是影响沉积物呼吸速率最重要的因素.微生物碳(MBC)虽然在有机质中所占比例很小(Kushwaha et al., 2000),但却是沉积物有机质中最具有活性的部分,是反硝化过程中最容易被利用的碳源(Groffman et al., 2003),与沉积物中的反硝化菌数量及反硝化潜力(Denitrification Enzyme Activity,DEA)往往具有相当密切的关系(Davis et al., 2008).尽管有少量研究认为反硝化速率与MBC之间存在负相关关系(Bohlen et al., 2007),但有关湿地沉积物的研究表明,沉积物MBC含量与反硝化速率之间存在显著的正相关关系(White et al., 2003).鄱阳湖湿地中3种沉积物(洲滩沉积物、内湾湖沼沉积物和连通湖沼沉积物)的MBC含量在空间上具有相当大的异质性(71.42 ~365.74 mg · kg-1),甚至在同一类型沉积物中,MBC含量的标准误差也较大(图 6).但将同类型湖区沉积物的MBC含量进行均值化处理后再与反硝化速率均值进行的相关性分析仍显示出显著的正相关关系(r=0.99,p=0.05).可据此认为鄱阳湖湿地沉积物的MBC含量与反硝化过程具有十分密切的关系,其原因是:一方面MBC提供了反硝化过程中的最优先可利用碳源(Groffman et al., 2003);另一方面,较高的MBC含量也往往预示着更多的反硝化菌数量和更强的反硝化潜力(Davis et al., 2008),从而导致更高的反硝化速率.
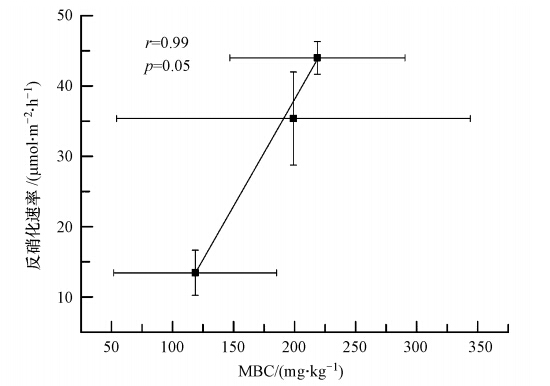 |
| 图 6 沉积物反硝化速率与MBC的关系(误差线为标准误差,n=3) Fig. 6 The relationship between denitrification rate and the MBC |
分析洲滩和不同类型湖沼沉积物的反硝化途径,发现耦合反硝化均小于非耦合反硝化,这说明非耦合反硝化是其主要反硝化方式.有研究表明,当上覆水硝酸盐浓度在133~141 μmol · L-1时,耦合反硝化一般占总反硝化速率的6%~9%,但当上覆水硝酸盐浓度较低(如5 μmol · L-1)时,耦合反硝化所占的比例可达72%(Nishio et al., 1983).本研究中除有机质水平最高,但水力联系最弱的半封闭湖湾(周溪湾)的耦合反硝化未能测出外,其余沉积物上覆水的硝酸盐浓度范围为23.57 ~55.71 μmol · L-1,即在上述较低浓度5μmol · L-1与较高浓度141 μmol · L-1之间,而这些沉积物耦合反硝化的比例为20.1%~52.6%,这与上述研究基本一致.对不同水力连通性湖区的进一步对比发现,内湾沉积物的耦合反硝化显著低于连通区的湖沼沉积物和洲滩沉积物.这主要是因为内湾沉积物中有机质含量较高,有机质在氧化过程中消耗的氧气加剧界面的厌氧状况,导致沉积物硝化作用较弱,因而耦合反硝化较低.在连通湖区中,由于有较强的水力联系,沉积物中有机质氧化消耗的氧气可以得到补充,氧气在表层沉积物中的入渗深度较大,因而耦合反硝化值较高.对比连通区中的两种沉积物可以发现,两者的耦合反硝化差别较小,但湖沼沉积物的非耦合反硝化高于洲滩沉积物,这是由于湖沼沉积物较高的孔隙率有利于上覆水体硝酸盐向反硝化层的迁移,进而提高了非耦合反硝化.
5 结论(Conclusions)1)反硝化速率在具有水力连通性的湖沼沉积物中最高,达到(43.98±2.33)μmol · m-2 · h-1;在洲滩沉积物中次之,为(35.36±6.12)μmol · m-2 · h-1;而在与大湖区连通性较弱的内湾湖沼沉积物中最低,为(13.45±3.21)μmol · m-2 · h-1.不同湖区上覆水硝酸盐浓度的差异影响了反硝化速率的空间差异性.不论是洲滩沉积物还是不同水力联系下的湖沼沉积物,反硝化速率都与上覆水硝酸盐显著相关(p<0.01),说明上覆水硝酸盐是反硝化的限制性因素.相关分析显示,不同湖区沉积物的呼吸速率及微生物有机碳含量对鄱阳湖湿地沉积物反硝化也具有一定的影响(p均为0.05),表明较高的沉积物呼吸速率及微生物有机质含量预示着沉积物较高的反硝化速率.
2)在两种反硝化途径中,洲滩和不同水力联系下的湖沼沉积物的耦合反硝化均小于以水体硝酸盐为底物的非耦合反硝化,说明非耦合反硝化是反硝化的主要方式.耦合反硝化与非耦合反硝化在内湾区湖沼沉积物中均较弱;与大湖区连通的湖沼沉积物的非耦合反硝化强于洲滩沉积物,说明了反硝化途径与水力联系及沉积物有机质水平具有一定的联系.
| [1] | An S, Gardner W S, Kana T.2001.Simultaneous measurement of denitrification and nitrogen fixation using isotope pairing with membrane inlet mass spectrometry analysis[J].Applied and Environmental Microbiology, 67(3): 1171-1178 |
| [2] | Arheimer B, Wittgren H B.2002.Modelling nitrogen removal in potential wetlands at the catchment scale[J].Ecological Engineering, 19(1): 63-80 |
| [3] | Bohlen P J, Gathumbi S M.2007.Nitrogen cycling in seasonal wetlands in subtropical cattle pastures[J].Soil Science Society of America Journal, 71(3): 1058-1065 |
| [4] | 陈果, 刘岳燕, 姚槐应, 等.2006.一种测定淹水土壤中微生物生物量碳的方法:液氯熏蒸浸提-水浴法[J].土壤学报, 43(6):981-988 |
| [5] | Cornwell J C, Kemp M W, Kana T M.1999.Denitrification in coastal ecosystems: methods, environmental controls, and ecosystem level controls, a review[J].Aquatic Ecology, 33(1): 41-54 |
| [6] | Davis J H, Griffith S M, Horwath W R, et al.2008.Denitrification and nitrate consumption in an herbaceous riparian area and perennial ryegrass seed cropping system[J].Soil Science Society of America Journal, 72(5): 1299-1310 |
| [7] | Groffman P M, Crawford M K.2003.Denitrification potential in urban riparian zones[J].Journal of Environmental Quality, 32(3): 1144-1149 |
| [8] | Heiri O, Lotter A F, Lemcke G.2001.Loss on ignition as a method for estimating organic and carbonate content in sediments: reproducibility and comparability of results[J].Journal of Paleolimnology, 25(1): 101-110 |
| [9] | Hill A.1979.Denitrification in the nitrogen budget of a river ecosystem[J].Nature, 281(5729): 291-292 |
| [10] | Hill A.1983.Denitrification: its importance in a river draining an intensively cropped watershed[J].Agriculture, Ecosystems & Environment, 10(1): 47-62 |
| [11] | Hill A R.1981.Niteate-nitrogen flux and utilizaton in a stream ecosystem during low summer flows[J].Canadian Geographer/Le Géographe Canadien, 25(2): 225-239 |
| [12] | Holligan P M, de Boois H.1993.Land ocean interactions in the coastal zone (LOICZ).Science plan[R].Report No.25 Stockholm: IGBP |
| [13] | Hurd T, Gökkaya M K, Kiernan B D, et al.2005.Nitrogen sources in Adirondack wetlands dominated by nitrogen-fixing shrubs[J].Wetlands, 25(1): 192-199 |
| [14] | Kana T M, Sullivan M B, Cornwell J C.1998.Denitrification in estuarine sediments determined by membrane inlet mass spectrometry[J].Limnology and Oceanography, 43(2):334-339 |
| [15] | Kanyiginya V, KansⅡme F, Kimwaga R, et al.2010.Assessment of nutrient retention by Natete wetland Kampala, Uganda[J].Physics and Chemistry of the Earth, Parts A/B/C, 35(13/14): 657-664 |
| [16] | Kern J, Kreibich H, Koschorreck M, et al.2011.Nitrogen balance of a floodplain forest of the Amazon River: the role of Nitrogen fixation[J].Amazonian Floodplain Forests, 210:281-299 |
| [17] | Kiernan B, Hurd T, Raynal D J.2003.Abundance of Alnus incana ssp.rugosa in Adirondack Mountain shrub wetlands and its influence on inorganic nitrogen[J].Environmental Pollution, 123(3): 347-354 |
| [18] | Kushwaha C, Tripathi S, Singh K P.2000.Variations in soil microbial biomass and N availability due to residue and tillage management in a dryland rice agroecosystem[J].Soil and Tillage Research, 56(3): 153-166 |
| [19] | Madigan M, Martinko J.2004.Brock Biology of Microorganisms (8th edn.)[J].New Jersey:Prentice Hall |
| [20] | Nielsen K, Nielsen L, Rasmussen P.1995.Estuarine nitrogen retention independently estimated by the denitrification rate and mass balance methods: a study of Norsminde Fjord, Denmark[J].Marine Ecology Progress Series.Oldendorf, 119(1): 275-283 |
| [21] | Nielsen L P, Christensen P B, Revsbech N P, et al.1990.Denitrification and oxygen respiration in biofilms studied with a microsensor for nitrous oxide and oxygen[J].Microbial Ecology, 19(1): 63-72 |
| [22] | Nishio T, Koike I, Hattori A.1983.Estimates of denitrification and nitrification in coastal and estuarine sediments[J].Applied and Environmental Microbiology, 45(2): 444-450 |
| [23] | Risgaard-Petersen N, Nielsen L P, Blackburn T H, et al.1998.Simultaneous measurement of benthic denitrification, with the isotope pairing technique and the N2 flux method in a continuous flow-through system[J].Water Research, 32(11): 3371-3377 |
| [24] | Rysgaard S, Risgaard-Petersen N, Nielsen L P, et al. 1993.Nitrification and denitrification in lake and estuarine sediments measured by the 15N dilution technique and isotope pairing[J].Applied and Environmental Microbiology, 59(7): 2093-2098 |
| [25] | Steingruber S M, Friedrich J, Gächter R.2001.Measurement of denitrification in sediments with the 15N isotope pairing technique[J].Applied and Environmental Microbiology, 67(9): 3771-3778 |
| [26] | Starr R C, Gillham R W.1993.Denitrification and organic carbon availability in two aquifers[J].Ground Water, 31(6): 934-947 |
| [27] | 孙志高, 刘景双, 于君宝.2010.三江平原典型草甸小叶章湿地土壤的反硝化作用[J].农业系统科学与综合研究, 26(1):117-122 |
| [28] | Weisner S, Thiere G.2010.Effects of vegetation state on biodiversity and nitrogen retention in created wetlands:a test of the biodiversity–ecosystem functioning hypothesis[J].Freshwater Biology, 55(2): 387-396 |
| [29] | White J R, Reddy K.2003.Nitrification and denitrification rates of Everglades wetland soils along a phosphorus-impacted gradient[J].Journal of Environmental Quality, 32(6): 2436-2443 |
| [30] | Witt C J, Gaunt L, Galicia C C, et al.2000.A rapid chloroform-fumigation extraction method for measuring soil microbial biomass carbon and nitrogen in flooded rice soils[J].Biology and Fertility of Soils, 30(5): 510-519 |
| [31] | 徐徽, 张路, 商景阁, 等.2009.太湖梅梁湾水土界面反硝化和厌氧氨氧化[J].湖泊科学, 21(6):775-781 |
| [32] | 张波, 杜应旸, 陈宇炜, 等.2012.太湖流域典型河流沉积物的反硝化作用[J].环境科学学报, 32(8):1866-1873 |
| [33] | Zhong J C, Fan C X, Liu G, et al.2010.Seasonal variation of potential denitrification rates of surface sediment from Meiliang Bay, Taihu Lake, China[J].Journal of Environmental Sciences, 22(7): 961-967 |
| [34] | Zhu G B, Wang S Y, Wang W D, et al.2013.Hotspots of anaerobic ammonium oxidation at land-freshwater interfaces[J].Nature Geoscience, 6(2): 103-107 |
 2014, Vol. 34
2014, Vol. 34


