2. 中国林业科学研究院森林生态环境与保护研究所, 北京 100091
2. Institute of Forest Ecology, Environment and Protection, Chinese Academy of Forestry, Beijing 100091
森林土壤是一个主要的长期碳(C)源,同时也是未受干扰的陆地生态系统的重要碳汇(Harrison et al., 1995; Liski et al., 2002).研究表明,土壤储存了大约1500 Pg C,约占陆地生态系统C库的70%,是大气C库2倍(Chapin et al., 2002).土壤呼吸是生物圈C循环的重要组成部分,约占整个生态系统呼吸的3/4,土壤呼吸也是C在土壤和大气之间进行流通的一个主要形式,是全球C循环的一个重要组成部分(Schimel,1995).据报道,全球每年释放75 Pg C(Schlesinger et al., 2000),土壤呼吸的微小改变也能引起大气中CO2浓度和土壤C汇速率的巨大改变(Bowden et al., 2004).
温带森林生态系统土壤呼吸的主要影响因素包括土壤基质质量(Waring et al., 1998)、土壤温度(Flanagan et al., 2013)、湿度(Jia et al., 2012)、根系生物量(Bae et al., 2013)和土壤微生物量(涂莉华等,2009)等.目前,国内关于森林土壤呼吸的研究报道主要集中在热带(骆土寿等,2001)和亚热带地区(2009a),且大多数集中于N沉降对针叶人工林(王光军等,2009a; 王光军等,2009b; 周小刚等,2012; Tu et al., 2011)、阔叶林和草地生态系统(Tu et al., 2011)的影响,而对温带地区天然油松林的研究尚未见报道.
现代农业、工业的发展和化石燃料的燃烧极大地加速了大气氮沉降速率,预测22世纪全球氮沉降将超过21世纪的1倍(Galloway et al., 2004).Magnani等(2007)研究揭示,N沉降是森林生态系统C汇的主要驱动力.大气N沉降对陆地生态系统和水生系统有很多负面影响,例如,富营养化和生物多样性丧失(Maskell et al., 2010).有关N沉降对森林土壤呼吸的影响结论也并不一致,包括N沉降下土壤呼吸显著提高(莫江明等,2005;涂莉华等,2010),N沉降对森林土壤CO2的排放无显著影响(Lee et al., 2003; Mo et al., 2007a; Allison et al., 2008; Samuelson,2009),N沉降会抑制森林土壤呼吸(Bowden et al., 2004; 雒守华等,2010)等.凋落物作为一个缓冲层覆盖在土壤表面,对降落到地上的N有一定的吸收作用,进而改变直接进入土壤中的N的量(Subke et al., 2004),而凋落物分解对土壤呼吸也会产生一定影响(骆土寿等,2001;王光军等,2009a; 2009b).根系是土壤中唯一的植物器官,可以利用外源N的输入促进其生物量的增加(涂莉华等,2010; Graefe et al., 2010),且根系及根际微生物也影响着土壤呼吸的变化(涂莉华等,2010).许多针对N沉降对土壤呼吸影响的研究均是在施氮后的月中或月末进行测量(雒守华等,2010;涂利华等,2011;李仁洪等,2010),这对于估计土壤呼吸对于N沉降的即时响应有很大不足.因此,本试验拟在切根、去凋的基础上增加施氮后土壤呼吸的测定频率,为N沉降下土壤呼吸变化的机制提供进一步的解释.
油松(Pinus tabulaeformis Carr.)是我国特有的树种,分布广泛,且油松林是我国北方温性针叶林中分布最广的森林群落,也是暖温带湿润半湿润气候区的地带性植被(陈云明等,2002).太岳山地区在山西省素称“油松之乡”,目前在全球气候变化背景下,有关该地区大气氮沉降对森林生态系统影响的研究较少,而关于油松林土壤呼吸对大气氮沉降的响应研究还鲜见报道,模拟N沉降对土壤呼吸的持续影响的研究在国内也尚未见报道.因此,本文在测定该地区大气氮沉降背景值的情况下,研究模拟氮沉降和采样频率对土壤呼吸的影响并探讨其机制,以期为全球气候变化背景下油松林生态系统管理提供理论依据.
2 材料与方法(Materials and methods) 2.1 研究地概况和样地描述本试验样地设在国家林业局太岳山森林生态系统定位站,该定位站位于山西太岳山的灵空山自然保护区灵空山林场,东经112°01′~112°15′,北纬36°31′~36°43′.林区海拔为1150~2088 m,平均海拔1500 m.地貌属大起伏喀斯特侵蚀高中山,土壤主要是褐土和棕壤.该区气候属温带大陆性季风气候,四季分明,雨量集中在夏季,占全年降雨量的60%以上,年平均降雨量662 mm.年均温度6.2 ℃,日均温≥10 ℃的年积温2542 ℃,年日照2600 h,无霜期110~125 d.油松(P.tabulaeformis)、辽东栎(Quercus liaotungesis)、山杨(Populus davidiana)、白桦(Betula platyphylla)是本区最具代表性的树种,灌木主要有毛榛(Corylus m and shurica)、沙棘(Hippophae rhamnoides)、黄刺梅(Rosaceae xanthina)、胡枝子(Lespedeza bicolor)等,草类有苔草、莎草、蒿类等.
2009年7月在油松天然林中选取未被破坏、有代表性的地段建立12个20 m×20 m的固定样地.2009年8月对所有样地进行了本底值调查,调查样地内所有胸径≥1 cm的全部植物个体种名、胸径、树高、冠幅及枝下高,并挂牌标记.同时,测定每个20 m×20 m样地内土壤表层(0~20 cm)的土壤全氮、有机质含量、土壤容重和pH值等样地本底值,结果如表 1所示.
| 表1 油松林各处理样地的主要林分和立地特征 Table.1 St and and site characteristics of the nitrogenloaded plots in the natural forest of Pinus tabulaeformis |
在每个20 m × 20 m的样地外,随机选择3个2 m × 2 m的小样方,对林地表面分别作3种凋落物处理:处理1为保持枯枝落叶层+保留根系(对照,C),处理2为去除枯枝落叶层+保留根系(去凋,B),处理3为去除枯枝落叶层+切断根系(去凋+切根,A),每种处理重复3次,总共36个小样方.去凋处理为:去除小样方土壤表面上的凋落物及其碎屑;切根处理为:采样挖壕法,壕沟深1.0 m,直到看不见根系,切断所有根系但不移走,并将裸露根系剪断后插入厚塑料板以阻止外围根系向小样方内生长,然后按顺序回填土壤,紧贴地面除去小样方内所有活体植物,尽量减少对地表土壤的扰动.所有去凋处理和切根+去凋处理的样方内定期清除地表植被和新鲜凋落物.
模拟氮沉降采用人工喷氮的方式进行.通过收集降雨和降尘,测定得到本地区自然N沉降量为21.2 kg · hm-2 · a-1,依据自然氮沉降背景值设置氮处理的强度和频度,按氮施用量的高低,36个小样方分为4个处理组:对照(CK,0 kg · hm-2 · a-1)、低氮(LN,50 kg · hm-2 · a-1)、中氮(MN,100 kg · hm-2 · a-1)和高氮(HN,150 kg · hm-2 · a-1),每种N水平重复3次.使用CO(NH2)2作为氮源,自2009年9月开始,将每种氮水平的应施氮量分成6份,保证每个月每种氮水平的施氮量相等,在每年生长季内(5—10月)的每月月底以溶液的形式给样地喷洒.将需要喷施的CO(NH2)2溶解在2 L水中,用喷壶在小样方内均匀喷洒.对照样方喷施等量的水以避免样方内外加水量不等造成的误差.
2.3 土壤呼吸速率的测定各分室土壤呼吸速率的测量:在每个2 m×2 m的小样方中布置1个内径为20 cm、高为10 cm的PVC环,PVC环一端削尖,压入土中,在整个观测过程中保持位置不变,土壤环布置完毕24 h后开始第一次测量.2012年7—10月期间,于每月施氮后的第1、2、3、5、8、15、30 d(遇见雨天自动取消当天的测定),在每天的8:00—18:00应用LI8100土壤CO2通量全自动测量系统(LICOR Inc.,Lincoln,Nebraska,USA)测定各种处理后的土壤呼吸速率,测量时间设定为2 min,按照样方顺序进行测量,总共3轮,每个小样方每天测量3次.测定土壤呼吸速率的同时,应用与LI8100配套的湿度传感器测定土壤5 cm深处的湿度,用数字式瞬时温度计(TR52i,Japan)测定10 cm处的温度.
2.4 土壤微生物生物量C、N的测定由于小样方面积有限,为了减小对其干扰,每个样方只取1次土样.于2012年10月下旬进行采样,在36个小样方内,去除表面凋落物层,每个小样方各取3个环刀,将每个小样方土样进行充分混合.将每个样地的土样充分混匀后,去除粗根、石块和其他杂物后过2 mm筛备用.用车载冰箱在低温下将所有土壤样品运送到北京的实验室,在1周内进行测量.采用氯仿熏蒸直接提取法(Brookes et al., 1985; Vance et al., 1987)测量微生物生物量C和N.
2.5 土壤酶活性的测定于2012年7月、9月中旬进行采样.在36个小样方内,去除表面凋落物层,由于小样方面积有限,为了减小对其干扰,每个小样方只取1个环刀,用车载冰箱将所有土壤样带回国家林业局太岳山生态定位站实验室,去除粗根、石块和其他杂物后过2 mm筛,然后放在-4 ℃冰箱中待测.多酚氧化酶用邻苯三酚比色法测定,以每克干土每小时产生的红紫棓精质量表示,单位为mg · kg-1 · h-1;过氧化物酶用蒽酮比色法测定,单位为mg · kg-1 · h-1(以焦性没食子酸计);脲酶用苯酚钠次氯酸钠比色法,单位为mg · kg-1 · h-1(以NH+4N计);土壤磷酸酶活性测定用磷酸苯二钠比色法,单位为mg · kg-1 · h-1(以酚计)(关松荫等,1986).
2.6 数据分析利用SPSS 18.0软件的Repeat measured ANOVA 进行方差分析和多重比较,检验不同处理的土壤呼吸、温度、湿度、土壤微生物生物量C、N、土壤酶活性的差异.用非线性方程分别建立土壤呼吸速率(Rs)与土壤温度(T)、土壤湿度(W)之间的单因素关系,用线性和非线性关系方程拟合土壤呼吸速率与土壤温度和土壤湿度的双变量关系模型.利用土壤呼吸速率和土壤温度指数关系方程(Rs= aebT)中的温度反应系数b计算土壤呼吸的温度敏感性指数Q10,其定义为Q10=e10b.用Sigmaplot 10.0绘制图表.
3 结果与分析(Results and analysis) 3.1 施氮后土壤呼吸连续变化由图 1可知,切根+去凋、去凋和对照3种处理在每月施氮后的第1 d土壤呼吸速率基本达到最大值,随即下降;切根+去凋、去凋处理的土壤呼吸速率在施氮后第3 d趋于稳定,而对照处理的土壤呼吸速率一直处于下降状态,说明施氮在短时间促进了土壤呼吸速率的增加.
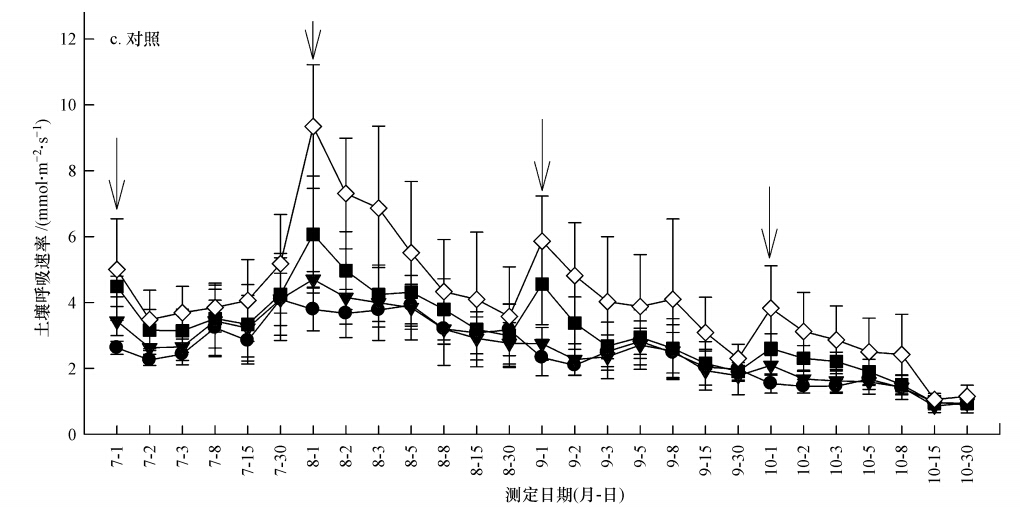 |
| 图 1 不同处理施氮后土壤呼吸的变化趋势(图中日期为土壤呼吸测定序列,图中箭头为每个月施氮后的第一天) Fig. 1 The change trend of soil respiration after nitrogen supply on forest floor with different treatments by removing the roots and /or litter |
由图 1可知,在切根+去凋处理中,施氮后第1 d,不施氮处理(CK)的土壤呼吸速率均低于各施氮水平;除10月份不施氮处理的土壤呼吸速率是一直低于高氮水平外,随着时间的延长其他月份不施氮处理的土壤呼吸速率逐渐高于各施氮水平;在整个观测期间,切根+去凋处理中不施氮处理(CK)的土壤呼吸显著高于低氮、中氮(p<0.05)处理,而与高氮处理之间差异不显著(p>0.05),各施氮水平的平均土壤呼吸速率分别比不施氮(CK)低17.8%、15.2%和2.0%(表 2).在去凋处理中,除9月份低氮、中氮水平外,其余月份各施氮水平下的土壤呼吸速率均在施氮后的第1 d达到最大值;整个观测期内,去凋处理各施氮水平的土壤呼吸均显著高于不施氮,各施氮水平的平均土壤呼吸速率分别比不施氮高29.4%、66.9%、51.3%(表 2).对照处理的不同施氮水平下的土壤呼吸速率在每个月份呈相似变化,均在施氮后的第1 d出现峰值,随后下降;整个观测期内高氮、中氮处理的土壤呼吸均显著高于低氮和不施氮处理(p<0.05),各施氮处理的平均土壤呼吸速率分别比不施氮高5.6%、23.9%和64.1%(表 2).
| 表2 油松林不同处理各施氮水平的土壤呼吸速率、土壤温度和土壤湿度的值 Table.2 Changes of soil respiration,soil temperature and soil moisture in different treatments in Pinus tabulaeformis forests |
切根+去凋、去凋和对照3种处理之间10 cm土壤温度没有显著差异(p>0.05),均呈现一个相同的变化趋势,最大值均出现在7月施氮后的第30 d,最小值均出现在10月施氮后的第15 d(图 2).3种处理的平均土壤温度分别为11.5、11.5、11.8 ℃.不同处理的各氮水平之间的土壤温度没有显著差异(p>0.05),不同处理的温度值均呈现显著月份变化(p<0.05)(表 2).
切根+去凋处理的5 cm土壤湿度显著高于去凋和对照处理(p<0.05),去凋和对照处理之间没有显著差异(p>0.05)(图 2);3种处理的5 cm土壤湿度均呈现一个平稳的变化趋势,均在7月份施氮后的第8 d出现上升拐点,在8月份施氮后第30 d出现下降的波谷.3种处理的平均土壤湿度分别为41.17%、36.36%、35.70%.
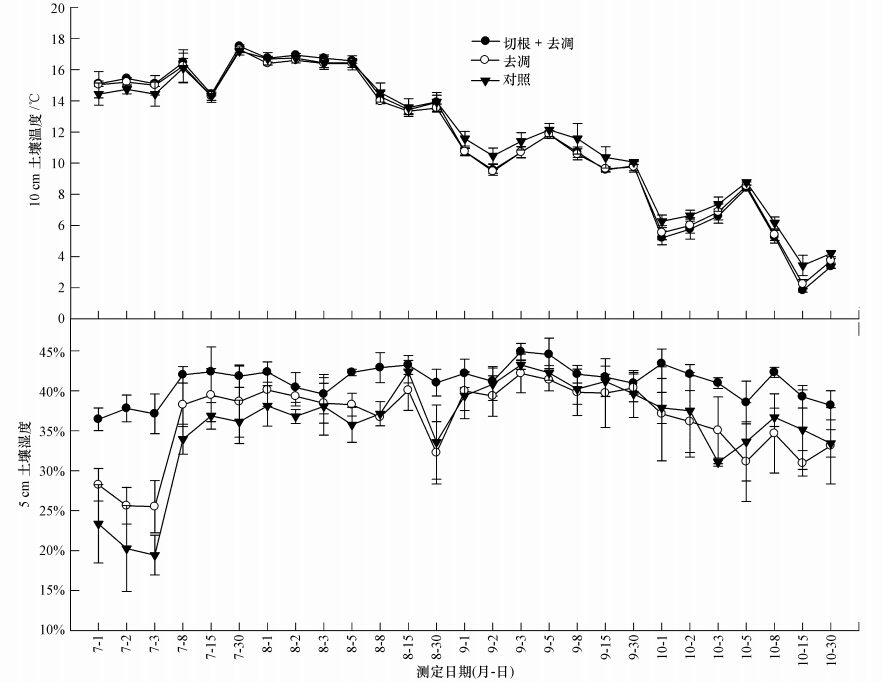 |
| 图 2 不同处理土壤温度、土壤湿度的变化趋势 Fig. 2 The change trend of soil temperature,soil moisture after removing the roots and /or litter |
研究表明,不同处理土壤呼吸速率与土壤温度均呈显著指数关系(p<0.001)(表 3),温度解释了34.1%~81.1%的土壤呼吸变异,施氮降低了每种凋落物处理的模型决定系数R2.Q10反映的是土壤呼吸速率对温度的敏感性.切根+去凋处理的不施氮和各施氮水平的土壤呼吸速率的温度敏感系数Q10值分别为 2.34、2.42、2.20和1.96,表现为低氮>不施氮>中氮>高氮;相应地,去凋处理的不施氮和各施氮水平的Q10值分别为 2.68、2.22、2.35和2.41,表现为不施氮>高氮>中氮>低氮;而对照处理的不施氮和各施氮水平Q10值分别为 2.69、2.59、2.69和2.72,表现为高氮>中氮=不施氮>低氮.
| 表3 土壤呼吸速率与10 cm土层温度的指数关系模型(Rs= aebT) Table.3 The exponential relationship between soil respiration rate and soil temperature at 10 cm depth(Rs= aebT) |
土壤呼吸速率与5 cm处土壤湿度的回归分析表明,土壤呼吸速率与土壤湿度之间呈二次曲线关系,但拟合关系并不显著(p>0.05),主要是本地区在观测期间降雨量较多,土壤较湿润,比较适合植物根系及微生物的活动,土壤水分不足以成为土壤呼吸的限制因子.
3.5 土壤呼吸与土壤温度、土壤湿度的复合关系方程分别利用线性和非线性双变量复合模型对土壤呼吸速率与土壤温度和土壤水分的复合关系进行了分析(表 4).从表 3、4可知,除了切根+去凋处理的中氮水平的非线性模型拟合效果不如单因子模型外,其它处理的非线性模型拟合效果基本均好于单因子模型,且线性模型的拟合效果基本上不如单因子模型.从非线性模型来看,土壤温度和水分能够共同解释土壤呼吸季节变化的40.1%~86.5%,表明在一定程度上非线性复合模型预测土壤呼吸的准确性更高.说明油松林土壤呼吸受土壤温度和湿度共同影响,可能是由于温度和湿度共同为植物根系活性与微生物代谢活动提供了适宜的环境,进而影响了土壤 CO2 通量的变化.
| 表4 土壤呼吸速率(Rs)与10 cm 深度土壤温度(T)及5cm深度土壤湿度(W)的复合关系方程 Table.4 Combined relationships between soil respiration and soil temperature at 10 cm depth as well soil moisture at 5 cm depth |
土壤微生物量在土壤物质转化和能量循环中起着重要的作用,氮沉降能直接或间接影响土壤微生物的活性,微生物的种群结构及其功能也将随之发生改变(Wang et al., 2008;周晓兵等,2011),进而影响植物生长和微生物呼吸,随之对土壤呼吸产生较大影响.切根+去凋中的不施氮处理的微生物生物量C、N显著高于各施氮水平(p<0.05)(图 4),且低氮处理显著高于中氮和高氮处理(p<0.05),中氮和高氮处理之间无显著差异(p>0.05),各施氮水平的平均微生物生物量N分别比不施氮降低50.8%、67.8%、66.2%,而平均微生物生物量C分别比不施氮降低44.3%、55.0%、56.3%.去凋处理中不施氮的微生物生物量C、N显著低于各施氮水平(p<0.05),且低氮处理显著低于中氮和高氮处理(p<0.05),中氮和高氮处理之间无显著差异(p>0.05);去凋处理的中氮、高氮处理的平均微生物生物量C显著高于低氮和不施氮处理(p<0.05),各施氮处理的平均微生物生物量N分别比不施氮处理高48.9%、132.9%、120.3%,而平均微生物生物量C分别比不施氮处理高23.7%、129.9%、80.6%.对照处理中高氮处理的微生物生物量C、N显著高于其他N水平(p<0.05),低氮、中氮处理的平均微生物生物量N分别比不施氮处理低16.3%、3.7%,高氮水平的平均微生物生物量N比不施氮处理高14.1%,各施氮水平的平均微生物生物量C分别比不施氮处理高27.0%、55.1%、84.3%.
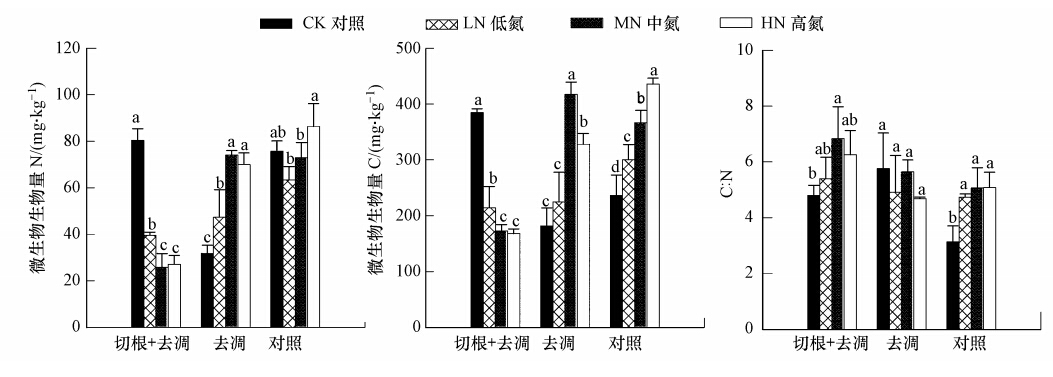 |
| 图 3 不同处理各施氮水平的土壤微生物生物量C、N及C : N Fig. 3 The microbial biomass N,microbial biomass C and C : N after nitrogen supply on forest floor with different treatments by removing the roots and /or litter |
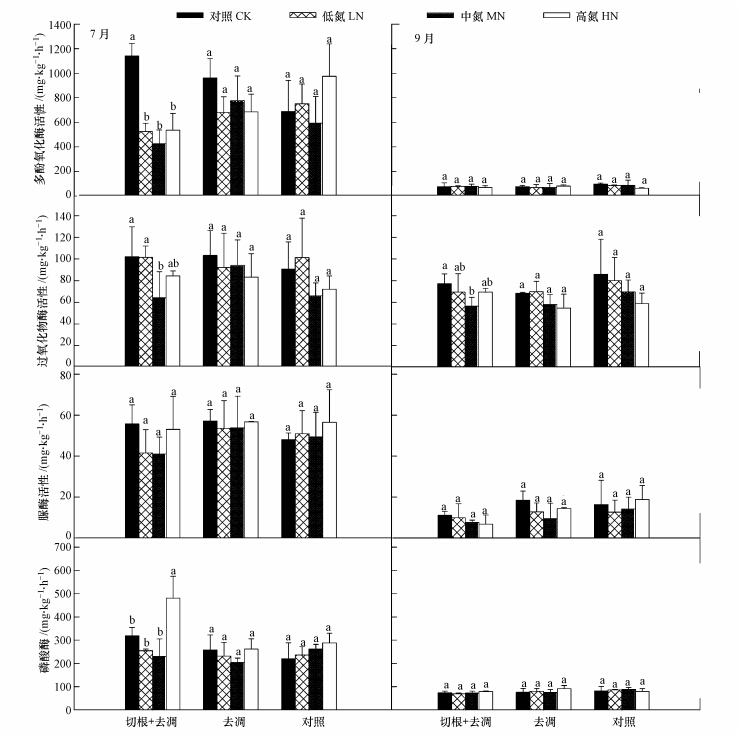 |
| 图 4 不同处理各施氮水平的土壤酶活性动态 Fig. 4 The dynamics of soil enzyme activities after nitrogen supply on forest floor with different treatments by removing the roots and /or litter |
切根+去凋处理的微生物C : N值显著高于不施氮处理,中氮与高氮、低氮处理之间无显著差异(p>0.05),不施氮与低氮、高氮处理之间无显著差异(p>0.05),不施氮和各施氮水平的微生物C : N分别为4.80、5.40、6.84、6.26.去凋处理的不同施氮水平之间的C : N无显著差异(p>0.05),不施氮和各施氮水平的微生物的C : N分别为5.76、4.91、5.64、4.69.对照处理的各施氮水平的C : N值显著高于不施氮处理(p<0.05),各施氮水平之间无显著差异(p>0.05),不施氮和各施氮水平的微生物的C : N分别为3.14、4.74、5.07、5.08.
3.7 不同处理各施氮水平的土壤酶活性土壤酶活性的决定因素主要受土壤微生物和凋落物种类的影响,也有研究认为微生物种群和土壤理化性质共同决定土壤酶活性(Frey et al., 2004).不同处理的土壤酶活性均表现为7月>9月(图 5).除7月切根+去凋的各施氮处理的多酚氧化酶活性显著低于不施氮处理(p<0.05)外,7月、9月其他处理各施氮处理之间的多酚氧化酶活性均无显著差异(p>0.05); 7月、9月切根+去凋的中氮处理的过氧化物酶活性显著低于不施氮、低氮、高氮处理(p<0.05),而7月、9月其他处理各施氮水平之间的多酚氧化酶活性均无显著差异(p>0.05);不同处理各施氮水平之间的脲酶活性无显著差异(p>0.05);除7月切根+去凋的高氮处理的磷酸酶活性值显著高于不施氮、低氮、中氮处理外(p<0.05),7月、9月其他处理各施氮水平之间的磷酸酶活性均无显著差异(p>0.05).
 |
| 图 5 抚仙湖流域非优化模式(BASE)与优化模式( OPT)的评价度比较 Fig. 5 Comparison of assessment index between BASE and OPT modes in Lake Fuxianhu Basin |
油松林土壤呼吸速率呈现一个明显的月份变化,8月初达到最高值,最低值出现在10月底,呈现一个明显的单峰趋势,这与很多研究结果相同(Bowden et al., 2004;Tu et al., 2011; Flanagan et al., 2013; Pang et al., 2013; 聂明华等,2011).施氮后不同时期呼吸速率存在差异,本实验得出不同凋落物处理下不同施氮水平的土壤呼吸速率基本都在施氮后的第1 d处在最高峰,随即下降,切根+去凋、去凋处理的土壤呼吸速率均在施氮后第3 d趋于稳定,而对照处理的土壤呼吸速率呈现一直下降趋势.原因可能是每次施氮后的初期,外源性N刺激了土壤微生物活性,提高了土壤酶活性,促进了土壤呼吸;但随着处理时间的延长,这种作用逐渐减弱,甚至消失,并且对照处理覆有凋落物缓冲了施氮对土壤呼吸的“激发效应”,使影响持续.莫江明等(2005)研究发现,在施氮后的第2 d施氮处理显著促进了季风林和马尾松林土壤对CH4的 吸收速率,与本试验结果一致.但Micks等(2004)研究发现,土壤呼吸速率在施氮后的短期内没有发生升高,原因可能是由于微生物的稳定性,除了一个特例外其他全部的土壤呼吸速率与微生物量的增加没有相关关系.从图 1可以看出,3种凋落物处理的土壤呼吸速率在7月份施氮后均呈现先下降后上升的趋势,原因是在施氮后第15、30 d的前1 d出现降雨,对土壤呼吸速率有较大影响,相关研究也证实降雨对土壤呼吸有较大影响(邓琦等,2009).去凋处理、对照处理的土壤呼吸速率均有一个明显的变化趋势,但切根+去凋处理的土壤呼吸速率变化趋势不明显,其各施氮水平的土壤呼吸速率均在施氮后第1 d高于不施氮处理;除10月份不施氮处理的土壤呼吸速率一直低于高氮处理外,其他月份均在施氮后第1 d以后,不施氮处理的土壤呼吸速率逐渐高于各施氮处理,原因可能是在施氮后第1 d外源N的输入产生“激发效应”,提高了微生物和土壤酶的活性,瞬间提高土壤呼吸速率,随着时间的延长这种作用减弱;且因为本实验是在施氮后的第3年进行的,本样地原先试验结果得出施氮已经抑制切根+去凋处理的土壤呼吸,所以会出现不施氮处理的土壤呼吸速率高于各个施氮水平的土壤呼吸速率.
4.2 氮沉降对油松林地不同凋落物处理土壤呼吸的影响从图 1 a可知,施氮在一定程度上抑制了切根+去凋处理后的土壤呼吸,即施氮抑制了矿质土壤呼吸;从图 1 b可知,施氮促进了去凋处理后的土壤呼吸,即施氮促进了矿质土壤+根的呼吸,但施氮抑制了矿质土壤呼吸,说明施氮对根呼吸的促进作用大于对矿质土壤呼吸的抑制作用,且中氮处理的促进作用最明显;从图 1c可知,施氮促进了对照处理的土壤呼吸,即促进了矿质土壤+根+凋落物的呼吸,且高氮处理的促进作用最明显,说明高氮处理对凋落物的呼吸促进作用大于中氮处理.施氮抑制了矿质土壤呼吸,这可能与施氮影响土壤微生物生物量C、N和土壤酶活性有关.氮沉降对土壤呼吸速率起促进作用的原因可能是:①施氮提高了土壤中有效氮的含量,缓解了土壤中氮缺乏,满足了植物生长需求,并且N的输入可增加凋落物量,提高土壤有机质含量和土壤微生物量及活性,有利于C被氧化成CO2(Emmett,1999);②施N增加了细根生物量,提高了根呼吸,并且根际分泌物还可提高自养型细菌的呼吸能力,进一步增加土壤CO2的排放量(涂利华等,2011);③施氮促进了植物对N的吸收,降低了凋落物中木质素的C/N比(Hobbie et al., 2004),较低C/N比的木质素易被分解,从而增加了土壤CO2排放量;④施氮改变了土壤中的C/N比,改变了微生物结构并增加了微生物的数量,从而提高了微生物的呼吸.本实验得出切根+去凋处理的微生物生物量C、N在不同处理之间有显著差异,不施氮处理的相应值显著高于其他施氮水平,并且多酚氧化酶、脲酶、过氧化物酶活性在不施氮处理中较高,高氮处理次之;去凋处理的各施氮水平的微生物生物量C、N均高于不施氮处理,中氮处理中相应值最高;对照处理各施氮水平的微生物生物量C、N基本均高于不施氮处理,高氮处理中相应值最高,可见微生物生物量C、N的变化趋势与土壤呼吸速率对氮沉降的响应一致,说明土壤微生物生物量C、N在一定程度上影响着不同处理的呼吸.这与涂利华等(2009)的研究结果相似,该研究发现在华西雨屏区苦竹林,沉降增加了微生物生物量C、N,其变化趋势与土壤总呼吸对氮沉降的响应一致,且在对照处理中土壤表层附有凋落物,N沉降提高了凋落物中的N含量或者是提高了土壤溶液中的N含量,对于分解者可用性N含量增加,这些都会促进有机质的分解,进而进一步提高土壤呼吸,这也证实了施氮较对照处理的呼吸促进最明显.
土壤呼吸速率与土壤湿度的拟合关系不显著(p>0.05),而与土壤温度的拟合关系显著(p<0.05),说明温度是温带油松林土壤呼吸的主导影响因子,且土壤呼吸与土壤温度呈显著指数关系,这与其他学者(Ruehr et al., 2010; Savage et al., 2013; 胡正华等,2010)的研究结果一致.本实验中利用线性和非线性双变量复合模型对土壤呼吸与土壤温度和土壤水分的复合关系进行了分析,发现除了切根+去凋的中氮处理外,对于其他不同处理非线性模型的拟合效果较好,模型共同解释了土壤呼吸季节变化的40.1%~86.5%,复合模型的R2值相比单因子模型均有一定程度的提高,并且对照处理非线性复合模型拟合效果最好,说明切根、去凋在一定程度上改变了土壤呼吸与土壤水热的关系.这与汪金松等(2012)的研究结果相似,该研究发现在油松人工林中土壤温度和水分的双变量模型均可以解释土壤呼吸的季节变化的49.0%~83.0%.并且施氮降低了每种凋落物处理指数关系模型(Rs=aebT)的决定系数R2,原因可能是施氮改变了土壤微生物的活性,提高了土壤微生物对土壤呼吸的影响程度,另一方面也降低了土壤温度对土壤呼吸变异的解释能力.涂莉华等(2009)在华西雨屏区所做的研究也得出相似的结论,该研究发现对照、低氮、中氮、高氮处理拟合模型(Rs=aebT)的决定系数R2的值分别为0.794、0.722、0.728、0.735,也说明施氮降低了决定系数R2.
Q10反映的是土壤呼吸速率对温度的敏感性.本实验对照处理的Q10为2.69,高于热带森林(2.1,Bekku et al., 2003)、中国亚热带森林(2.55,黄承才等,1999),全球范围众多生态系统土壤呼吸Q10值的中位值为2.4.并且切根+去凋、去凋处理的Q10明显低于对照,说明去除凋落物降低了土壤呼吸速率对温度的敏感性,这与去除凋落物以后土壤呼吸速率对外界环境变化的防御能力降低有关,这与邓琦等(2007)对我国南亚热带森林及Boone 等(1998)对哈佛森林的研究结论一致.并且对切根+去凋处理Q10值降低幅度较大,说明氮沉降降低了切根+去凋处理土壤呼吸对温度的敏感性,可能主要是由于氮沉降的增加降低了土壤微生物数量及多酚氧化酶、过氧化物酶、脲酶的活性,进而使土壤呼吸速率降低有关.施氮使去凋处理的Q10值降低,这可能与氮沉降的增加降低了多酚氧化酶、过氧化物酶、脲酶的活性进而降低土壤呼吸速率对温度的敏感性有关.李仁洪等(2010)研究发现,施氮降低了华西雨屏区慈竹林土壤呼吸对温度的敏感性,认为原因是氮沉降的增加降低了土壤微生物数量及活性,进而使土壤呼吸速率降低.施氮使对照处理的Q10值无较大变化,高氮处理的Q10值最大,说明施高氮增加了土壤呼吸对温度的敏感性,这与由于氮沉降的增加提高了土壤微生物数量和多酚氧化酶、脲酶、磷酸酶的活性,进而使土壤呼吸速率升高.而贾淑霞等(2007)认为施氮对土壤呼吸的Q10影响不大的主要原因是施氮没有改变根系组织氮含量,从而保持了较恒定的细胞呼吸.
5 结论(Conclusions)施氮在短期内促进了油松林的土壤呼吸速率,切根+去凋、去凋、对照处理均在施氮后的第1 d处在土壤呼吸速率最高峰,切根+去凋、去凋处理的土壤呼吸速率均在施氮后第3 d趋于稳定,而对照处理呈现一直下降趋势.施氮在一定程度上抑制了油松林切根+去凋处理的土壤呼吸速率,而促进了去凋处理、对照处理的土壤呼吸速率.土壤微生物生物量C、N的变化与土壤呼吸速率变化一致,土壤呼吸速率与土壤酶活性、土壤湿度的拟合关系不显著(p>0.05),而与土壤温度的拟合关系显著(p<0.05).施氮降低了切根+去凋、去凋处理的Q10,而对对照处理的Q10无明显影响.
| [1] | Amann M, Klimont Z, Winiwarter W.2012.Emissions from agriculture and their control potentials[R].TSAP Report #3-Version 1.0.Austria: International Institute for Applied Systems Analysis (ⅡASA). |
| [2] | Allison S D, Czimczik C I, Treseder K K.2008.Microbial activity and soil respiration under nitrogen addition in Alaskan boreal forest[J].Global Change Biology, 14: 1156-1168 |
| [3] | Bae K, Lee D K, Fahey T J, et al.2013.Seasonal variation of soil respiration rates in a secondary forest and agroforestry systems[J].Agroforestry Systems, 87 (1): 131-139 |
| [4] | Bekku Y S, Nakatsubo T, Kume A.2003.Effect of warming on the temperature dependence of soil respiration rate in arctic, temperate and tropical soils[J].Applied Soil Ecology, 22: 205-210 |
| [5] | Boone R D, Nadelhoffer K J, Canary J D, et al.1998.Roots exert a strong influence on the temperature sensitivity of soil respiration[J].Nature, 396(6711): 570-572 |
| [6] | Bowden R D, Davidson E, Savage K, et al.2004.Chronic nitrogen additions reduce total soil respiration and microbial respiration in temperate forest soils at the Harvard Forest[J].Forest Ecology and Management, 196: 43-56 |
| [7] | Brookes P C, Landman A, Pruden G, et al.1985.Chloroform fumigation and the release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen in soil[J].Soil Biology and Biochemistry, 17(6): 837-842 |
| [8] | Chapin F, Matson P, Mooney H.2002.Principles of Terrestrial Ecosystem Ecology[M].New York: Springer.436 |
| [9] | 陈云明, 梁一民, 程积民.2002.黄土高原林草植被建设地带性特征[J].植物生态学报, 26 (3):339-345 |
| [10] | Compton J E, Watruda L S, Porteous L, et al.2004.Response of soil microbial biomass and community composition to chronic nitrogen additions at harvard forest[J].Forest Ecology and Management, 196: 143-158 |
| [11] | 邓琦, 刘世忠, 刘菊秀, 等2007.南亚热带森林凋落物对土壤呼吸的贡献及其影响因素[J].地球科学进展, 22(9): 976-986 |
| [12] | Emmett B A.1999.The impact of nitrogen on forest soils and feedbacks on tree growth[J].Water, Air & Soil Pollution, 116: 65-74 |
| [13] | Flanagan L B, Sharp E J, Letts M G.2013.Response of plant biomass and soil respiration to experimental warming and precipitation manipulation in a Northern Great Plains grassland[J].Agricultural and Forest Meteorology, 173: 40-52 |
| [14] | Frey S D, Knorr M, Parrent J L, et al.2004.Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests[J].Forest Ecology and Management, 196: 159-171 |
| [15] | Galloway J N, Dentener F J, Capone D G, et al.2004.Nitrogen cycles: past, present, and future[J].Biogeochemistry, 70: 153-226 |
| [16] | Graefe S, Hertel D, Leuschner C.2010.N, P and K limitation of fine root growth along an elevation transect in tropical mountain forests[J].Acta Oecologica, 36: 537-542 |
| [17] | 关松荫.1986.土壤酶及其研究方法[M].北京:中国农业出版社 |
| [18] | Harrison A F, Howard P J A, Howard D M, et al.1995.Carbon storage in forest soils[J].Forestry, 68: 335-348 |
| [19] | Hobbie S E, Gough L.2004.Litter decomposition in moist acidic and non-acidic tundra with different glacial histories[J].Oecologia, 140: 113-124 |
| [20] | 胡正华, 李涵茂, 杨燕萍, 等.2010.模拟氮沉降对北亚热带落叶阔叶林土壤呼吸的影响[J].环境科学, 31(8): 1726-1732 |
| [21] | 黄承才, 葛滢, 常杰, 等.1999.中亚热带东部三种主要木本群落土壤呼吸的研究[J].生态学报, 19(3): 324-328 |
| [22] | Jia X X, Shao M A, Wei X R.2012.Responses of soil respiration to N addition, burning and clipping in temperate semiarid grassland in northern China[J].Agricultural and Forest Meteorology, 166: 32-40 |
| [23] | 贾淑霞, 王政权, 梅莉, 等.2007.施肥对落叶松和水曲柳人工林土壤呼吸的影响[J].植物生态学报, 31(3): 372-379 |
| [24] | Lee K H, Jose S.2003.Soil respiration, fine root production, and microbial biomass in cottomvood and loblolly pine plantations along a nitrogen fertilization gradient[J].Forest Ecology and Management, 185: 263-273 |
| [25] | 李仁洪, 涂利华, 胡庭兴, 等.2010.模拟氮沉降对华西雨屏区慈竹林土壤呼吸的影响[J].应用生态学报, 21(7): 1649-1655 |
| [26] | Liski J, Perruchoud D, Karjalainen T.2002.Increasing carbon stocks in the forest soils of western Europe[J].Forest Ecology and Management, 169(1/2): 159-175 |
| [27] | 雒守华, 胡庭兴, 张健, 等.2010.华西雨屏区光皮桦林土壤呼吸对模拟氮沉降的响应[J].农业环境科学学报, 29(9): 1834-1839 |
| [28] | 骆土寿, 陈步峰, 李意德, 等.2001.海南岛尖峰岭热带山地雨林土壤和凋落物呼吸研究[J].生态学报, 21(12): 2013-2017 |
| [29] | Magnani F.2007.The human footprint in the carbon cycle of temperate and boreal forests[J].Nature, 447: 848-850 |
| [30] | Maskell L C, Smart S M, Bullock J M, et al.2010.Nitrogen deposition causes widespread loss of species richness in British habitats[J].Global Change Biology, 16: 671-679 |
| [31] | Mo J M, Zhang W, Zhu W X, et al.2007a.Response of soil respiration to simulated N deposition in a disturbed and a rehabilitated tropical forest in southern China[J].Plant Soil, 296: 125-135 |
| [32] | Micks P, Aber J D, Boone R D, et al.2004.Short-term soil respiration and nitrogen immobilization response to nitrogen applications in control and nitrogen-enriched temperate forests[J].Forest Ecology and Management, 196: 57-70 |
| [33] | 莫江明, 方运霆, 徐国良, 等.2005.鼎湖山苗圃和主要森林土壤CO2排放和CH4吸收对模拟氮沉降的短期响应[J].生态学报, 25(4): 682-690 |
| [34] | 聂明华, 刘敏, 侯立军, 等.2011.长江口潮滩土壤呼吸季节变化及其影响因素[J].环境科学学报, 31(4): 824-831 |
| [35] | Pang X Y, Bao W K, Zhu B, et al.2013.Responses of soil respiration and its temperature sensitivity to thinning in a pine plantation[J].Agricultural and Forest Meteorology, 171: 57-64 |
| [36] | Ruehr N K, Knohl A, Buchmann N.2010.Environmental variables controlling soil respiration on diurnal, seasonal and annual time-scales in a mixed mountain forest in Switzerland[J].Biogeochemistry, 98: 153-170 |
| [37] | Samuelson L, Mathew R, Stokes T, et al.2009.Soil and microbial respiration in a loblolly pine plantation in response to seven years of irrigation and fertilization[J].Forest Ecology and Management, 258: 2431-2438 |
| [38] | Savage K, Davidson E A, Tang J.2013.Diel patterns of autotrophic and heterotrophic respiration among phenological stages[J].Global Change Biology, 19(4): 1151-1159 |
| [39] | Schimel D S.1995.Terrestrial ecosystems and the carbon cycle[J].Global Change Biology, 1(1): 77-91 |
| [40] | Schlesinger W H, Andrews J A.2000.Soil respiration and the global carbon cycle[J].Biogeochemistry, 48: 7-20 |
| [41] | Subke J, Hahn V, Battipaglia G, et al.2004.Feedback interactions between needle litter decomposition and rhizosphere activity[J].Oecologia, 139(4): 551-559 |
| [42] | Tu L H, Hu T X, Zhang J, et al.2011.Short-term simulated nitrogen deposition increases carbon sequestration in a Pleioblastus amarus plantation[J].Plant Soil, 340: 383-396 |
| [43] | 涂利华, 胡庭兴, 黄立华, 等.2009.华西雨屏区苦竹林土壤呼吸对模拟氮沉降的响应[J].植物生态学报, 33(4): 728-738 |
| [44] | 涂利华, 戴洪忠, 胡庭兴, 等.2011.模拟氮沉降对华西雨屏区撑绿杂交竹林土壤呼吸的影响[J].应用生态学报, 22(4): 829-836 |
| [45] | 涂利华, 胡庭兴, 张健, 等.2010.模拟氮沉降对华西雨屏区苦竹林细根特性和土壤呼吸的影响[J].应用生态学报, 21(10): 2472-2478 |
| [46] | Vance E D, Brookes P C, Jenkinson D S.1987.An extraction method for measure microbial biomass C[J].Soil Biology and Biochemistry, 19(6): 703-707 |
| [47] | 王光军, 田大伦, 闫文德, 等.2009a.马尾松林土壤呼吸对去除和添加凋落物处理的响应[J].林业科学, 45(1): 27-30 |
| [48] | 王光军, 田大伦, 闫文德, 等.2009b.改变凋落物输入对杉木人工林土壤呼吸的短期影响[J].植物生态学报, 33(4): 739-747 |
| [49] | 汪金松, 赵秀海, 张春雨, 等.2012.改变 C 源输入对油松人工林土壤呼吸的影响[J].生态学报, 32(9): 2768-2777 |
| [50] | Wang Q K, Wang S L, Liu Y X.2008.Responses to N and P fertilization in a young Eucalyptus dunnⅡ plantation: microbial properties, enzyme activities and dissolved organic matter[J].Applied Soil Ecology, 40(3): 484-490 |
| [51] | Waring R H, Running S W.1998.Forest Ecosystems: Analysis at Multiple Scales[M].CA: San Diego |
| [52] | 周晓兵, 张元明, 陶冶, 等.2011.古尔班通古特沙漠土壤酶活性和微生物量氮对模拟氮沉降的响应[J].生态学报, 31(12): 3340-3349 |
| [53] | 周小刚, 郭胜利, 车升国, 等.2012.黄土高原刺槐人工林地表凋落物对土壤呼吸的贡献[J].生态学报, 32(7): 2150-2157 |
 2014, Vol. 34
2014, Vol. 34


