2. 浙江省水环境与海洋生物资源保护重点实验室, 温州大学, 温州 325035;
3. 中国水产科学研究院东海水产研究所, 上海 200090
2. Zhejiang Provincial Key Laboratory for Subtropical Water Environment and Marine Biological Resources Protection, Wenzhou University, Wenzhou 325035;
3. East China Sea Fisheries Research Institute, Chinese Academy of Fisheries Science, Shanghai 200090
水华具有分布广、规模大和持续时间长的特点,是人类淡水资源安全利用的重要威胁,也是世界范围内的研究热点(Paerl et al., 2008; Qin et al., 2010; Paerl et al., 2011).我国由水体富营养化引起的水华问题也日趋严重,不仅滇池、太湖、巢湖等大型淡水湖泊每年夏秋季都会爆发水华;华中、华东、华南、西南等地的许多中小型湖泊、饮用水源地水库、观赏性湖泊也相继发生了不同程度的水华(汪育文等,2007; 陆开宏等,2008; 陈丽丽等,2011; 黄成等,2011;李大命等,2011; 吴阿娜等,2011).水华的发生提高了水体的浊度,从而限制了光在水体中的传递,这又会限制大型水生植物和底栖大型藻类的生存(Jeppesen et al., 2007; Scheffer et al., 1997; Scheffer,2001).水华藻类通过夜间的呼吸作用和细胞分解消耗氧气,引起水体中鱼类死亡和其它生物的损失,甚至威胁到人类安全(Watkinson et al., 2005; Garcia et al., 2006; Paerl et al., 2006).因此,水华发生对淡水生态系统的健康发展及水库水源的饮用、灌溉、水上娱乐都是一个主要威胁(Carmichael,2001; Osborne et al., 2001,2007).
研究各类型水华的形成机制,对于科学预测水华的发生,并采取相应措施减少其有害影响具有重要的生态和环境意义(孔繁翔等,2005).水华发生过程中必然会对其所在水域的浮游动物产生各种影响,而浮游动物是联系初级生产者与高级消费者的纽带,在整个水生生态系统中起到承上启下的关键作用.同时,由于浮游动物数量庞大,便于捕获及运用常规方法对样品进行分析比较,也是很多鱼类幼体的饵料,其种群结构和数量的变化对一定时期内渔业资源的变化具有先锋指示作用(Batchelder et al., 2002; Beaugrand et al., 2003).因此,某一水域浮游动物群落结构的变动必将对该区域渔业资源和生态系统的稳定性产生重大影响.而研究各类型水华生消对浮游动物的影响,尤其是对不同类群(枝角类、桡足类、轮虫类)的影响及机理,不但能够使人们了解不同类型水华的生态危害,也可为评估渔业资源的间接损失和水华消失后生态系统的恢复情况提供科学依据和数据支持.
目前,关注水华对浮游动物群落影响的研究非常有限,少数的研究发现,水体中的微囊藻毒素含量与总的浮游动物生物量呈负相关,含有高浓度微囊藻毒素的水体中,枝角类(水溞类)和哲水蚤桡足类的生物量降低而个体较小对浮游植物摄食效率较低的剑水蚤桡足类、象鼻溞及轮虫的数量却有所增加(Hansson et al., 2007; Ke et al., 2008; Deng et al., 2010; Sun et al., 2012).这意味着不同类群的浮游动物对同一种水华的耐受性存在差异,因此,同一种水华生消过程对不同浮游动物种群的发展可能会产生截然相反的结果,这需要进行更多的研究来证实.而捕食者与浮游植物的相互作用也具有种间特异性,因此,在通过受控实验研究水华生消对其摄食者的影响时要充分考虑其种内和种间变化(Wilson et al., 2007; Tillmanns et al., 2008).
颗粒直链藻(Aulacoseira granulate)隶属于硅藻门(Bacillariophyta),其在世界范围内广泛分布,是江河、湖泊和水库等各种内陆淡水系统中的常见优势种(Karim et al., 1978; Höetzel et al., 1996; Tsukada et al., 2006; Wang et al., 2009; 王超等,2012).此外,由于其对水体环境变化非常敏感,易受水温和营养盐等环境条件的影响,在富营养化水体中极易形成优势种群或发展为水华,因此,也是富营养化及污染水体的指示物种(Nogueira, 2000,Kamenir et al., 2004).鉴于颗粒直链藻在水生生态系统中的重要地位,研究其水华生消过程对桡足类种群的影响对于认识硅藻水华对浮游动物群落结构和动态的影响具有重要的生态学意义.
基于以上科学观点并鉴于室内受控实验受限于容器体积和培养条件而难以和自然条件相符,而野外调查结果又受采样时间、天气状况和鱼类摄食压力的影响.本研究以人工池为培养系统,通过在池内诱导颗粒直链藻水华形成,而后接入婆罗异剑水蚤(Apocyclops borneoensis),研究无鱼类摄食压力下颗粒直链藻水华生消对其种群动态的影响,并探讨其生态意义.
2 材料与方法(Materials and methods) 2.1 实验地点及人工池该研究所有实验均在中国水产科学研究院东海水产研究所海南琼海研究中心(基地)完成.该中心位于琼海市长坡镇,靠近海边,占地60余亩,设备齐全,建有各种型号的人工池和设备齐全的实验室.本实验选的两个养殖池为圆型的水泥池,深1.8 m,直径5.0 m,实验时池内水深80 cm.
2.2 实验材料颗粒直链藻分离自基地附近废弃的对虾养殖池,在实验室内扩大培养后作为种源,培养温度为25 ℃,光照强度为300 μmol · m-2 · s-1,光暗期比为12 h ∶ 12 h.浮游动物采用自制的90目生物网(网孔直径为160 μm)在废弃虾塘中反复拖曳收集获得,经显微镜下鉴定其主要种类为婆罗异剑水蚤,占个体数量的95%以上.婆罗异剑水蚤为剑水蚤科异剑水蚤属的动物,是广温广盐的小型桡足类,广泛分布于热带水域,是营养价值很高的饵料生物(张其永等,1988; Farhadian,2006; Farhadian et al., 2007).
2.3 实验设计向冲洗干净的水泥池中注入淡水,注水深度为80 cm,水体按BG-11培养基配方加富后用250 μg · L-1 的次氯酸钠(NaClO)消毒12 h,然后以25~30 μg · L-1 硫代硫酸钠(Na2S2O4)中和.曝气1 d后接入5.0 L经扩大培养的颗粒直链藻液,待池中水体呈现肉眼可见的淡黄色时开始于每天傍晚(18:00)取样监测叶绿素浓度的变化,并在叶绿素浓度达到100 μg · L-1时接入浮游动物(初始丰度为56 ind · L-1),并每天监测其数量变化,直至水华消退(图 1).而在即将接入浮游动物前,每池先取200 L藻液至一个白色塑料桶中,并将其放在水泥池旁边继续通气培养作为对照组.
 |
| 图 1 颗粒直链藻水华在人工池中的诱发过程(a.接入藻种前,b.水华爆发前,c.水华爆发后) Fig. 1 The development process of A. granulate bloom induced in artificial ponds.(a.the state before the algae inoculation,b. the state prior to algal bloom,c.the state after algal bloom) |
每天下午18:00用采水器(2.5 L)在距离人工池底部30 cm处从每个培养池中取水样,将其中1.0 L转入容积为1 L的玻璃烧杯中,其余水样再倒回水泥池中,每个水泥池取水样两次.把烧杯中的水样以每次约100 mL的量转入培养皿中,在日光灯下靠目测对浮游动物计数(Ma et al., 2010),并根据浮游动物的数量和水样体积计算浮游动物丰度(ind · L-1).统计后把浮游动物和水样再倒回水泥池中,这样两个水泥池共取4个水样,结果以平均值±方差表示.
2.5 叶绿素a(Chl a)含量的测定为了监测水华生消过程中叶绿素浓度的变化,首先把去除浮游动物后的100 mL 藻液经Whatman GF/F玻璃纤维滤膜过滤(Φ 25 mm),然后用100%的甲醇在4 ℃下过夜提取(Porra,2002),经离心(5000 g,5 min)后,取上清液用分光光度计(Shimadzu,UV 2501-PC)测定其吸收光谱,并根据文献(Porra,2002)提供的叶绿素a含量(μg · L-1)计算公式([Chl a] = 16.29×E665.2-8.54×E652.0,其中,E665.2和E652.0分别为上清液在665.2 nm和652.0 nm处的光吸收值)计算水体中的叶绿素a浓度.每次从每个人工池中取两个水样用于叶绿素a浓度测定,结果以平均值±方差表示.
3 结果(Results) 3.1 实验期间池中水体温度的变化虽然实验安排在2010年冬季进行,但由于该中心位于热带区域,加之晴天居多,所以实验期间池中水体的温度基本在20 ℃左右,早(8:00)、中(13:00)、晚(18:00)的温度波动范围分别为17.6~22.9、 22.1~27.6、21.0~26.0 ℃,而全天的最大温差为4.9 ℃(图 2).
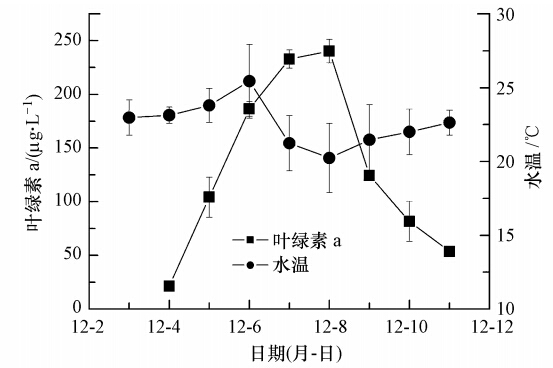 |
| 图 2 颗粒直链藻水华生消过程中日平均水温与水体中叶绿素a浓度的变化 Fig. 2 Changes of daily average water temperature and chlorophyll a concentration during the process of A. granulate bloom induced in artificial ponds |
颗粒直链藻在接入人工池后迅速发展为水华,水体颜色由浅黄色变为深褐色(图 1).叶绿素a浓度仅经过3 d就从初始检测时的(21.24± 0.76)μg · L-1升高到(232.92± 8.38)μg · L-1,增加了近10倍(图 2).而再经历1 d短暂的增加后水华又迅速消退,水体颜色变浅,叶绿素a浓度也从最高时的(240.34±11.00)μg · L-1在1 d内快速下降到(124.41±3.17)μg · L-1(图 2).此后水华进一步消退,水体颜色也由褐色重新变为浅黄色,并且伴随着浮游植物细胞解体,水体表面有大量的白色泡沫出现.而叶绿素浓度在2 d后也降低到(53.63±0.47)μg · L-1(图 2).
3.3 婆罗异剑水蚤摄食对颗粒直链藻水华生消进程的影响待池中水体的叶绿素a浓度增加到(104.15±18.63)μg · L-1时接入以婆罗异剑水蚤为主的浮游动物. 尽管其在浮游植物细胞浓度已经很高的情况下已不能抑制水华的发生,但其摄食作用对浮游植物细胞浓度的增加仍表现出明显的抑制效应并使其消退加速(图 3).添加浮游动物组水体的叶绿素a比对照组(未添加浮游动物)低18.62~26.08 μg · L-1,平均为21.24 μg · L-1,且差异显著(p<0.05).
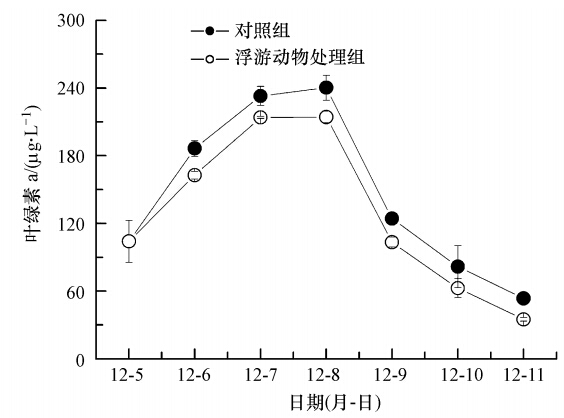 |
| 图 3 颗粒直链藻水华生消中婆罗异剑水蚤摄食对水体中叶绿素a浓度的影响 Fig. 3 Effects of A. borneoensis′ predation on chlorophyll a concentration in waters during the process of A. granulate bloom induced in artificial ponds |
由图 4可知,在转入已形成颗粒直链藻水华的水体后,婆罗异剑水蚤的丰度在2 d后开始有所增加,并且这种增长趋势一直持续到水华消退.经一周时间其丰度从更接入时的(56.50±4.32)ind · L-1上升到(142.11±6.35)ind · L-1,增加了151.58%.在实验结束后,将所有浮游动物都收集起来,发现其生物量从初接入时的25.01 g增加到68.76 g,增加了174.9%,与按丰度统计的结果基本一致(图 5).
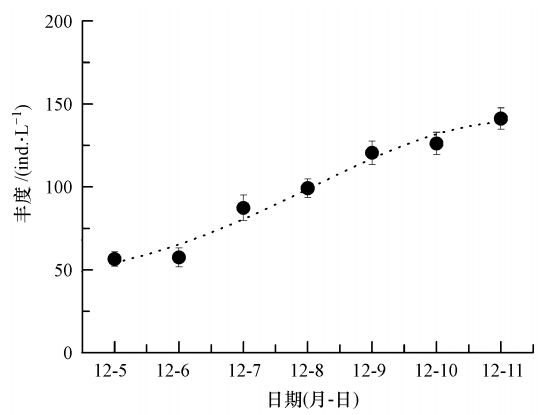 |
| 图 4 桡足类婆罗异剑水蚤丰度随颗粒直链藻水华生消过程的变化 Fig. 4 Changes in abundance of copepod A. borneoensis during the process of A. granulate bloom induced in artificial ponds |
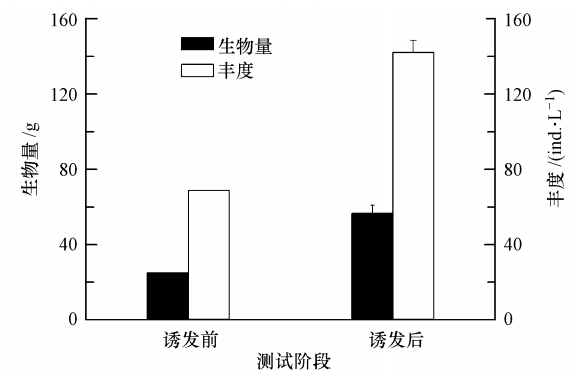 |
| 图 5 颗粒直链藻水华人工池诱发前后对婆罗异剑水蚤丰度和总生物量变化 Fig. 5 Abundance and total biomass of copepod Apocyclops borneoensis inoculated and harvested before and after the Aulacoseira granulate bloom |
作为滤食性的小型桡足类,婆罗异剑水蚤在颗粒直链藻水华发生过程尽管其摄食没能对水华的发生起到完全的控制作用,但却显著降低了水华物种的细胞浓度.此外,婆罗异剑水蚤的种群数量并没有因为颗粒直链藻水华的爆发而降低,反而出现了稳步提高,这也保证了其能在水华爆发过程中对颗粒直链藻保持持续的摄食压力,进而加速其水华消亡过程.
在淡水生态系统中,蓝藻水华对大型枝角类(水溞)浮游动物的负面效应已得到很多研究的确认(Demott et al., 1991; Rohrlack et al., 2001,2005,Gustafsson et al., 2005; Tillmanns et al., 2008; Guo et al., 2011).此外,很多种类的蓝藻及其所产的藻毒素也能抑制桡足类和轮虫等浮游动物类群的摄食活动(Sarnelle,1993; Paerl et al., 2001; Reinikainen et al., 2002).小型桡足类主要摄食浮游植物,在水华生消进程中起到关键作用(李超伦等,2000; 孙军等,2004).
颗粒直链藻属于硅藻,尽管有些研究认为对浮游动物饵料而言,其可能和其它硅藻一样存在营养缺陷,但其并不产生毒素(Klein Breteler et al., 2005).此外,浮游动物对水华物种还存在选择性摄食(孙军等,2007),这种选择性摄食可能导致其偏好饵料被大量摄食,而遭排斥的物种将获得更多的生存机会,进而影响水华进程,使得水华物种向不被摄食的物种方向演替.在本研究中,婆罗异剑水蚤在任何阶段都对颗粒直链藻水华维持了较高的摄食压力(图 3).此外,即使在藻体浓度最大时,婆罗异剑水蚤种群数量也出现了平稳的增长(图 4),这除了实验中向水体通入空气抵消了水华发生可能引起的缺氧外,更可能是由于与甲藻和蓝藻相比,颗粒直链藻毒性较弱的缘故.
浮游动物是控制水华发生的重要因素(Storm,2002),通常情况下浮游动物的摄食和浮游植物的生长是平衡的,但一旦环境发生一定变化,就会有一些物种逃出浮游动物的摄食控制,迅速生长而发生水华,即水华的Loop-Hole理论(Irigoien et al., 2005).在浮游动物摄食活跃的水域,浮游植物的生长能受到良好的控制; 在摄食较弱的水体中,浮游植物即使比生长率较低,仍有爆发水华的可能; 而一旦水华爆发,浮游动物的摄食行为对浮游植物群落的控制作用则大幅减弱(孙军等,2009).在本研究中,为了考察硅藻水华生消对浮游动物种群动态的影响,我们在硅藻水华开始爆发时(叶绿素浓度达到104.15 μg · L-1)才接入浮游动物,因此,尽管其一直保持较高的摄食压力,但却未能消除或延缓水华的发生过程(图 2).但如此高的摄食压力如果在水华孕育的早期(浮游植物细胞密度较低时)就存在或者期间因为天气等原因浮游植物没有繁殖的如此迅速,则完全有可能延缓甚至是阻止水华的发生.在实验期间,婆罗异剑水蚤的数量增加了约1.5倍,在颗粒直链藻水华发生过程中其数量的持续增加维持了较高的摄食压力(图 3,图 4),也有利于水华消退后水生生态系统的尽快恢复.此外,颗粒直链藻水华在一天中急剧消退可能与营养盐耗竭有关,在室内培养时也经常出现该现象,在细胞浓度很大时,如果不及时添加新的培养基,细胞就会迅速死亡,藻液颜色也急剧改变.因此,我们有理由相信营养盐缺乏对藻体的胁迫作用累积到一定程度就会引起细胞死亡,导致水华急剧消退(图 3).而不含婆罗异剑水蚤的对照组和含有婆罗异剑水蚤的处理组颗粒直链藻水华发展趋势一致(图 3),则可能是由于婆罗异剑水蚤的摄食作用相对于颗粒直链藻的内禀增长率还是比较弱的,因此,在水华发爆发时就很难再起到较强的抑制作用了.
本研究利用较大水体的土池实验研究了富营养化水体中颗粒直链藻水华的生消过程,并证实了高浓度的颗粒直链藻水华并不会影响婆罗异剑水蚤的生长和繁殖,反而由于水华期间为后者提供了充足饵料而对其种群扩大起到促进作用.当然如果水体搅动不足,水华发生产生的低氧环境可能会对浮游动物产生一定的负面影响,但应该不是很严重,因为桡足类浮游动物通过合成血红蛋白能够耐受0.5 mg · L-1(以O2计)的低氧环境(Weider et al., 1985; Sell,1998).该研究排除了来自其它动物的摄食压力对婆罗异剑水蚤种群动态的影响,这也为其种群数量的持续增加创造了条件.而关于其种群变化与毒性较强的甲藻和蓝藻水华生消过程的交互作用还需要做进一步的研究.
5 结论(Conclusions)在排除鱼类摄食压力条件下,硅藻颗粒直链水华的发生并不会对小型桡足类婆罗异剑水蚤的生长和繁殖产生负面影响,反而会对其种群的扩大具有促进作用.而要想把该结论扩展到整个硅藻水华对所有浮游动物种群的影响,无疑还需要更多的研究论证.
致谢: 本实验在中国水产科学研究院东海水产研究所海南省琼海养殖基地完成,在此期间得到基地领导夏连军研究员、杨庆华师傅等工作人员的支持和帮助;东海所的孙鲁峰在样品鉴定及实验过程中也给予了大力帮助; 两位审稿专家的建设性意见也对本文的提高起到了巨大的推动作用,在此一并谨致谢忱!
| [1] | Batchelder H P, Barth J A, Kosro P M, et al.2002.The GLOBEC northeast Pacific California current system program[J].Oceanography, 15(2): 36-47 |
| [2] | Beaugrand G, Brander K M, Lindley J, A et al.2003.Plankton effect on cod recruitement in the North Sea[J].Nature, 426: 661-664 |
| [3] | Carmichael W W, 2001.Health effects of toxin producing cyanobacteria: the cyanoHABs[J].Human Ecology Risk Assessment, 7: 1393-1407 |
| [4] | 陈丽丽, 李秋华, 滕明德, 等, 2011.两座高原水库蓝藻群落结构与微囊藻毒素的分布对比研究[J].生态环境学报, 20(6/7): 1068-1074 |
| [5] | DeMott W R, Zhang Q, Carmichael W W.1991.Effects of toxic cyanobacteria and purified toxins on the survival and feeding of a copepod and three species of Daphnia[J].Limnology and Oceanography, 36: 1346-1357 |
| [6] | Deng D, Zhang S, Li Y, et al.2010.Effects of Microcystis aeruginosa on population dynamics and sexual reproduction in two Daphnia species[J].Journal of Plankton Research, 32: 1385-1392 |
| [7] | Farhadian O.2006.Culture of planktonic cyclopoid Apocyclops dengizicus (Lepeshkin, 1990) and its suitability as live feed for giant black tiger shrimp, Penaeus monodon Fabricius (1978), postlarvae[D].Serdang: University of Putra Malaysia |
| [8] | Farhadian O, Yusoff F M, Arshad A.2007.Ingestion rate of postlarvae Penaeus monodon fed Apocyclops dengizicus and Artemia[J].Aquaculture, 269: 265-270 |
| [9] | Garcia R, Johnstone R W.2006.Effects of Lyngbya majuscule (Cyanophycea) blooms on sediment nutrients and meiofaunal assemblages in seagrass beds in Moreton Bay, Australia[J].Marine and Freshwater Research, 57: 155-165 |
| [10] | Guo N, Xie P.2011.A study on the effects of food quantity and quality on glutathione S-transferase (GST) activity and growth rate parameters of Daphnia carinata varying in age[J].Aquatic Ecology, 45: 63-73 |
| [11] | Gustafsson S, Rengefors K, Hansson L A.2005.Increased consumer fitness following transfer of toxin tolerance to offspring via maternal effects[J].Ecology, 86: 2561-2567 |
| [12] | Hansson L A, Gustafsson S, Rengefors K, et al.2007.Cyanobacterial chemical warfare affects zooplankton composition[J].Freshwater Biology, 52: 1290-1301 |
| [13] | Höetzel G, Croome R.1996.Population dynamics of Aulaseira granulate (Ehren.) SIMONSON (Bacillariophyceae, Centrales), the dominant alga in the Murray River, Australia[J].Archiv für Hydrobiologia, 136: 191-215 |
| [14] | 黄成, 侯伟, 顾继光, 等, 2011.珠江三角洲城市周边典型中小型水库富营养化与蓝藻种群动态[J].应用与环境生物学报, 17(3): 295-302 |
| [15] | Irigoien X, Flynn K J, Harries R P.2005.Phytoplankton blooms: a "loophole" in microzooplankton grazing impact[J].Journal of Plankton Research, 27(4): 313-321 |
| [16] | Jeppesen E, Søndergaard M, Meerhoff M, et al.2007.Shallow lake restoration by nutrient loading reductiondsome recent findings and challenges ahead[J].Hydrobiologia, 584: 239-252 |
| [17] | Kamenir Y, Dubinsky Z, Zohary T.2004.Phytoplankton size structure stability in a meso-eutrophic subtropical lake[J].Hydrobiologia, 520: 89-104 |
| [18] | Karim A G A, Saeed O M.1978.Studies on the freshwater algae of the Sudan Ⅲ, vertical distribution of Melosira granulate (Ehren.) ralfs.In the White Nile, with reference to certain environmental variables[J].Hydrobiologia, 57: 73-79 |
| [19] | Ke Z, Xie P, Guo L.2008.Controlling factors of spring-summer phytoplankton succession in Lake Taihu (Meiliang Bay, China)[J].Hydrobiologia, 607:41-49 |
| [20] | Kleim Breteler W C M, Schogt N, Rampen S.2005.Effect of diatom nutrient limitation on copepod development: role of essential lipids[J].Marine Ecology Progress Series, 291: 125-133 |
| [21] | 孔繁翔, 高光.2005.大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J].生态学报, 25(3): 589-595 |
| [22] | 李超伦, 王荣.2000.莱州湾夏季浮游桡足类的摄食研究[J].海洋与湖沼, 28(6): 579-587 |
| [23] | 李大命, 孔繁翔, 张民, 等, 2011.太湖和巢湖夏季蓝藻水华期间产毒微囊藻和非产毒微囊藻种群丰度的空间分布[J].应用与环境生物学报, 7(4): 480-485 |
| [24] | 陆开宏, 朱津永, 王扬才, 等, 2008.湖南镇水库浮游生物及其影响因子的典范对应分析[J].中国水产科学, 15(6): 950-960 |
| [25] | Ma Z, Li W, Gao K.2010.Horizontal migration of Acatia pacifica Steuer (copepoda) in response to UV-radiation[J].Journal of Photochemistry and Photobiology (B: Biology), 101: 233-237 |
| [26] | Mohamed Z A.2001.Accumulation of cyanobacterial hepatotoxins by Daphnia in some Egyptian irrigation canals[J].Ecotoxicology and Environmental Safety, 50: 4-8 |
| [27] | Nogueira M G.2000.Phytoplankton composition, dominance and abundance as indicators of environmental compartmentalization in Jurumirim Reservoir (Paranapanema River), So Paulo, Brazil[J].Hydrobiologia, 431: 115-128 |
| [28] | Osborne N J, Shaw G R, Webb P M.2007.Health effects of recreational exposure to Moreton Bay, Australia waters during a Lyngbya majuscula bloom[J].Environment International, 33: 309-314 |
| [29] | Osborne N J T, Webb P M, Shaw G R.2001.The toxins of Lyngbya majuscula and their human and ecological health effects[J].Environment International, 27: 381-392 |
| [30] | Paerl H W, Fulton R S, Moisander P H, et al.2001.Harmful freshwater algal blooms, with an emphasis on cyanobacteria[J].The Scientific World, 1: 76-113 |
| [31] | Paerl H W.2008.Nutrient and other environmental controls of harmful cyanobacterial blooms along the freshwater-marine continuum[J].Advances in Experimental Medicine and Biology, 619: 216-241 |
| [32] | Paerl H W, Fulton Ⅲ R S.2006.Ecology of Harmful Cyanobacteria//Graneli E, Turner J, Eds.Ecology of Harmful Marine Algae[M].Berlin:Springer-Verlag.95-107 |
| [33] | Paerl H W, Hai X, McCarthy M J, et al.2011.Controlling harmful cyanobacterial blooms in a hyper-eutrophic lake (Lake Taihu, China): the need for a dual nutrient (N & P) management strategy[J].Water Research, 45: 1973-1983 |
| [34] | Porra R J.2002.The chequered history of the development and use of simultaneous equations for the determination of chlorophylls a and b[J].Photosynthesis Research, 73: 149-156 |
| [35] | Qin B, Zhu G, Gao G, et al.2010.A drinking water crisis in Lake Taihu, China: linkage to climatic variability and lake management[J].Environmental Management, 45: 105-112 |
| [36] | Reinikainen M, Lindvall F, Meriluoto J A O, et al.2002.Effects of dissolved cyanobacterial toxins on the survival and egg hatching of estuarine calanoid copepods[J].Marine Biology, 140: 577-583 |
| [37] | Rohrlack T, Christoffersen K, Dittmann E, et al.2005.Ingestion of microcystins by Daphnia: Intestinal uptake and toxic effects[J].Limnology and Oceanography, 50: 440-448 |
| [38] | Rohrlack T, Dittmann E, Börner T, et al.2001.Effects of cell-bound microcystins on survival and feeding of Daphnia spp[J].Applied Environmental Microbiology, 67: 3523-3529 |
| [39] | Sarnelle O.1993.Herbivore effects on phytoplankton succession in a Eutrophic lake[J].Ecological Monographs, 63: 129-149 |
| [40] | Scheffer M, Rinaldi S, Gragnani A, et al.1997.On the dominance of filamentous cyanobacteria in shallow, turbid lakes[J].Ecology, 78: 272-282 |
| [41] | Scheffer M, Straile D, van Nes E H, et al.2001.Climatic warming causes regime shifts in lake food webs[J].Limnology and Oceanography, 46: 1780-1783 |
| [42] | Sell A F.1998.Adaptation to oxygen deficiency: contrasting patterns of haemoglobin synthesis in two coexisting Daphnia species[J].Comparative Biochemistry and Physiology, part A, 120: 119-125 |
| [43] | Storm S.2002.Novel interactions between phytoplankton and microzooplankton: their influence on the coupling between growth and grazing rates in the sea[J].Hydrobiologia, 480: 41-54 |
| [44] | 孙军, 刘东艳, 王宗灵, 等.2004.浮游动物摄食在赤潮生消过程中的作用[J].生态学报, 24(7): 1514-1522 |
| [45] | 孙军, 宋书群, 徐兆礼, 等.2007.东海米氏凯伦藻水华中中华哲水蚤的选择性摄食[J].海洋与湖沼, 38(6): 536-541 |
| [46] | 孙军, 宋书群.2009.东海春季水华期浮游植物生长与微型浮游动物摄食[J].生态学报, 29(12): 6429-6438 |
| [47] | Sun X, Tao M, Qin B, et al.2012.Large-scale field evidence on the enhancement of small-sized cladocerans by Microcystis blooms in Lake Taihu, China[J].Journal of Plankton Research, 34: 853-863 |
| [48] | Tillmanns A R, Wilson A E, Pick F R, et al.2008.Metaanalysis of cyanobacterial effects on zooplankton population growth rate: species specific responses[J].Fundamental and Applied Limnology, 171: 285-295 |
| [49] | Tsukada H, Tsujimura S, Nakahara H.2006.Seasonal succession of phytoplankton in Lake Yogo over 2 year: effect of artificial manipulation[J].Limnology, 7: 3-14 |
| [50] | Wang C, Li X, Lai Z, et al.2009.Seasonal variations of Aulacoseira granulate population abundance in the Pearl River Estuary[J].Estuarine, Costal and Shelf Science, 85: 585-592 |
| [51] | 王超, 赖子尼, 李跃飞, 等.2012.西江颗粒直链藻种群特征[J].生态学报, 32(15): 4793-4802 |
| [52] | 汪育文, 李建宏, 吴敏, 等.2007.南京玄武湖微囊藻水华种类组成的研究[J].环境科学, 28(10): 2187-2191 |
| [53] | Watkinson A J, O'Neil J M, Dennison W C.2005.Ecophysiology of the marine cyanobacterium Lyngbya majuscule (Oscillatoriaceae) in Moreton Bay, Australia[J].Harmful Algae, 4: 697-715 |
| [54] | Weider L J, Lampert W.1985.Differential response of Daphnia genotypes to oxygen stress: respiration rates, hemoglobin content and low-oxygen tolerance[J].Oecologia, 65: 487-491 |
| [55] | Wilson A E, Hay M E.2007.A direct test of cyanobacterial chemical defense: variable effects of microcystin-treated food on two Daphnia pulicaria clones[J].Limnology and Oceanography, 52: 1467-1479 |
| [56] | 吴阿娜, 朱梦杰, 汤琳, 等.2011.淀山湖蓝藻水华高发期叶绿素 a 动态及相关环境因子分析[J].湖泊科学, 23(1): 67-72 |
| [57] | 张其永, 吴慧端.1988.婆罗异剑水蚤的培养试验[J].水产科学, 7(1): 9-11 |
 2014, Vol. 34
2014, Vol. 34


