2. 南开大学环境污染过程与基准教育部重点实验室, 天津市城市生态环境修复与防治重点实验室, 南开大学环境科学与工程学院, 天津 300071;
3. 保定市环境工程评估中心, 保定 071051
2. Key Laboratory of Processes and Environmental Criteria, Ministry of Education, Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300071;
3. Environmental Engineering Assessment Center in Baoding City, Baoding 071051
水体沉积物为许多底栖生物提供栖息场所,是水生生态系统的重要组成部分(黄钥,吴群河,2003).研究表明,沉积物中污染物浓度通常是水溶液中的数百倍甚至数十万倍(Salomons et al., 1995; 刘清风等,2005; 张鑫等,2004).在适当的条件下,沉积物中的污染物会再次释放到水体中,形成二次污染(Frstner,1987).重金属作为沉积物中的一类主要污染物,具有毒性大、难降解、易被生物富集等特性,能经过食物链传递最后影响生态系统和人体健康.沉积物中重金属的毒性不仅取决于重金属的总量,更与沉积物中的赋存形态有关(郭鹏然等,2010; 刘峰等,2009).Toro和Allen等认为水体沉积物中重金属的重要结合相是酸可挥发性硫化物(AVS)、颗粒有机碳和铁与锰的羟氧化物(Di Toro,1992a; Allen,1993).在厌氧和缺氧的沉积环境中,AVS是控制沉积物重金属生物有效性的关键形态,也决定了沉积物重金属的毒性大小(Di Toro et al., 2001; Steven et al., 2005).
目前关于水相中重金属对水生生物毒性效应的研究较多,而有关淡水沉积物中重金属毒性与生物有效性的研究较少.国内有以大型蚤为受试生物,通过测定其体内的金属硫蛋白和超氧化物歧化酶来研究重金属Cd和Zn的联合作用(张融等,2008);范文宏等也以大型蚤研究了水体-沉积物共存体系中Cd的毒性(范文宏等,2009).而赵艳民等以泥鳅死亡率、血液红细胞数量等指标考察了沉积物中Cd的毒性效应(赵艳民等,2011).
本研究以淡水单孔水丝蚓和伸展摇蚊幼虫作为受试生物,它们都是典型的底栖生物物种,被广泛应用在生物毒性实验中(付荣恕等,2008; 曾毅等,2012).摇蚊幼虫还是美国环保总局(EPA)推荐的生物毒性测试物种.通过对沉积物进行Cu、Cd、Ni、Pb、Zn等5种重金属染毒,分析沉积物中重金属对水丝蚓和摇蚊幼虫的毒性效应,探讨沉积物中酸可挥发性硫化物(AVS)、同时可提取金属(SEM)与毒性效应之间的关系.研究结果有助于了解沉积物重金属对底栖生物的毒害效应,为建立基于生物毒性的沉积物质量基准提供有效数据.
2 材料与方法(Materials and methods) 2.1 沉积物的准备欧洲环境毒理化学学会认为生物暴露试验是评价沉积物中重金属毒性的唯一可靠途径(赵艳民等,2011).由于难以获得大量重金属本底值较低的天然沉积物,本研究按照Pasteris等推荐的方法(Pasteris et al., 2003),采用洁净土壤模拟沉积物进行加标染毒.从天津市郊区农田采集洁净土壤,经自然风干后,过40目筛以去除粗颗粒,将所得土壤按1 ∶ 1的体积比与经曝气去氯的自来水混合并搅拌均匀,所得泥浆静置一周,获得与自然沉积物状态相似的混合物质,加标染毒前弃去上覆水.
所用土壤的重金属浓度值(测定结果见表 1)与国家标准进行比较,Cr、Ni、Cu、Zn、Hg、Pb的背景值达到我国土壤环境质量标准(GB 15618—1995)的一级标准,基本为自然背景水平,而Cd和As的浓度值高于一级标准,低于二级标准,基本不会对生物造成毒害作用.
| 表 1 实验用土壤中重金属含量(以干重计) Table 1 The original concentrations of heavy metals in the soil mg · kg-1 |
使用分析纯的重金属盐试剂,用去离子水配制金属离子浓度为1000 mg · L-1的标准储备液.在250 mL的烧杯中放入平衡好的洁净沉积物(约含干沉积物30 g),加入一定体积的重金属储备液,按1 ∶ 4的体积比在烧杯中加入上覆水进行混合,配制成含有不同浓度梯度的染毒沉积物,具体染毒浓度见表 2.用干净的小木铲搅拌1 h使混合均匀,然后静止14 d.期间每隔3 d对加标沉积物充分搅拌1次,对照组沉积物除不加重金属储备液外按相同方式进行处理.
| 表 2 沉积物中重金属的染毒浓度(以干重计) Table 2 The concentrations of heavy metals in sediments |
淡水单孔水丝蚓和伸展摇蚊幼虫均在实验室长期培养驯化.本研究挑选健康受试生物用于毒性实验.驯养及生物实验用水为经48 h 曝气除氯处理的自来水,pH 7.80~8.30,DO > 6 mg · L-1,电导率 900~1100 μS · cm-1,水温(22.4±0.3)℃.
2.3.2 毒性试验选择体长3~4 cm左右、环带明显且大小一致的健康成年水丝蚓,将它们放入装有清水的培养皿中,进行24 h清肠.清肠后仍然健康的水丝蚓方可用于正式实验.根据美国EPA底栖生物标准实验方法(Liber et al., 2011;Mehler et al., 2011; Anderson et al., 2012)进行21 d毒性试验.在每个烧杯中放入10只水丝蚓,每个浓度组设置5个平行.实验过程中轻微曝气,实验温度为(23±1)℃,光照比16h ∶ 8h,每周进行1次喂食.
根据美国EPA底栖生物标准实验方法(EPA,2000;OECD,2004),使用二龄摇蚊幼虫作为受试生物,24 h清肠后进行14 d毒性试验.在每个烧杯中放入10只摇蚊幼虫,每个浓度设置5个平行.实验条件基本同水丝蚓,每隔3 d喂食1次.及时观察记录受试生物的活动情况、中毒症状和死亡情况等,用针刺激受试生物个体,无反应的视作死亡.试验结束过筛后计算死亡个体.
2.4 AVS、SEM测定采用美国EPA推荐的吹气-吸收-比色方法测定沉积物中的AVS(雷琳,雷志丹,2009;孟妍等,2012).在氮气保护的环境中,称取3~5 g湿沉积物放于反应瓶中,与1 mol · L-1盐酸溶液反应40 min.所生成硫化氢气体随高纯氮气转移到吸收液(碱性醋酸锌-醋酸钠溶液)中,然后用亚甲基蓝比色法测定其中的硫化物含量.
将提取完AVS剩下的泥水混合物离心,取上清液;往剩余沉积物中加入1 mL盐酸(1 ∶ 1)清洗,离心,再取上清液;用蒸馏水清洗两遍后离心;将离心所得溶液混合并过0.45 μm膜,然后用ICP-MS测定其中重金属含量,即为SEM.将离心后的沉积物放入烘箱中烘干,称重,即为样品干重.
2.5 数据处理试验中所有数据均采用Excel 2007进行处理,对平均数做Pearson相关性分析,运用Origin 8.5作图.平行样中SEM的相对标准偏差均在10%以内.
3 结果与讨论(Results and discussion) 3.1 沉积物中重金属对水丝蚓的21 d毒性效应在实验过程中,上覆水pH值在6.98~7.87之间,DO值在3.4~4.9 mg · L-1之间.对照组的平均存活率为100%,其结果符合沉积物底栖生物实验标准.分别以水丝蚓的死亡率和自断率为毒性终点,实验结束后过筛计算死亡个数,失踪的个体按死亡计数.自断率为发生烂尾、尾部断裂的个体之和.
水丝蚓对5种重金属的毒性反应类似,当沉积物中重金属浓度较高时,水丝蚓出现急剧身体扭动且不钻入沉积物中.随着暴露时间的延长,水丝蚓身体弯曲抱团,对外界的刺激反应逐渐变得迟缓,最终失去逃避能力,身体由红变白,产生自断或糜烂直至死亡.当重金属浓度降低时,水丝蚓的身体扭动反应减弱并有不同程度的延后,部分或全部水丝蚓钻入沉积物中.
沉积物中重金属(以干重计)对水丝蚓21 d毒性效应结果如图 1所示.5种重金属中Cd对水丝蚓的毒性效应最强.水丝蚓放入高浓度沉积物后立即开始剧烈扭动,在浓度25 mg · kg-1出现自断现象,在50 mg · kg-1出现个体死亡;而在浓度400 mg · kg-1的沉积物中死亡率达70%,自断率达88%.水丝蚓的死亡率和自断率均随Cd浓度增加而增大,与浓度均呈显著正相关(p<0.01).沉积物中Cu和Ni也会使水丝蚓产生身体自断和个体死亡,但其毒性效应略低于Cd.水丝蚓对沉积物中Pb和Zn的中毒症状较轻,没有发现身体自断现象,在较高浓度下会出现死亡.根据概率单位法计算,水丝蚓21 d半数致死浓度(LC50)和50%身体自断效应浓度(EC50)结果见表 3.
 |
| 图 1 水丝蚓的毒性效应与沉积物中重金属浓度的关系 Fig. 1 Relationship between the toxic effects of Monopylephorous limosus and the concentrations of heavy metals in sediments |
| 表 3 沉积物中重金属对水丝蚓21 d LC50和EC50值 Table 3 The LC50 and EC50 values of heavy metals in sediments to Monopylephorous limosus |
根据水丝蚓的21 d LC50值可知,5种金属对水丝蚓的毒性大小为Cd>Ni>Cu>Pb>Zn.本研究得出沉积物中Cd对水丝蚓21d LC50为281 mg · kg-1.有文献报道,当沉积物中Cd的浓度高于60 mg · kg-1(8 d暴露实验)时,水丝蚓(Limnodrilus udekemianus)会出现死亡情况(Deeds,1999).美国USGS给出Ni加标沉积物28 d对水丝蚓(Tubifex tubifex)无效应浓度为494 mg · kg-1.由于不同种受试生物对同种污染物的耐受能力相差较大,同时不同实验室所采用实验条件不同也会造成毒性数据的差异.总体来说,本研究的毒性结果基本与已有文献相符.
付荣恕(2008)采用静水生物测试法,研究了Pb、Cd单一及复合情况下对霍甫水丝蚓的急性毒性.单一Pb和Cd对水丝蚓24h LC50分别为7.096和31.621 mg · L-1,48 h LC50分别为4.731和23.441 mg · L-1.孙新元(2010)测定了水中Cu对颤蚓的毒性效应,其24 h LC50、48h LC50、72h LC50 分别为237.8、212.2、174.3 μg · L-1.由此可见,水体中Cu对水丝蚓的毒性要高于Cd和Pb,这与沉积物中几种重金属的毒性顺序不同.这说明重金属对生物的毒性与其在环境中存在的状态有很大的关系.重金属可以通过络合等作用与沉积物中的组分发生结合,其结合态的生物可利用性决定了对生物的毒性.因而需要进一步研究讨论沉积物中重金属的生物有效性与底栖生物毒性的关系.
3.2 沉积物中重金属对摇蚊幼虫14 d毒性效应在实验过程中,上覆水pH值在6.98~7.87之间,DO值在3.4~4.9 mg · L-1之间.毒性效应采用死亡率和平均干重的抑制率为指标.生长抑制率为14 d毒性试验后存活幼虫的平均干重与对照组平均干重的差值的百分比.
沉积物中重金属对摇蚊幼虫14 d毒性效应结果如图 2所示.与水丝蚓的中毒症状相似,当沉积物中重金属浓度较高时,摇蚊幼虫会发生剧烈的身体扭动且不钻入沉积物中.随着暴露时间的延长,摇蚊幼虫由开始的剧烈扭动逐渐变得行动迟缓,失去逃避能力,最终身体会变透明甚至死亡.当浓度逐渐降低时,摇蚊幼虫会很快钻入沉积物中,而且在沉积物中的挖洞行为逐渐变得活跃.但是,在一定重金属浓度时,摇蚊幼虫的生长明显受到抑制.如图 2所示,摇蚊幼虫的死亡率随重金属的浓度增加而增大,呈现较好的相关性;而其生长抑制率也随浓度增加而升高.同样,对于摇蚊幼虫Cd的毒性最强,在20.7 mg · kg-1时生长抑制率达到61%,死亡率达到50%.5种重金属对摇蚊幼虫14 d LC50和50%平均干重抑制效应浓度(EC50)结果见表 4.
 |
| 图 2 伸展摇蚊幼虫的毒性效应与沉积物中重金属浓度的关系 Fig. 2 Relationship between the toxic effects of Chironomus tentans and the concentrations of heavy metals in sediments |
| 表 4 金属对摇蚊幼虫的毒性结果 Table 4 The toxicity effects of metals on Chironomus tentans |
由伸展摇蚊幼虫的14 d LC50可知,5种加标金属沉积物对摇蚊幼虫的毒性顺序为Cd > Pb ≈ Cu > Ni > Zn.Depledge和Rainbow(1990)认为,生物体对重金属的敏感度和毒性作用受其本身对重金属离子的吸收、累积和排泄的平衡调节决定.而Bidwell和Gorrie(2006)的研究表明水体理化性质,如温度、盐度、溶氧、pH等也会影响重金属对生物的毒性效应.Klaas进行的淡水沉积物暴露试验表明Cd在0.6~1030 mg · kg-1时 摇蚊幼虫的存活率为46%~81%.得出Ni对摇蚊幼虫的最低可观察效应浓度(LOEC)为353 mg · kg-1,与本研究观察到的致死率浓度基本相符.
除了Zn以外,其它4种重金属的摇蚊幼虫的LC50值都显著低于水丝蚓,说明沉积物中重金属对摇蚊幼虫的毒性效应要强于水丝蚓,也就是说摇蚊幼虫比水丝蚓对沉积物中重金属更敏感.综合考虑,摇蚊幼虫更适用于监测沉积物中重金属污染.
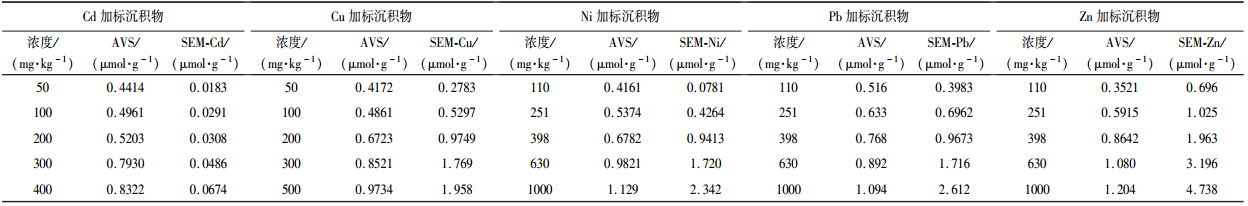
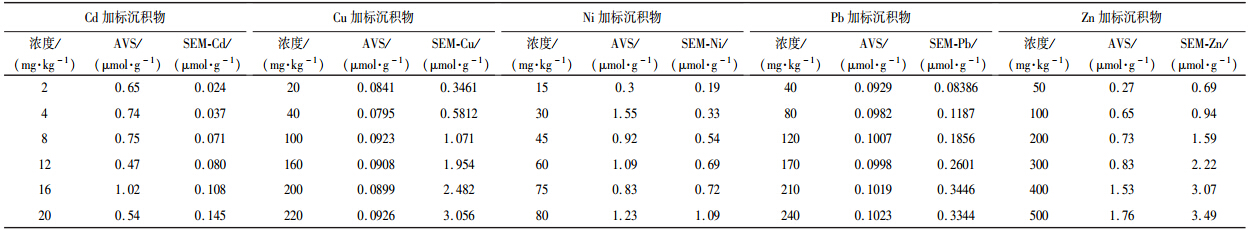
3.3 AVS与SEM之间的关系及对重金属生物有效性的影响沉积物中重金属的不同存在形态决定着沉积物中重金属的污染程度,即决定着沉积物中重金属的毒性(曾毅,2012).研究表明,SEM/AVS的比值与沉积物中重金属毒性有关,即当二价金属离子的含量高于沉积物中S2-时会引起毒性作用(Di Toro et al., 1992b).Di Toro和Ankley认为,当SEM/AVS<1或SEM-AVS<0时,沉积物中重金属对底栖生物基本不产生毒害效应;SEM/AVS>1或SEM-AVS>0时,沉积物重金属对生物具有潜在毒性(Di Toro et al., 1992b; Ankley et al., 1996).本研究中沉积物AVS含量、重金属SEM含量以及两种底栖生物的毒性效应见表 5~表 6.
| 表 5 用于水丝蚓毒性实验的沉积物中AVS、SEM测定结果(以μmol · g-1计) Table 5 AVS and SEM in the metal-spiked sediments for Monopylephorous limosus |
| 表 6 用于摇蚊幼虫毒性试验的沉积物中AVS、SEM测定结果(以μmol · g-1计) Table 6 AVS and SEM in the metal-spiked sediments for Chionomus tentans |
如图 3所示,水丝蚓和摇蚊幼虫的死亡率随着SEM/AVS摩尔比值的增大而逐渐升高.当SEM/AVS值大于1时,除Cd外,重金属对水丝蚓和摇蚊幼虫的毒性效应比较明显,这说明AVS确实是控制沉积物中重金属毒性效应的关键因素.而Cd加标沉积物的SEM/AVS值虽然小于1,但其生物暴露实验表明其加标沉积物具有较强的生物毒性.从图 3可以看出,除了Cu和Cd以外,Pb、Zn、Ni对水丝蚓和摇蚊幼虫的致死率与SEM/AVS比值之间表现出良好的一致性,进一步说明用SEM/AVS可以较好的描述沉积物中重金属的生物可利用性,同时也说明它们对两种底栖生物具有相似的致毒机制.
不同重金属与沉积物中S2-结合作用的强弱不同,因此会表现出不同的生物有效性.Cd的硫化物溶度积(Ksp=3.6×10-29)比其他几种重金属硫化物的溶度积都要低,因此Cd的SEM/AVS值非常低(均小于1).然而,Cd仍对水丝蚓和摇蚊幼虫均有较高毒性,说明Cd对底栖生物的毒性效应非常强,即使具有生物有效性的Cd浓度很低,仍然可能导致生物中毒.这也可能与底栖生物吞食沉积物的习性有关,沉积物中的AVS结合态Cd可以通过大量的吞食活动在其体内产生累积引起毒性(汪飞,2012).
 |
| 图 3 水丝蚓、摇蚊幼虫的死亡率与沉积物中SEM/AVS的关系 Fig. 3 Relationship between the mortality of Monopylephorous limosus and Chironomus tentans with SEM/AVS in sediments |
1)5种重金属加标沉积物对淡水单孔蚓的21 d毒性顺序为Cd > Ni > Cu > Pb > Zn;对伸展摇蚊幼虫14 d毒性顺序为Cd > Pb > Cu > Ni > Zn.摇蚊幼虫比淡水单孔蚓对沉积物中重金属更敏感.综合考虑,摇蚊幼虫更适用于监测淡水沉积物中重金属污染.
2)当SEM/AVS>1时,除Cd外其余4种重金属均对受试生物表现出较为明显的毒性效应,用SEM/AVS可以较好地反映沉积物中重金属的生物有效性.
3)目前关于沉积物中重金属对底栖生物毒性效应的数据比较少,相关的理论也不成熟,急需开展相关的研究,为水体污染控制提供理论基础.
| [1] | Allen H E, Fu G, Deng B.1993.Analysis of AVS and SEM for the estimation of potential toxicity in aquatic sediment[J].Environ Toxicol Chem, 12:1441-1453 |
| [2] | Anderson J, Wiseman S B, Wang N, et al.2012.Effectiveness of ozonation treatment in eliminating toxicity of oil sands process-affected water to Chironomus dilutus[J].Environ Sci Technol, 46 (1):486-493 |
| [3] | Ankley G T, Di Toro D M, Hansen D J.1996.Technical basis and proposal for deriving sediment quality criteria for metals[J].Environ Toxicol Chem, 15:2056-2066 |
| [4] | Besser J M, Brumbaugh W G, Kemble N E, et al.2011.Toxicity of nickel-spiked freshwater sediments to benthic invertebrates—Spiking methodology, species sensitivity, and nickel bioavailability 2011-5225[R].U.S.Geological Survey Scientific Investigations, 53 |
| [5] | Bidwell J R, Gorrie J R.2006.The uptake of cadmium by the midge larvae Chironomus riparius as a function of salinity[J].Env Pollut, 139: 206-213 |
| [6] | Deeds J R, Klerks P L.1999.Metallothionein-like proteins in the freshwater oligochaete Limnodrilus udekemianus and their role as a homeostatic mechanism against cadmium toxicity[J].Environmental Pollution, 106: 381-389 |
| [7] | Depledge M H, Rainbow P S.1990.Models of regulation and accumulation of trace-metals in marineinvertebrates[J].Comp Biochem Physiol, 97C: 1-7 |
| [8] | Di Toro.1992a.AVS predicts the acute toxicity of Cd and Ni in sediments[J].Environ Sci Technol.26: 96-101 |
| [9] | Di Toro D M, Mahony J D, Hansen D J, et al.1992b.Acid volatile sulphide predicts the acute toxicity of cadmium and nickel in sediments[J].Environ Sic Technol, 26: 96-101 |
| [10] | Di Toro D M, Allen H E, Bergnan H L, et al.2001.Biotic ligand model of the acute toxicity of metal Technical basis[J].Environmental Toxicology and Chemistry, 20(10): 2382-2396 |
| [11] | 范文宏, 段勇, 林爽, 等.2009.水体沉积物结合态镉对大型蚤(Daphnia magna)的生物毒性研究[J].生态毒理学报, 4(4):544-551 |
| [12] | Fargasova A.2001.Winter third-to fourth-instar larvae of Chironomus plumosus as bioassay tools for assessment of acute toxicity of metals and their binary combinations[J].Ecotoxicol Envir Saf, 48: 1-5 |
| [13] | 付荣恕, 杜作滨.2008.铅、镉污染对水丝蚓的急性毒性效应[J].山东师范大学学报(自然科学版), 23(4): 93-95 |
| [14] | Frstner U.1987.Sediment-associated contaminants an overview of scientific bases for developing remedial options[J].Hydrobiologia, 149: 221-246 |
| [15] | 郭鹏然, 仇荣亮, 牟德海, 等.2010.珠江口桂山岛沉积物中重金属生物毒性评价和同步萃取金属形态特征[J].环境科学学报, 30 (5): 1079-1086 |
| [16] | 黄钥, 吴群河.2003.水体沉积物质量基准问题的研究和进展[J].环境技术, (S1): 24-27 |
| [17] | Liber K, Doig L E, White-Sobey S L, et al.2011.Toxicity of uranium, molybdenum, nickel, and arsenic to Hyalella azteca and Chironomus dilutus in water-only and spiked-sediment toxicity tests[J].Ecotoxicol Environ Saf, 74(5): 1171-1179 |
| [18] | 刘峰, 秦樊鑫, 胡继伟, 等.2009.红枫湖沉积物中酸可挥发硫化物及重金属生物有效性[J].环境科学学报, 29(10):2215-2223 |
| [19] | 刘清风.2005.松花江吉林省段表层沉积物中重金属污染研究.成都:成都理工大学.1-33 |
| [20] | 雷琳, 雷志丹.2009.沉积物中酸可挥发性硫的测定方法的研究[J].化工设计通讯, 35(01): 55-57 |
| [21] | Mehler W T, Du J, Lydy M J, et al.2011.Joint toxicity of a pyrethroid insecticide, cypermethrin, and a heavy metal, lead, to the benthic invertebrate Chironomus dilutus[J].Environmental Toxicology and Chemistry, 30(12):2838-2845 |
| [22] | 孟妍, 尹希杰, 冯静.2012.品清湖沉积物可挥发性硫化物与重金属生物毒性效应研究[J].海洋科学进展, 1(30):119-124 |
| [23] | OECD.2004.OECD Guideline for the testing of Chemicals N°218"Sediment-water chironomid toxicity test using spiked sediment"Adopted April 2004[S].Organisation for Economic, Co-operation and Development, Paris, France |
| [24] | Pasteris A, Vecchi M, Reynoldson T B, et al.2003.Toxicity of copper-spiked sediments to Tubifex tubifex (Oligochaeta, Tubificidae): a comparison of the 28-day reproductive bioassay with a 6-month cohort experiment[J].Aquat Toxicol, 65(3): 253-265 |
| [25] | Salomons W, Stigliani W.1995.Biogeodynamics of pollutants in soils and sediments[M].Heidelberg: Springer-Verlag.352 |
| [26] | Sibley P K, Benoit D A, Ankley G T.1997.The significance of growth in Chironomus tentans sediment toxicity tests: relationship to reproduction and demographic endpoints[J].Environ Toxicol Chem, 16: 336-345 |
| [27] | Steven W, John M C, John H, et al.2005.Sulfide species as a sink for mercury in lake sediments[J].Environ Sci Technol, 39: 6644-6648 |
| [28] | 孙新元 宋志慧 吴光前.2010.水中铜离子对颤蚓的毒性效应研究[J].环境科学与技术, 33(7): 40-43 |
| [29] | Timmermans K R, Spijkerman E, Tonkes M, et al.1992.Cadmium and Zinc Uptake by Two Species of Aquatic Invertebrate Predators from Dietary and Aqueous Sources[J].Canadian Journal of Fisheries and Aquatic Sciences, 49(4): 655-662 |
| [30] | United States Environmental Protection Agency(US EPA).2000.Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates, second edition[M].Washington DC: US Environmental Protection Agency.64-99 |
| [31] | United States Environmental Protection Agency(US EPA).2004.The incidence and severity of sediment contamination in surface Water of the United States.Vol 1:National Sediment Quality Survey(2nd edtion)[M].Washington D C, United States Environmental Protection Agency.280 |
| [32] | 汪飞, 黄小平.2012.海洋沉积物中重金属对底栖无脊椎动物的生物有效性[J].生态学杂志, 31(1):207-214 |
| [33] | Williams K L, Green W J.1986.The acute toxicity of cadmium to different larval stages of Chironomus riparius (Diptera: Chironomidae) and its ecological significance for pollution regulation[J].Oecologia (Berlin), 70: 362-366 |
| [34] | 曾毅, 钟文珏, 祝凌燕, 等.2012.太湖地区全沉积物毒性识别评估研究[J].中国科学: 化学, 42(8):1234-1241 |
| [35] | 赵艳民, 张雷, 秦廷文, 等.2011.镉"加标"对泥鳅(Misgurnus anguillicaudcuus)毒性研究[J].生态毒理学报, 6(1):80-86 |
| [36] | 张融, 范文宏, 唐戈, 等.2008.水体中重金属镉和锌对大型蚤联合毒性效应的初步研究[J].生态毒理学报, 3(3):286-290 |
| [37] | 张鑫, 周涛发, 袁峰, 等.2004.铜陵矿区水系沉积物中重金属存在形态特征研究[J].地球科学进展, 19: 462-465 |
 2014, Vol. 34
2014, Vol. 34