2. 宁夏天然药物工程技术研究中心, 银川 750021
2. Ningxia Engineering Research Centre for Nature Medicine, Yinchuan 750021
泰乐菌素(Tylosin)是一种由弗氏链霉菌(Streptomyces fradiae )产生的大环内酯类兽用抗生素,主要由泰乐菌素A、B、C、D 4个组分组成(Van et al., 2003),分子结构式见图 1和表 1.除泰乐菌素D组分基本不具抗菌活性外,泰乐菌素A、B、C均具有抗菌活性,其中以泰乐菌素A的抗菌活性最高.我国每年约有6000 t兽用抗生素用于畜禽饲料添加剂,占全球抗生素饲料添加剂使用量的50%(张远等,2006),其中泰乐菌素等大环内酯类抗生素是目前国际上广泛应用的兽用抗生素之一(Prats et al., 2002).通过口服和肌肉注射进入畜禽体内的泰乐菌素并不能完全被机体吸收,仍有60%~90%以母体或代谢物的形式随尿或粪便排出体外(Bound et al., 2004; Kümmerer et al., 2003; Prats et al., 2002),经土壤渗透、空气流动、水土流失等途径进入地球生态系统(Huber et al., 2003),并通过食物链富集危害人类健康(Andersona et al., 2003; Wajih et al., 2000; Skinner et al., 1997),具体表现为耳蜗神经和前庭损害,严重者可导致肾、肝及造血系统的严重损害(陈礼仁等,1992).研究表明:在不同的环境中均可检测到泰乐菌素的存在,Kolz等(2005)在研究泰乐菌素吸附性时,发现泰乐菌素在粪便池中的含量是1~30 mg · L-1;Hoese等(2009)研究发现猪粪中泰乐菌素的含量为0.3 mg · g-1.尽管泰乐菌素在环境中的浓度很低,但由于大量广泛地使用,导致耐药菌株的产生,不仅使该抗生素的疗效降低,还给临床治疗带来困难,同时进入环境中的泰乐菌素会抑制某些微生物的生长,通过影响微生物之间的竞争而改变菌体数量和菌群结构(Pruden et al., 2006),从而破坏环境中的微生态平衡.鉴于泰乐菌素应用的广泛性及其潜在危害,迫切需要寻找控制泰乐菌素残留的新途径和新技术.
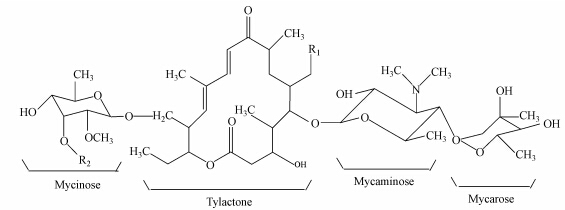 |
| 图 1 泰乐菌素的化学结构 Fig. 1 Chemical structure of tylosin |
| 表 1 泰乐菌素A及相关化合物的的化学结构 Table 1 Structures of the tylosin A and related compounds |
近年来,国内外关于泰乐菌素降解的研究主要侧重于土壤吸附、水解、光解等方面(Homem et al., 2011; Yahiat et al., 2011; Davide et al., 2009).Paeson等(1995)发现泰乐菌素A在酸性条件下可水解脱去碳霉糖转化成泰乐菌素B,而在中性或碱性条件下,可生成泰乐菌素丁间醇醛和一些极性的分解产物.Loke等(2000)研究了泰乐菌素A在肥料中的稳定性,发现泰乐菌素A在厌氧条件下半衰期小于2 d,泰乐菌素A在厌氧或有氧条件下主要转化为泰乐菌素B,而泰乐菌素D是次要的转化产物.Hu等(2007)研究了泰乐菌素在水和土壤中的有氧降解和光降解,发现在光照条件下池塘水中泰乐菌素B的浓度比黑暗条件下明显升高,表明光照可以促进泰乐菌素B的形成.目前,有关泰乐菌素微生物降解的报道仅集中在降解菌的筛选驯化和降解特性等方面(马玉龙等,2010; Prado et al., 2009; Ingerslev et al., 2001),而缺乏对其微生物降解途径的研究.因此,本文以前期分离得到 1 株泰乐菌素降解菌B.vietnamiensis为对象,研究该菌降解泰乐菌素的能力,并对其降解产物进行分析与鉴定,探讨B.vietnamiensis对泰乐菌素的生物降解途径,旨在为泰乐菌素微生物降解机制的研究以及在此基础上降解酶的确定和工程菌株的构建提供相关基础.
2 材料与方法(Materials and methods) 2.1 试验材料 2.1.1 菌种来源从长期堆放泰乐菌素药渣附近土壤中筛选驯化出1株泰乐菌素降解菌,经16S rRNA鉴定为越南伯克霍尔德氏菌(Burkholderia vietnamiensis),在Genbank中的登录号为KC282371.该菌为革兰氏阴性杆菌,在酵母浸膏胨葡萄糖(Yeast extract peptone dextrose,YPD)固体培养基上呈圆形,中间凸起,乳白色,表面光滑,不透明,边缘整齐.由本实验室保存.
2.1.2 供试样品泰乐菌素标样购买于美国Sigma公司,纯度为99.0%.
泰乐菌素药渣由泰乐菌素生产企业提供,药渣中残留泰乐菌素含量为2.14 mg · g-1.
2.1.3 培养基及试剂YPD培养基:酵母浸膏1.0 g,蛋白胨2.0 g,葡萄糖2.0 g(分装),水100 mL.固体培养基在上述培养基中加入1.2 g琼脂.
泰乐菌素药渣提取液:泰乐菌素药渣与水按1∶10比例(质量百分比)混合后,通过加入水或泰乐菌素标准品,将泰乐菌素含量调节为50、100、200、300、400和500 mg · L-1.
磷酸盐缓冲溶液(PBS,pH 7.0,1000 mL):A溶液:Na2HPO4 3.5815 g,定容至50 mL容量瓶;B溶液:NaH2PO4 1.5600 g,定容至50 mL容量瓶,取A液36 mL,B液14 mL,NaCl 8.2 g,定容至1000 mL容量瓶.
2.2 试验方法 2.2.1 降解菌悬液制备取保存的B.vietnamiensis试验菌株,解冻后,接种于YPD培养基中,35 ℃、130 r · min-1下培养48 h.为了获得对数生长期菌株,接种10 mL菌液与100 mL新鲜YPD培养基中,35 ℃摇床中孵育至对数生长期,于4 ℃以4000 r · min-1离心10 min,用紫外可见分光光度计(UV-12000,上海精密科学仪器),在500 nm处测定细菌光密度(OD值),每毫升悬液降解菌浓度调为1×108菌落形成单位(Colony-Forming Units,CFU).以上操作均在无菌条件下进行.
2.2.2 B.vietnamiensis生长与泰乐菌素降解关系曲线的测定配制泰乐菌素初始浓度为50 mg · L-1的药渣提取液90 mL于250 mL三角瓶中,然后接入10 mL浓度为1×108 CFU · mL-1的菌悬液,置于恒温振荡摇床中,在35 ℃,130 r · min-1下培养7 d,间隔24 h定期取样测定OD500值及泰乐菌素浓度,以此研究B. vietnamiensis的生长情况及其对泰乐菌素的降解效果.每个处理设置3个平行,同时设未接菌的含有相同浓度的泰乐菌素药渣提取液为空白对照.
2.2.3 B.vietnamiensis降解能力的研究分别取泰乐菌素初始浓度为100、200、300、400和500 mg · L-1的药渣提取液90 mL于250 mL三角瓶中,在2.2.2节所述条件下培养7 d,间隔24 h定期取样测定泰乐菌素浓度,以此研究菌株对不同初始浓度泰乐菌素的降解效果.每个处理设3个平行,同时设未接菌的含有相同浓度的泰乐菌素药渣提取液为空白对照.B.vietnamiensis对泰乐菌素的降解率按公式(1)进行计算.

式中,X为泰乐菌素的生物降解率,C0为未接菌对照中泰乐菌素浓度(mg · L-1),Ct为接菌处理后培养基中泰乐菌素浓度(mg · L-1).
2.2.4 B.vietnamiensis产生的酶对泰乐菌素的降解效果将B.vietnamiensis悬液(菌液浓度为1×108 CFU · mL-1)以10%的接种量接种到100 mL YPD培养基中,35 ℃、130 r · min-1振荡培养至稳定期,然后5000 r · min-1离心10 min.沉淀菌体用等量冰冷的PBS洗涤3次,并悬浮于10 mL冰冷的 PBS中,置于冰浴中用超声波细胞破碎仪(JY92-II,宁波)处理,超声破碎10 s,间隙10 s,处理总时间为10 min,将所得的破碎液在4 ℃、12000 r · min-1条件下离心10 min,取上清液即为B.vietnamiensis产生的降解泰乐菌素的酶.
称取0.02 g泰乐菌素标准品,加入适量的PBS溶解后,取10 mL上述制备的酶液,用PBS定容使泰乐菌素的初始浓度为200 mg · L-1,35 ℃,130 r · min-1下培养,然后分别在0、0.5、2、4、12 h取样并加入10%的三氯乙酸溶液终止反应.每个处理设3个平行,同时设不加酶的含有相同浓度的泰乐菌素溶液为空白对照.
2.2.5 泰乐菌素降解产物分离分别取20 mL 0.5、2、12 h的泰乐菌素酶解试样,12000 r · min-1离心5 min,收集上清液并转入圆底烧瓶中,45 ℃下减压旋转浓缩至一定量.采用制备型高效液相色谱仪(Cheetch HP 100,天津博纳艾杰尔)收集各个峰的洗脱液,通过多次制备纯化,收集并合并有相同保留时间的洗脱液.取少量洗脱液过0.45 μm滤膜后供液相色谱进行纯度分析,确定其为纯品后,室温下真空抽除流动相中的有机溶剂,冷冻干燥,得到降解产物.
色谱条件:色谱柱:Venusil ASB C18制备柱(30 mm×250 mm,5 μm);流动相:乙腈-0.03%的三氟乙酸水溶液 = 25∶75(体积比);流速:25 mL · min-1;检测波长:285 nm;进样量:2 mL;柱温:25 ℃.
2.3 分析方法 2.3.1 泰乐菌素浓度的测定降解前后药渣中残留泰乐菌素浓度用高效液相色谱仪(LC-20AT,日本岛津)测定,外标法定量检测.样品前处理为:取5 mL样品于50 mL聚丙烯离心管中,加10 mL甲醇,振荡混合5 min后,超声提取10 min,5000 r · min-1 离心10 min,收集上清液.沉淀用上述方法重复提取2次,合并上清液并全部转入圆底烧瓶中,45 ℃下减压旋转蒸干溶剂.用0.5 mL甲醇溶解残渣,再加入9.5 mL醋酸钠缓冲溶液(pH 5.5),用少量醋酸钠溶液洗涤圆底烧瓶于50 mL聚丙烯离心管中,加入5 mL正己烷,5000 r · min-1 离心 10 min,弃去正己烷,水相准备过柱.分别用5 mL甲醇,5 mL水活化C18固相萃取柱,加入上述处理所得样品,以1 mL · min-1速度过柱,待样液全部流出后,用5 mL水,5 mL 15%甲醇溶液淋洗,抽干,分析物用5 mL甲醇洗脱并收集.洗脱液在45 ℃下用减压旋转蒸发仪旋转至干,残留物用体积比为30 ∶70的乙腈-磷酸二氢钾溶液溶解并定容至10 mL量瓶中,摇匀,过0.45 μm滤膜后供液相色谱检测.
色谱条件:色谱柱为Agilent HC-C18柱(5 μm,250 mm × 4.6 mm);流动相:乙腈∶KH2PO4(0.02 mol · L-1,pH 2.5)= 30∶70(体积比)等度洗脱;流速:1mL · min-1;柱温:25 ℃;进样量:20 μL;检测波长:285 nm.
2.3.2 泰乐菌素降解产物结构鉴定将2.2.5节制备纯化后得到的3个泰乐菌素降解产物用质谱仪(Thermo Scientific LTQ XL,美国赛默飞)分析.
质谱仪条件:采用电喷雾离子源(Electrospry ionization,ESI),正离子模式检测,质谱扫描范围:150~1200.
3 结果(Results) 3.1 菌株生长与降解泰乐菌素的关系菌株在初始浓度为50 mg · L-1药渣提取液中的生长情况及其与泰乐菌素的降解关系见图 2.由该图可见,菌株的生长曲线和泰乐菌素的降解曲线具有一定的一致性,随着菌株进入对数生长期(2~3 d),对泰乐菌素的降解效率显著升高;之后随着时间的延长,由于营养成分的缺失和代谢物的增加,菌株生长逐渐到衰退期,对泰乐菌素的降解能力也随之下降,降解曲线趋于平缓.当用降解菌处理初始浓度为50 mg · L-1的药渣提取液6 d时,用高效液相色谱法未检出残留泰乐菌素,而空白对照中泰乐菌素6 d的自然降解率仅为2.96%.
 |
| 图 2 菌株生长量(OD500)与降解泰乐菌素的关系曲线 Fig. 2 The relationship between B.vietnamiensis growth(OD500) and tylosin degradation |
降解菌对不同初始浓度泰乐菌素(100~500 mg · L-1)的降解效果见图 3.由图 3可知,降解菌能高度耐受并快速降解泰乐菌素,培养6 d后,初始浓度为100 mg · L-1的药渣提取液中检测不到泰乐菌素;当泰乐菌素初始浓度为200 mg · L-1时,用降解菌处理6 d可降解99%的泰乐菌素;而当泰乐菌素初始浓度为300~500 mg · L-1时,7 d内则可降解99%以上.虽然在所试泰乐菌素初始浓度范围内,降解菌对泰乐菌素的降解率不同,但菌株对泰乐菌素的绝对降解量随其初始浓度的增高而增大.
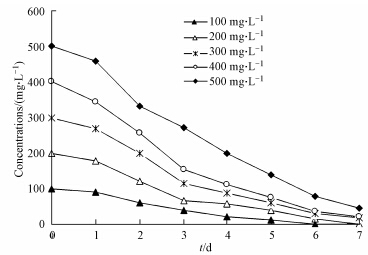 |
| 图 3 B.vietnamiensis对不同初始浓度泰乐菌素的降解效果 Fig. 3 Degradation by B.vietnamiensis to tylosin with variously initial concentrations |
本研究从B. vietnamiensis中提取了可降解泰乐菌素的酶,该酶对泰乐菌素的降解效果见图 4.泰乐菌素A的出峰时间为16.701 min(图 4a),当它用降解酶处理0.5 h后,泰乐菌素A的峰消失(图 4b),说明其已被完全转化或降解,形成一个不稳定中间产物;当用酶处理2 h时(图 4c),该中间产物的峰面积降低了约68.1%;伴随其降解过程,出现了另外2个新的降解产物,出峰时间分别为4.885和7.115 min,从2 h到12 h,这2个产物的峰面积分别增加了79.7%和25.9%.
 |
| 图 4 泰乐菌素酶解产物的液相色谱图(a. 0 h,b. 0.5 h,c. 2 h,d. 12 h) Fig. 4 HPLC chromatograms of degradation products of tylosin by enzyme produced from B.vietnamiensis(a. 0 h,b. 0.5 h,c. 2 h,d. 12 h) |
采用制备型高效液相色谱仪分离纯化得到3个主要的泰乐菌素转化或降解产物,它们分别对应图 5中的产物1、2、3,通过对泰乐菌素降解产物的质谱图分析及参照相关文献(Fernández et al., 2010),得出泰乐菌素在B. vietnamiensis菌株降解下时的可能产物.
 |
| 图 5 泰乐菌素的降解产物色谱、质谱及结构图 Fig. 5 The Chromatograms,mass spectrum and structure of the degradation products of tylosin |
产物1:形成的中间产物1的出峰时间10.057 min与降解前标样中泰乐菌素B的保留时间相吻合,分子离子峰m/z 772的检出进一步验证了是由泰乐菌素A脱掉碳霉糖而形成泰乐菌素B.
产物2:随着降解时间的增长,泰乐菌素B不稳定,7.720 min处峰的分子离子峰m/z 790与泰乐菌素B的分子离子峰m/z 772相差18,很有可能是泰乐菌素B中内酯环酯键断裂加上1个氢原子和羟基的差值,由此推测这一新物质是泰乐菌素B的水解产物.
产物3:在泰乐菌素B降解过程中还伴随有5.036 min的峰出现,它的分子离子峰为m/z 792与泰乐菌素B的分子离子峰m/z 772相差20,可能是泰乐菌素B内酯环酯键水解后醛基继续发生还原反应生成醇,由此推测这一新物质是泰乐菌素B水解后的还原产物.
根据泰乐菌素母体的分子特征和降解产物质谱信息,推测泰乐菌素微生物降解途径如图 6所示.从图 6可知,泰乐菌素的降解位点有3处,分别是泰乐菌素A脱糖及内酯环酯键水解和醛基还原,主要降解途径如图 6所示.
 |
| 图 6 泰乐菌素微生物降解途径 Fig. 6 Possible microbical degradation pathway of tylosin |
由此可见,B.vietnamiensis降解泰乐菌素A的途径主要是: 泰乐菌素A首先脱去1个碳霉糖转化成泰乐菌素B.泰乐菌素B在B.vietnamiensis的作用下按2条途径降解,一是通过内酯环酯键断裂发生水解反应生成降解产物2;二是泰乐菌素B内酯环酯键水解后醛基继续发生还原反应转化为醇,生成降解产物3.
4 讨论(Discussion)微生物降解是抗生素在环境中降解的最重要方式.因此,筛选高效降解菌是开展生物修复工作的前提(Singh et al., 2006).研究表明:光合菌、放线菌、酵母菌、芽孢杆菌、硝化细菌、乳酸菌等都对抗生素具有降解功能(刘伟等,2009).目前有关泰乐菌素微生物降解的研究主要集中在堆肥化技术对残留泰乐菌素的去除效果,但作为大环内酯类抗生素特别是泰乐菌素降解菌及其降解机理却鲜见报道.Holly等(2008)研究发现泰乐菌素在堆肥期间会发生降解,堆肥期间泰乐菌素的降解率为54%~76%,泰乐菌素的半衰期为19 d.实验室在前期试验过程中已筛选出1株泰乐菌素降解菌,经鉴定为柠檬酸杆菌(Citrobacter amalonaticus),该菌株经48 h发酵处理后对50 mg · L-1泰乐菌素的降解率达到 95.2%,加入C.amalonaticus胞内酶对20 mg · L-1泰乐菌素的降解率仅达到41.34%(张新莎等,2012; 刘力嘉等,2011).本研究所采用的B.vietnamiensis能高度耐受并快速降解泰乐菌素,当用降解菌处理初始浓度为50 mg · L-1的药渣提取液6 d时,用高效液相色谱法未检出残留泰乐菌素,而空白对照中泰乐菌素6 d的自然降解率仅为2.96%;当泰乐菌素初始浓度为100~200 mg · L-1时,用降解菌处理6 d可降解99%以上的泰乐菌素;当泰乐菌素浓度为300~500 mg · L-1时依然保持较高的降解率,而目前报道的降解抗生素的菌株大多在抗生素浓度超过100 mg · L-1 时,就会受到明显的抑制作用(Migliore et al., 2012).B.vietnamiensis能快速适应并降解高浓度泰乐菌素的特点表明该菌具有处理环境中泰乐菌素残留的能力.
抗生素降解或代谢产物相比其母体而言,往往活性降低,毒性却大大增强.因此,研究抗生素微生物降解途径十分必要.微生物降解抗生素主要是通过其分泌酶的生物化学过程来完成,其本质都是酶促降解.微生物降解途径通常有水解、氧化还原和基团转移3种机制.Kolz等(2005)对猪粪池中的泰乐菌素降解分析表明,泰乐菌素在初始阶段迅速降解,随后缓慢降解;且耗氧条件下的降解速率大于厌氧条件,泰乐菌素被降解为二氢泰乐菌素B(dihydrodemycosin)和质荷比(m/z)为934.5未知化合物.本研究中表明,B.vietnamiensis首先通过脱糖反应使泰乐菌素A转化为泰乐菌素B,而后泰乐菌素B继续发生酯键水解或醛基还原生成产物2和产物3.该研究表明泰乐菌素降解是一个复杂的过程,包括脱糖、水解和还原3个步骤.B.vietnamiensis降解泰乐菌素,不仅降解速度快,而且出现了新的降解产物,为泰乐菌素的微生物降解途径研究提供了可参考数据.
5 结论(Conclusions)1)用B.vietnamiensis处理泰乐菌素药渣提取液,6 d内能完全降解初始浓度分别为50和100 mg · L-1的泰乐菌素;6 d内对200 mg · L-1泰乐菌素的降解率达99% 以上,7 d内对300~500 mg · L-1泰乐菌素的降解率均达99%以上.
2)B.vietnamiensis降解泰乐菌素的可能途径是:泰乐菌素首先脱掉1个碳霉糖转化成泰乐菌素B,然后分子中内酯键和醛基再发生水解还原反应,产生2种新的降解产物.
| [1] | Ande rsona B S, Hunta J W. 2003. Integrated assessment of the impacts of agricultural drainwater in the Salinas River[J]. Environmental Pollution, 124: 523-532 |
| [2] | Bound J P, Voulvoulis N. 2004. Pharmaceuticals in the Aquatic Environment-A Comparison of Risk Assessment Strategies[J]. Chemosphere, 56(11): 1143-1151 |
| [3] | Chee-Sandford J C, Mackie R I, Koike S, et al. 2009. Fate and transport of antibiotic residues and antibiotic resistance genes following land application of manure[J]. Journal of Environmental Quality, 34: 1086-1108 |
| [4] | 陈礼仁, 陈慧琴. 1992. 泰乐菌素研究进展[J]. 微生物学报, 19(5): 293 |
| [5] | 崔浩. 2006. 抗生素的细菌耐药性:酶降解和修饰[J]. 国际药学研究杂志, 33(1): 34-36 |
| [6] | Davide V, Serge C. 2009. Phototransformation of selected human-used macrolides in surface water:Kinetics, model predictions and degradation pathways[J]. Water Research, 43(7): 1959-1967 |
| [7] | Fernández R A, Velasco M I, Rossi L I, et al. 2010. Transfer of tylosin across the H2O/1,2-dichloroethane interface. Analysis of degraded product in acid solutions[J]. Journal of Electroanalytical Chemistry, 650: 47-54 |
| [8] | Guo P, Wang B Z, Hang B J, et al. 2009. Pyrethroid-degrading Sphingobium sp. JZ-2 and the purification and characterization of a novel pyrethroid hydrolase[J]. International Biodeterioration & Biodegradation, 63: 1107-1112 |
| [9] | Hoese A, Clay S A, Clay D E, et al. 2009. Chlortetracyline and tylosin runoff from soils treated with antimicrobial containing manure[J]. Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 44(4): 371-378 |
| [10] | Holly D, Satish G, Sally N. 2008. Antibiotic degradation during manure composting[J]. Journal of Environmental Quality, 37(3): 1245-1253 |
| [11] | Homem V, Santos L. 2011. Degradation and removal methods of antibiotics from aqueous matrices-a review[J]. Journal of Environmental Management, 92(10): 2304-2347 |
| [12] | Huber A, Bh M, Frede H G. 2000. Pollution of surface waters with pesticides in Germany: modeling non_point source inputs[J]. Agriculture Ecosystems and Environment, 80: 191-204 |
| [13] | Hu D F, Coats Joel R. 2007. Aerobic degradation and photolysis of tylosin in water and soil[J]. Environmental Toxicology and Chemistry, 26(5): 884-889 |
| [14] | Ingerslev F, Halling-Søren B. 2001. Biodegradability of metronidazole, olaquindox, and tylosin and formation of tylosin degradation products in aerobic soil-manure slurries[J]. Ecotoxicology and Environmental Safety, 48(3): 311-320 |
| [15] | Kolz A C, Moorman T B, Ong S K, et al. 2005. Degradation and metabolite production of tylosin in anaerobic and aerobic swine-manure lagoons[J]. Warer Environment Research, 77(1): 49-56 |
| [16] | Kolz A C, Ong S K, Moorman T B. 2005. Sorption of tylosin onto swine manure[J]. Chemosphere, 60(2): 284-289 |
| [17] | Kümmerer K, Henninger A. 2003. Promoting resistance by the emission of antibiotics from hospitals and households into effluent[J]. Clinical microbiology and infection, 9(12): 1203-1214 |
| [18] | 刘力嘉, 谢丽, 张作义, 等. 2011. 泰乐菌素高效降解菌的筛选及降解特性研究[J]. 农业环境科学学报, 30(5): 1027-1030 |
| [19] | 刘伟, 王慧, 陈小军, 等. 2009. 抗生素在环境中降解的研究进展[J]. 动物医学进展, 30(3): 89-94 |
| [20] | Loke M L, Ingerslev F, Halling-Søren B, et al. 2000. Stability of Tylosin A in manure containing test systems determined by high performance liquid chromatography[J]. Chemosphere, 40(7): 759-765 |
| [21] | 马玉龙, 张作义, 刘宁普. 2010. 废弃药渣中残留泰乐菌素降解菌的筛选[J]. 环境科学研究, 28(8): 1076-1080 |
| [22] | Migiore L, Fiori M, Spadonni A, et al. 2012. Biodergradtion of oxytetracyline by Pleurotus ostreatus mycelium: a mycoremediation technique[J]. Journal of Hazardous Materials, 215: 227-232 |
| [23] | Paeson J, Cypers W, Busson R. 1995. Isolation of decomposition products of tylosin using chromatography[J]. Journal of Chromatography A, 699: 99-106 |
| [24] | Prado N, Ochoa J, Amrane A. 2009. Biodegradation and Biosorption of tetracycline and tylosin antibiotics in activated sludge system[J]. Process Biochemistry, 44: 1302-1306 |
| [25] | Prats C, Francesch R, Arboix M, et al. 2002. Determination of tylosin residues in different animal tissues by high performance liquid chromatography[J]. Journal of Chromatography B, 766(1): 57-65 |
| [26] | Pruden A, Pei R T, Storteboom H, et al. 2006. Antibiotic resistance genes as emerging contaminants: studies in northern Colorado[J]. Environmental Science & Technology, 40(23): 7445-7450 |
| [27] | Singh B K, Walker A. 2006. Microbial degradation of organophosphorus compounds[J]. FEMS Microbiology Reviews, 30(3): 428-471 |
| [28] | Skinner J A, Lewis K A, Bardon K S J, et al. 1997. An overview of the environmental impact of agriculture in the UK[J]. Journal of Environmental Management, 50: 111-128 |
| [29] | Van P C, De K K, Baltusnikiene A, et al. 2003. Liquid chromatographic-tandem mass spectrometric detection of banned antibacterial growth promoters in animal feed[J]. Analytica Chimica Acta, 483: 99-109 |
| [30] | Wajih N S, Fawzia A. 2000. Dietary intake of organophosphate pesticides in Kuwait[J]. Food Chemistry, 69: 331-338 |
| [31] | Yahiat S, Fourcade F, Brosillon S, et al. 2011. Removal of antibiotics by an integrated process coupling photocatalysis and biological treatment-Case of tetracycline and tylosin[J]. International Biodeterioration & Biodegradation, 65: 997-1003 |
| [32] | 张新莎, 马玉龙, 刘力嘉, 等. 2012. 药渣残留泰乐菌素的酶促降解特性[J]. 环境工程学报, 6(11): 4180-4184 |
| [33] | 张远, 王永强, 高世君,等. 2006. 动物性食品中抗生素残留的危害及防控[J]. 广西农业科学, 37(1): 97-99 |
 2015, Vol. 35
2015, Vol. 35


