2. 山东农业大学, 泰安 271018
2. Shangdong Agricultural University, Tai'an 271018
毒死蜱(Chlorpyrifos)是一种高效、广谱、中等毒性的有机磷酸酯类杀虫杀螨剂,是目前全世界生产和销售量最大的杀虫剂品种之一,也是世界卫生组织唯一许可的有机磷品种,有着非常广阔的市场和应用前景.但其残留对环境和人畜都会带来一定的负面影响:对动物眼睛有轻度刺激,对人类皮肤有明显刺激,对水生生物及蜜蜂具有较高的毒性,对烟草、番茄等较敏感(Tyler et al., 2008),可能对人的神经系统和脑部发育有潜在影响,对儿童健康有害(王金花等,2006).国内外研究表明,生物降解是控制和去除毒死蜱残留的有效途径之一,目前国内已报道的毒死蜱降解菌有人苍白杆菌(Ochrobactrum anthropi)、假单胞茵属(Pseudomonas sp.)、伯克霍尔德氏菌属(Burkholderia sp.)、鞘氨醇单胞菌(Sphingomonas sp.)、玫瑰红红球菌(Rhodocouus rhodochrous)、蜡状芽孢杆菌(Bacillus cereus)、哈夫尼菌(Hafnia sp.)、镰孢霉菌(Fusarium sp.)、侧芽孢杆菌(Bacillus latersprorus)和粪产碱杆菌(Alcaligenes faecalis)(史延华,2011;李晓慧等,2007;吴祥为等2006;段海明等,2011;张利等,2008;王金花等,2005;王晓等,2006;杨丽等,2005)等.随着毒死蜱的广泛生产和使用,毒死蜱的污染也势必会越来越严重,因此,有必要筛选出更多、更加高效的降解菌株(黄强等,2008).
嗜铁菌作为一类重要的植物根际促生菌,在促进植物生长和防治植物病害方面都发挥了很大的作用.研究证实,嗜铁菌产生的嗜铁素可与植物根际病原微生物争夺有限的铁营养,从而抑制病原微生物生长繁殖,起到生物防治作用;同时,植物可以利用微生物产生的嗜铁素螯合的铁,从而改善植物的铁营养,防治土壤植物缺铁失绿症的发生,促进植物生长(Miethke et al., 2007;余贤美,2009).如果嗜铁菌同时具有降解某种农药的性能,将对环境污染的生物修复有重大意义.然而,目前尚未有将植物根际促生菌与农药污染土壤生物修复结合起来研究的相关报道.
因此,本研究拟采用改良定向培育法,即在培养基中添加农药,对分离自土壤的嗜铁菌菌株进行驯化,筛选毒死蜱降解菌株,并研究农药本身、温度、振荡速率、pH值、接种量和碳氮源等环境因子对菌株降解毒死蜱活性的影响.以期为植物根际促生菌在毒死蜱污染环境生物修复中的开发利用,提供实验数据和科学依据.
2 材料与方法(Materials and methods) 2.1 主要仪器、试剂和培养基 2.1.1 主要仪器UV-2201 紫外分光光度计(Shimadzu,Japan),Biometra PCR 仪(Biometra,Germany),DYY-10 三恒电泳仪,Biorad GelDoc XR凝胶成像系统(BioRad,America).
2.1.2 试剂95%毒死蜱原药购自山东天成农药有限公司;EasyTaqTM DNA Polymerase、dNTPs、EasyPureTM Quick Gel Extraction Kit、pEASY-T1 Cloning Kit等分子生物学试剂购自北京全式金生物技术有限公司;石油醚等生化试剂均为国产分析纯.
2.1.3 培养基LB培养液:胰蛋白胨10 g,酵母粉5 g,氯化钠10 g,1000 mL去离子水,pH值7.0,高压蒸汽灭菌(121 ℃、30 min),每个150 mL的三角瓶均装50 mL.
LB平板:胰蛋白胨10 g,酵母粉5 g,氯化钠10 g,琼脂粉17 g,1000 mL去离子水,pH 值7.0,高压蒸汽灭菌(121 ℃、30 min).
CAS蓝色检测液的制作:将0.07 g的CAS(Chrome azurol S)溶于50 mL去离子水中,再加入10 mL(1 mmol · L-1)的FeCl3溶液(含有10 mmol · L-1的HCl),记为溶液a;将0.06 g的HDTMA(Hexadecyltrimethylammonium bromide)溶于40 mL去离子水中,记为溶液b;将a溶液沿着烧杯壁缓缓加入到b溶液中,轻轻晃动,使得溶液a与溶液b混合均匀,得到溶液c,即CAS蓝色检测液.121 ℃、15 min灭菌.
通用CAS检测平板制作:先配制好1 mmol · L-1 CaCl2溶液、1 mmol · L-1 MgSO4 · 7H2O溶液、10% 酸水解酪蛋白溶液(121 ℃、15 min单独灭菌);再分别取0.2 mL CaCl2溶液、0.2 mL MgSO4 · 7H2O溶液、6 mL 10%的酸水解酪蛋白溶液,加入生物缓冲液Pipes(sigma),调pH 6.8~7.0.去离子水定容到100 mL.加入2 g琼脂粉,121 ℃、15 min灭菌.当以上的固体培养基灭完菌后,温度降低到60 ℃时,以5 mL CAS蓝色检测液/每100 mL CAS培养基的量沿着三角瓶壁加入,混合均匀.注意不要产生气泡,影响平板检测实验.然后按照每皿30 mL倾注于培养皿(直径90 mm)中.
2.2 嗜铁菌菌株的分离及驯化 2.2.1 嗜铁菌菌株的分离采集苹果、梨、核桃等果树的根际土壤,带回实验室,自然风干后过筛(孔径为0.85 mm)备用.取1 g土样,加入50 mL灭菌蒸馏水,于室温150 r · min-1条件下振荡培养2 h,静置取上清液,通过CAS检测平板法(Machuca et al., 2003)进行筛选.根据橘黄色晕圈的有无及大小筛选出产嗜铁素能力较强的菌株.
2.2.2 毒死蜱降解菌的驯化将已获得的具有较强嗜铁能力的嗜铁菌细菌菌株接种于含有毒死蜱(浓度为50 mg · L-1)的LB培养液中,30 ℃、150 r · min-1振荡培养48 h后,取1 mL接入到含100 mg · L-1毒死蜱的LB培养液中,以同样的方法培养,直到毒死蜱的浓度达到800 mg · L-1(毒死蜱浓度由低到高依次为50、100 、200、400、800 mg · L-1).最后,用平板稀释法在含200 mg · L-1毒死蜱的LB 培养基平板上进行分离纯化,4 ℃保存备用.根据菌株生长情况,确定菌株可耐受的毒死蜱浓度,并获得具有降解毒死蜱能力的菌株.
2.3 菌株鉴定 2.3.1 细菌菌液的制备从划线培养的平板上挑取单菌落接种到100 mL LB液体培养基中,30 ℃、150 r · min-1振荡培养过夜.
2.3.2 引物设计及PCR 反应所用引物为细菌16S rDNA 通用引物(P1F:5′-AGA GTT TGA TCC TGG CTC AG-3′; P2R:5′-AAG GAG GTG ATC CAG CCG CA-3′),引物由北京赛百盛基因技术有限公司合成,配成100 mg · L-1的母液备用,预期获得1500 bp 左右的片段.反应体系:25 μL体系中含有10×PCR buffer 2.5 μL,dNTPs(各2.5 mmol · L-1)2.0 μL,P1F(10 mg · L-1)1.0 μL,P2R(10 mg · L-1)1.0 μL,菌液1.0 μL,Taq 酶(5 U · μL -1)0.2 μL,ddH2O 17.3 μL.反应条件:94 ℃预变性5 min;94 ℃变性1 min,64 ℃退火1 min,72 ℃延伸2 min,30个循环;72 ℃延伸10 min.PCR扩增产物经1.0%琼脂糖凝胶电泳检测.
2.3.3 PCR 产物的回收及连接转化PCR 产物采用EasyPureTM Quick Gel Extraction Kit进行回收,操作步骤严格按照说明书进行.取1.0 μL PCR 回收产物与克隆载体连接,连接体系及反应,按照pEASY-T1 Cloning Kit说明书进行.将连接产物转化到E.coli DH5α感受态细胞,涂平板,待菌液吸干后倒置平板,于37 ℃培养12~16 h;随机挑取白色单菌落到含有50 mg · L-1 Amp的LB 液体培养基中,37 ℃、200~300 r · min-1 振荡培养过夜,然后以1 μL 菌液为模板进行PCR 扩增反应,同时以无菌水为模板设为对照.反应体系及反应条件同2.3.2节).
2.3.4 16S rDNA 序列分析将阳性克隆穿刺培养,委托北京六合华大基因科技有限公司进行测序.测序结果通过GenBank 中的Blastn 搜索数据库进行序列的同源性比较分析,并用MEGA 4.0软件构建系统进化树.
2.4 降解菌的培养与菌悬液的制备将筛选出的对毒死蜱具有较高降解活性的菌株挑取单菌落接种于LB培养液中,30 ℃、150 r · min-1振荡培养 48 h后,10000 r · min-1下离心15 min,弃去上清液,收集菌体;将菌体用磷酸缓冲液(pH=7. 2,0.2 mol · L-1)洗涤2次,再用该缓冲液制成OD600 = 2的菌悬液(张丽珍等,2006),待用.
2.5 毒死蜱的降解检测用石油醚配制不同浓度的毒死蜱溶液,在紫外分光光度计下扫描,并确定最大吸收波长,测定吸光值并绘制标准曲线.同时对石油醚进行扫描,确定其对毒死蜱的吸收有无影响. 将配制的菌悬液以4%(文中均为体积比)的接种量接种到含有毒死蜱的LB培养液中,30 ℃、150 r · min-1振荡培养 48 h 后10000 r · min-1 离心;取上清液用等体积的石油醚萃取,剧烈振荡提取2 min,静置20 min,分层,收集有机相;按此步骤再重复萃取1次,合并两次有机相提取液后在紫外分光光度计下检测(钱博,2007).以不添加菌株的毒死蜱LB培养液的石油醚萃取液为对照,每个处理设3个重复.该方法在毒死蜱添加浓度分别为5、80、200 mg · L-1时的添加回收率为分别为87.0%±7.4%、95.0%±3.9%、107.0%±2.8%,满足残留分析的要求(段海明等,2009).降解率η的计算公式为:η=(A0-A)/A0×100%,其中,A0为对照培养液的吸光值,A为接菌培养液的吸光值.
2.6 降解菌的生长与降解曲线将制备的菌悬液以4%的接种量接种到含毒死蜱浓度为100 mg · L-1的LB培养液中,于30 ℃摇床中以150 r · min-1的振荡速率培养,分别在培养12、24、36、48、60和72 h时测定菌株生长情况及对毒死蜱的降解情况,选出最适降解时间.
2.7 降解菌对毒死蜱的最适降解浓度将制备的菌悬液以4%的接种量接种到毒死蜱浓度分别为25、50、100、200和400 mg · L-1的LB培养液中,于30 ℃摇床中以150 r · min-1的振荡速率培养48 h后,测定毒死蜱的降解情况,确定其对毒死蜱的最适降解浓度.
2.8 降解菌的降解特性 2.8.1 降解菌的最适降解温度将制备的菌悬液以4%的接种量接种到含毒死蜱浓度为100 mg · L-1的LB培养液中,分别在20、25、30、35和40 ℃下以150 r · min-1的振荡速率培养48 h,测定其在不同生长温度下的降解活性.
2.8.2 降解菌的最适振荡速率将制备的菌悬液以4%的接种量接种到含毒死蜱浓度为100 mg · L-1的LB培养液中,30 ℃下分别以90、120、150、180和210 r · min-1的振荡速率培养48 h,测定其降解率以确定最适振荡速率.
2.8.3 降解菌的最适初始pH值将制备的菌悬液以4%的接种量接种到含毒死蜱浓度为100 mg · L-1的LB培养液(LB培养液的初始pH值分别为5、6、7、8和9)中,于30 ℃摇床中以150 r · min-1的振荡速率培养48 h后测定降解率,以确定最适初始pH值.
2.8.4 降解菌的最适接种量将制备的菌悬液分别以2%、4%、6%、8%和10%的接种量接种到含毒死蜱浓度为100 mg · L-1的LB培养液中,于30 ℃摇床中以150 r · min-1的振荡速率培养48 h后测定降解率,确定其最适接种量.
2.9 降解菌培养基的优化 2.9.1 最佳外加碳源的筛选以2%的蛋白胨为氮源,0.5%的NaCl为无机盐,分别用2%的麦芽糖、果糖、葡萄糖、可溶性淀粉、甘露醇和蔗糖为外加碳源,pH值为7.0制作培养基对筛选出的菌株进行发酵培养,以不接入其他外加碳源的培养基为对照(毒死蜱浓度均为100 mg · L-1).48 h后测定降解率,以确定最佳外加碳源.
2.9.2 最佳氮源的筛选以2%的葡萄糖为外加碳源,0.5%的NaCl为无机盐,分别用2%的酵母粉、大豆蛋白胨、胰蛋白胨、蛋白胨和牛肉浸膏为氮源,pH值为7.0制作培养基对筛选出的菌株进行发酵培养,以不接入氮源的培养基为对照(毒死蜱浓度均为100 mg · L-1).48 h后测定降解率,以确定最佳氮源.
2.9.3 最佳无机盐的筛选以2%的葡萄糖为外加碳源,2%的蛋白胨为氮源,分别用0.5%的硫酸镁、氯化钠、氯化锌、氯化钾和氯化钙为无机盐,pH值为7.0制作培养基对筛选出的菌株进行发酵培养,以不加入无机盐的培养基为对照(毒死蜱浓度均为100 mg · L-1).48 h后测定降解率,以确定最佳无机盐.
3 结果(Results) 3.1 菌株的获得及驯化经CAS检测平板筛选,获得一批具有嗜铁能力的细菌菌株,其中CAS17嗜铁能力较强,在CAS检测平板上具有明显的橘黄色嗜铁圈(图 1).驯化结果显示,CAS17对毒死蜱具有高的耐受力,在毒死蜱浓度为800 mg · L-1的LB培养液中培养48 h后其OD值仍可达0.976(在不添加毒死蜱的LB培养液中的OD值为2.642).
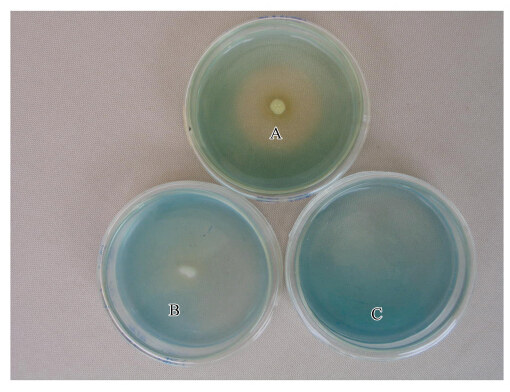 |
| 图 1 CAS17在CAS检测平板上产生的嗜铁圈(A: CAS17;B: 对照;C: CAS空白平板) Fig. 1 The siderophore producing halo produced by CAS17 on CAS agar plate(A: CAS17;B: control;C: CAS blank agar plate) |
PCR产物经1.0%琼脂糖凝胶电泳检测,获得了约1500 bp大小的片段,将该片段回收后转化到E.coli DH5α感受态细胞.随机挑取4 个白色菌落振荡培养过夜,以菌液为模板进行PCR 扩增筛选阳性克隆,以sddH2O为模板设为对照.结果显示,所挑选的转化子均扩增得到1500 bp左右的条带,为阳性克隆.挑选2 个阳性克隆,经北京六合华大基因科技有限公司测序,结果表明,所获得的基因片段为1542 bp.通过Blastn 搜索,该片段与Brevibacterium halotolerans strain DSM 8802菌株16S rRNA基因片段(NR-042638)在覆盖范围内仅有1个碱基的差异,具有99.9%的同源性.系统进化树(图 2)显示,该片段与Brevibacterium halotolerans strain DSM 8802(NR-042638)亲缘关系最近,因此,将该菌株鉴定为耐盐短杆菌(Brevibacterium halotolerans),并将该序列提交到GenBank(登录号:JX644589).
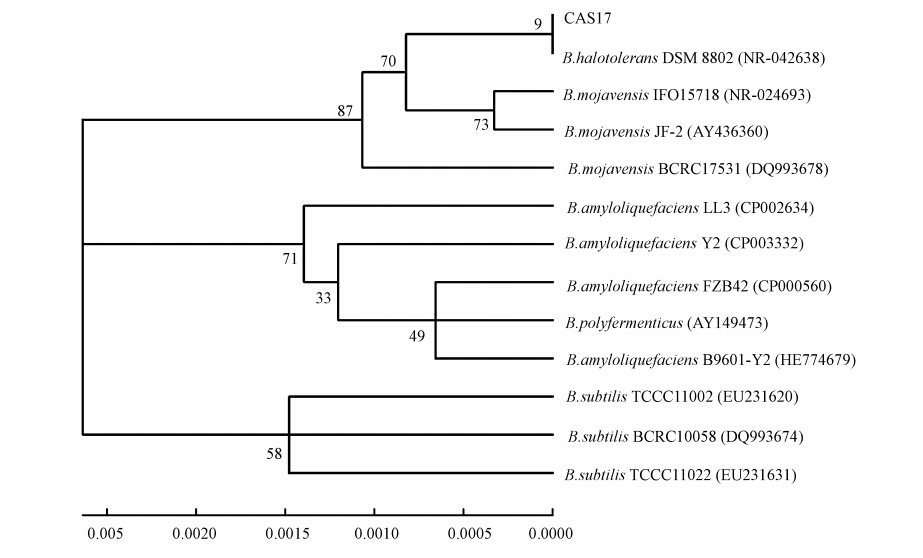 |
| 图 2 基于16S rRNA序列构建的菌株CAS17系统进化树 Fig. 2 The phylogenetic tree of strain CAS17 based on 16S rRNA sequence |
将石油醚及用石油醚溶解的毒死蜱分别在紫外分光光度计下进行扫描,毒死蜱在290 nm有最大吸收峰,而石油醚在此处没有吸收,因此,确定在290 nm下对毒死蜱进行检测.
3.4 分离降解菌株的生长及降解曲线由图 3可以看出,菌株CAS17在生长24 h后即进入稳定期,48 h后进入衰退期.从降解方面看,其在生长过程中降解率不断提高,在48 h后趋于稳定,降解率可达67%左右,与72 h的降解率无明显差异.为了缩短试验时间,采用48 h为最佳降解时间.
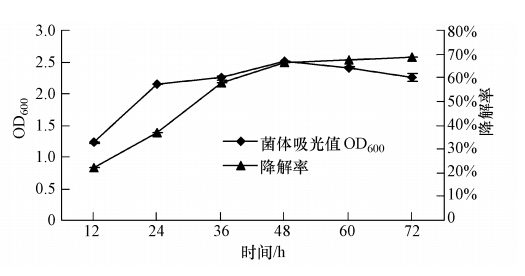 |
| 图 3 菌株CAS17的生长及对毒死蜱的降解曲线 Fig. 3 The growth and chlorpyrifos-degradation curve of strain CAS17 |
菌株CAS17对不同初始浓度毒死蜱的降解情况如图 4所示,在毒死蜱浓度低于100 mg · L-1时降解率无显著差异,均可达67%左右.在毒死蜱浓度高于100 mg · L-1时,随着浓度的继续增加,其降解率逐渐降低,在毒死蜱浓度为400 mg · L-1时,其降解率下降到43.9%.说明毒死蜱浓度过高,对菌株的毒性开始显现,或其降解产物对降解菌的增殖有抑制作用.因此,选用此菌株对毒死蜱有较高耐受程度的浓度100 mg · L-1用于以下试验.
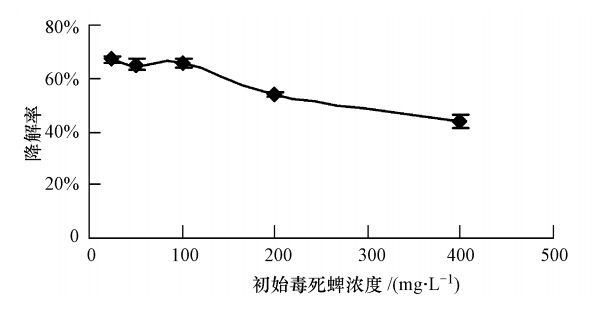 |
| 图 4 菌株CAS17对毒死蜱的最适降解浓度 Fig. 4 The optimal degradation-concentration to chlorpyrifos of strain CAS17 |
在农药的化学结构一定的情况下,降解菌所处环境的营养水平、pH值、温度、药剂浓度、接菌量等对农药的降解率都有不同程度的影响.只有在适宜的环境条件下,微生物才能充分发挥其降解能力(Mohana et al., 2007;任南琪,2010).从图 5可以看出,初始pH值在7.0时其降解率最高,pH值在5~9之间的降解率波动不大,说明CAS17菌株对pH值有着较强的适应范围;温度在30 ℃时,其降解率最高,可达69.51%,温度继续升高后其降解率迅速降低,说明CAS17菌株对高温非常敏感;振荡速率为150 r · min-1时其降解率可达67.66%,转速过低,菌株无法与培养液充分接触,而转速过高又会对菌体产生机械损伤;接种量为4%时其降解率可达67.16%,接种量继续增大降解率反而降低.可能是由于接种量增大时菌体浓度升高,消耗氧气和营养成分较大,使培养液中的营养成分不能满足其产生降解物质的条件造成.
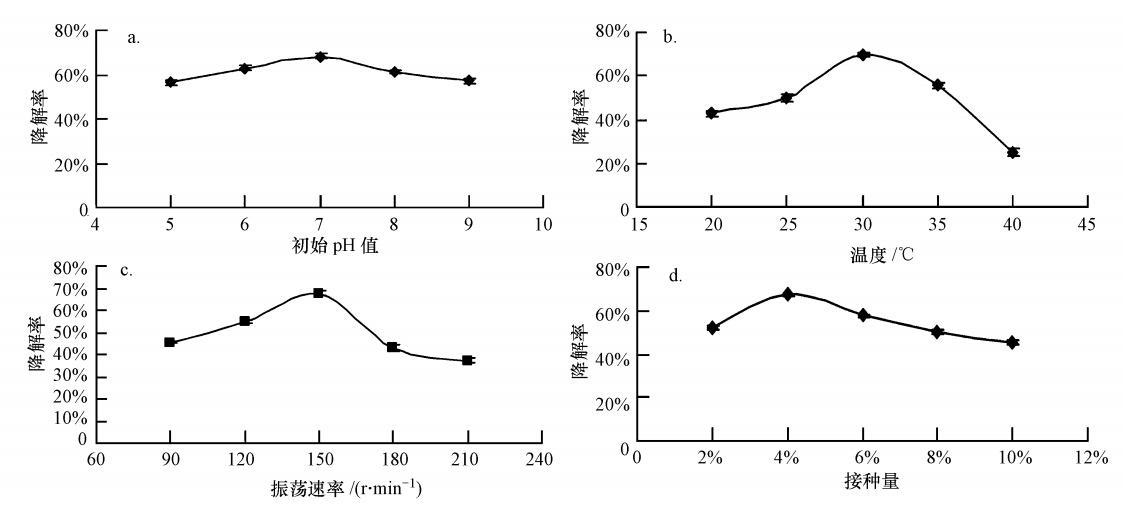 |
| 图 5 环境条件对菌株CAS17降解活性的影响(a.pH,b.温度,c.转速,d.接种量) Fig. 5 The effect of environmental conditions on the efficiency of strain CAS17 in degradation of chlorpyrifos(a.pH,b.temperature,c.rotation speed,d.inoculation quantity) |
在最佳外加碳源的筛选中(图 6a),添加葡萄糖的培养基中毒死蜱降解率最高,为22.07%,其次为蔗糖,毒死蜱降解率为21.8%,不添加其他外加碳源时毒死蜱降解率也达到了16.94%,说明CAS17菌株可以以毒死蜱为唯一碳源生长.而添加麦芽糖、果糖、可溶性淀粉和甘露醇的培养基中毒死蜱降解率反而比对照还要低,说明这几种物质妨碍了CAS17菌株对毒死蜱的降解.因此,本文选用葡萄糖为最佳外加碳源.
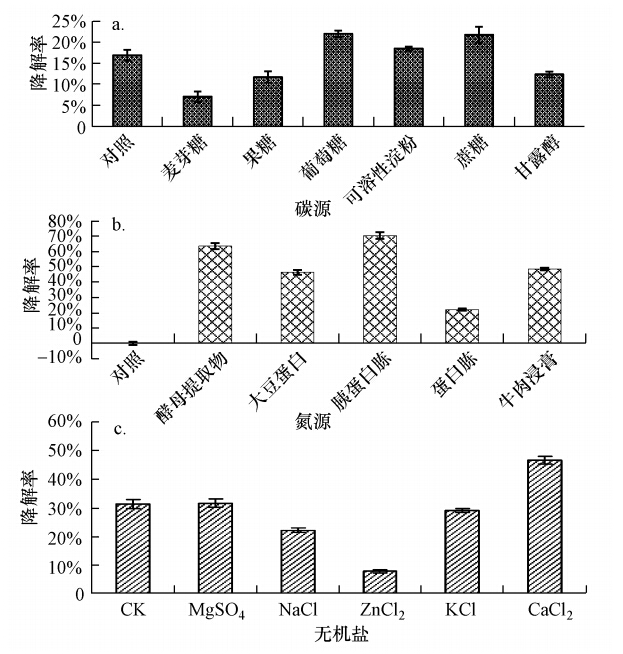 |
| 图 6 菌株CAS17最佳培养基的优化 Fig. 6 The optimization of optimal fermentation medium of strain CAS17 |
在最佳氮源的筛选中,胰蛋白胨和酵母粉的效果最好,其降解率分别达到了70.35%和63.58%,二者差异不显著(图 6b).其他几种氮源的添加也均能使菌株对毒死蜱有较好的降解效果.而不添加氮源的培养基中,菌株几乎不生长且无降解,说明氮源对菌株的生长是必不可少的.考虑到酵母粉比胰蛋白胨的价格更便宜,因此,选用酵母粉为最佳氮源.
在最佳无机盐的筛选中,加入CaCl2的降解效果明显高于其他几种,而加入NaCl和ZnCl2的降解效果却低于不添加无机盐的对照的效果(图 6c),说明CaCl2能促进CAS17菌株对毒死蜱的降解,而NaCl和ZnCl2不利于CAS17菌株对毒死蜱的降解.因此,选用CaCl2为最佳无机盐.
4 讨论(Discussion) 4.1 嗜铁菌在农药污染生物修复领域的应用潜力微生物是影响有机磷农药在环境中降解的最主要因素,也被认为是降解有机磷农药最可靠、最高效的途径(Aislabie et al., 1995).分离筛选毒死蜱(或其预处理代谢产物)高效降解微生物(或降解酶制剂)已成为毒死蜱污染治理的关键.目前,关于微生物降解毒死蜱的报道很多,但尚未有嗜铁微生物同时具有农药降解效能的报道.本研究通过定向培育与驯化筛选出的对毒死蜱具有降解效能的嗜铁细菌CAS17,经鉴定为耐盐短杆菌.虽然其对毒死蜱的降解率只能达到67%左右,并不能称为高效,但其兼有的嗜铁性能是目前所筛选到的其他毒死蜱降解菌无法比拟的.因此,该菌株可以作为新的菌种资源,不仅可以促进植物生长和防治植物病害,而且在毒死蜱等农药污染地区的生物修复方面都具有潜在的应用价值.
4.2 广谱性农药降解菌的开发与降解机理的研究目前,绝大多数降解菌都是在实验室条件下筛选到的,实际用于毒死蜱污染治理的相关报道较少.且国内外大多数研究都局限在降解菌对某一特定农药的降解特性研究方面,然而在实际环境中,大多数情况下都为2种及以上农药(或其中间体)造成的复合污染.因此,筛选广谱性农药降解菌更加切合实际(段海明等,2009).农药降解菌之所以能够降解农药,归根结底是由其分泌的酶来完成的,研究降解菌产生降解酶的外界环境条件就显得非常重要(尤民生等,2004).因此,有必要进一步研究降解菌CAS17的土壤修复能力,降解菌CAS17对其他有机磷农药的降解效能,以及CAS17所产生的降解酶的种类和降解酶产生的最适环境条件等.
1)通过改良定向培育法,对分离自土壤的嗜铁菌菌株进行驯化,筛选到1株对毒死蜱有降解作用的菌株CAS17,结合其生理生化特性及16S rRNA 序列分析,将其鉴定为耐盐短杆菌(Brevibacterium halotolerans).
2)耐药性实验表明,该菌株对毒死蜱有较高的耐受性,在毒死蜱浓度达到800 mg · L-1时仍可生长.
3)该菌株对毒死蜱的最适降解环境条件为:最适毒死蜱降解浓度为≤100 mg · L-1,最适降解温度为30 ℃,pH值在5~9之间的降解率波动不大,最适降解时间为48 h,振荡速率为150 r · min-1,接种量为4%;适合其降解的最佳外加碳源为葡萄糖,最佳氮源为酵母粉,最佳无机盐为CaCl2.
| [1] | Aislabie J, Jones G L.1995.A review of bacterial degradation of pesticides[J].Australian Journal of Soil Research, 33(6):925-942 |
| [2] | 段海明, 王开运, 乔康, 等.2009.两株毒死蜱降解细菌的分离鉴定及其降解特性[J].环境科学学报, 29(4): 723-731 |
| [3] | 段海明, 王开运, 于彩虹.2011.耐盐性毒死蜱降解菌HY-1 的产酶培养基及发酵条件优化[J].微生物学通报, 38(3): 355-361 |
| [4] | 黄强, 吴祥为, 花日茂, 等.2008.农药毒死蜱环境污染微生物修复研究进展[J].安徽农业科学, 36(22): 9682-9683 |
| [5] | 李晓慧, 贾开志, 何健, 等.2007.一株毒死蜱降解菌株Sphingomonas sp.Dsp-2的分离鉴定及降解特性[J].土壤学报, 44(4): 734-739 |
| [6] | Machuca A, Milagres A M F.2003.Use of CAS-agar plate modified to study the effect of different variables on the siderophore production by Aspergillus[J].Letters in Applied Microbiology, 36: 177-181 |
| [7] | Miethke M, Marahiel M A.2007.Siderohore-based iron acquisition and pathogen control[J].Microbiol Mol Biol Rev, 71: 413-451 |
| [8] | Mohana S V, Sirishab K, Rao N C, et al.2007.Bioslurry phase remediation of chlorpyrifos contaminated soil:Process evaluation and optimization by Taguchi design of experimental (DOE) methodology[J].Ecotoxicology and Environmental Safety, 68(2): 252-262 |
| [9] | 钱博.2007.毒死蜱高效降解细菌的筛选及其降解特性研究[D].泰安:山东农业大学 |
| [10] | 任南琪.2010.高浓度难降解有机工业废水生物处理技术关键[J].给水排水, 36(9):1-3, 58 |
| [11] | 史延华.2011.毒死蜱降解菌的分离、鉴定及其降解特性[D].北京:中国农业科学院 |
| [12] | Tyler W, Lance J, Michael J.2008.Examining the joint toxicity of chlorpyrifos and atrazine in the aquatic species: Lepomis macrochirus, Pimephales promelas and Chironomus tentans[J].Environmental Pollution, 152(1): 217-224 |
| [13] | 王晓, 楚小强, 虞云龙, 等.2006.毒死蜱降解菌株Bacillus latersprorus DSP 的降解特性及其功能定位[J].土壤学报, 43(4): 648-654 |
| [14] | 王金花, 陆贻通.2006.农药毒死蜱的生态风险及其微生物修复技术研究进展[J].环境污染与防治, 28(2): 125-127 |
| [15] | 王金花, 朱鲁生, 王军, 等.2005.3株真菌对毒死蜱的降解特性[J].应用与环境生物学报, 11(2): 211-214 |
| [16] | 吴祥为, 花日茂, 操海群, 等.2006.毒死蜱降解菌的分离鉴定与降解效能测定[J].环境科学学报, 26 (9): 1433 -1439 |
| [17] | 杨丽, 赵宇华, 张炳欣, 等.2005.一株毒死蜱降解细菌的分离鉴定及其在土壤修复中的应用[J].微生物学报, 45(6): 905-909 |
| [18] | 尤民生, 刘新.2004.农药污染的生物降解与生物修复[J].生态学杂志, 23(1):73-77 |
| [19] | 余贤美.2009.海南岛橡胶根际嗜铁细菌B.subtilis CAS15筛选及嗜铁素基因dhbC克隆、表达与功能分析[D].泰安:山东农业大学 |
| [20] | 张丽珍, 乔雄悟, 马利平, 等.2006.多菌灵降解菌NY9721 的鉴定及降解条件[J].环境科学学报, 26(9):1440-1444 |
| [21] | 张利, 刘红玉, 曾光明, 等.2008.一株毒死蜱降解菌的分离鉴定及降解性能研究[J].环境工程学报, 2(10):1421-1424 |
| [22] | 周启星, 宋玉芳, 孙铁珩.2004.生物修复研究与应用进展[J].自然科学进展, 14(7): 721-728 |
 2014, Vol. 34
2014, Vol. 34


