2. 吉林建筑大学, 长春 130000
2. Jilin Jianzhu University, Changchun 130000
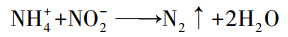
传统氮循环过程中,氨氮通常是在有氧条件下由氨氧化细菌在氨单加氧酶(ammonia monooxygenase large-subunit-amoA)的催化作用下,氧化为亚硝酸盐,由此开始生物氮循环.但是新近研究发现,氨不仅可以在有氧条件下发生氧化作用,还可以在厌氧氨氧化菌的作用下,在厌氧/缺氧的条件下被亚硝酸盐氧化为氨气,被称为厌氧氨氧化(anaerobic ammonium oxidation,anammox)其反应式为式(1)(Zhu,2008).
厌氧氨氧化最初发现于人工生物脱氮反应器(Mulder,1995),目前已广泛应用于高浓度氨氮污水处理(Boran,2011).在自然生态系统中厌氧氨氧化菌的相关报道多以海洋生态环境为主,且已探明海洋氮循环中厌氧氨氧化菌贡献(Dale,2009; Schmid,2007; Risgaard-Petersen,2004).但仅从厌氧氨氧化反应发生的条件来看,淡水生态系统中的沉积物中具有有氧和缺氧界面,是发生厌氧氨氧化反应的良好生境;而且沉积物中的有机质矿化后会产生NH4+,在硝化与反硝化反应的过程中产生中间产物NO2-,为厌氧氨氧化菌的生长提供了良好的底物基础.因此,近年来,厌氧氨氧化菌的研究逐渐从海洋向陆地和淡水生态系统中发展.Schubert 等2006年首次在天然淡水生态系统中发现有厌氧氨氧化菌的分布,之后陆续有研究报道了在湖泊(王衫允,2012)、河流(Zhang,2007;范改娜,2010;Wang,2012)、稻田土壤(Zhu,2011)、人工湿地(Zhu,2011)中厌氧氨氧化菌的分布、活性及对氮循环的贡献和厌氧氨氧化反应发生的热区(Zhu,2012),但是目前尚未有内陆高海拔地区的低温水体中厌氧氨氧化菌的相关报道.
本文选择天山天池的沉积物作为研究对象,通过定量/定性PCR、构建克隆文库等分子生物学手段验证厌氧氨氧化细菌在以天山天池为代表的高海拔低温湿地生态系统中的存在并分析其生物多样性构成;同时,通过同位素示踪技术测定其厌氧氨氧化速率,对厌氧氨氧化菌的活性及其在样品所处生态系统氮素循环中的贡献率做初步研究.
2 实验方法(Experimental mothods) 2.1 样品的采集2011年7月采集自天山天池的湖滨水陆交界带沉积物样品.天山天池(43°53′35″N,88°07′39″E)是天山山脉东段主峰博格达峰北麓处的一个冰碛湖,湖面海拔1928 m,是典型的天然高海拔淡水湖泊,其水源主要为冰川及积雪融水,常年低温(全年平均3~4℃).取样点选择在天山天池的主湖湖滨水陆交界带的水下沉积物,距岸线5.0 m的区域.取样时,主要选取0~20 cm的表层沉积物,取出后迅速用聚乙烯自封袋密封包好,放入便携式冰箱,冷藏保存(0~4℃).返回实验室后贮存于4℃冷库待用.
2.2 理化指标的测定沉积物样品的全氮(TN)、全碳(TC)、全硫(TS)和有机质的测定均按照《土壤农化分析》规范进行(鲍士旦,2000).氨氮和硝氮的浓度是用2 mol·L-1的KCl浸提2 h后,使用连续流动分析仪(SAN plus,Skalar Analytical B. V.,Netherl and s)测定.
2.3 DNA的提取和PCR扩增使用Fast DNA spin kit for soil(Bio101,USA)试剂盒进行沉积物样品的DNA提取.
厌氧氨氧化菌16S RNA采用巢式PCR扩增的方法,先使用引物46f和630R进行浮霉菌属的PCR扩增(Neef,1998;Juretschko,1998);再以稀释100倍的第一步PCR产物为模板,使用厌氧氨氧化菌特异引物368f和820r对厌氧氨氧化菌的16S RNA序列进行PCR扩增,最终得到片段长度为487 bp的有效扩增(Schmid,2003).
厌氧氨氧化菌 hzsB功能基因PCR扩增使用针对hzsB基因的引物AmxF和AmxR进行一步PCR扩增,得到片段长度为386 bp的有效扩增(Wang,2012).引物序列见表 1.
| 表 1 PCR扩增引物来源及反应程序 Table 1 The primer used in PCR and the source of the primer |
使用Promega Agarose Gel DNA(Promega,Madison,W I)凝胶纯化试剂盒对PCR产物进行切胶纯化,将回收的PCR产物用pGEM T-easy载体试剂盒(Promega,Madison,W I)做连接处理后,转入JM109感受态细胞中,进行克隆培养.将阳性克隆结果,放入液体培养基进行37 ℃恒温振荡培养24 h后,使用引物T7和SP6对菌液进行PCR检验,再将得到的阳性克隆子使用Hha I和 Mbo I 限制性内切酶做酶切分型后,挑取菌株进行测序.返回的测序结果使用DNA Star 软件去除载体序列后,在NCBI 数据库进行比对分析,与已发表的Anammox 16S RNA序列进行多重序列对齐,运用MEGA 4. 1 软件中NJ法(Neighbor-Joining)构建系统发育树.
2.5 厌氧氨氧化细菌丰度的测定用定量PCR来测定厌氧氨氧化细菌的丰度,定量PCR方法采用SYBR Green法.将测序返回的质粒使用ND2000超微量分光光度计(NanoDrop公司,美国)检测其质粒浓度,选取浓度为100~200 ng · μL-1,260/280值最接近2.0的质粒作为定量PCR的标线模板.为确保实验数据的可信度,该实验设制阴性对照,标线为7个标准样品,每个样品做两次平行,以基线(背景)荧光信号的标准偏差的10倍为阈值,得到CT值,并作出浓度与CT值的标准曲线,其扩增斜率为-4.2~-3.5之间,扩增效率不小于80%,且溶解曲线呈单一峰值.
厌氧氨氧化细菌定量使用与hzsB功能基因引物AmxF和AmxR(浓度为10 mmol · mL-1),和SYBR Green ExTaq 酶试剂盒(TARAKA公司),按比例配置成20 μL反应体系.使用ABI 7300 Real-Time PCR System扩增仪(美国BIO-RAD公司)进行定量PCR扩增(Wang,2012).定量PCR结果用7300 SDS System 配套软件进行分析运算,得出厌氧氨氧化细菌的丰度值.
2.6 厌氧氨氧化速率和反硝化速率的测定采用15N同位素示踪来测定厌氧氨氧化反应速率及对N2生成的贡献.取3.30 g左右的沉积物样品放入12.6 mL的Labco瓶中,同时放入2~3粒玻璃珠使之在反应时可以充分摇匀,向瓶内注满饱和氮气的无氧水,形成密闭无氧(缺氧)环境.在室温(20℃)环境下培养25 h以除去瓶中的NO3-,然后通过向瓶内加入一定浓度的15N同位素对样品进行3种不同的前处理:只加15NH4+(处理①);加入15NH4+和14NO3-(处理②);加入14NH4+和15NO3-(处理③).用旋转振荡器以室温(20℃)进行培养,分别在0、3、6、12、24 h向瓶内加入0.2 mL 7mol · L-1的ZnCl2溶液以终止反应进行.其中处理①、②分别为阴性和阳性对照,③为实验样品.
将终止反应后的样品在室温非阳光直射处静置沉淀,待样品明显分层后,在厌氧操作箱内取2 mL上清液,移入事先充满氦气的Labco瓶中,剧烈振荡1 min后使瓶内气体通过气相色谱-同位素比值质谱仪(Gasbench-MAT253),得到各时间点30N2和29N2的浓度值.
3 实验结果(Results) 3.1 理化指标通过化学分析测得样品的理化指标数据中,其总氮(TN)为1.522 g · kg-1,总碳(TC)为14.362 g · kg-1,总有机质为25.52 g · kg-1,与我国其它低人为扰动的淡水环境相近.沉积物样品中的氨氮(NH4+)和硝氮(NO3-)含量非常低,氨氮仅为0.81 mg · kg-1,而硝氮不高于0.1 mg · kg-1.
3.2 建立克隆文库对样品的厌氧氨氧化菌16S rRNA和hzsB 功能基因的PCR阳性结果作为模板分别构建克隆文库,各获得96个阳性克隆样品. 通过酶切分型后分别选取12个16S rRNA菌液样品和10个hzsB 功能基因菌液样品送测序公司后返回的结果.将返回的厌氧氨氧化菌序列在GenBank数据库中进行Blast比对,除一个hzsB功能基因菌液样品以外均为厌氧氨氧化菌阳性结果.使用CLUSTALX多重序列比对软件和DOTUR软件对所得的每个克隆序列进行多样性比较,发现厌氧氨氧化细菌的全部12个16S RNA序列都属于同一个操作分类单元(operational taxonomic unit,下文简称为OTU),相似度高于99%;而9个hzsB 功能基因序列分别属于3个OTU,其相似度为82%~97%.
3.3 构建系统发育树依据所得的16S rRNA克隆序列与已知的厌氧氨氧化菌16S rRNA序列,构建系统发育树如图 1所 示.由图中可以看出,天山天池的16S rRNA克隆序列,其生物多样性非常低,只有一个OTU,介于Brocadia菌和Jettenia菌之间,与后者关系更近.这一结果,与以往的同类研究有一定程度的相似性—在自然或人工的生态系统中发现的厌氧氨氧化菌群落,均呈现较低的生物多样性.例如,在海洋生态系统中,所有的厌氧氨氧化菌都属于C and idatus Scalindu属(Schmid,2007);而Kuenenia和Brocadia菌则常见于淡水湖泊与河流三角洲的沉积物中(Dale,2009等).
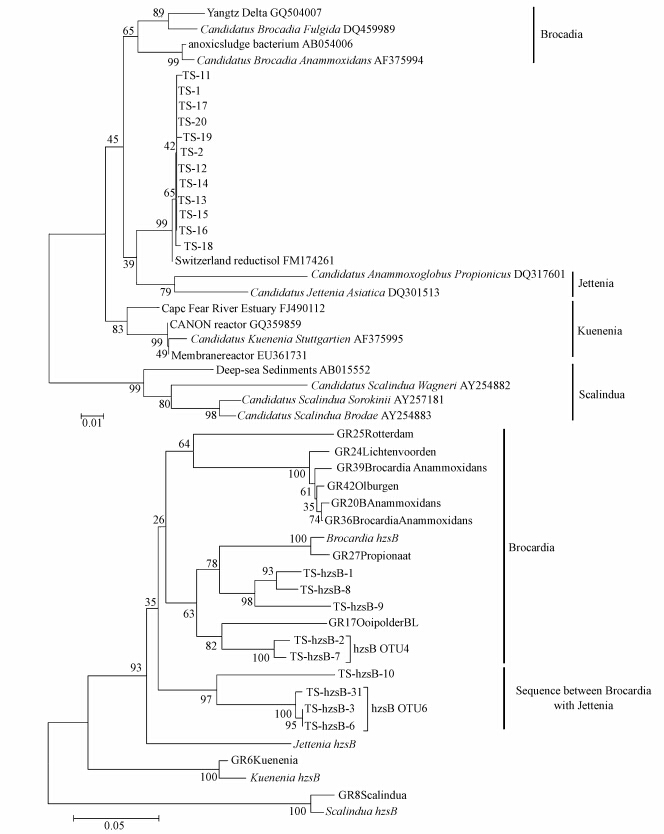 |
| 图 1 天山天池沉积物厌氧氨氧化细菌16S rRNA(上)和hzsB功能基因(下)系统发育树(本文中的参照序列引自GenBank 数据库,序列名称后的字母加数字代表提交序号,分支节点上的数字表示每1000次bootstrap分析所支持的次数,小于50则不显示.左下角图例线段表示1%序列差异的分支长度) Fig.1 Phylogenetic tree of anaerobic ammonia-oxidizing bacteria in the sediments of Tianshan Lake targeted on the 16S rRNA and hzsB functional gene(all the reference sequences in this paper were obtained from GenBank, and were listed by sequence accession number. The numbers next to the nodes represent the bootstrap values of 1000 replications; the scale bar represents 1 nucleotide substitutions per 100 nucleotides) |
将得到的hzsB功能基因克隆序列与已知的hzsB功能基因参比序列共同构建系统发育树(如图 1).从hzsB 功能基因序列的树图可以看到,天山天池的hzsB功能基因序列明显分为3个OTU,相似度为82%~97%.在这3个OTU中,有2个是属于Brocadia菌分支的,而另外1个OTU则介于Brocadia菌和Jettenia菌之间.相较于16S rRNA基因,hzsB 功能基因可以更好的体现出厌氧氨氧化细菌在该地的生物多样性,它能够截取到一些未知厌氧氨氧化菌的功能基因序列,从而更好的反映出厌氧氨氧化细菌在该地的丰度和多样性.
3.4 厌氧氨氧化菌的丰度通过7300 SDS 软件对定量PCR结果进行分析,得到天山天池沉积物样品的厌氧氨氧化细菌丰度为2.93×105±0.25×105 copy每克沉积物干样,其标线的扩增斜率为-3.62,溶解曲线在86°C呈现单一峰值,且阴性对照样品平行均无污染现象,证明该实验结果可信.而达到2.93×105 copy每克沉积物干样的丰度值说明,在天山天池这样的高海拔,低温,低氨氮硝氮的极端环境中,厌氧氨氧化细菌扔保持一定的数量.
3.5 厌氧氨氧化速率及氮气贡献率对同位素示踪实验数据处理后,得到结果见图 2.通过对①处理样品的结果进行测定,未发现有30N2和29N2出现,从而证明经过25 h的培养过后,样品中的NO3-已经消耗完,不会对后续的处理产生影响.在进行②处理的样品中,29N2的浓度随着时间的延长而增加,呈正相关分布,则说明在该处理方式下确实有厌氧氨氧化反应发生.只有在③处理中,30N2和29N2同时存在,且均随着时间的延长而增加,则说明在该反应处理中,同时存在着反硝化反应和厌氧氨氧化反应.在图 2中,将③处理的样品通过气相色谱-同位素比值质谱仪得到的数据通过公式(2)、(3)计算(叶磊,2010).
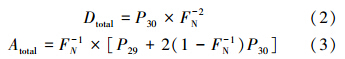
式中,Dtotal和Atotal分别为反硝化和厌氧氨氧化反应的总氮气生成量,P30、P29为通过质谱仪得到的30N2和29N2数据,再通过总氮气生成量对时间分别进行回归,从而得到该样品的反硝化和厌氧氨氧化反应速率见表 2.经统计得出:反硝化速率为0.24 nmol · g-1 · h-1,而厌氧氨氧化速率为1.162 nmol · g-1 · h-1,由此可知厌氧氨氧化过程在天山天池的沉积物中对氮气产生量的贡献率为82.88%.
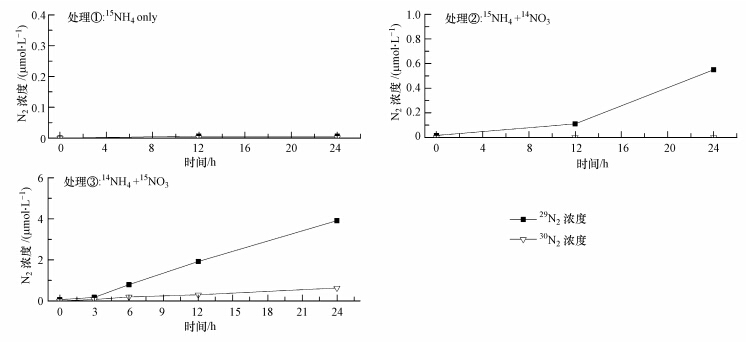 |
| 图 2 基于15N同位素示踪的天山天池沉积物样品中厌氧氨氧化和反硝化过程 Fig.2 Anaerobic ammonium oxidation coupled to nitrate reduction in the sediment sample of Tianshan Lake amended with 15N labeled on ammonium and nitrate separately |
| 表 2 天山天池沉积物厌氧氨氧化和反硝化速率 Table 2 The rate of Anammox and Denitrification in the sediment of Tianshan Lake |
本研究通过对样品DNA进行anammox菌16S rRNA和hzsB功能基因的PCR扩增,成功地在天山天池的沉积物中检测到了厌氧氨氧化菌.再分别对anammox菌的16S rRNA和hzsB功能基因构建克隆文库,并结合树图分析结果,可以看出,在天山天池的高海拔,低温,贫氮环境,低污染和人为扰动的生态系统中,仍然有厌anammox菌存在,但是其生物多样性相对单一,且与其它淡水湿地生态系统基本一致,说明这一部分anammox菌可能有较强的环境适应性,温度和海拔高度等外界环境因子对其生长影响不大.值得注意的是介于Brocadia菌和Jettenia菌之间的1个OTU(图 1),它们可能是某些尚未发现的厌氧氨氧化菌种——最近有研究表明,湿地土壤中存在一种介于Brocadia菌和Jettenia菌之间的未知Anammox菌(Hu,2011),这与本文中得到的结果相吻合.
虽然通过构建克隆文库得到的anammox菌的生物多样性相对单一,但通过定量PCR得到2.93×105 copy每克沉积物干样的丰度值,证明在这种高海拔,低温的极端环境下,anammox菌仍然有着一定的种群数量.而达到1.126 nmol · g-1 · h-1的厌氧氨氧化速率则说明,该地区的anammox菌仍然保持着一定的活性,这一数据与其它已有报道淡水湿地生态系统相当(Strous,1999;Kuypers,2003).这一结论,进一步证明了在该处anammox菌的存在,同时,这也说明,海拔高度和温度条件并不是限制anammox菌生长的关键因素.而该处的反硝化速率只有0.24 nmol · g-1 · h-1,比厌氧氨氧化速率低了很多,这可能是因为天山天池沉积物中本身极低的硝氮含量和硝化速率导致的;另一方面,藉由天然环境低温的限制,反硝化微生物的活性本身会受到一定的限制,因此在该生态系统中厌氧氨氧化过程有着高达82.88%的贡献率,这一数值远高于之前报道中淡水湿地和河口地区厌氧氨氧化4%~37%的贡献率(Schubert,2006;Erler,2008;Dale,2009),处于绝对主导地位.
在天山天池的高海拔、低温环境下anammox菌有着对氮气产生量如此高的贡献率,一方面是在该环境下anammox菌仍保有一定的种群数量,另一方面由于高海拔带来的强光照和冰渍湖泊的水体低温可能限制了硝化细菌的生长,极大的限制了NO3-的生成和沉积,底物的不足导致反硝化反应过程受限;而于此同时,自养生长的anammox菌发生的厌氧氨氧化反应却没有明显的受抑制特征,说明在该环境下并不缺少用于厌氧氨氧化反应的NO2-底物.因此推断在反硝化或者硝化反应的中间产物NO2-可能直接被用作厌氧氨氧化反应,进一步限制NO3-的生成.同时,天山天池地区几乎没有大规模的人工氮源输入,更接近于原始的自然氮循环系统,这意味着在自然界的厌氧/缺氧环境中,anammox菌存在相对单一的生物多样性的同时,保持对氮循环中N2生成的较高贡献率.在天山天池这种高海拔,低温的极端环境中发现有厌氧氨氧化菌的存在,进一步证实了厌氧氨氧化菌在陆地淡水生态系统中的广泛存在性.同时厌氧氨氧化菌在天山天池沉积物中所表现出的高活性和对该地生态系统中氮素循环的高贡献率,说明在高海拔,低温低氧条件下,相对于反硝化细菌,厌氧氨氧化菌可能对氮循环有着更大的贡献量.
| [1] | Bora n K, Wim G, Jetten M S M. 2011. Chapter four - Cultivation, Detection, and Ecophysiology of Anaerobic Ammonium-Oxidizing Bacteria[J]. Methods in Enzymology, 486: 89-108 |
| [2] | 鲍士旦.2000.土壤农化分析[M].北京:中国农业出版社 |
| [3] | Dale O R, Tobias C R, Song B. 2009. Biogeographical distribution of diverse anaerobic ammonium oxidizing(anammox) bacteria in Cape Fear River Estuary[J]. Environmental Microbiology, 11(5): 1194-1207 |
| [4] | Dalsgaard T, Thamdrup B. 2002. Factors controlling anaerobic ammonium oxidation with nitrite in marine sediments[J].Applied and Environmental Microbiology, 68(8): 3802-3808 |
| [5] | Erler D V, Eyre B D, Davison L. 2008. The contribution of Anammox and denitrification to sediment N2 production in a surface flow constructed wetland[J]. Environ Sci Technol, 42(24):9144-9150 |
| [6] | 范改娜,祝贵兵,王雨,等.2010.河流湿地氮循环修复过程中的新型功能微生物 [J].环境科学学报,30(8):1558-1563 |
| [7] | Hu B, Rush D, van der Biezen E, et al. 2011. New Anaerobic, Ammonium-Oxidizing Community Enriched from Peat Soil[J]. Applied and Environmental Microbiology, 77: 966-971 |
| [8] | Juretschko S, Timmermann G, Schmid M, et al. 1998. Combined molecular and conventional analyses of nitrifying bacterium diversity in activated sludge: Nitrosococcus mobilis and Nitrospira-like bacteria as dominant populations[J]. Applied and Environmental Microbiology, 9: 2364-2374 |
| [9] | Kuypers M M M, Lavik G, Wöbken D, et al. 2003. Massive nitrogen loss from the Benguela upwelling system through anaerobic ammonium oxidation[J]. Proceedings of the National Academy of Sciences, 102(18):6478-6483 |
| [10] | Mulder A, Vandegraaf A A, Robertson L A. 1995. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor[J]. FEMS Microbiology Ecology, 16(3): 177-183 |
| [11] | Neef A, Amann R, Schlesner H. 1998. Monitoring a widespread bacterial group: in situ detection of planctomycetes with 16S rRNA-targeted probes[J]. Microbiology-UK, 144: 3257-3266 |
| [12] | Risgaard-Petersen N, Meyer R L, Schmid M, et al. 2004. Anaerobic ammonia oxidation in an estuarine sediment[J]. Aquatic Microbial Ecology, 36(3):293-304 |
| [13] | Schmid M, Walsh K, Webb R, et al. 2003. Candidatus "Scalindua brodae", sp nov., Candidatus "Scalindua wagneri", sp nov., two new species of anaerobic ammonium oxidizing bacteria[J]. Systematic and Applied Microbiology, 26: 529-538 |
| [14] | Schmid M C, Risgaard-Petersen N, van de Vossenberg J, et al. 2007. Anaerobic ammonium-oxidizing bacteria in marine environments: widespread occurrence but low diversity[J]. Environmental Microbiology, 9(6): 1476-1484 |
| [15] | Schubert C J, Durisch-Kaiser E, Wehrli B, et al. 2006. Anaerobic ammonium oxidation in a tropical freshwater system (Lake Tanganyika) [J]. Environmental Microbiology, 8(10): 1857-1863 |
| [16] | Strous M, Fuerst J A, Kramer E H M, et al. 1999. Missing lithotroph identified as new planctomycete[J]. Nature, 400(6743): 446-449 |
| [17] | Wang S Y, Zhu G B, Jetten M S M, et al. 2012. Anammox bacterial abundance, activity and contribution in riparian sediments of the Pearl River Estuary[J]. Environmental Science & Technology, 46: 8834-8842 |
| [18] | Wang Y, Zhu G B, Harhangi H R, et al. 2012. Co-occurrence and distribution of nitrite-dependent anaerobic ammonium and methane-oxidizing bacteria in a paddy soil[J]. FEMS Microbiology Letters, 336(2):79-88 |
| [19] | 叶磊,祝贵兵,伦中财,等.2011.应用分子生物学与同位素示踪技术研究厌氧氨氧化菌活性及功效[J].环境科学学报,31(6): 1206-1211 |
| [20] | Zhang Y,Ruan X H, Op den Camp H J M, et al. 2007. Diversity and abundance of aerobic and anaerobic ammonium-oxidizing bacteria in freshwater sediments of the Xinyi River (China) [J]. Environmental Microbiology, 9(9): 2375-2382 |
| [21] | Zhu G B, Jetten M S M, Kuschk P, et al. 2010. Potential roles of anaerobic ammonia and methane oxidation in the nitrogen cycle of wetland ecosystems[J]. Applied Microbiology and Biotechnology. 86(4): 1043-1055 |
| [22] | Zhu G B, Wang S Y, Feng X J, et al. 2011. Anammox bacterial abundance, biodiversity and activity in a constructed wetland[J]. Environmental Science & Technology, 45(23): 9951-9958 |
| [23] | Zhu G B, Wang S Y, Wang W D, et al. 2013. Hotspots of anaerobic ammonia oxidation in land/freshwater interfaces[J]. Nature Geoscience, 6, 103-107 |
| [24] | Zhu G B, Peng Y Z, Li B K, et al. 2008. Biological Removal of Nitrogen from Wastewater[J]. Reviews of Environmental Contamination and Toxicology, 192:159-195 |
| [25] | Zhu G B, Wang S Y, Wang W D, et al. 2012. Hotspots of anaerobic ammonia oxidation in land/freshwater interfaces[J]. Nature Geoscience, 6: 103-107 |
 2015, Vol. 35
2015, Vol. 35


