2. 中国科学院上海应用物理研究所 熔盐化学与工程技术部 嘉定园区 上海 201800;
3. 中国科学院大学 北京 100049
2. Department of Molten Salt Chemistry and Engineering, Shanghai Institute of Applied Physics, Chinese Academy of Sciences, Jiading Campus, Shanghai 201800, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
CRISPR (Clustered regularly interspaced short palindromic repeat)基因编辑系统是生命进化历史上细菌和病毒进行斗争产生的免疫武器。目前,CRISPR/Cas9介导的强大的基因编辑工具已成功应用于各种真核生物、人类细胞系和细菌的基因组编辑[1-3]。
直接向细胞内输运CRISPR Cas9/gRNA核糖核蛋白复合物(Cas9 ribonucleoprotein complexes, Cas9 RNP)是进行各种基因编辑、基因表达调控和DNA/RNA成像研究的重要方法[4-7]。由于快速高效、脱靶率低、不需要优化密码子和启动子等,该方法易应用于进一步的基因治疗和临床研究中[8-10]。电转(Electroporation)是一种简单高效的蛋白转染方式[11]。应用该技术,不仅能将Cas9 RNP直接导入细胞质,而且能够使其穿过核膜进入细胞核,从而快速高效地对感兴趣的目标基因进行编辑[12]。因此,在基于电转技术的Cas9 RNP基因编辑研究中,首先研究不同电转条件对该复合物基因编辑效率的影响具有十分重要的意义。
本工作以电转Cas9 RNP进入人T淋巴细胞白血病Jurkat细胞为研究对象,考察了电压、脉冲长度及脉冲间隔等电转参数对该复合物靶向敲除编码免疫检查点的PD-1基因效率的影响,并评估了不同电转条件下细胞的存活率,研究结果为其更好地应用于基因编辑领域打下了基础。
1 实验材料 1.1 实验试剂大肠杆菌E. coli BL21(DE3)和DH5α感受态购自天根生化科技(北京)有限公司。
氨苄青霉素,Caspase-3活性检测试剂盒购自碧云天生物技术;蛋白酶抑制剂混合物(cOmplete Tablets EDTA-free)购自罗氏试剂公司;异丙基硫代半乳糖苷(Isopropyl β-D-Thiogalactoside, IPTG)、咪唑、溶菌酶购自Sigma-Aldrich上海贸易有限公司;质粒小提试剂盒购自天根生化科技(北京)有限公司;Ni-NTA亲和树脂购自德国QIAGEN公司;胎牛血清(Fetal bovine serum, FBS)、RMPI-1640培养基购自美国GIBCO公司;Agarose琼脂糖(A21813)购自美国Bio-Rad公司;限制性内切酶BbsI、SmaI,T7核酸内切酶1(T7E1),T4 DNA连接酶,Q5高保真DNA聚合酶购自英国NEB公司;DNA纯化试剂盒、细胞基因组提取试剂盒、T7体外转录试剂盒购自大连TaKaRa公司。
1.2 主要仪器HYL-C小型组合式摇床:强乐实验设备有限公司;超声破碎仪(Q800R2):美国QSonica公司;高速离心机(5417R):德国Eppendorf公司;电泳仪(PowerPac):美国Bio-Rad公司;凝胶成像系统(G:BOX):美国Syngene公司;二氧化碳细胞培养箱(3423)、细胞电转仪(Invitrogen Neon):美国Thermo Fisher Scientific公司。
2 实验方法 2.1 Cas9蛋白的表达纯化pET-Cas9-NLS-6xHis质粒(由David Liu赠予,Addgene plasmid # 62933)加入感受态细胞,42 ℃热击,加入LB培养基,37 ℃、150 r·min-1培养1.5h,将菌液涂布在含氨苄青霉素(100 μg·mL-1)的LB固体培养基上,37 ℃培养过夜。挑取单克隆,接种在LB液体培养基中继续培养,待菌液光密度(Optical Density, OD600)值达到0.6~0.8,加入1mmol·L-1 IPTG,18 ℃下继续培养16 h。离心收集菌体,SDS-PAGE凝胶电泳检测Cas9融合蛋白的表达。
超声破碎菌体,Ni-NTA亲和树脂纯化Cas9蛋白[13-14]。设置不同的洗脱频数,收集洗脱样品,SDS-PAGE凝胶电泳和Western Blot检测Cas9蛋白纯度。
2.2 sgRNA的体外转录线性化载体pUC57-T7-sgRNA质粒(2842 bp,Invitrogen)。酶切体系(10 μL)如下:pUC57-T7- sgRNA质粒2 μg;BbsI 100/U,1 μL,37 ℃孵育20 min。1%琼脂糖凝胶电泳进行验证,并割胶回收线性化后的质粒。
重构sgRNA载体质粒。根据目的基因合成sgRNA序列(表 1,cgRNA为非靶向无关序列)[15],退火形成含粘性末端的双链。退火体系:双链2 μL,线性化载体质粒100 ng,按T4 DNA连接酶试剂盒方法连接。产物转化后,挑取阳性克隆扩增培养,质粒小提试剂盒提取质粒,测序鉴定。
| 表 1 构建靶向PD-1基因的sgRNA载体质粒的序列 Table 1 Oligonucleotides for generating sgRNA expression vectors |
sgRNA的体外转录。SmaI酶切重构的质粒,1%琼脂糖凝胶电泳后,割胶回收质粒。以该质粒为转录模板,T7体外转录试剂盒转录sgRNA。
2.3 Cas9蛋白活性鉴定300nmol·L-1 (330 ng) Cas9蛋白与360nmol·L-1 (150 ng) sgRNA在Cas9蛋白缓冲液(50 mmol·L-1 NaH2PO4·H2O,1 mol·L-1 NaCl,1 mmol·L-1 MgCl2·6H2O,30%甘油,1 mmol·L-1二硫苏糖醇(Dithiothreitol, DTT))中25 ℃孵育10 min,组装成Cas9 RNP复合物。以Cas9 RNP:DNA=5:1或10:1的摩尔比加入PD-1基因的DNA序列模板(由Invitrogen合成),37 ℃酶切90 min后,使用1%琼脂糖凝胶电泳进行验证。
2.4 细胞培养人急性淋巴细胞白血病细胞(Jurkat细胞),购于中国科学院上海典型培养物保藏委员会细胞库。细胞培养于RMPI-1640培养基(含链霉素100μg·mL-1,青霉素100 U·mL-1,谷氨酰胺4mmol·L-1,10%灭活的FBS)中。培养条件为5% CO2,温度37 ℃。
2.5 电转Cas9 RNP进细胞2×106细胞分散于10 μL的电转缓冲液中,加入Cas9 RNP复合物(Cas9 1500 ng,sgRNA 500 ng),混匀加入电转杯,在不同的条件下电转后,继续培养48 h。
2.6 T7E1酶切检测电转Cas9 RNP基因敲除效率基因组DNA提取试剂盒(TaKaRa,货号No.9765)提取基因组DNA。按PCR试剂盒扩增基因组中PD-1片段(长度390 bp),PCR引物见表 2。PCR产物回收试剂盒纯化回收产物。
| 表 2 PCR扩增PD-1基因的引物序列 Table 2 Sequences of primers for PCR amplification of PD-1 gene |
取200 ng PCR产物进行退火复性,退火程序如下:1) 95 ℃保持5 min;2) 95~85 ℃,以-2 ℃·s-1的速率降低温度,共执行5个循环;3) 85~25 ℃,以-0.1 ℃·s-1的速率降低温度,共执行600个循环;4) 25 ℃保持1 min;5) 4 ℃保存。在10 μL体系中加入0.4 μL的T7E1酶,37 ℃,酶切0.5~1 h,加入1 μL 10×上样缓冲液,65 ℃水浴10 min,2%琼脂糖凝胶电泳检测基因敲除效率。
2.7 电转Cas9 RNP的生物安全性评估不同条件电转实验组细胞,电转后继续培养48h,MTT法检测细胞存活率(V)。计算公式:V(%)=(ODtreat-ODblank)/(ODcontrol-ODblank)×100%。。
裂解细胞,Caspase-3活性检测试剂盒进行检测。反应体系为10 μL细胞裂解液,80 μL反应缓冲液,10 μL Caspase-3底物,37 ℃孵育4 h后,使用酶标仪测OD 405 nm吸光值。
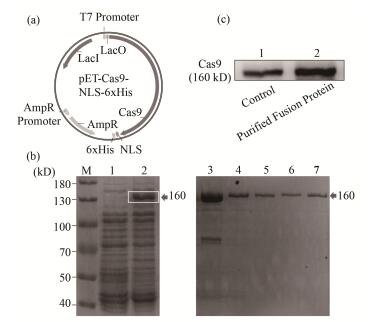
3 实验结果 3.1 Cas9蛋白的表达和活性鉴定我们首先选择了应用最广的酿脓链球菌(Streptococcus pyogenes) Cas9,通过在大肠杆菌中的过量表达,成功获得了C端融合核定位序列的重组Cas9蛋白,分子量160 kD。经Ni亲和柱纯化,咪唑缓冲液洗涤数次后,得到纯化的单一蛋白。免疫印迹结果进一步证明纯化的蛋白是Cas9(图 1)。
|
图 1 Cas9蛋白的表达和纯化 (a) pET-Cas9-NLS-6xHis质粒图谱,(b) SDS-PAGE电泳分析(泳道1和2分别为对照组和表达组菌液蛋白裂解液,泳道3~7分别为洗涤3、5、7、9和11次后的蛋白溶液),(c) Western Blot分析 Figure 1 Expression and purification of Cas9 protein (a) Plasmid map of pET-Cas9-NLS-6xHis, (b) SDS-PAGE analysis (Lane 1 and 2 are total protein extracts of the control and induced cells, respectively; Lane 3 to 7 are column wash fractions after 3, 5, 7, 9 and 11 washes, respectively), (c) Western Bolt analysis |
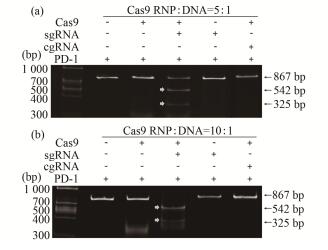
该蛋白和体外转录的识别免疫检查点PD-1的sgRNA孵育,得到的Cas9/sgRNA复合物可以高效切割PD-1基因(序列全长867 bp)。并且,在Cas9 RNP与DNA比例为10:1时,对PD-1基因的酶切效率达到100%(图 2)。
|
图 2 Cas9活性鉴定,当Cas9蛋白和sgRNA组装成Cas9 RNP复合物后才具有酶切PD-1基因DNA序列的活性 (a) Cas9 RNP: DNA= 5:1,(b) Cas9 RNP: DNA= 10:1 Figure 2 Cas9 activity assessment using PD-1 gene as substrate Only Cas9 complexed with sgRNA can digest the DNA (a) Cas9 RNP: DNA= 5:1, (b) Cas9 RNP: DNA= 10:1 |
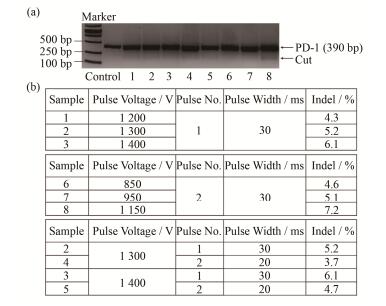
以人T淋巴细胞白血病Jurkat细胞为研究对象,考察了不同电压、脉冲次数及脉冲宽度下Cas9 RNP靶向敲除PD-1基因的效率。结果发现(图 3)在脉冲次数为1,脉冲宽度为30 ms时,编辑效率随着电压而升高(1200~1400 V)。然后,我们在选用较低电压的情况下(850~1150 V),将脉冲次数设定为2,脉冲宽度设定为30 ms,发现基因编辑效率也是随着电压而升高。当电压为1150 V时,编辑效率最高达到7.2%。我们考察了不同的脉冲次数和脉冲宽度组合对基因编辑效率的影响,发现在同一电压下(1300 V或1400 V),较少的脉冲次数和较大的脉冲宽度组合(1脉冲30 ms组合)更有利于提高基因编辑效率。综上所述,我们发现脉冲宽度为30 ms,电压和脉冲次数为1300 V/1、1400 V/1、950 V/2、1150 V/2组合时,基因编辑效率都高于5%。
|
图 3 不同电转条件下Cas9 RNP靶向敲除目的基因的效率(a) T7E1检测,(b)电转条件和相应的编辑效率 Figure 3 Electroporation conditions for CRISPR/Cas9-mediated genome editing (a) Gene editing efficiency detected by T7E1 cleavage assay, (b) Electroporation conditions and their corresponding gene editing efficiencies |
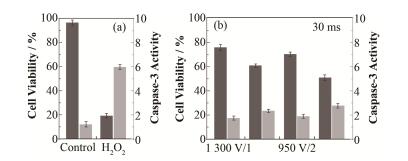
筛选得到具有较高基因编辑效率的电转条件后,我们进一步考察了这些电转条件对细胞的生物相容性。结果显示(图 4):脉冲宽度为30 ms,电压和脉冲次数为1300 V/1、1400 V/1、950 V/2和1150 V/2条件下,细胞存活率分别为(75.9±2.1)%、(60.9±1.3)%、(70.3±1.5)%和(50.9±1.4)%,细胞凋亡相关的半胱氨酸蛋白酶Caspase-3活性测定结果和MTT结果趋势一致。由此总结得出,脉冲宽度为30 ms、电压为1300 V、脉冲次数为1条件下,电转Cas9 RNP进入细胞能够实现较高的基因编辑效率,同时对细胞的毒性较小。
|
图 4 不同电转条件介导Cas9 RNP进细胞的生物相容性研究,分别检测了细胞存活率和Caspase-3活性(a)不处理组为正常对照,H2O2 (100 μmol·L-1,24 h)处理组为诱导细胞凋亡的阳性对照,(b)不同电转条件下Cas9 RNP进入细胞 Figure 4 Biocompatibility assessment of electroporation for the cellular delivery of Cas9 RNP. Cell viability and Caspase-3 activity determination (a) Cells without any treatment were used as control. Cells with 24 h 100 μmol·L-1 H2O2 treatment were used as positive controls for apoptosis induction, (b) Cells were treated with Cas9 RNP using various electroporation conditions |
选择合适的电转条件,使得在获得高转染效率的同时细胞也处于较好的存活状态,是Cas9 RNP复合物发挥有效细胞内基因编辑作用的关键。本工作考察了电压、脉冲次数和脉冲宽度等电转参数对Cas9 RNP的细胞内基因编辑效率的影响,得到了脉冲宽度、电压、脉冲次数为30 ms/1300 V/1最佳组合条件,同时安全性评估结果显示该条件对细胞的毒性较小。
但是,我们也发现该组合条件下,Cas9 RNP靶向敲除Jurkat细胞中PD-1基因的效率仍只有5.2%,后续的研究中,除了上述电转参数外,我们将进一步优化细胞密度、Cas9蛋白和sgRNA序列的配比、电转缓冲液中各组分的浓度等,以期获得更好的基因编辑效果,从而将电转技术更好地应用于CRISPR / Cas9系统介导的生物医学应用中。
| [1] |
Hsu P D, Scott D A, Weinstein J A, et al. DNA targeting specificity of RNA-guided Cas9 nucleases[J]. Nature Biotechnology, 2013, 31(9): 827-832. DOI:10.1038/nbt.2647 |
| [2] |
Hsu P D, Lander E S, Zhang F. Development and applications of CRISPR-Cas9 for genome engineering[J]. Cell, 2014, 157(6): 1262-1278. DOI:10.1016/j.cell.2014.05.010 |
| [3] |
Sander J D, Joung J K. CRISPR-Cas systems for editing, regulating and targeting genomes[J]. Nature Biotechnology, 2014, 32(4): 347-355. DOI:10.1038/nbt.2842 |
| [4] |
Kim S, Kim D, Cho S W, et al. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins[J]. Genome Research, 2014, 24(6): 1012-1019. DOI:10.1101/gr.171322.113 |
| [5] |
Woo J W, Kim J, Kwon S I, et al. DNA-free genome editing in plants with preassembled CRISPR-Cas9 ribonucleoproteins[J]. Nature Biotechnology, 2015, 33(11): 1162-1164. DOI:10.1038/nbt.3389 |
| [6] |
Zuo X L, Fan C H, Chen H Y. Biosensing:CRISPR-powered diagnostics[J]. Nature Biomedical Engineering, 2017, 1: 0091. DOI:10.1038/s41551-017-0091 |
| [7] |
Nelles D A, Fang M Y, O'Connell M R, et al. Programmable RNA tracking in live cells with CRISPR/Cas9[J]. Cell, 2016, 165(2): 488-496. DOI:10.1016/j.cell.2016.02.054 |
| [8] |
Wu Y, Liang D, Wang Y, et al. Correction of a genetic disease in mouse via use of CRISPR-Cas9[J]. Cell Stem Cell, 2013, 13(6): 659-662. DOI:10.1016/j.stem.2013.10.016 |
| [9] |
Yin H, Song C Q, Dorkin J R, et al. Therapeutic genome editing by combined viral and non-viral delivery of CRISPR system components in vivo[J]. Nature Biotechnology, 2016, 34(3): 328-333. DOI:10.1038/nbt.3471 |
| [10] |
Remy S, Chenouard V, Tesson L, et al. Generation of gene-edited rats by delivery of CRISPR/Cas9 protein and donor DNA into intact zygotes using electroporation[J]. Scientific Reports, 2017, 7(1): 16554. DOI:10.1038/s41598-017-16328-y |
| [11] |
Zu Y, Huang S, Liao W C, et al. Gold nanoparticles enhanced electroporation for mammalian cell transfection[J]. Journal of Biomedical Nanotechnology, 2014, 10(6): 982-992. DOI:10.1166/jbn.2014.1797 |
| [12] |
Schumann K, Lin S, Boyer E, et al. Generation of knock-in primary human T cells using Cas9 ribonucleoproteins[J]. Proceedings of the National Academy of Sciences, 2015, 112(33): 10437-10442. DOI:10.1073/pnas.1512503112 |
| [13] |
Yan Q L, Kong H T, Xia K, et al. Expression and radiolabeling of Cas9 protein[J]. Nuclear Science and Techniques, 2017, 28(1): 11. DOI:10.1007/s41365-016-0165-8 |
| [14] |
D'Astolfo D S, Pagliero R J, Pras A, et al. Efficient intracellular delivery of native proteins[J]. Cell, 2015, 161(3): 674-690. DOI:10.1016/j.cell.2015.03.028 |
| [15] |
Su S, Hu B, Shao J, et al. CRISPR-Cas9 mediated efficient PD-1 disruption on human primary T cells from cancer patients[J]. Scientific Reports, 2016, 6: 20070. DOI:10.1038/srep20070 |


