2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
熔盐堆是四代堆中唯一的液态燃料反应堆,其最主要特征是使用熔融氟盐作为核燃料载体盐和冷却剂。在钍基液态燃料熔盐堆中,核燃料以氟化物(ThF4、UF4等)形式均匀溶解在由LiF(7Li丰度大于99.95%)和BeF2组成的载体盐中,构成无固定几何形状的可流动液态燃料盐,这种存在形式使不停堆在线燃料处理和燃料循环成为可能。也基于此,熔盐堆被公认为是实施钍铀循环的最佳堆型之一[1]。
钍的分离和再利用是熔盐堆实施闭式燃料循环策略中必不可少的一个环节。在中国科学院上海应用物理研究所提出液态燃料钍基熔盐堆燃料处理概念流程中,采取了氟化挥发法分离铀、减压蒸馏法分离载体盐、熔盐电解法分离钍的技术路线。燃料盐经过氟化挥发和减压蒸馏后,ThF4与裂变产物的氟化物共存[2]。钍与裂变产物特别是与化学性质相似的镧系元素的分离是熔盐电化学法分离回收钍的关键。在熔盐电化学常用的熔盐体系中,LiCl-KCl熔盐拥有更宽的电化学窗口、更低的共熔点温度、更正的Th析出电位,以及在乏燃料处理领域拥有相当广泛的应用经验[3-5],因此选择该体系作为ThF4与裂变产物电化学分离的介质。
迄今为止,国际上不少学者已经对LiCl-KCl熔盐中镧系元素的电化学行为及其与锕系元素的电解分离进行了研究。例如,Sakamura等[6]对LiCl-KCl熔盐中Ce3+在固态惰性阴极上的电化学行为进行了研究,指出Ce3+在阴极上的还原是一步三电子转移的过程;他们比较了La、Ce、Nd、Gd 4种镧系元素与U、Pu、Am、Np 4种锕系元素的标准电极电位,发现可以通过电化学方法将锕系元素从熔盐中还原以实现镧锕分离;Misra等[7]研究了多组分镧系氯化物的存在对LiCl-KCl熔盐中特定镧系离子的电化学行为的影响,发现加入其他镧系氯化物,目标镧系离子的还原电位发生正移;Castrillejo等[8]研究了LiCl-KCl熔盐中多种镧系金属离子分别在固态电极、液态电极以及活性电极上的电化学行为。研究显示:因与电极形成金属间化合物,Ln3+/Ln电对在液态阴极和活性电极上的氧化还原电位均比固态阴极上的更正。另外,还有其他研究团队也对一种或多种镧系元素在熔盐中的电化学行为进行了研究[9-12]。
然而,以上这些研究基本都在纯氯化物熔盐的体系中进行,在LiCl-KCl体系中实现含氟镧锕化合物(如LnF3与ThF4)的电解分离有许多尚待解决的问题,如Th4+和Ln3+在ThF4-LnF3-LiCl-KCl混合体系中的电化学行为,F-的存在和随电解导致的浓度积累对阳极过程、Th4+和Ln3+电化学行为以及离子电解还原过程的影响等。在我们之前的工作中开展了ThF4 (w=3%)在LiCl-KCl体系的电化学行为研究[13],表明F-离子的存在并不影响Th4+在电极上的还原反应,Th4+→Th的还原电位为-1.67V(相对于Ag/AgCl),通过实施脉冲电解法获得了85%以上钍的分离率,但也发现F-较强的络合能力,该体系中Th4+的扩散系数略小于纯氯盐体系,扩散活化能则明显增加[13]。本工作采用循环伏安法(Cyclic Voltammetry, CV)和方波伏安法(Square Wave Voltammetry, SWV)研究了几种具有代表性的镧系元素离子在LnF3-LiCl-KCl体系中的电化学行为,研究结果将有助于评估在氯盐体系中进行电化学方法分离TMSR燃料中钍和镧系元素的可行性。
1 实验部分 1.1 试剂与材料实验用的LiCl、KCl、CeF3、GdF3、NdF3、EuF3、SmF3均购自Sigma-Aldrich,纯度为99.99%。作为工作电极(Working Electrode, WE)的W丝(⌀ 1.0mm, S=0.227cm2)购自Alfa-Aesar公司;作为对电极(Counter Electrode, CE)的石墨棒(光谱纯,⌀3mm×50mm)购自烟台美尔森石墨有限公司;参比电极(Reference Electrode, RE)为自制的Ag/AgCl (x=5%)-LiCl-KCl参比电极[14]。
1.2 熔盐制备实验操作在自行研制的与氩气手套箱相连的电加热炉内进行[15-16],设计的最高炉温为1273K。
按n(LiCl):n(KCl)=59:41的比例在手套箱内称取LiCl和KCl粉末;混合均匀后转移至刚玉坩埚内,将刚玉坩埚放入电炉内,密封炉膛;将电炉升温至573 K,在该温度下保温2h,以除去微量水分;然后将电炉加热至773K,并保温12h,使共晶盐充分混合;缓慢冷却至室温;取块状熔盐,在手套箱内研磨备用。
在电化学实验之前,称取一定量LnF3,使熔盐中LnF3的浓度w=3%。采用上述相同的方法,制备LnF3-LiCl-KCl熔盐,最后将制备好的熔盐温度保持在773K,用于后续的电化学实验。
1.3 Ln3+的电化学性质测量所有电化学测试和电解均使用石墨为对电极,W丝为工作电极,Ag/AgCl作参比电极。将电极插入到LnF3-LiCl-KCl熔盐中,保持工作电极的插入深度为7mm。使用AUTOLAB PGSSTAT 302N电化学工作站进行实验,使用的软件为Nova 1.9。采用循环伏安法和方波伏安法测量LnF3-LiCl-KCl体系中Ln3+的电化学行为。
2 结果与讨论 2.1 Ln3+的电极反应过程图 1是773K下在0~-2.63V(相对于Ag/AgCl)范围内扫描速率0.10V·s-1得到的w=3% CeF3-LiCl- KCl体系的伏安曲线。在未加入CeF3的LiCl-KCl熔盐体系(即空白体系)的循环伏安曲线中,只观察到一对位于-2.60V(相对于Ag/AgCl)处的氧化还原峰。根据文献报道和该体系的组成,该氧化还原峰对对应熔盐的窗口电位,即Li++e-↔Li的反应电位[17]。对于CeF3-LiCl-KCl体系,除了窗口电位的氧化还原峰,在-2.21V和-2.00V(相对于Ag/AgCl)处还有一对尖锐的氧化还原峰。与空白熔盐体系相比,该体系中仅增加了CeF3,因此认为该氧化还原峰对是由Ce3+在电极上的反应所致。
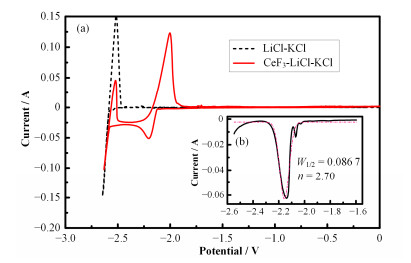
|
图 1 773 K下LiCl-KCl和w=3% CeF3-LiCl-KCl熔盐体系中CV曲线(a)以及w=3% CeF3-LiCl-KCl熔盐体系中SWV曲线(b) Figure 1 Cyclic voltammograms of LiCl-KCl eutectic and CeF3-LiCl-KCl (w=3% CeF3) molten salt on a W electrode (S = 0.227 cm2) (a), and square wave voltammogram of CeF3-LiCl-KCl molten salt system (b) at 773 K |
为确定Ce3+在电极上反应的转移电子数,对CeF3-LiCl-KCl体系进行了方波伏安扫描,频率设置为10Hz,见图 1。方波伏安图中有一个明显的还原峰,根据式(1)[18]可以计算电极反应的电子转移数:
| $ W_{1/2}^{} = 3.52RT/nF $ | (1) |
式中:W1/2是峰的半峰宽;R是气体常数;F是法拉第常数;n是反应的电子转移数;T是温度,K。计算得到电子转移数为2.70。因此,认为该电极反应是Ce3+一步还原成Ce的反应,即Ce3++3e-→Ce。
图 2(a)是在-2.40~-1.80 V(相对于Ag/AgCl)范围内改变扫描速率获得的一系列w=3% CeF3-LiCl-KCl体系循环伏安曲线。从图 2中可以观察到,氧化峰电位与还原峰电位之差ΔEp远大于0.153/n(2.3RT/nF,n为转移电子数),且随着扫描速率的增大,Ce3+的还原峰电位向负方向移动,氧化峰电位逐渐向正方向移动,ΔEp逐渐增大。氧化峰电流与还原峰电流比值(Ipa/Ipc)也是判断反应可逆性的标准,虽然在CV扫描中氧化峰和还原峰均成对出现,但是Ipa/Ipc的比值大于1(以扫描速率0.10V·s-1时获得的循环伏安曲线为例,Ipa/Ipc为2.7)。以上这些数据表明:Ce3+离子在LiCl-KCl熔盐中的氧化还原反应是准可逆电极过程。
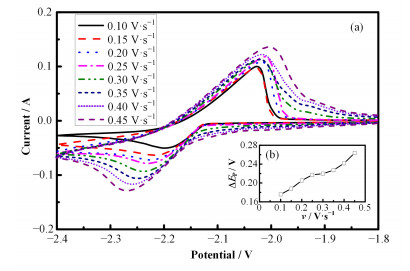
|
图 2 773 K下w=3% CeF3-LiCl-KCl熔盐体系中循环伏安曲线(a)和峰电位之差随扫描速率的变化(b) Figure 2 Cyclic voltammograms of CeF3-LiCl-KCl (w=3% CeF3) molten salt at scan rates ranging from 100 mV·s-1 to 450mV·s-1 on a W electrode at 773K (a), potential difference between oxidation and reduction peaks (∆Ep = Epa-Epc) obtained from cyclic voltammograms with different scan rates (b) |
使用同样的方法测量了GdF3、NdF3、SmF3和EuF3在LiCl-KCl体系中的电极反应过程(见图 3和4)。从图 3、4中可以发现,Gd3+和Ce3+的电化学过程非常类似,在电极上均为一步还原为金属,氧化峰和还原峰非对称,为准可逆反应;而Sm3+和Eu3+只能还原为二价离子,氧化峰和还原峰较为对称且ΔEp≈0.153/n (n=1),发生可逆的单电子还原反应;Nd3+的还原过程则比较复杂,通过两步反应还原为金属。将这5种具有代表性的镧系元素的研究结果与纯氯盐体系进行了比较(表 1),发现参与反应的离子种类和电极反应的转移电子数均与纯氯盐体系中相同,这说明熔盐中引入的少量F-并没有改变镧系离子在惰性电极上电极反应过程,这与Th4+的研究结果一致[13, 19]。本工作中得到的还原峰电位Epc(相对于Ag/AgCl)结果比文献报道的结果虽然略有负移,但总体来说一致性较好。电极电位测量差异的原因可能是参比电极内参盐中AgCl的浓度不同[20-21]。
| 表 1 773 K下Ln3+在LiCl-KCl熔盐中的扩散系数 Table 1 Diffusion coefficient of Ln3+ in LiCl-KCl molten salt at 773 K |
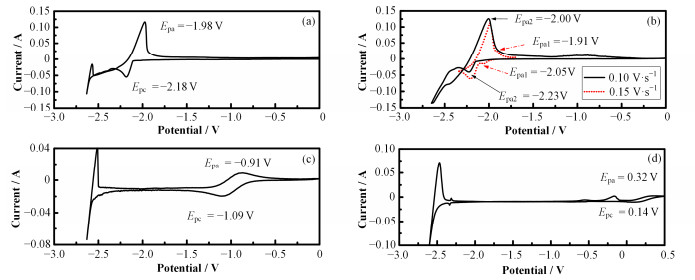
|
图 3 773 K下w=3% LnF3-LiCl-KCl熔盐体系中循环伏安曲线(a) GdF3,(b) NdF3,(c) SmF3,(d) EuF3 Figure 3 Cyclic voltammograms of LnF3-LiCl-KCl (w=3% LnF3) molten salt on a W electrode at 773K (a) GdF3, (b) NdF3, (c) SmF3, (d) EuF3 |
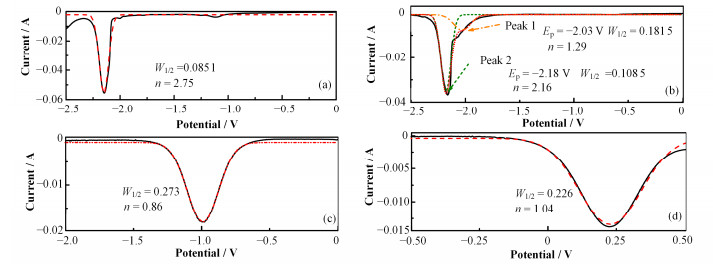
|
图 4 773K下w=3% LnF3-LiCl-KCl熔盐体系中的SWV曲线(a) GdF3,(b) NdF3,(c) SmF3,(d) EuF3 Figure 4 Square wave voltammogram of LnF3-LiCl-KCl (w=3% LnF3) molten salt on a W electrode at 773K (a) GdF3, (b) NdF3, (c) SmF3, (d) EuF3 |
据文献[31]报道,在773 K时实现三价或四价An元素阳离子与Ln元素分离所需要的电位差与体系中两者从熔盐中的提取率η有关,当ηAn = 99.999%和ηLn = 0.01%时,对于四价An金属阳离子与Ln的分离需要的最小电位差为0.19 V。在我们之前的工作中,已经对Th(Ⅳ)在w=3% ThF4-LiCl- KCl熔盐中的电化学行为进行了详细研究,该体系下Th(Ⅳ)在惰性电极上的还原峰电位约为-1.83V[13]。表 2给出了钍和以上几种镧系元素在惰性电极(W阴极)上的析出电位差ΔE,实验数据表明:在LiCl-KCl熔盐体系中实现Th与Ln的分离在理论上是可行的。
| 表 2 钍和部分镧系元素在W阴极上的析出电位差ΔE(相对于Ag/AgCl) Table 2 Difference of deposition potential between Th and Lanthnides on W electrode (vs. Ag/AgCl) |
需要特别指出的是,在LiCl-KCl熔盐的电化学窗口内,Sm3+和Eu3+只能还原成低价态离子Sm2+和Eu2+,且还原电位均比Th4+的还原电位更正。这个现象表明:在使用电化学方法分离Th4+和Ln3+的过程中,当金属Th从阴极上析出时,Sm3+和Eu3+也会在阴极上被还原成Sm2+和Eu2+。这两种离子的还原产物在熔盐中都是溶解性的离子,极易从阴极还原区向阳极氧化区扩散,并将在阳极被氧化为相应的氧化态离子。在这种可逆的电化学反应中,溶解性离子的氧化态和还原态由于离子的扩散作用在阴阳极上发生反复变价,将会引起电流和电能的消耗和浪费,从而降低Th电解过程的电流效率。
2.2 Ln3+的扩散行为在大部分电化学反应体系中,离子的扩散是一个缓慢的过程,往往是电极反应的速率控制步骤。离子的扩散速度常决定了电化学反应的速度,扩散系数越大,电极的大电流放电能力越好,对电解过程来说,离子扩散的快慢最终会影响电解的效率与电流效率。因此,在电极过程中,离子扩散系数是一个重要参数,扩散系数的测量也是研究电极动力学性能的重要手段。在本工作中,我们对Ln3+在熔盐中的扩散系数进行了测量。
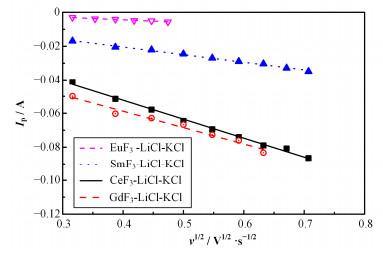
通过改变扫描速率,可以得到LnF3-LiCl-KCl熔盐体系的一系列循环伏安曲线。曲线中的还原峰电流Ipc与扫描速率的平方根v1/2存在线性关系(图 5),对于有单质析出的准可逆体系,可以根据Berzins-Delahay方程[32],计算Ln3+的扩散系数:
|
图 5 773K下LnF3-LiCl-KCl (w=3% LnF3)熔盐体系中Ln3+还原峰电流与扫描速率平方根的关系 Figure 5 Dependence of cathodic current (Ipc) on square root of sweep rate (v) at 773 K in LnF3-LiCl-KCl (w=3% LnF3) system |
| $ I_{{\rm{pc}}}^{} = - 0.61(nF)_{}^{3/2}(RT)_{}^{ - 1/2}Scv_{}^{1/2}D_{}^{1/2} $ | (2) |
对于纯离子间反应的可逆体系,可以通过Randles-Sevcik[33]方程获得Ln3+的扩散系数:
| $ I_{{\rm{pc}}}^{} = - 0.446nFSc(nFD)_{}^{1/2}(RT)_{}^{ - 1/2}v_{}^{1/2} $ | (3) |
式中:Ipc是还原峰电流;n是反应的电子转移数流;F是法拉第常数;R是气体常数;S是电极面积;c是Ln(Ⅲ)的浓度;v是扫描速率;T是温度,K。
通过式(2)和(3)计算得到773K时Ln3+扩散系数。表 3为Ln3+在LiCl-KCl熔盐中的扩散系数比较。数据表明:Ln3+在含F-的熔盐中的扩散系数低于其在纯氯盐体系中的数值,大部分离子的扩散系数有数量级的差异。导致这种差异可能有两方面原因:一是各实验中使用的Ln3+浓度不同,浓度差异可能导致扩散系数有所变化。如Caravaca等[25]和Bermejo等[34]的实验中Gd3+的浓度分别为1.19× 10-3mol·cm-3和1.04×10-4mol·cm-3,均小于本文实验中的2.17×10-4mol·cm-3。离子的扩散系数随离子浓度而改变的现象,在其他镧系元素研究中也有发现,如Wang等[35]发现LiCl-KCl熔盐中La3+的扩散系数随离子浓度的增加而减小;另一个原因可能来自于熔盐体系中引入的F-离子。由于F-的强络合作用,F-与Ln3+形成稳定的大团簇络合物,这种大团簇的形成会导致Ln3+的扩散系数减小。这种情形在文献中也有类似的报道,如Tumidajski等[36]使用电势滴定法研究发现,在引入F-的氯化物熔盐中,由于形成ThF62-络合物,Th4+活性降低。Delpech[19]的计算结果也表明:稳定钍氟络合物的形成使得Th4+的扩散系数明显降低。Ln3+与Th4+在熔盐中的化学性质类似,也可能存在LnFn(n-3)-络合物,使得体系中Ln3+的活度降低,从而降低其扩散性能。
| 表 3 773 K下Ln3+在LiCl-KCl熔盐中的扩散系数 Table 3 Diffusion coefficient of Ln3+ in LiCl-KCl molten salt at 773 K |
本文使用循环伏安和方波伏安法研究了多种具有代表性的镧系元素离子在LnF3-LiCl-KCl熔盐中的电化学行为。研究结果显示:Ce3+、Gd3+、Nd3+、Eu3+和Sm3+离子在惰性金属电极上的析出电位与Th4+相差较大,其中Ce3+和Gd3+在电极上均一步还原为金属,Nd3+则是通过两步反应还原为金属,Sm3+和Eu3+只能还原为低价态的Sm2+和Eu2+;氯盐中F-的存在并不会对Ln3+的电极反应造成明显影响,但与纯氯盐体系相比,F-的存在使得Ln3+在LiCl-KCl熔盐中的活度降低,扩散系数也相应减小。上述结果表明:在LiCl-KCl熔盐体系中ThF4与LnF3的电化学分离虽然在理论上是可行的,但相比于纯氯盐体系,熔盐中F-离子浓度的增加,不仅造成镧锕元素离子扩散系数的降低,进而可能导致电极反应的电流密度下降,而且会改变阳极反应类型和阳极材料的使用寿命,最终影响镧锕元素的电化学分离过程。因此,在氯盐体系中进行镧锕氟化物的电解分离还有很多关键的科学技术和工艺问题需要解决。
| [1] |
Xu H, Dai Z, Cai X. Some physical issues of the thorium molten salt reactor nuclear energy system[J]. Nuclear Physics News, 2014, 24(2): 24-30. DOI:10.1080/10619127.2014.910434 |
| [2] |
Li Q. Current progress in pyroprocess technologies for TMSR in SINAP[R]. Idaho, USA: 2014 IPRC, 2014.
|
| [3] |
Chamelot P, Massot L, Cassayre L, et al. Electrochemical behaviour of thorium(Ⅳ) in molten LiF-CaF2, medium on inert and reactive electrodes[J]. Electrochimica Acta, 2010, 55(16): 4758-4764. DOI:10.1016/j.electacta.2010.03.073 |
| [4] |
Chamelot P, Massot L, Hamel C, et al. Feasibility of the electrochemical way in molten fluorides for separating thorium and lanthanides and extracting lanthanides from the solvent[J]. Journal of Nuclear Materials, 2007, 360(1): 64-74. DOI:10.1016/j.jnucmat.2006.08.015 |
| [5] |
Clayton F R, Mamantov G, Manning D L. Electrochemical studies of uranium and thorium in molten LiF-NaF-KF at 500℃[J]. Journal of Electrochemical Society, 1974, 121(1): 86-90. DOI:10.1149/1.2396838 |
| [6] |
Sakamura Y, Hijikata T, Kinoshita K, et al. Measurement of standard potentials of actinides (U, Np, Pu, Am) in LiCl-KCl eutectic salt and separation of actinides from rare earths by electrorefining[J]. Journal of Alloys & Compounds, 1998, s271-273(98): 592-596. DOI:10.1016/S0925-8388(98)00166-2 |
| [7] |
Misra M, Raja K S, Jaques A V, et al. Effect of addition of multi-component lanthanides to LiCl-KCl eutectic on thermal and electrochemical properties[C]. ECS Meeting, 2015: 351-360. DOI: 10.1149/1.3484793.
|
| [8] |
Castrillejo Y, Bermejo R, Martínez A M, et al. Application of electrochemical techniques in pyrochemical processeselectrochemical behaviour of rare earths at W, Cd, Bi and Al electrodes[J]. Journal of Nuclear Materials, 2007, 360(1): 32-42. DOI:10.1016/j.jnucmat.2006.08.011 |
| [9] |
Marsden K C, Pesic B. Evaluation of the electrochemical behavior of CeCl3 in molten LiCl-KCl eutectic utilizing metallic Ce as an anode[J]. Journal of the Electrochemical Society, 2011, 158(6): F111-F120. DOI:10.1149/1.3575637 |
| [10] |
Liu K, Liu Y L, Yuan L Y, et al. Electroextraction of gadolinium from Gd2O3, in LiCl-KCl-AlCl3 molten salts[J]. Electrochimica Acta, 2013, 109(11): 732-740. DOI:10.1016/j.electacta.2013.07.084 |
| [11] |
Yamana H, Park B G, Shirai O, et al. Electrochemically produced divalent neodymium in chloride melt[J]. Cheminform, 2006, S408-412(18): 66-70. DOI:10.1016/j.jallcom.2005.04.104 |
| [12] |
Iida T, Nohira T, Ito Y. Electrochemical formation of Sm-Co alloy films by Li codeposition method in a molten LiCl-KCl-SmCl3 system[J]. Electrochimica Acta, 2003, 48(7): 901-906. DOI:10.1016/S0013-4686(02)00786-7 |
| [13] |
Wang X, Huang W, Gong Y, et al. Electrochemical behavior of Th(Ⅳ) and its electrodeposition from ThF4-LiCl-KCl melt[J]. Electrochimica Acta, 2016, 196: 286-293. DOI:10.1016/j.electacta.2016.02.184 |
| [14] |
一种银/氯化银参比电极及其制作方法[P]. 中华人民共和国. 201510282229. 3. 20150529. A Ag/AgCl reference electrode and its preparation method[P]. China. 201510282229. 3. 20150529. |
| [15] |
Long D, Huang W, Jiang F, et al. Study on the electrochemical extraction of rare earth elements from FLINAK[C]. Global 2013, Salt Lake City, Utah, 2013: 411-418.
|
| [16] |
Huang W, Tian L, She C, et al. Electrochemical behavior of Europium(Ⅲ)-Europium(Ⅱ) in LiF-NaF-KF molten salt[J]. Electrochimica Acta, 2014, 147: 114-120. DOI:10.1016/j.electacta.2014.08.119 |
| [17] |
Bermejo M R, De la Rosa F, Barrado E, et al. Cathodic behaviour of europium (Ⅲ) on glassy carbon, electrochemical formation of Al4Eu, and oxoacidity reactions in the eutectic LiCl-KCl[J]. Journal of Electroanalytical Chemistry, 2007, 603(1): 81-95. DOI:10.1016/j.jelechem.2007.01.018 |
| [18] |
Chamelot P, Lafage B, Taxil P. Using square-wave voltammetry to monitor molten alkaline fluoride baths for electrodeposition of niobium[J]. Electrochimica Acta, 1998, 43(5-6): 607-616. DOI:10.1016/S0013-4686(97)00102-3 |
| [19] |
Delpech S, Jaskierowicz S, Rodrigues D. Electrochemistry of thorium fluoride in LiCl-KCl eutectic melts and methodology for speciation studies with fluorides ions[J]. Electrochimica Acta, 2014, 144: 383-390. DOI:10.1016/j.electacta.2014.07.096 |
| [20] |
Serp J, Konings R J M, Malmbeck R, et al. Electrochemical behavior of plutonium ion in LiCl-KCl eutectic melts[J]. Journal of Electroanalytical Chemistry, 2004, 561(1-2): 143-148. DOI:10.1016/j.jelechem.2003.07.027 |
| [21] |
Fusselman S P, Roy J J, Grimmett D L, et al. Thermodynamic properties for rare earths and americium in pyropartitioning process solvents[J]. Biophysics & Other Topics, 1999, 146(7): 2573-2580. DOI:10.1149/1.1391974 |
| [22] |
Wang C, Yi L, Hu H E, et al. Electrochemical behavior of cerium ion in molten LiCl-KCl[J]. Journal of Rare Earths, 2013, 31(4): 405-409. DOI:10.1016/S1002-0721(12)60295-6 |
| [23] |
Yoon D, Phongikaroon S. Electrochemical properties and analyses of CeCl3 in LiCl-KCl eutectic salt[J]. Journal of the Electrochemical Society, 2015, 162(10): E237-E243. DOI:10.1149/2.0401510jes |
| [24] |
Kim S H, Paek S, Kim T J, et al. Electrode reactions of Ce3+/Ce couple in LiCl-KCl solutions containing CeCl3 at solid W and liquid Cd electrodes[J]. Electrochimica Acta, 2012, 85(85): 332-335. DOI:10.1016/j.electacta.2012.08.084 |
| [25] |
Caravaca C, Córdoba G D, Tomás M J, et al. Electrochemical behaviour of gadolinium ion in molten LiCl-KCl eutectic[J]. Journal of Nuclear Materials, 2007, 360(1): 25-31. DOI:10.1016/j.jnucmat.2006.08.009 |
| [26] |
Zhou W, Liu Y L, Liu A K, et al. Electroreduction of Gd3+ on W and Zn electrodes in LiCl-KCl eutectic:a comparison study[J]. Journal of the Electrochemical Society, 2015, 162(10): D531-D539. DOI:10.1149/2.0541510jes |
| [27] |
Vandarkuzhali S, Chandra M, Ghosh S, et al. Investigation on the electrochemical behavior of neodymium chloride at W, Al and Cd electrodes in molten LiCl-KCl eutectic[J]. Electrochimica Acta, 2014, 145(145): 86-98. DOI:10.1016/j.electacta.2014.08.069 |
| [28] |
Cordoba G, Caravaca C. An electrochemical study of samarium ions in the molten eutectic LiCl+KCl[J]. Journal of Electroanalytical Chemistry, 2004, 572(1): 145-151. DOI:10.1016/j.jelechem.2004.05.029 |
| [29] |
Castrillejo Y, Fernández P, Medina J, et al. Electrochemical extraction of samarium from molten chlorides in pyrochemical processes[J]. Electrochimica Acta, 2011, 56(24): 8638-8644. DOI:10.1016/j.electacta.2011.07.059 |
| [30] |
Caravaca C, Córdoba G, Tomás M J. Electrochemical study of europium trichloride in molten eutectic LiCl-KCl[C]. Information Exchange Meeting on P&T, Seoul, Republic of Korea, 2015.
|
| [31] |
刘雅兰, 叶国安, 柴之芳, 等. 铝合金化技术在乏燃料干法后处理中的应用研究进展[J]. 核化学与放射化学, 2017, 39(1): 13-21. LIU Yalan, YE Guoan, CHAI Zhifang, et al. Research progress on molten salt electrorefining process by forming aluminum alloys[J]. Journal of Nuclear and Radiochemistry, 2017, 39(1): 13-21. DOI:10.7538/hhx.2017.39.01.0013 |
| [32] |
Berzins T, Delahay P. Kinetics of fast electrode reactions[J]. Journal of the American Chemical Society, 1955, 77(24): 6448-6453. DOI:10.1021/ja01629a006 |
| [33] |
Bard A J, Faulkner L R. Electrochemical methods: fundamentals and applications[M]. USA: Wiley, 1980.
|
| [34] |
Bermejo M R, Gómez J, Medina J, et al. The electrochemistry of gadolinium in the eutectic LiCl-KCl on W and Al electrodes[J]. Journal of Electroanalytical Chemistry, 2006, 588(2): 253-266. DOI:10.1016/j.jelechem.2005.12.031 |
| [35] |
Wang Z H, Rappleye D, Simpson M F. Voltammetric analysis of mixtures of molten eutectic LiCl-KCl containing LaCl3 and ThCl3 for concentration and diffusion coefficient measurement[J]. Electrochimica Acta, 2016, 191: 29-43. DOI:10.1016/j.electacta.2016.01.021 |
| [36] |
Tumidajski P J, Flengas S N. Potential measurements of thorium tetrachloride in alkali halide solution[J]. Canadian Journal of Chemistry, 2011, 69(3): 462-467. DOI:10.1139/v91-069 |


